EFFECTIVENESS OF KENANGA (Cananga odorata (Lam).) FLOWER EXTRACT TO INHIBIT THE GROWTH OF Colletotrichum acutatum (Jenkins & Winstead) CAUSES OF ANTHRACNOSE DISEASE IN CHILI (Capsicum annum L.) PLANT
on
SIMBIOSIS X (1):109-121 http://ojs.unud.ac.id/index.php/simbiosis
Program Studi Biologi FMIPA UNUD
eISSN: 2656-7784
Maret 2022
EFEKTIVITAS EKSTRAK BUNGA KENANGA (Cananga odorata (Lam).) UNTUK MENGHAMBAT PERTUMBUHAN JAMUR (Colletotrichum acutatum (Jenkins & Winstead) (PENYEBAB PENYAKIT ANTRAKNOSA PADA TANAMAN CABAI BESAR (Capsicum annum L.)
EFFECTIVENESS OF KENANGA (Cananga odorata (Lam).) FLOWER EXTRACT TO INHIBIT THE GROWTH OF Colletotrichum acutatum (Jenkins & Winstead) CAUSES OF ANTHRACNOSE DISEASE IN CHILI (Capsicum annum L.) PLANT
Silviana Febrionita Meiskia Agung. Sang Ketut Sudirga, Anak Agung Ketut Darmadi
Program Studi Biologi, Fakultas Matematika dan ilmu Pengetahuan Alam, Universitas Udayana, Kampus Bukit Jimbaran, Badung-Bali (80631)
Email: meiskiaagung@gmail.com
ABSTRAK
Jenis C. acutatum merupakan jamur patogen penyebab penyakit antraknosa pada tanaman budidaya, salah satunya tanaman cabai. Pengendalian penyakit antraknosa umumnya menggunakan pestisida sintetis. Penggunaan pestisida sintetis secara terus menerus dapat menimbulkan efek samping yang merugikan, sehingga diperlukan senyawa lain untuk mengendalikan jamur patogen tersebut salah satunya melalui penggunaan fungisida nabati. Penelitian ini bertujuan untuk mengetahui efektivitas ekstrak bunga kenanga dalam menghambat pertumbuhan C. acutatum dan untuk mengetahui golongan senyawa aktif yang terkandung dalam ekstrak bunga kenanga. Penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan tujuh perlakuan yaitu P0: kontrol negatif, P1: kontrol positif, P2: konsentrasi ekstrak 1% (b/v), P3: konsentrasi ekstrak 2% (b/v), P4: konsentrasi ekstrak 3% (b/v), P5: konsentrasi ekstrak 4% (b/v), P6: konsentrasi ekstrak 5% (b/v) dengan masing-masing perlakuan diulang sebanyak 4 kali. Parameter yang diamati yaitu terbentuknya diameter zona hambat, diameter koloni, kerapatan spora, dan uji fitokimia ekstrak. Hasil penelitian uji sumur difusi menunjukan zona hambat terbesar terdapat pada konsentrasi 5% (P6) yaitu sebesar 10,05 mm dan zona hambat terkecil pada konsentrasi 1% (P2) sebesar 7,53 mm. Hasil uji koloni menunjukan diameter koloni terkecil pada hari ke-10 terdapat pada konsentrasi 3% (P4) sebesar 7,09 cm dan diameter koloni terbesar pada konsentrasi 1% (P2) sebesar 8,46 cm. Hasil uji kerapatan spora menunjukan jumlah kerapatan spora terbesar terdapat pada konsentrasi 1% (P3) yaitu 3,24×104 spora/mL dan jumlah spora terkecil terdapat pada konsentrasi 3% (P4) sebesar 2,36×104 spora/mL. Ekstrak bunga kenanga mengandung golongan senyawa alkaloid, steroid, flavonoid, fenolik, saponin dan tanin.
Kata kunci: Antraknosa, Colletotrichum acutatum, daya hambat, kenanga, senyawa anti-jamur
ABSTRACT
C. acutatum is a pathogenic fungal that causes anthracnose disease in cultivated plants, one of them is chili. The anthracnose disease commonly controlled by using synthetic pesticides. The continuous use of synthetic pesticides can cause adverse side effects, so the alternative compound was need to replaced by plant-based fungicides. This study aimed to determine the effectiveness of cananga flower extract in inhibiting the growth of Colletotrichum acutatum and to determine the group of bioactive compounds in cananga flower extract. The study used a Completely Randomized Design (CRD) with seven treatments consisting of P0: negative control, P1: positive control, and with different consentration of cananga extracts at P2: 1%(w/v), P3: 2%(w/v), P4:
3%(w/v), P5: 4%(w/v), and P6: 5%(w/v) with each treatment repeated 4 times. The parameters observed were zone of inhibition, colony diameter, spores density, and phytochemical test. The results of the diffusion well test showed that largest inhibition zone at concentration of 5% (P6) by 10,05 mm and smallest inhibition zone at concentration 1% (P2) by 7,53 mm. The result of the colony test showed that smallest colony diameter on the 10th day was at concetration of 3% (P4) by 7,09 cm and the largest colony diameter was at concentration of 1% (P2) by 8,46 cm. The result of the spore density test showed that the highest density at concentration 1% (P3) by 3,24×104 spores/mL and the smallest spore number at concentration 3% (P4) by 2,36×104 spores/mL. The group of active compunds found in cananga flower extract includes alkaloid, steroid, flavonoid, phenolic, saponin, and tanin.
Keywords: Anthracnose, C. acutatum, inhibitory activity, kenanga, compound anti-fungal.
PENDAHULUAN
Tanaman cabai besar (C. annum L.) merupakan salah satu tanaman yang memiliki nilai ekonomis tinggi (Departemen Pertanian, 2004). Kebutuhan cabai besar setiap tahun selalu meningkat pesat meskipun diperlukan dalam jumlah yang sedikit. Seiring dengan peningkatan kebutuhan cabai besar, jumlah produksi cabai besar di Indonesia masih sangat rendah dengan rata-rata nasional hanya mencapai 5,5 ton/ha dari potensi produksi yaitu sebanyak 20 ton/ha (Santika, 2001). Rendahnya produktivitas cabai disebabkan oleh beberapa faktor salah satunya yaitu hama dan penyakit. Penyakit antraknosa merupakan penyakit busuk buah cabai yang disebabkan oleh jamur Colletotricum acutatum. Penyakit ini mampu menurunkan produksi, kualitas dan nilai estetika pada buah cabai (Hersanti dan Zulkarnaen, 2001).
Penanganan penyakit antraknosa pada cabai, umumnya menggunakan fungisida sistetis. Penggunaan fungisida sintetis secara terus menerus dengan dosis
yang tidak tepat dapat menyebabkan efek samping seperti keracunan pada konsumen, pencemaran lingkungan, dan resistensi patogen (Habazar dan Yaherwandi, 2006). Untuk itu, diperlukan alternatif penanggulangan penyakit antraknosa dengan memanfaatkan potensi tanaman sebagai anti-jamur yang efektif dan aman untuk digunakan melalui fungisida nabati.
Menurut penelitian yang dilakukan oleh Dusturia dkk. (2016), bunga kenanga mampu menghambat pertumbuhan Staphylococcus aureus dengan metode konvensional (perasan bunga). Sejalan dengan penelitian yang dilakukan oleh Kurnilia dkk. (2020) bahwa bunga kenanga mampu menghambat C. albicans secara in vitro sebesar 1,30 mm. Berdasarkan latar belakang tersebut di atas, perlu dilakukan penelitian lebih lanjut mengenai efektivitas ekstrak bunga kenanga menghambat pertumbuhan jamur C. acutatum penyebab penyakit antraknosa pada tanaman cabai besar (C. annum L.).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli 2019 sampai Maret 2020 di Laboratorium Biokimia, Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Bukit Jimbaran-Bali. Pembuatan ekstrak dilakukan di UPT Laboratorium Sumber Daya Genetika dan Biologi Molekuler Gedung Pascasarjana, Laboratorium Analitik
Prosedur Kerja
Pembuatan ekstrak bunga kenanga
Bunga kenanga dipotong kecil-kecil dan dikeringanginkan sampai beratnya konstan. Setelah kering, bunga kenanga diblender sampai menjadi serbuk dan ditimbang. Serbuk dimasukan ke dalam toples kaca dan dilakukan proses maserasi yaitu dengan cara memasukan metanol kedalam toples kaca berisi serbuk bunga dengan perbandingan 1:10 (berat/volume), kemudian wadah ditutup rapat dan di simpan ditempat gelap selama 72 jam pada suhu kamar. Filtrat yang diperoleh disaring dengan kertas saring dan dilakukan secara berulang. Filtrat yang diperoleh diuapkan dengan menggunakan alat vacuum rotary evaporator pada suhu 40°C untuk memperoleh ekstrak kasar
Pengujian daya hambat dengan metode sumur difusi
Pengujian daya hambat metode sumur difusi dilakukan menggunakan Rancangan Acak lengkap (RAL) dengan 7 perlakuan yaitu kontrol negatif (P0), kontrol positif (P1), dan konsentrasi ekstrak 1% (P2), 2% (P3), 3% (P4), 4% (P5) dan 5% (P6). Sebagai
Gedung LPPM Universitas Udayana, dan Laboratorium Forensik Polri Cabang Denpasar. Biakan murni jamur Colletotrichum acutatum diperoleh dari koleksi Laboratorium Biokimia Program Studi Biologi FMIPA Universitas Udayana yang sebelumnya telah diisolasi dan diidentifikasi dari cabai yang terinfeksi penyakit antraknosa dan diinokulasi pada media PDA.
kontrol digunakan metanol tanpa penambahan ekstrak (kontrol negatif). Sebanyak 100µL suspensi jamur ke dalam cawan Petri steril menggunakan mikropipet, kemudian ditambahkan 10 mL PDA steril yang masih encer dan diputar secara simultan sampai media merata dan dibiarkan memadat. Media PDA dilubangi dengan Cork Borer sebanyak 7 lubang dan diangkat dengan menggunakan jarum Oose. Setiap lubang diisi dengan setiap perlakuan masing-masing sebanyak 20µL. Media diinkubasi pada suhu kamar selama 3 hari. Setiap perlakuan dibuat 4 ulangan dan pengukuran dilakukan sebanyak 2 kali dengan orientasi yang berbeda dan hasilnya dirata-ratakan. Menurut Sudirga (2016), pengamatan yang dilakukan yaitu mengukur diameter zona daya hambat pada hari keempat setelah inkubasi.
Pengujian daya hambat dengan metode koloni
Pengujian daya hambat metode koloni dilakukan menggunakan Rancangan Acak lengkap (RAL) dengan 7 perlakuan yaitu kontrol negatif (P0), kontrol positif
(P1), dan konsentrasi ekstrak 1% (P2), 2% (P3), 3% (P4), 4% (P5) dan 5% (P6). Sebagai kontrol digunakan metanol tanpa penambahan ekstrak (kontrol negatif). Pengujian dilakukan dengan memasukan perlakuan sebanyak 100µL yang telah disiapkan pada masing-masing cawan Petri dan dicampurkan dengan media PDA sebanyak 10 mL. Cawan Petri digoyang secara simultan sampai media merata dan dibiarkan padat. Isolat murni jamur C. acutatum di Cork Borer dan diletakkan pada
bagian tengah media dari setiap perlakuan kemudian diinkubasi pada suhu kamar. Perlakuan diulang sebanyak 4 kali dengan hasil pengukuran dilakukan setelah koloni jamur memenuhi media kontrol negatif dan dihitung dengan cara merata-ratakan diameter jamur tiap perlakuan dalam bidang pandang berbeda (Awaludin dkk., 2020). Menurut Darmadi et al. (2019), perhitungan persentase daya hambat ekstrak terhadap diameter koloni dilakukan dengan rumus:
Diameter koloni kontrol — Diameter Koloni Perlakuan Daya hambat =---------—---———----—;--------- × 100%
Diameter koloni kontrol
Pengujian kerapatan spora
Pengujian kerapatan spora dilakukan menggunakan Rancangan Acak lengkap (RAL) dengan 7 perlakuan yaitu kontrol negatif (P0), kontrol positif (P1), dan konsentrasi ekstrak 1% (P2), 2% (P3), 3% (P4), 4% (P5) dan 5% (P6). Pengujian dilakukan dengan memasukan 10 mL air steril pada masing-masing unit percobaan hasil uji daya hambat metode koloni pada hari terakhir kemudian, dihomogenkan
Kerapatan spora kontrol — Kerapatan spora perlakuan Kerapatan spora kontrol
Daya hambat (%) =
Analisis fitokimia
Menurut Rahmawati et al. (2017), uji fitokimia merupakan uji yang dilakukan untuk mengetahui golongan senyawa dari komponen aktif yang diperoleh, dengan Metode Pengolahan Data
Data uji sumur difusi, uji koloni dan uji kerapatan spora yang diperoleh dari penelitian ini dianalisis secara statistik menggunakan aplikasi SPSS for Windows
menggunakan vortex dan dilakukan pengenceran. Isolat jamur diambil sebanyak 1 mL, kemudian diteteskan pada haemocytometer dan diamati di bawah mikroskop dengan perbesaran 400 kali untuk menghitung jumlah kerapatan spora. Perhitungan persentase pengaruh daya hambat ekstrak terhadap kerapatan spora dapat dihitung dengan rumus:
× 100%
menggunakan pereaksi golongan senyawa yang spesifik. Uji ekstrak bunga kenanga yang dilakukan meliputi uji alkaloid, flavonoid, fenolik, steroid, saponin dan tanin.
versi 22. Data terdistribusi normal dianalisis menggunakan One Way ANOVA dan apabila menunjukan hasil yang berbeda nyata
(P≤0,05), dilakukan uji Post-hoc Duncan untuk melihat perbedaan antar perlakuan.
HASIL
Reidentifikasi jamur C. acutatum
Gambar 1 dan Gambar 2 menunjukan hasil reidentifikasi dan pengamatan C. acutatum pada media PDA yang diinkubasi selama 7 hari di suhu kamar. Pengamatan mikroskopis dilakukan dengan menggunakan mikroskop perbesaran 10×40 kali dan
tekstur permukaan koloni halus, koloni berbentuk circular, dan tepi koloni rata (Gambar 1). Sedangkan, pengamatan mikroskopis menunjukan C. acutatum memiliki ciri-ciri: memiliki konidia berbentuk bulan sabit dengan ujung tumpul,
aplikasi Image Raster. Pengamatan
panjang konidia 12,16 µm dan lebar konidia
makroskopis menunjukan bahwa C.
4,54 µm, memiliki konidiofor, hifa bersekat
acutatum memiliki ciri morfologi yaitu (Gambar 2).
permukaan koloni berwarna putih keabuan,
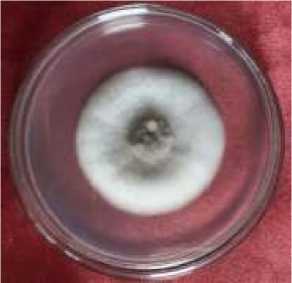
Gambar 1. Koloni jamur C. acutatum hari ke-3 setelah isolasi pada media PDA

Gambar 2. Pengamatan mikroskopis C. acutatum perbesaran 400x. Konidia (panah kuning), konidiofor (panah biru), hifa bersekat (panah merah)
Uji daya hambat metode sumur difusi
Hasil uji daya hambat ekstrak bunga dan 5%, menunjukan bahwa ekstrak mampu
kenanga dengan konsentrasi 1%, 2%, 3%, 4% menghambat pertumbuhan C. acutatum.
Tabel 1. Pengaruh pemberian ekstrak bunga kenanga terhadap zona hambat C. acutatum hari ke-4 setelah isolasi pada media PDA
|
Perlakuan |
Diameter zona hambat (mm) |
|
P0 |
0,00±0,00a |
|
P1 |
12,43±0,88e |
|
P2 |
7,53±0,53b |
|
P3 |
8,02±0,59b |
|
P4 |
8,53±0,67bc |
|
P5 |
9,20±0,57cd |
|
P6 |
10,05±0,93d |
Nilai-nilai pada Tabel 1±standar deviasi merupakan rata-rata dari 4 kali ulangan. Nilai yang diikuti huruf sama pada masing-masing perlakuan di kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji Duncan taraf 5%. P0: kontrol negatif, P1: kontrol positif, P2: konsentrasi 1% (b/v), P3: konsentrasi 2% (b/v), P4: konsentrasi 3% (b/v), P5: konsentrasi 4% (b/v), P6: konsentrasi 5% (b/v).
Data pada Tabel 1 menunjukan bahwa ada kecendrungan besarnya diameter zona hambat C. acutatum sejalan dengan peningkatan konsentrasi ekstrak bunga kenanga. Jika dibandingkan dengan kontrol, meningkatnya konsentrasi konsentrasi ekstrak memberikan efek yang secara statistik berbeda nyata (p<0.05) terhadap
Uji daya hambat metode koloni
Hasil uji ekstrak bunga kenanga terhadap diameter jamur C. acutatum secara in vitro menunjukan bahwa koloni jamur
diameter zona hambat C. acutatum. Rata-rata diameter zona hambat tertinggi terjadi pada konsentrasi 5% yaitu sebesar 10,05 mm. Selanjutnya, diikuti oleh konsentrasi 4%, 3%, 2%, dan 1%, masing-masing diameter zona hambatan sebesar 9,20 mm; 8,53 mm; 8,02 mm; dan 7,53 mm.
tumbuh memenuhi seluruh permukaan media PDA pada kontrol setelah diinkubasi selama 10 hari seperti yang tersaji pada Gambar 13.

4 5
Maret 2022

Gambar 3. Diameter koloni jamur C. acutatum hari ke-10 pada media PDA. (1) Kontrol negatif, (2) Kontrol positif, (3) konsentrasi 1%, (4) konsentrasi 2%, (5) konsentrasi 3%, (6) konsentrasi 4%, (7) konsentrasi 5%
Rata-rata diameter koloni tertinggi terjadi pada kontrol negatif yaitu sebesar 9,2 cm. Selanjutnya, diikuti oleh konsentrasi 1%, 5%, 4%, 2% dan 3% masing-masing diameter zona hambat sebesar 8,46 cm; 8,30
cm; 8,28 cm; 8,20 cm dan 7,09 cm. Kontrol positif juga menunjukan terbentuknya diameter koloni jamur sebesar 4, 21 cm (Tabel 2.).
Tabel 2. Pengaruh pemberian ekstrak bunga kenanga terhadap diameter koloni C. acutatum hari ke-10 setelah isolasi pada media PDA
|
Perlakuan |
Diameter Koloni (cm) |
Daya Hambat Ekstrak Dibanding Kontrol (%) |
|
P0 |
9,20±0,00d |
0 |
|
P1 |
4,21±0,22a |
54,24 |
|
P2 |
8,46±0,12c |
8,04 |
|
P3 |
8,20±0,42c |
10,87 |
|
P4 |
7,09±0,34b |
22,93 |
|
P5 |
8,28±0,11c |
10,00 |
|
P6 |
8,30±0,35c |
9,78 |
Nilai-nilai pada Tabel 2 ± standar deviasi merupakan rata-rata dari 4 kali ulangan. Nilai yang diikuti huruf sama pada masing-masing perlakuan di kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji Duncan taraf 5%. P0: kontrol negatif, P1: kontrol positif, P2: konsentrasi 1% (b/v), P3: konsentrasi 2% (b/v), P4: konsentrasi 3% (b/v), P5: konsentrasi 4% (b/v), P6: konsentrasi 5% (b/v).
Uji kerapatan spora
Hasil uji ekstrak bunga kenanga konsentrasi 1%, 2%, 3%, 4% dan 5%,
terhadap kerapatan spora C. acutatum dengan menunjukan bahwa ekstrak bunga kenanga
mampu menghambat pertumbuhan C. acutatum. Rata-rata jumlah kerapatan spora terkecil terjadi pada konsentrasi 3% yaitu sebesar 2,36×104 spora/mL. Selanjutnya, diikuti oleh konsentrasi 4% , 5%, 2%, dan 1%, masing-masing jumlah kerapatan spora sebesar 3,06×104 spora/mL, 3,06×104
spora/mL, 3,14×104 spora/mL dan 3,24×104 spora/mL. Kontrol negatif dan positif juga memberikan hasil untuk kerapatan spora jamur yang diujikan. Hal ini dibuktikan dengan kerapatan spora sebesar 3, 54×104 spora/mL dan 1,46×104 spora/mL (Tabel 3.).
Tabel 3. Pengaruh pemberian ekstrak bunga kenanga terhadap kerapatan spora koloni
C. acutatum hari ke-10
Perlakuan Kerapatan spora (×104 Daya Hambat Ekstrak Dibanding
|
spora/mL) |
Kontrol (%) | |
|
P0 |
3,54±0,55c |
0 |
|
P1 |
1,46±0,31a |
58,76 |
|
P2 |
3,24±0,43c |
8,55 |
|
P3 |
3,14±0,53c |
11,30 |
|
P4 |
2,36±0,17b |
33,33 |
|
P5 |
3,06±0,09c |
13,56 |
|
P6 |
3,06±0,20c |
13,56 |
Nilai-nilai pada Tabel 3± standar deviasi merupakan rata-rata dari 4 kali ulangan. Nilai yang diikuti huruf sama pada masing-masing perlakuan pada kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji Duncan taraf 5%. P0: kontrol negatif, P1: kontrol positif, P2: konsentrasi 1% (b/v), P3: konsentrasi 2% (b/v), P4: konsentrasi 3% (b/v), P5: konsentrasi 4% (b/v), P6: konsentrasi 5% (b/v).
Analisis fitokimia
Hasil yang diperoleh setelah dilakukan uji fitokimia terhadap ekstrak bunga kenanga menunjukan bahwa bunga kenanga mengandung senyawa diantaranya alkaloid, steroid, fenolik, saponin, flavonoid, Tabel 4. Hasil uji fitokimia bunga kenanga
dan tanin (Tabel 4). Uji fitokimia menunjukan senyawa paling banyak (+++) terdiri dari alkaloid, steroid, dan flavonoid. Kandungan dari senyawa saponin dan tanin ditemukan dalam jumlah paling sedikit (+).
|
Uji Fitokimia |
Metode Pengujian |
Hasil |
Keterangan |
|
Alkaloid |
Liebermann Buchard |
+++ |
Terbentuknya endapan putih |
|
Steroid |
Pereaksi Meyer |
+++ |
Berubah warna kehijauan |
|
Terpenoid |
Liebermann Buchard |
- |
Berubah warna kemerahan |
|
Fenolik |
FeCl3 |
++ |
Berubah warna kehijauan |
|
Saponin |
Air + HCL |
+ |
Terbentuk busa |
|
Flavonoid |
Mg+ HCL |
+++ |
Berubah warna kemerahan |
|
Tanin |
FeCl3 |
+ |
Berubah warna kebiruan |
Simbol +++: memberikan endapan/ warna yang sangat mencolok, ++: memberikan endapan/ warna yang sedang, +: memberikan endapan/ warna yang cukup, -: tidak ada endapan
PEMBAHASAN
Proses reidentifikasi jamur C. acutatum dilakukan dengan tujuan untuk mendapatkan biakan murni jamur untuk uji selanjutnya. Koloni jamur yang tumbuh pada media PDA menunjukan ciri-ciri yaitu permukaan koloni berwarna putih keabuan, tekstur permukaan koloni halus, koloni berbentuk circular dengan tepi koloni rata, konidia berbentuk bulan sabit dengan ujung tumpul, memiliki konidiofor, dan hifa bersekat. Hal ini serupa dengan penelitian yang dilakukan Sudirga (2016) dan Damm et al. (2012) yang menyatakan C. acutatum memiliki ciri makroskopis yaitu koloni berwarna putih abu-abu, isolat menghasilkan banyak miselium pada media PDA, dengan ciri mikroskopis antara lain hifa berwarna hyaline, bercabang dan bersekat, konidia berwarna hyaline, konidia tidak bersekat berbentuk ovoid (fusiform) dan silindris dengan ujung tumpul pada kedua sisi, panjang konidia 11-14,5 µm dan lebar konidia 3,5-4,5 µm.
Berdasarkan hasil uji DMRT (Duncans Multi Ring Test) yang disajikan pada (Tabel 1) menunjukan bahwa ekstrak bunga kenanga mampu menghambat pertumbuhan jamur C. acutatum. Adanya daya hambat dari tiap konsentrasi yang diujikan menunjukan bahwa ekstrak bunga kenanga mengandung bahan aktif yang mampu menghambat pertumbuhan jamur. Secara statistik, rata-rata diameter zona hambat ekstrak bunga kenanga dalam
menghambat C. acutatum menunjukan hasil yang berbeda nyata dengan kontrol pada taraf uji 5%. Menurut Goldman dan Green (2009), terbentuknya zona bening di sekitar sumur difusi menunjukan kemampuan daya hambat suatu ekstrak tanaman terhadap pertumbuhan jamur. Perbedaan ukuran zona hambat yang terbentuk menunjukan kekuatan senyawa antijamur dari suatu ekstrak (Tabel 1).
Menurut Morales et al. (2003), penggolongan daya hambat berdasarkan diameter zona hambat dibagi menjadi empat kategori. Berdasarkan kategori tersebut, rata-rata zona hambat ekstrak bunga kenanga terhadap C. acutatum dengan metode sumur difusi pada konsentrasi 1% (7,53 mm), konsentrasi 2% (8,02 mm), konsentrasi 3% (8,53 mm) dan konsentrasi 4% (9,20 mm) termasuk dalam kategori daya hambat sedang sedangkan, konsentrasi 5% (10,05 mm) termasuk kategori daya hambat sedang-kuat. Hasil ini sesuai dengan penelitian yang dilakukan oleh Chand et al. (2017), bahwa aktivitas anti-jamur dari kenanga menghasilkan zona hambat yang besar pada konsentrasi yang lebih tinggi. Lemahnya aktivitas anti-jamur terjadi karena berkurangnya golongan senyawa aktif anti-jamur seperti senyawa fenolik dan senyawa terpenoid pada ekstrak bunga kenanga.
Hasil uji koloni ekstrak bunga kenanga terhadap diameter koloni jamur menunjukan bahwa ekstrak kenanga mampu menghambat pertumbuhan diameter koloni
SIMBIOSIS X (1):109-121
Program Studi Biologi FMIPA UNUD sampai 10 hari setelah isolasi. Rata-rata diameter koloni jamur pada Tabel 2 menunjukan hasil yang berbeda nyata antara kontrol dan perlakuan pada uji taraf 5% . Selain itu, uji Duncan juga menunjukan perbedaan nyata besarnya diameter koloni antara P4 dengan perlakuan P2, P3, P5 dan P6. Persentase daya hambat menunjukan pemberian konsentrasi ekstrak 3% memberikan persentase daya hambat terbesar yaitu 22,93 % sedangkan, konsentrasi 1% memiliki persentase daya hambat terkecil yaitu 8,04%.
Menurut Suharjo dan Aeny (2011), efektivitas ekstrak tanaman dalam menghambat pertumbuhan diameter koloni jamur yang efektif tidak selalu dari taraf konsentrasi yang tinggi. Hal ini dapat disebabkan oleh suhu dan pH media yang mempengaruhi golongan senyawa dalam konsentrasi ekstrak tanaman. Menurut Rota et al. (2008), golongan senyawa terpenoid seperti minyak atsiri mudah dipengaruhi oleh pH dan suhu media. Lebih lanjut hasil penelitian Achmad dan Mulyaningsih (2015) juga melaporkan bahwa pH media yang berbeda dapat mempengaruhi diameter dan pertumbuhan miselium jamur.
Uji kerapatan spora untuk mengetahui jumlah spora dalam suatu suspensi. Hasil yang diperoleh menunjukan P4 (konsentrasi ekstrak 3%) memiliki jumlah spora paling rendah yaitu sebesar 2,35×104 spora/mL dan persentase daya hambat terbesar yaitu 33,33%. Uji Duncan menunjukan perbedaan nyata pada jumlah kerapatan spora antara P0 dengan P1 dan P0 dengan P4. Hal tersebut disebabkan karena konsentrasi 3% (P4) juga memiliki diameter koloni terkecil diantara semua pemberian perlakuan konsentrasi
ekstrak. Menurut Darmadi dkk. (2017), spora merupakan alat perkembangbiakan pada jamur sehingga, sangat penting dilakukan penelitian tentang daya hambat pembentukan spora jamur. Dengan adanya penghambatan pembentukan spora mampu mengurangi jumlah dan pembentukan inokulum yang menginfeksi tanaman.
Berdasarkan penelitian yang dilakukan Mengane dan Kamble (2014), tentang bioefikasi ekstrak tanaman terhadap F. oxysporum bahwa penggunaan bahan kimia alami sebagai perlindungan tanaman dari serangan jamur dapat mengindikasikan potensi dalam menghambat pertumbuhan jamur. Selain itu, penggunaan ekstrak dan essential oil tumbuhan, efektif sebagai agen antimikroba untuk jamur patogen dan jamur tanah tanpa menimbulkan efek samping.
Hasil analisis fitokimia (Tabel 4) menunjukan bahwa ekstrak bunga kenanga positif mengandung senyawa diantaranya alkaloid, steroid, flavonoid, fenolik, saponin, dan tanin. Hal ini sesuai dengan penelitian yang dilakukan oleh Putri dkk. (2020) mengenai analisis kualitatif bunga kenanga secara fitokimia, yang menyatakan kenanga (C. odorata) memiliki kandungan senyawa seperti flavonoid, tanin, saponin, dan steroid. Sejalan dengan penelitian yang dilakukan oleh Kuspradini et al. (2015) bahwa kenanga memiliki golongan senyawa aktif antimikroba yang tergolong kedalam golongan fenolik seperti lonalool dan golongan senyawa terpenoid seperti pinene, myrcene dan minyak atsiri. Golongan senyawa ini menunjukan pola aktivitas yang berbeda terhadap mikroorganisme dengan kemampuan dalam menghambat
pertumbuhan dan diameter pertumbuhan mikroba.
Menurut Rota et al. (2008), minyak atsiri merupakan metabolit sekunder yang bersifat volatil dan berguna sebagai perlindungan terhadap bakteri, jamur dan hama. Selain minyak atsiri, flavonoid dan saponin yang terkandung dalam bunga kenanga bersifat mudah larut dalam air dan menguap pada temperatur tinggi. Senyawa flavonoid dan saponin bersifat antibakteri dan antiinflamasi (Dusturia, 2016). Sedangkan, menurut Angelina dkk. (2018), golongan senyawa tanin memiliki
SIMPULAN
Ekstrak bunga kenanga efektif menghambat pertumbuhan jamur, diameter koloni, dan kerapatan spora C. acutatum secara in vitro. Hasil diameter zona hambat pada uji sumur difusi, konsentrasi ekstrak 5% memberikan hasil zona hambat terbesar yaitu 10,05 mm. Sementara itu, konsentrasi ekstrak 3% memberikan hasil daya hambat terbesar
mekanisme kerja bereaksi dengan protein dan membentuk senyawa yang tidak dapat larut. Golongan senyawa saponin memiliki mekanisme kerja dengan memecah lemak pada membran sel sehingga menyebabkan gangguan permiabilitas membran sel. Hal ini mengakibatkan terganggunya proses difusi zat yang diperlukan oleh jamur, yang akhirnya sel membengkak dan lisis. Golongan senyawa flavonoid memiliki mekanisme kerja dengan mengganggu difusi makanan kedalam sel sehingga pertumbuhan jamur terhenti (Angelina, dkk. 2018).
pada uji diameter koloni dan uji kerapatan spora yaitu 22,93% dan 33,33%. Golongan senyawa aktif yang terkandung dalam ekstrak bunga kenanga yang berpotensi menghambat pertumbuhan C. acutatum yaitu alkaloid, steroid, fenolik, saponin, flavonoid, dan tanin.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Dr. Drs. Ida Bagus Gede Darmayasa, M.Si., Dr. I Ketut Ginantra, S.Pd., M.Si., dan I Made Saka Wijaya, M.Si., M.Sc. yang telah memberikan masukan untuk perbaikan tulisan ini. Penulis juga mengucapkan terima kasih kepada Tyara dan Siti Masnunah yang telah membantu pengumpulan data penelitian.
DAFTAR PUSTAKA
Achmad dan I. Mulyaningsih. 2015.
Pengaruh pH, Penggoyangan Media, dan Ekstrak Daun Sirih Merah (Piper Crocatum Linn.) Terhadap Pertumbuhan Cendawan Rhizoctonia sp. J. Hort. 25(2): 150159.
Angelina, S., I. N. Suartha dan A. L. T. Rompis. 2018. Efektivitas Ekstrak daun Sirsak Terhadap Jamur Microsporum gypseum Penyebab Dermatitis Kompleks Pada Anjing. Buletin Veteriner Udayana. 12(2): 155-160.
Awaludin, M. A., Efri dan Sudiono. 2020. Pengaruh Ekstrak Daun Pepaya Terhadap Penyakit Antraknosa Pada Buah Pepaya. J. Agrotek Tropika. 8(3): 409-421.
Chand, R. R., A. D. Jokhan, R. D. Gopalan and T. Osborne. 2017. Antibacterial and Antifungal Activities of Essential Oils from Medical Plants Found in South Pacific. The South Pacific Journal of Natural and Applied Sciences. 35(1): 10-19
Damm, U., P. F. Cannon, J. H. C. Woundenberg and P. W. Crous. 2012. The Colletotrichum acutatum Species Complex. Studies in Micology. 73: 37-113.
Darmadi, A. A. K., I. K. Ginantra dan M. Joni. 2017. Uji Efektivitas Ekstrak Aseton Daun Kayu Manis (Cinnamomum burmanni Blume) Terhadap Jamur Fusarium solani Penyebab Penyakit Busuk Batang Pada Buah Naga (Hylocereus sp.) Secara in Vitro. Jurnal
Metamorfosa. 4(1): 79-86.
Darmadi, A. A. K., S. K. Sudirga, N. L. Suriani dan I. G. A. S. Wahyuni. 2019. Antifungal Activities of Cinnamon Leaf Extracts Agaist Shigatoka Fungus
(Pseudocercospora fijiensis). 6th
International Conference on Sustainable Agriculture, Food and Energy. IOP. Conf. Series: Earth and Environmental Science. IOP Publishing.
Departemen Pertanian. 2004. Pola Produksi Hortikultura Direktorat Jendral
Bina Produksi Hortikultura. Departemen Pertanian, RI. Jakarta.
Dusturia, N., S. R. Hikamah dan D. Sudiarti. 2016. Efektivitas Antibakteri Bunga Kenanga (Cananga odorata)
dengan Metode Konvensional Terhadap Pertumbuhan
Staphylococcus aureus. Bioshell. 5(1): 324-332.
Goldman, E. dan L. H. Green. 2009. Practical Handbook of
Microbiology Edition 2nd. Taylor and Francis Group. New York.
Habazar, T. dan Yaherwandi. 2006. Pengendalian Hayati Hama dan Penyakit Tumbuhan. Andalas
University Press. Padang.
Hersanti, F. L. dan I. Zulkarnaen. 2001. Pengujian Kemampuan Campuran Senyawa Benzothiadiazol 1% -
Mankozeb 48% dalam
Meningkatkan Ketahanan Cabai Merah Terhadap Penyakit
Antraknosa. Prosiding Kongres Nasional XVI dan Seminar Hasil PFI. Bogor.
Kurnilia, K. W., S. K. Sudirga dan Y. Ramona. 2020. Potensi Minyak Atsiri Cananga odorata dan Cymbopon citratus dalam
Menghambat Pertumbuhan
Staphylococcus aureus ATCC 25923 dan Candida albicans ATCC 10231 Secara in Vitro. Jurnal
Metamorfosa. 7(2): 191-198.
Kuspradini, H., A. S. Putri, E. Sukaton and T. Mitsunaga. 2015. Bioactivity of Essential Oils from Leaves of Dryopbalanops lanceolata,
Cinnamomum burmanni, Cananga odorata, and Scorodocarpus borneensis. International
Conference on Food, Agriculture, and Natural Resources, FANRes 2015. Universitas Jember. Jember.
Mengane, S. K. dan S. S. Kamble. 2014. Bioefficacy Of Plant Extracts n Fusarium oxisporum F. Sp. Cubense Causing Panama Wilt of Banana. IJPBS. 4(3): 24-27.
Morales, G., P. Sierra, A. Mancilla, A. Paredes, L. A. Loyola, O. Gallardo and J. Borques. 2003. Secondary Metabolites From our Medicinal Plant From Northern Chile: Antimicrobial activity and
Biotoxicity Against Artemia salina. J. Chil.Chem Soc. 49(1): 44-49.
Putri, A. M., A. O. Muham, S. Anggraini, S. Maisarmah dan P. A. R. Yulis. 2020. Analisis Kualitatif Kandungan Bunga Kenanga (Cananga odorata) Secara Fitokimia Dengan
Menggunakan Pelarut Etanol. Journal of Research Education Chemistry. 2(1): 43-48.
Rahmawati, F., M. Bintang dan I. M. Artika. 2017. Antibacterial Activity and Phytochemical Analysis of
Geranium homeanum Turez Leaves. Current Biochemistry. 4(3): 13-22.
Rota, M. C., A. Herrera, R. M. Martinez, J.A. Sotomayor dan M. J. Jordan. 2008. Antimicrobial Activity and Chemical Composition Of Thymus vulgari, Thymus zygis and Thymus hyemalis Essential Oil. Food Control. 19: 681-687.
Santika. 2001. Agribisnis Cabai. Penebar Swadaya. Jakarta.
Sudirga, S. K. 2016. Isolasi dan Identifikasi Jamur Colletotrichum spp. Isolat PCS Penyebab Penyakit Antraknosa Pada Buah Cabai Besar (Capsicum annum L.) di Bali. Jurnal Metamorfosa. 3(1): 23-30.
Suharjo, R. dan T. N. Aeny. 2011. Eksplorasi Potensi Gulma Siam (Chromolaena odorata) Sebagai Biofungisida Pengendali Phytopthora palmivora) yang Diisolasi Dari Buah Kakao. Jurnal HPT Tropika. 11(2): 201
209.
121
Discussion and feedback