KUALITAS SPERMATOZOA MENCIT JANTAN DEWASA (Mus musculus L.) SETELAH DIBERIKAN MONOSODIUM GLUTAMAT (MSG)
on
JURNAL SIMBIOSIS I (1) :40- 50
Jurusan Biologi FMIPA Universitas Udayana
ISSN : 2337-7224
KUALITAS SPERMATOZOA MENCIT JANTAN DEWASA (Mus musculus L.) SETELAH DIBERIKAN MONOSODIUM GLUTAMAT (MSG)
Oleh:
Ni Made Lina Pebrianti
Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana
INTISARI
Penelitian yang bertujuan mengetahui kualitas spermatozoa mencit jantan dewasa (Mus musculus L.) setelah diberikan MSG telah dilakukan di Laboratorium Struktur Hewan Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, dari bulan Oktober 2011 sampai November 2011.Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan subjek mencit jantan dewasa umur 3 bulan, berat 25-35 gram sebanyak 32 ekor, yang terdiri atas 4 perlakuan yaitu; kontrol, perlakuan pertama sebanyak 1,5 mg/g bb, perlakuan kedua 3 mg/g bb dan perlakuan ketiga sebanyak 4,5 mg/g bb. Tiap perlakuan terdiri atas 4 kali ulangan yang masing-masing ulangan terdiri atas 2 ekor. Variabel yang diamati yaitu motilitas, viabilitas, morfologi dan jumlah spermatozoa. Hasil penelitian menunjukkan bahwa pemberian MSG menyebabkan penurunan viabilitas spermatozoa, menurunkan kualitas motil spermatozoa, serta meningkatkan abnormalitas morfologi spermatozoa secara bermakna dimana p< 0,05. Hal ini dikarenakan MSG berlebih menyebabkan peningkatan natrium dan pembentukan ROS yang mengakibatkan stress oxidative dan menyebabkan kerusakan sel, jaringan dan organ, khususnya untuk sistem reproduksi.
Kata kunci: Mencit jantan, monosodium glutamat (MSG), kualitas spermatozoa, ROS.
ABSTRACT
This research aimed to know the sperm quality of mice (Mus musculus L.) which are given monosodium glutamate (MSG), it was carried out from Oktober to November 2011 at Animal Structure Laboratory of Biology FMIPA Udayana University.This study uses a design with the subject of mice aged 3 months, 25-35 gram, total 32 mice consisting of 4 treatment, is control, 1,5 mg/g bb, 3mg/g bb and 4 mg/g bb. Each treatment consisting of 4 replications, each consisting of 2 mice. Data were analyzed with defferent real 5% and if followed by a LSD test. This results showed the given MSG causes decreased sperm viability degrade the quality of motil sperm and increased abnormalities in sperm morphology were significantly difference (p < 0,05). This is because the MSG excess natrium leads to increased formation of ROS and the resulting stress oxidative and cause cell damage tissues and organs, especially to the reproductive system.
Keywords: Mice, monosodium glutamate, sperm quality, ROS.
Monosodium glutamat (MSG) adalah garam sodium “L glutamate acid” yang sering digunakan sebagai bahan penyedap masakan untuk merangsang selera atau mengaktifkan rasa (Dhindsa et al., 1981). Pada permulaan tahun 1900, substansi yang dapat mengaktifkan rasa ini diisolasi dari ganggang laut dan diidentifikasi oleh Ikeda sebagai garam “L glutamate acid”.
Rangsangan selera dari makanan yang diberi MSG disebabkan oleh kombinasi rasa khas dari efek sinergis MSG dengan 5 ribonukleotida yang terdapat di dalam makanan dan bekerja pada membran sel reseptor kecap (Cogan et al., 1979).
Penggunaan MSG dalam makanan biasanya dilakukan dalam jangka waktu pemakaian yang cukup lama dan MSG diperjualbelikan secara bebas. Total pemakaian MSG pada beberapa negara cukup tinggi, yaitu antara lain di Jepang yang mencapai 65.000 ton per tahun, Korea yang mencapai 30.000 ton per tahun, dan Amerika yang mencapai 26.000 ton per tahun (Cogan et al., 1979).
Sampai saat ini belum diketahui secara pasti jumlah MSG yang aman untuk dikonsumsi per harinya (Anonim, 1996). Namun jika Mengkonsumsi MSG dalam
skala kecil masih tidak berbahaya. Asupan MSG dalam jumlah yang besar dapat menyebabkan Chinese restaurant syndrome yang dapat mengakibatkan rasa terbakar pada daerah leher bagian belakang menjalar ke tangan dan dada, mati rasa pada daerah belakang leher, hangat, lemah pada wajah, punggung, leher, dan tangan, rasa kaku pada wajah, nyeri dada, mual, dan mengantuk (Anonim, 1996), selain itu juga dapat menyebabkan nekrosis pada neuron hipotalamus, nukleus arkuata hipotalamus, kemandulan pada jantan dan betina, berkurangnya berat hipofisis anterior, adrenal, tiroid, uterus, ovarium, dan testis, kerusakan fungsi reproduksi, dan berkurangnya jumlah anak (Geha et al., 2000).
Melihat luas dan bebasnya pemakaian MSG dalam kehidupan sehari-hari baik pada makanan maupun jajanan anak-anak seperti yang disebutkan oleh Cogan et al, (1979), serta berdasarkan berbagai penelitian, maka perlu diadakan penelitian terhadap hewan uji yaitu mencit jantan dewasa (Mus musculus L.) dengan pemberian MSG dosis berbeda untuk melihat kualitas spermatozoa.
-
II. METODE PENELITIAN
Alat dan Bahan
Alat-alat dan bahan yang digunakan dalam penelitian ini antara lain mikroskop, disecting set, hand counter, timbangan, sonde (spuit yang ujung jarumnya ditumpulkan), gelas ukur, flakon, cawan petri, pipet tetes, batang pengaduk, hemositometer dan kaca preparat, mencit jantan dewasa (Mus musculus L.) umur sekitar tiga bulan dengan berat 25-35 gram, monosodium glutamat (MSG) murni, NaCl 0,9%, kauda epididimis mencit jantan dewasa, pewarna Eosin 2 % dalam aquades, formalin 2% dalam aquades, dan aquades.
Rancangan Percobaan
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL). Hewan percobaan yang digunakan adalah mencit jantan dewasa yang berjumlah 32 ekor yang dibagi menjadi 4 perlakuan dengan 4 kali ulangan. Setiap ulangan terdiri atas 2 ekor mencit, dimana:
M0 = kontrol, diberikan air
M1 = diberikan MSG sebanyak 1,5 mg/g bb M2 = diberikan MSG sebanyak 3 mg/g bb M3 = diberikan MSG sebanyak 4,5 mg/g bb
Tabel 1. Pengelompokan mencit jantan
|
Konsentrasi |
Ulangan (n) | |||
|
Kontrol |
M01 (2) |
M02 (2) |
M03 (2) |
M04 (2) |
|
1,5 mg/gr bb |
M11 (2) |
M12 (2) |
M13 (2) |
M14 (2) |
|
3 mg/gr bb |
M21 (2) |
M22 (2) |
M23 (2) |
M24 (2) |
|
4,5 mg/gr bb |
M31 (2) |
M32 (2) |
M33 (2) |
M34 (2) |
dewasa (Mus musculus L.) dengan pemberian monosodium glutamat (MSG) dan kontrol
Pemeliharaan Hewan Percobaan
Penelitian ini menggunakan mencit jantan dewasa (Mus musculus L.) sebagai hewan percobaan. Kisaran umur mencit yang digunakan sekitar tiga bulan dengan berat badan 25-35 gram, sebelum diberi perlakuan, 32 mencit jantan dewasa (Mus musculus L.) yang digunakan sebagai hewan percobaan diaklimatisasi selama 7 hari. Kandang yang digunakan selama pemeliharaan berupa bak plastik yang berukuran panjang 39 cm, lebar 31 cm dan tinggi 15 cm yang ditutup dengan penutup kawat dan dialasi dengan sekam.
Mencit diberi pakan berupa konsentrat dan air minum yang diberikan secara ad libitum.
Pemberian Perlakuan
Perlakuan diberikan secara oral dengan menggunakan jarum gavage sekali sehari selama 35 hari sebanyak 0,5 ml sedangkan kelompok kontrol diberikan air.
Variabel yang Diamati
a. Motilitas Spermatozoa
Sehari setelah perlakuan, mencit dibunuh dan dibedah. Spermatozoa diambil dari kauda epididimis. Salah satu kauda epididimis diletakkan pada cawan petri yang telah berisi 2 ml NaCl 0,9% kemudian organ dicacah menjadi potongan-potongan kecil. Suspensi spermatozoa dalam NaCl 0,9% diteteskan pada kaca objek sebanyak satu tetes dan diamati dibawah mikroskop dengan perbesaran 100 kali. Pengamatan diulang dua kali untuk satu ekor mencit. Jumlah spermatozoa yang motil dihitung berdasarkan kriteria WHO yaitu, kategori 0 (spermatozoa tidak bergerak sama sekali), kategori 1 (spermatozoa bergerak lambat), kategori 2 (spermatozoa bergerak ke depan dengan kecepatan sedang atau berputar-putar) dan kategori 3 (spermatozoa bergerak cepat lurus ke depan) (Anonim, 1988). Persentase jumlah
spermatozoa motil ditentukan dengan menjumlahkan kategori 2 dan 3, dibagi dengan banyaknya spermatozoa yang diamati kemudian dikalikan 100%. Pengamatan dilakukan 2 kali pada masing-masing mencit (Subratha, 1999).
Suspensi spermatozoa dipipet sebanyak 1 tetes, kemudian diletakkan pada gelas benda, dilanjutkan fiksasi dengan formalin 2% dalam aquades selama 10 menit lalu dibuat apusan. Setelah kering diberi pewarna Eosin 2% dalam aquades selama 15 menit kemudian dibilas dengan aquades dan diamati dibawah mikroskop dengan pembesaran 400 kali. Pengamatan diulang 2 kali pada masing-masing mencit. Spermatozoa yang hidup tidak berwarna sedangkan spermatozoa mati berwarna merah dan hasilnya dinyatakan dalam persen (Subratha, 1999).
Pemeriksaan morfologi dapat diamati pada sediaan apusan spermatozoa yang menggunakan pewarna Eosin 2% dengan menggunakan mikroskop pembesaran 400 kali. Pemeriksaan morfologi ditekankan pada kelainan bentuk atau abnormalitas
spermatozoa. Bentuk spermatozoa disebut abnormal bila terdapat satu atau lebih bagian spermatozoa yang abnormal (kepala, midpiece dan ekor). Pengamatan diulang 2 kali pada masing-masing mencit. Hasil dinyatakan dalam persen (Subratha, 1999).
Suspensi spermatozoa diteteskan pada kamar hitung Neubauer/hemositometer dan diamati di bawah mikroskop dengan pembesaran 100 kali. Pengamatan diulang dua kali pada masing-masing mencit, jumlah dinyatakan dengan satuan juta per kauda epididimis (Ekayana, 2004).
Analisa Data
Data yang diperoleh dari hasil penelitian ini dianalisa secara statistika dengan Analysis of Variance (ANOVA) menggunakan Software SPSS Release For Window versi 15, satu faktor perlakuan dengan 4 kali ulangan dan apabila terdapat pengaruh MSG terhadap perlakuan atau berbeda nyata taraf 5% maka dilanjutkan dengan uji LSD.
-
III. HASIL DAN PEMBAHASAN
Viabilitas Spermatozoa
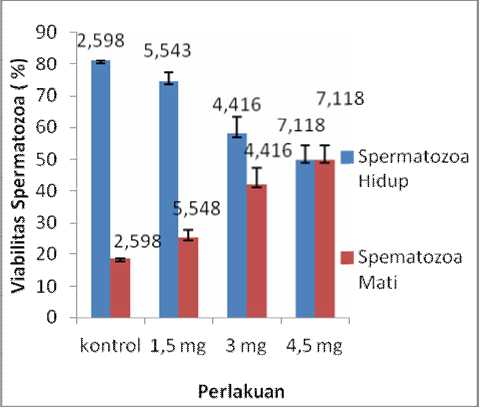
Berdasarkan analisis dengan uji one way Anova menunjukkan bahwa pemberian MSG menyebabkan penurunan jumlah spermatozoa hidup dan peningkatan jumlah spermatozoa mati secara bermakna (p < 0,05). Berdasarkan uji LSD dengan Post Hoc test terdapat perbedaan bermakna (p < 0,05) antara dosis 3 mg dan 4,5 mg. Nilai mean viabilitas spermatozoa hidup adalah kontrol = 81,25; 1,5 mg = 74,62; 3 mg = 58,00; 4,5 mg = 50,00. Nilai mean viabilitas
spermatozoa mati adalah kontrol = 18,75; 1,5 mg = 25,37; 3 mg = 42,00; 4,5 mg = 50.00 (gambar 1).
Gambar1. Grafik rata-rata viabilitas spermatozoa.
(a) (b)
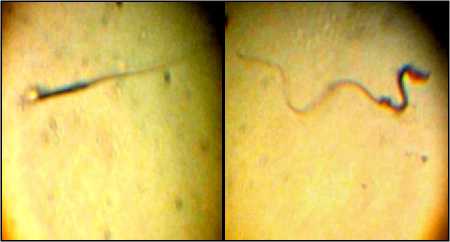
Gambar 2. (a) Spermatozoa hidup dengan kepala berwarna bening, (b)Spermatozoa mati dengan kepala berwarna merah.
Berdasarkan hasil penelitian ini, pemberian MSG 3 mg/g bb dan 4,5 mg/g bb pada mencit jantan dewasa secara oral menyebabkan terjadinya penurunan viabilitas spermatozoa. Hal ini disebabkan karena MSG mengandung natrium sehingga bila dikonsumsi dalam dosis berlebih maka akan menyebabkan peningkatan natrium dalam tubuh, selain itu MSG juga dapat membentuk Reactive oxygen species (ROS), dimana keduanya akan sama-sama merusak membran plasma spermatozoa. Berdasarkan penelitian Nayanatara et al., (2008), pemberian MSG 4 g/kg selama 15 hari dan 30 hari secara intraperitoneal pada tikus jantan dewasa memperlihatkan bahwa, salah satu mekanisme yang mungkin berperan dalam timbulnya ROS akibat pemberian MSG berlebih, disebabkan karena terjadi penurunan asam askorbat dimana asam
askorbat merupakan antioksidan yang dapat mendonorkan elektronnya sehingga dapat mencegah zat lain teroksidasi. Peningkatan kadar ROS akan menghasilkan stress oksidatif akibat kadar ROS melampaui batas pertahanan antioksidan tubuh sehingga akan menyebabkan kerusakan sel, jaringan dan organ (Sikka, 2004).
Stress oksidatif adalah suatu kondisi dimana terjadi peningkatan kerusakan seluler yang disebabkan oleh oksigen dan oxygenderived oxidants yang lebih dikenal sebagai ROS. Proses ini adalah hasil dari ketidakseimbangan antara produksi dan eliminasi ROS, dimana terjadi peningkatan pembentukan ROS tanpa diimbangi oleh eliminasinya oleh antioksidan dalam tubuh. Pembentukan ROS adalah proses fisiologi tubuh, namun apabila terjadi peningkatan yang berlebihan maka akan berpengaruh negatif terhadap tubuh. Menurut Sikka (2004), tingginya kadar ROS pada sperma menyebabkan 40,88 % pasien pria mengalami infertilitas.
Kerusakan membran plasma oleh ROS dan natrium berlebih pada spermatozoa menyebabkan pompa natrium tidak lagi berfungsi dengan baik untuk mengatur sirkulasi zat-zat dari dan keluar sel sehingga pewarna Eosin masuk ke dalam sel dan tetap
tinggal di dalam dan mewarnai spermatozoa menjadi merah terutama pada bagian kepala. Spermatozoa yang hidup memiliki membran plasma yang masih utuh sehingga pompa natrium dapat berfungsi dengan baik.
Motilitas Spermatozoa
Berdasarkan analisis dengan uji one way Anova menunjukkan bahwa pemberian MSG menyebabkan penurunan jumlah spermatozoa gerak cepat dan peningkatan jumlah spermatozoa tidak bergerak atau diam secara bermakna (p < 0,05), berdasarkan uji LSD dengan Post Hoc test terdapat perbedaan bermakna (p < 0,05) antara kontrol dengan perlakuan. Tetapi tidak terdapat perbedaan secara bermakna jumlah spermatozoa gerak pelan/berputar dan spermatozoa gerak ditempat (p > 0,05). Nilai mean dari motilitas spermatozoa kategori gerak cepat (kontrol = 21,56; 1,5 mg = 13,20; 3 mg = 4,67; 4,5 mg = 0,82), kategori gerak ditempat (kontrol = 20,31; 1,5 mg = 20,08; 3 mg = 16,26; 4,5 mg = 18,06), kategori gerak pelan (kontrol = 30,61; 1,5 mg = 25,23; 3 mg = 19,25; 4,5 mg = 26,45), kategori diam (kontrol = 26,52; 1,5 mg = 42,27; 3 mg = 52,61; 4,5 mg = 68,68) (gambar 3).
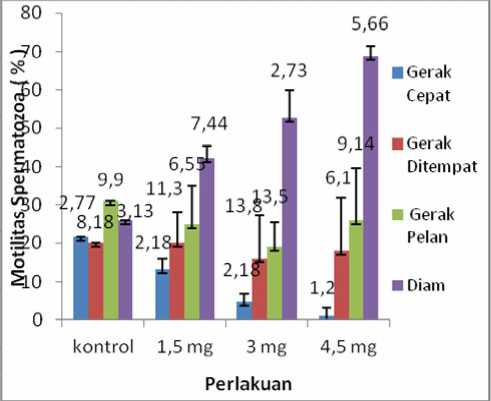
Gambar 3. Grafik rata-rata motilitas spermatozoa
Motilitas spermatozoa dibagi mejadi empat kategori yaitu spermatozoa gerak cepat, gerak pelan, gerak ditempat, dan diam. Pada penelitian ini, MSG menyebabkan penurunan jumlah spermatozoa kategori gerak cepat spermatozoa dan sebaliknya terjadi peningkatan jumlah spermatozoa kategori diam. Hal ini disebabkan karena sperma mamalia kaya akan asam lemak tidak jenuh pada membran plasma sehingga sangat rentan terhadap serangan ROS (Tremallen, 2008).
Alat gerak spermatozoa terletak pada bagian ekor spermatozoa yang disusun oleh aksonema. Aksonema terdiri dari sepasang mikrotubulus sentral dan dikelilingi 9 pasang mikrotubulus di luarnya. Mikrotubulus luar terdiri dari subfibril A dan subfibril B yang
disusun oleh protein dinein. Protein dinein dapat menghidrolisis ATP yang dipergunakan untuk motilitas sperma, tetapi ROS menyebabkan penurunan produksi ATP pada mitokondria sehingga protein dinein tidak dapat menghidrolisis ATP dan mengakibatkan terganggunya motilitas spermatozoa (Purwaningsih, 1996).
Morfologi Spermatozoa
Berdasarkan analisis dengan uji one way Anova menunjukkan bahwa pemberian MSG menyebabkan penurunan jumlah spermatozoa normal dan peningkatan jumlah spermatozoa abnormal secara bermakna (p < 0,05) Berdasarkan uji LSD dengan Post Hoc test terdapat perbedaan bermakna (p < 0,05) antara kontrol dengan perlakuan namun tidak terdapat perbedaan bermakna antar kelompok perlakuan (p > 0,05). Nilai mean dari morfologi spermatozoa kategori abnormal adalah kontrol = 26,75; 1,5 mg = 43,00; 3 mg = 46,25; 4,5 mg = 50,50 dan nilai mean dari morfologi spermatozoa untuk kategori normal adalah kontrol = 73,25; 1,5 mg = 57,00; 3 mg = 53,75; 4,5 mg = 49,50 (gambar 4). Adapun kelainan morfologi spermatozoa setelah diberikan MSG selama 35 hari adalah spermatozoa tanpa kepala, spermatozoa tanpa
ekor, ekor spiral, kepala amorf dan kepala mikro (gambar 5).
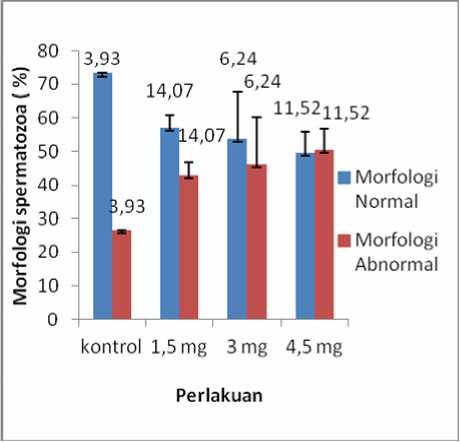
Gambar4. Grafik rata-rata morfologi spermatozoa
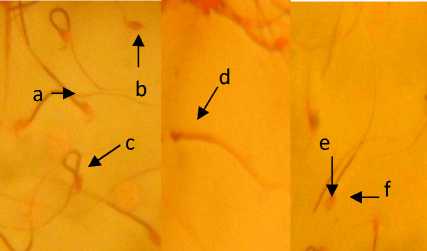
Gambar5. Morfologi spermatozoa; (a) spermatozoa normal, (b) tanpa ekor, (c) ekor melingkar, (d) kepala mikro, (e) tanpa kepala, (f) kepala amorf.
Pada penelitian ini ditemukan adanya abnormalitas primer dan sekunder pada spermatozoa. Abnormalitas primer yang
terlihat berupa kepala kecil, kepala amorf dan ekor spiral, sedangkan abnormalitas sekunder yang terlihat yaitu spermatozoa tanpa kepala dan tanpa ekor. Hal ini disebabkan karena ROS mempengaruhi membran plasma spermatozoa yang mengandung fosfolipid dan asam lemak tak jenuh dalam jumlah besar, dimana asam lemak tak jenuh rentan terhadap ROS terutama radikal hidroksil yang merupakan turunan paling reaktif, ini dikarenakan radikal hidroksil akan menimbulkan reaksi rantai yang disebut peroksidasi lipid sehingga berakibat terputusnya rantai asam lemak menjadi senyawa yang bersifat toksik terhadap sel spermatozoa, antara lain malondialdehida (MDA),9-hidroksi-noneal,etana(C2H6) dan pentana (C5H12) (Tremallen, 2008).
Proses peroksidasi dimulai dengan terbentuknya carbon centered radical pada lapisan fosfolipid dan selanjutnya bereaksi dengan oksigen membentuk radikal bebas baru yaitu radikal bebas peroksil. Radikal peroksil cukup reaktif untuk menyerang asam lemak di sekitarnya sehingga dapat terbentuk lipid hidroperoksida dan carbon centered radical yang baru dan disebut radikal hidroksil. Penimbunan hidroperoksida lipid pada membran akan menyebabkan gangguan pada fungsi sel. Hal inilah sebagai agen
utama perubahan morfologi spermatozoa dari normal menjadi abnormal (Ammikhalid, 2010).
Jumlah Spermatozoa
Berdasarkan analisis dengan uji one way Anova menunjukkan bahwa pemberian MSG tidak menyebabkan penurunan maupun peningkatan jumlah spermatozoa secara bermakna (p < 0,05). Nilai mean dari jumlah spermatozoa adalah kontrol = 691,5; 1,5 mg
= 507,12; 3 mg = 397,0; 4,5 mg = 514,5
(gambar 6).
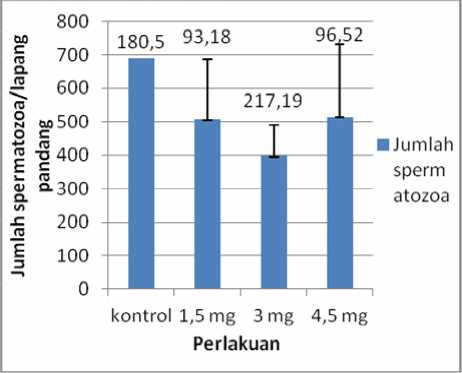
Gambar 6. Grafik rata-rata jumlah spermatozoa
Pada penelitian ini MSG tidak mempengaruhi jumlah spermatozoa. Hal ini sejalan dengan penelitian yang dilakukan oleh Suparni (2009) menggunakan mencit jantan dewasa dengan pemberian MSG secara intraperitoneal sebanyak 4 mg/g bb
yang dilarutkan dalam NaCl 0,9% selama 15 dan 30 hari dan dilanjutkan dengan pemberian vitamin C 0,2 mg/g bb selama 15 hari berikutnya menyebutkan bahwa, kemungkinan penurunan jumlah sel Leydig oleh ROS belum menurunkan kadar testosteron intratestikular sehingga tidak berpengaruh terhadap spermatogenenesis atau ROS belum mampu menurunkan jumlah sel Leydig, sehingga tidak terjadi penurunan spermatozoa. Tetapi hasil ini tidak sejalan
dengan penelitian Nayanatara et al., (2008) yang kemungkinan dikarenakan subyek yang digunakan berbeda yaitu rat.
SIMPULAN
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa pemberian MSG menyebabkan penurunan viabilitas spermatozoa, menurunkan kualitas motil spermatozoa, serta meningkatkan abnormalitas morfologi spermatozoa.
KEPUSTAKAAN
Ammikhalid. 2010. Analisis Tingkat Peroksidasi Lipid dengan MDA.
Available at:
http://analisis_tingkat_peroksidasi_lipid_wordpress.com.
Opened :20.02.2012
Anonim. 1988. Penuntun Laboratorium WHO untuk Pemeriksaan Semen Manusia dan Interaksi Semen-Getah Servik. Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Jakarta.
Anonim. 1996. Monosodium Glutamate. FDA Medical Bulletin. 26 Number 1.
Cogan, R. H., K.Tori dan M.R. Kare. 1979. Biochemical Studies of Glutamate Taste Receptor: The Synergistic Ribonucleotides. Raven Press. New York.
Dhindsa, K.S., R.G. Omran dan R. Bhup. 1981. Histological Changes in the Thyroid Gland Induces by Monosodium Glutamate in Mice. Acta. Anat: 109.
Geha, R., A. Beiser, C. Ren, R. Patterson, P. Greenberger, I. Grammer, A. Ditto, K. Harris, M. Saughnessy, P. Yarnold, J. Corrent dan A. Saxon. 2000. Review of Alleged Reaction to Monosodium Glutamate and Outcome of A Multicenter Double-Blind Placebo-Controlled Study. The Journal of Nutrition, 130, 1058S-1062S.
Ekayana, A. 2004. Pengaruh Pemberian Infus dalam Gandarusa (Justica gandarussa Brurm. f.) terhadap Produksi dan Kualitas Spermatozoa pada Kauda Epididimis Tikus Putih (Rattus norvegicus). Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana. Skripsi S-1. Tidak dipublikasikan
Nayanatara, A., N. Vinodini, G. Damodar, B. Ahamed, C. Ramaswamy, dan B. R. Shabarinath. 2008. Role of Ascorbic Acid in Monosodium Glutamate Mediated Effect on Testicular Weight, Sperm Morphology and Sperm Count, in Rat Testis. Journal of Chinese Clinical Medicine, 3, 1-5.
Purwaningsih, E. 1996. Morfologi Spermatozoa Adakah Kaitannya dengan Kehamilan. Jurnal Kedokteran YARSI, 4 (1), 54-65.
Sikka, S. 2004. Role of Oxidative Stress and Antioxidant in Andrology, Journal of Andrology. 25 (1) 2699-2722.
Subratha, I. M. 1999. Analisis Sperma Rutin. PT Upada Sastra. Bali.
Suparni. 2009. Pengaruh Pemberian Vitamin C Terhadap Jumlah Sperma dan Morfologi Sperma Mencit Jantan Dewasa (Mus musculus L.) yang Dipaparkan Monosodium Glutamat (MSG). Universitas Sumatera Utara. Medan
Tremallen, K. 2008. Oxidative Stress and Male Infertility – A Clinical Perspective. Human Reproduction Update, 1 – 16.
Discussion and feedback