THE MORPHOLOGICAL CHARACTERISTICS OF ADAPTED LAMTORO (Leucaena leucocephala CV TARRAMBA) pH 3.4 THAT PRODUCED BY 40GY GAMMA RAY IRRADIATION BASED ON DIFFERENCES OF CYTOKININS IN TISSUE CULTURE
on
pastura Vol. 8 No. 2 : 63 - 68
p-ISSN 2088-818X e-ISSN 2549-8444
KARAKTERISTIK MORFOLOGI KALUS LAMTORO (Leucaena leucocephala CV TARRAMBA) TERADAPTASI pH 3.4 HASIL IRADIASI SINAR GAMMA 40Gy BERDASARKAN PERBEDAAN SUMBER SITOKININ (KINETIN, BAP, TDZ) PADA KULTUR JARINGAN
Prihantoro, I1), Anandia, A2), Aryanto, A. T.3), Karti, P. D. M. H.4) 1,2,3,4Depertemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Jl. Agatis Kampus IPB Dramaga Bogor, Jawa Barat. Kode Post 16680 – Indonesia
Email: iprihantoro@yahoo.com
ABSTRAK
Lamtoro merupakan tanaman leguminosa pohon dengan kandungan protein tinggi yang memiliki tingkat adaptasi lingkungan yang luas terhadap cekaman kering, tetapi kemampuan adaptasi lamtoro terhadap cekaman masam relatif terbatas. Pemutasian lamtoro melalui iradiasi sinar gamma dosis 40 Gy pada tingkat kalus melalui kultur jaringan menghasilkan kandidat kalus lamtoro teradaptasi asam pada pH 3.4. Penelitian ini bertujuan untuk mengukur karakteristik morfologi kalus lamtoro cv Tarramba teradaptasi pH 3.4 hasil iradiasi sinar gamma 40Gy berdasaarkan perbedaan sumber sitokinin (kinetin, BAP, TDZ) pada kultur jaringan. Rancangan penelitian adalah RAL dengan 3 perlakuan perbedaan sumber sitokinin (kinetin, BAP dan TDZ) dan 10 ulangan. Hasil penelitian menunjukkan sumber sitokinin TDZ 0.5 ppm memberikan respon diameter kalus terbaik serta mampu menghasilkan tekstur kalus yang remah, tetapi menunjukkan respon warna kalus yang cenderung hijau muda.
Kata kunci: Leucaena leucocephala cv Tarramba, morfologi kalus, teradaptasi pH 3.4, iradiasi sinar gamma, sitokinin
THE MORPHOLOGICAL CHARACTERISTICS OF ADAPTED LAMTORO (Leucaena leucocephala CV TARRAMBA) pH 3.4 THAT PRODUCED BY 40GY GAMMA RAY IRRADIATION BASED ON DIFFERENCES OF CYTOKININS IN TISSUE CULTURE
ABSTRACT
Lamtoro, a legume tree plant with high protein content that has a wide range of environmental adaptation to dry stress, but relatively limited to acid stress. Mutation of lamtoro through 40 Gy gamma ray irradiation on callus culture produces lamtoro callus candidates adapted with pH 3.4. Aim of the study was to measure the morphological characteristics of adapted lamtoro cv Tarramba pH 3.4 that produced by 40Gy gamma ray irradiation based on differences of cytokinins in tissue culture. The study used complete randomized design with three treatments of different sources of cytokines i.e. kinetin, BAP and TDZ with 10 replications. The results showed that 0.5 ppm TDZ was the best treatment in callus diameter, and produced crumbly callus texture, but showed callus color response that tended to be light green.
Keywords: Leucaena leucocephala cv Tarramba, callus morphology, pH 3.4 adaptation, gamma rays irradiation, cytokinins
PENDAHULUAN
Lamtoro (Leucaena leucocephala cv Tarramba) merupakan salah satu jenis tanaman pakan kelompok leguminosa sumber protein dengan kemampuan adaptasi yang tinggi terhadap lingkungan kering dan tahan kutu loncat. Lamtoro mengandung komposisi zat kimia berupa 25,90% protein kasar, 20,40% serat kasar dan 11% abu (2,3% Ca dan 0.23% P), karotin 530.000 mg/kg dan tannin 10,15% mg/ kg (NAS 1984)
dengan tingkat produktivitas tinggi (11 ton BK ha-1) dibanding kultivar lokal (8,1 ton BK ha-1) (Bamuallim 2011). Meskipun demikian, pertumbuhan tanaman lamtoro kurang baik pada pH di bawah 5 (Purwantari et al. 2005).
Pemuliaan tanaman bertujuan untuk mendapatkan tanaman unggul yang mampu beradaptasi pada berbagai kondisi lingkungan yang diharapkan. Salah satu metode pemuliaan tanaman adalah melalui mutasi (Mugiono et al. 2009). Mutasi merupakan
suatu proses perubahan pada materi genetik dari suatu sel, yang mencakup perubahan pada tingkat gen, molekuler atau kromosom (Poehlman dan Slepper 1995). Pemuliaan tanaman merupakan suatu kegiatan mengubah susunan genetik individu maupun populasi tanaman untuk tujuan tertentu. Bahan mutagen yang sering dilakukan dalam penelitian pemuliaan diantaranya mutagen kimia dan mutagen fisik. Mutagen fisik salah satunya sinar gamma. Sinar gamma adalah bentuk sinar paling kuat dari bentuk radiasi yang diketahui, kekuatannya hampir mencapai 1 miliar kali lebih berenergi dibandingkan sinar-X. Penggunaan sinar gama sebagai mutagen lebih akurat dan penetrasi penyinaran ke dalam sel bersifat homogen (BATAN, 2006).
Pemuliaan tanaman melalui mutasi bermanfaat untuk perbaikan sebagian sifat tanaman dengan tidak perlu mengubah sifat asli tanaman untuk tetap dipertahankan (Shu et al., 2012). Mutasi induksi sementara ini merupakan metode pemuliaan yang paling efektif untuk perbaikan satu atau beberapa sifat yang tidak diinginkan (Anna et al., 2013). Salah satu sifat yang ingin ditingkatkan dari tanaman lamtoro var Tarramba adalah ketahanan terhadap pH rendah yang membuat pertumbuhan dan produktivitas terganggu. Berdasarkan penelitian Manpaki et al. (2017) telah didapatkan kalus yang tumbuh baik pada pH 3.4 hasil iradiasi sinar gamma 40 Gy.
Kalus merupakan kumpulan sel tanaman yang amorphous (tidak berbentuk atau belum terdiferensiasi) yang terbentuk dari sel-sel yang membelah terus menerus secara in vitro (Hartman dan Kester 1983). Kalus tersebut perlu dikembangkan menjadi tanaman baru melalu teknik embriogenesis somatik. Embriogenesis somatik merupakan suatu proses sel-sel somatik (baik haploid maupun diploid) berkembang membentuk tumbuhan baru melalui tahapan perkembangan embrio yang spesifik tanpa melalui fusi gamet (Williams dan Maheswara 1986). Proses embriogenesis dipengaruhi oleh beberapa faktor, antara lain adalah genotip tanaman, sumber eksplan, komposisi media, zat pengatur tumbuh dan keadaan fisiologi sel. Dua golongan zat pengatur tumbuh yang sangat penting adalah sitokinin dan auksin. Di antara jenis sitokinin untuk kultur jaringan adalah kinetin, BAP, TDZ dan auksin adalah NAA (Naphthalene Acetic Acid). Secara umum diketahui bahwa auksin dalam konsentrasi tinggi mendorong embrio somatik secara efektif. Pada umumnya pemberian auksin ke dalam medium padat tanpa sitokinin dapat menginduksi kalus embriogenik, tetapi dengan penambahan sitokinin akan meningkatkan proliferasi kalus embriogenik (Purnamaningsih 2002). Menurut Sapsuha et al. (2011), penambahan auksin berupa NAA (Naphthalene Acetic Acid) 1,5 ppm
menjadikan media optimum dalam pertumbuhan kalus embriogenik lamtoro.
Asam amino merupakan salah satu faktor penunjang keberhasilan kultur jaringan sebagai salah satu sumber nitrogen yang berperan dalam induksi pembentukan kalus, regenerasi tunas adventif, embriogenesis, dan androgenesis eksplan (Das dan Mandal 2010). Glutamin merupakan salah satu jenis asam amino yang paling banyak digunakan pada kultur jaringan tanaman untuk berbagai tujuan, baik untuk induksi pembentukan maupun pertumbuhan kalus embriogenik (Das dan Mandal, 2010), induksi pembentukan dan proliferasi tunas (Patil et al., 2009), serta peningkatan kualitas (Wang et al., 2007). Penambahan glutamin pada konsentrasi 250 ppm merupakan konsentrasi terbaik, yakni mampu mendukung pertumbuhan volume kalus mencapai 102 mm3 per kalus dan 1,4 tunas per eksplan (Winarto 2011). Penelitian ini bertujuan untuk mengukur karakteristik morfologi kalus lamtoro cv Tarramba teradaptasi pH 3.4 hasil iradiasi sinar gamma 40Gy berdasaarkan perbedaan sumber sitokinin (kinetin, BAP, TDZ) pada kultur jaringan.
MATERI DAN METODE
Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kultur Jaringan Tanaman Pakan, Bagian Ilmu dan Teknologi Tumbuhan Pakan dan Pastura, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini dilakukan pada bulan Januari hingga April 2018.
Materi
Bahan yang digunakan sebagai eksplan dalam penelitian ini yaitu kalus tanaman lamtoro cv. Tarramba koleksi Laboratorium Kultur Jaringan Tanaman Pakan, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan IPB hasil iradiasi sinar gamma dosis 40 Gy dan terseleksi pada media asam (pH 3.4), spirtus, alkohol 70%, natrium hipoklorit (5%, 10% dan 20%), aquades, zat pengatur tumbuh dengan konsentrasi larutan stok NAA 1000 ppm (1,5 ml l-1 ) media, agarose, gula, media MS (Murashige Skoog), larutan stok kinetin, larutan stok TDZ (thidiazuron), larutan stok BAP (Benzyl amino purine), dan glutamin. Peralatan yang digunakan dalam penelitian meliputi, botol kultur (kapasitas 100 ml), plastic wrap, alumunium foil, botol, cawan petri, laminar air flow, sudip, sendok, pipet volumetrik 0.5 ml, bulp, gunting, label, gelas piala, jangka sorong, magnetic stirer, Munsell Color Plant Tissue Book, pH meter, dan autoclave.
Prosedur
Persiapan Ruang dan Alat
Sterilisasi ruang dengan formalin dan kalium permanganat (KMnO4) konsentrasi 5 : 3. Suhu ruang diatur ± 20ºC dengan pencahayaan lampu flourescent ± 2298 lux selama 16 jam/hari. Sterilisasi alat (botol kultur, sudip, pinset, cawan petri, dan botol selai) menggunakan autoclave pada suhu 121ºC dengan tekanan 17.5 psi selama 15 menit.
Pembuatan Media
Media terdiri dari media MS + NAA 1,5 ppm + Glutamin 250 ppm + Sitokinin (Kinetin, BAP, TDZ). Tahapan pembutan media meliputi: sebanyak Murashige Skoog 4,43 g dan gula 30 g dilarutkan dalam akuades 1 l dan dihomogenkan menggunakan magnetic stirer. Larutan media yang telah homogen ditetapkan pada pH 6,8. Selanjutnya ditambahkan agarose sebanyak 7 g l-1 dan dipanaskan hingga mendidih. Masing-masing media tersebut dimasukkan ke dalam botol kultur ± 15 ml dan ditutup menggunakan alumunium foil. Media tanam kemudian disterilisasi menggunakan autoclave pada suhu 121ºC dan tekanan 17,5 psi selama 15 menit. Media yang sudah steril siap dipergunakan atau disimpan sesuai kebutuhan.
Penanaman Eksplan pada Media Perlakuan
Kalus lamtoro koleksi terpilih dipotong menjadi bagian yang lebih kecil untuk ditanam dalam media perlakuan. Eksplan berupa potongan kalus, dipindahkan ke dalam media perlakuan melalui teknik subkultur dalam laminar air flow.
Rancangan Percobaan dan Analisis Data Perlakuan
Perlakuan penambahan kombinasi zat pengatur tumbuh yang terdiri dari auksin dan sitokinin (kinetin, BAP, TDZ) dan glutamin dengan rincian sebagai berikut :
A : MS + NAA 1,5 ppm + Glutamin 250 ppm + Kinetin 0,5 ppm
B : MS + NAA 1,5 ppm + Glutamin 250 ppm + BAP 055 ppm
C : MS + NAA 1,5 ppm + Glutamin 250 ppm + TDZ 0,5 ppm
Rancangan Percobaan dan Analisis Data
Rancangan penelitian yang digunakan adalah rancangan acak lengkap (RAL) yang terdiri dari 3 perlakuan dengan 10 ulangan. Selanjutnya data dianalisis menggunakan metode deskriptif dan rancangan acak lengkap yang diuji dengan analisis ragam ANOVA. Apabila pada analisis ragam perlakuan yang dicobakan berpengaruh nyata maka akan dilakukan analisis lanjut dengan Uji Jarak Berganda Duncan (DMRT).
Peubah yang diamati
Peubah yang diamati pada penelitian meliputi :
-
1. Tinggi kalus
Pengukuran tinggi dilakukan menggunakan alat bantu jangka sorong dari bagian kalus di atas media hingga bagian tertinggi kalus.
-
2. Diameter Kalus
Pengukuran diameter dilakukan menggunakan alat bantu jangka sorong dari bagian bawah botol pada sisi terpanjang kalus.
-
3. Warna Kalus
Warna kalus diperoleh dengan mengukur perubahan warna pada awal dan akhir pengamatan dengan menggunakan Munsell Color Plant Tissue Color Book.
-
4. Tekstur Kalus
Tekstur kalus diamati berdasarkan bentuk kalus yang dihasilkan dalam setiap botol. Tekstur kalus terdiri dari bentuk remah dimana kalus terlihat tidak padat dan bentuk kompak di mana tekturnya lebih padat.
-
5. Viabilitas (%)
Viabilitas kalus dihitung dengan mengukur jumlah kalus yang dapat tumbuh dengan baik dari awal hingga hari terakhir pengamatan. Nilai viabilitas dihitung menggunakan rumus sebagai berikut :
(Jumlah kalus yang hidup pada setiap perlakuan) Viabilitas (%)= ×100
(Total kalus pada setiap perlakuan)
HASIL DAN PEMBAHASAN
Respon Viabilitas Kalus Lamtoro Tahan Asam terhadap Perbedaan Zat Pengatur Tumbuh
Viabilitas menggambarkan tingkat kemampuan kalus dalam beradaptasi dan bertahan terhadap lingkungan. Tingkat viabilitas kalus lamtoro tahan asam terhadap perbedaan zat pengatur tumbuh disajikan dalam Tabel 1.
Tabel 1. Respon viabilitas kalus lamtoro (Leucaena leucocephala) tahan asam perbedaan zat pengatur tumbuh
|
Peubah |
Perlakuan | ||
|
A |
B |
C | |
|
Kalus Hidup |
10 |
10 |
9 |
|
Kalus Mati |
0 |
0 |
1 |
|
Viabilitas (%) |
100 |
100 |
90 |
A (MS + NAA 1,5 ppm + Glutamin 250 ppm + Kinetin 0,5 ppm); B (MS + NAA 1,5 ppm + Glutamin 250 ppm + BAP 0,5 ppm); C (MS + NAA 1,5 ppm + Glutamin 250 ppm + TDZ 0,5 ppm).
Hasil penelitian menunjukkan bahwa tingkat viabilitas kalus cukup baik yakni ≥ 90%. Salah satu penyebab kematiaan kalus adalah proses pencoklatan. Proses pelukaan yang diberikan pada eksplan saat sub kultur diduga menjadi faktor yang mempengaruhi eksplan mengalami pencoklatan. Kerusakan ini
diakibatkan oleh senyawa fenol yang terakumulasi pada sel kemudian mengalami oksidasi. Hutami (2008) menjelaskan bahwa pencoklatan terjadi diakibatkan oleh enzim oksidase yang mengandung senyawa fenol yang disintesis dalam kondisi oksidatif ketika diberi pelukaan. Luka eksplan mengakibatkan terjadinya enzim dan substrat keluar dari sel kemudian terjadi ikatan antara hidrogen dengan protein yang diikuti dengan meningkatnya aktivitas fenilalanin amonia liase (PAL) yang memproduksi fenilpropanoid yang menyebabkan adanya pencoklatan.
Respon Pertumbuhan Kalus Lamtoro Tahan Asam terhadap Perbedaan Zat Pengatur Tumbuh
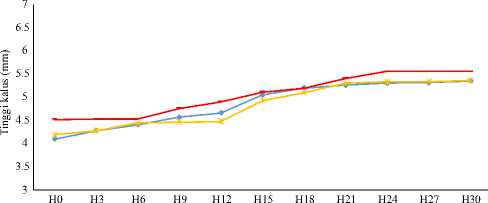
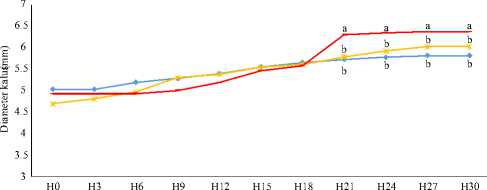
Respon pertumbuhan kalus didasarkan pada respon tinggi dan diameter kalus. Pertumbuhan merupakan faktor penting yang menggambarkan kemampuan berkembang kalus terhadap lingkungan. Kalus yang bertambah ukurannya merupakan indikator terpenuhinya kebutuhan hara bagi kalus. Pengaruh kombinasi zat pengatur tumbuh jenis auksin (NAA) dan sitokinin (kinetin, BAP, TDZ) serta glutamin terhadap pertambahan tinggi dan diameter kalus tanaman lamtoro (Leucaena leucocephala) yang telah diiradiasi sinar gamma 40 Gy dan tahan pada pH 3.4 disajikan pada Grafik 1.
Pola pertumbuhan kalus terhadap perbedaan sumber sitokinin, menunjukkan respon yang positif terhadap tinggi kalus dari semua perlakuan seiring bertambahnya umur kalus (Grafik 1a). Hasil sidik ragam tinggi kalus kelompok perlakuan, tidak menunjukkan beda nyata. Hasil ini menunjukkan bahwa perbedaan sumber sitokinin (kinetin, BAP, TDZ) tidak berbeda terhadap tinggi kalus dan ketiganya dimungkinkan sebagai sumber sitokinin dalam kultur kalus lamtoro. Respon berbeda dihasilkan terhadap diameter kalus, yakni diameter kalus dengan sumber sitokonin TDZ nyata lebih lebar (p<0.05) dibandingkan perlakuan dengan sumber sitokinin lainnya (Grafik 1 b). Hasil ini menunjukkan bahwa TDZ mampu mendukung kebutuhan sitokinin bagi kalus lamtoro teradaptasi asam. Hasil ini, selaras dengan Zhu et al. (2014) bahwa penambahan TDZ pada media kultur yang telah mengandung NAA adalah yang optimum untuk mendukung pertumbuhan kalus Tulipa edulis.
Yelnititis (2012) menyatakan bahwa penambahan TDZ pada media yang sudah mengandung auksin menyebabkan kandungan zat pengatur tumbuh di dalam kalus meningkat. Peningkatan tersebut menyebabkan jaringan mengalami cekaman sehingga terjadi pembelahan sel secara terus menerus dan akhirnya menyebabkan ukuran kalus bertambah besar. Selain itu, menurut Winarto (2011) penambahan glutamin dapat menginduksi pembentukan maupun
ABC
(a)
ABC
(b)
Gambar 1 Grafik respon pertumbuhan kalus lamtoro; (a) tinggi kalus umur 30 HST, (b) diameter kalus umur 30 HST
pertumbuhan kalus embriogenik dan mampu menginduksi pembentukan dan proliferasi tunas (Patil et al., 2009).
Respon Perubahan Warna Kalus Lamtoro Tahan Asam terhadap Perbedaan Zat Pengatur Tumbuh
Respon warna kalus lamtoro var Tarramba teradaptasi asam pada media dengan berbagai kombinasi zat pengatur tumbuh dan glutamin disajikan pada Tabel 2. Hasil penelitian menunjukkan, bahwa perbedaan sumber sitokinin memberikan respon yang berbeda terhadap warna kalus. Sumber sitokinin berupa kinetin memberikan dominan respon warna yang lebih hijau dibandingkan perlakuan lainnya. Tingkat warna kalus paling muda dihasilkan dari perlakuan C (TDZ).
Warna hijau menggambarkan tingkat klorofil kalus. Menurut Lizawati (2012) kualitas kalus yang baik memiliki warna yang hijau. Warna hijau pada kalus adalah akibat efek sitokinin dalam pembentukan klorofil. Menurut Wattimena (1992), sitokinin berperan dalam memperlambat proses senesensi (penuaan) sel dengan menghambat perombakan butir-butir klorofil dan protein dalam sel.
Pencoklatan merupakan peristiwa alamiah dan proses perubahan adaptif bagian tanaman akibat adanya pengaruh fisik seperti pengupasan dan pemotongan. Kalus dengan warna kecoklatan dimungkinkan akibat adanya metabolisme senyawa fenol yang bersifat toksik dan dapat menghambat pertumbuhan atau bahkan menyebabkan kematian jaringan (Yusnita 2004).
Tabel 2. Respon perubahan warna kalus lamtoro (Leucaena leucoceph-ala) tahan asam terhadap perbedaan zat pengatur tumbuh
|
Perlakuan |
Perubahan Warna | |||
|
Warna Awal |
Persentase (%) |
Warna Akhir |
Persentase (%) | |
|
A |
5GY 6/10 |
70 |
5GY 5/8 |
70 |
|
2.5GY 8/4 |
30 |
5GY 7/10 |
20 | |
|
2.5GY 9/3 |
10 | |||
|
B |
5GY 6/10 |
50 |
5GY 5/8 |
50 |
|
5GY 7/10 |
50 |
5GY 6/10 |
50 | |
|
5GY 6/10 |
50 | |||
|
C |
5GY 6/10 |
10 |
5GY 8/6 |
10 |
|
5GY 7/10 |
90 |
2.5GY 9/2 |
30 | |
|
2.5Y 5/6 |
10 | |||
|
5GY 9/6 |
50 | |||

Waraa KjiluiScsnkui
A (MS + NAA 1,5 ppm + Glutamin 250 ppm + Kinetin 0,5 ppm); B (MS + NAA 1,5 ppm + Glutamin 250 ppm + BAP 0,5 ppm); C (MS + NAA 1.5 ppm + Glutamin 250 ppm + TDZ 0,5 ppm)
Kecenderungan kalus berwarna kuning putihan sebagai indikasi kalus yang embriogenik. Peterson dan Smithm (1991) mengatakan bahwa kalus yang embriogenik dicirikan dengan warna kalus yang putih kekuningan dan mengkilat. Glutamin memiliki peran penting dalam dediferensiasi sel, proliferasi, dan menjaga potensi embriogenik eksplan (Ogita et al. 2001) dan sangat diperlukan untuk biosintesis asam amino, protein lain hingga auksin yang penting dalam pertumbuhan dan perkembangan sel tanaman (Winkel-Shirley 2001). Selanjutnya 250 ppm merupakan konsentrasi glutamin yang potensial memberikan pengaruh positif terhadap induksi pembentukan kalus (Winarto 2011).
Respon Tekstur Kalus Lamtoro Tahan Asam terhadap Perbedaan Zat Pengatur Tumbuh
Struktur sel kalus dapat diamati dengan melihat tekstur pada kalus yang terbentuk. Struktur kalus merupakan salah satu penanda yang dipergunakan untuk menilai kualitas suatu kalus. Hasil tekstur kalus berdasarkan perbedaan zat pengatur tumbuh disajikan dalam Tabel 3.
Tabel 3 Respon tekstur kalus lamtoro (Leucaena leucocephala) tahan asam terhadap perbedaan zat pengatur tumbuh
|
Peubah |
Perlakuan | ||
|
A |
B |
C | |
|
Tekstur Kalus (%) Remah |
10 |
0 |
30 |
|
Kompak |
90 |
100 |
70 |
A (MS + NAA 1,5 ppm + Glutamin 250 ppm + Kinetin 0,5 ppm); B (MS + NAA 1,5 ppm + Glutamin 250 ppm + BAP 0,5 ppm); C (MS + NAA 1.5 ppm + Glutamin 250 ppm + TDZ 0,5 ppm)
Hasil penelitian menunjukkan bahwa struktur kalus yang terbentuk dalam penelitian ini didominasi dengan struktur yang kompak. Perlakuan sitokinin berupa TDZ mampu meningkatkan jumlah kalus
bertekstur remah. Kalus dengan tekstur remah (friable), sebagai salah satu indikasi kualitas yang baik dan bersifat embriogenik. Struktur kalus yang remah dianggap baik karena memudahkan dalam pemisahan menjadi sel-sel tunggal pada kultur suspensi, di samping itu akan meningkatkan aerasi oksigen antar sel. Dengan demikian, dengan struktur tersebut upaya untuk perbanyakan dalam hal jumlah kalus yaitu melalui kultur suspensi lebih mudah (Lizawati 2012). Kalus bertekstur remah terbentuk akibat dari tingginya konsentrasi auksin dibandingkan dengan sitokinin serta penambahan asam amino (Yelnitis 2012). Menurut Zulkarnain dan Lizawati (2011) kalus yang bertekstur kompak diduga karena penggunaan komposisi media dan pemilihan kombinasi atau konsentrasi zat pengatur tumbuh dan asam amino yang kurang tepat.

(a) (b)
Gambar 2. Tekstur kalus lamtoro teradaptasi asam. (a) adalah kalus bertekstur remah (friable) dan (b) adalah kalus bertekstur kompak (non friable)
SIMPULAN DAN SARAN
Simpulan
Sumber sitokinin TDZ 055 ppm memberikan respon diameter kalus terbaik serta mampu menghasilkan tekstur kalus yang remah, tetapi menunjukkan respon warna kalus yang cenderung hijau muda.
Saran
Saran dari penelitian ini adalah (1) perlu dilakukan optimasi level TDZ untuk dihasilkan dominasi kalus bertekstur remah dan bersifat embriogenik, (2) Lebih lanjut berorientasi pada regenerasi kalus untuk dihasilkan eksplen tanaman yang sempurna.
DAFTAR PUSTAKA
Anna PKL, Ying CU, Sobri H, Abdul RH, Atsusi T, Hase Y. 2013. Morpohological and biochemical responses of Oryza sativa L. (kultival MR 219) to ion beam irradiation. Journal of Zhenjiang University SCIENCE B. 4(12).
Bamualim AM. 2011. Pengembangan teknologi pakan sapi potong di daerah semi-arid Nusa Tenggara. Pengembangan Inovasi Pertanian. 4(3) : 175-188.
BATAN. 2006. Kelompok Pemuliaan Tanaman. Jakarta (ID): BATAN.
Das A, Mandal N. 2010. Enhanced development of embryogenic callus in Stevia rebaudiana Bert. by additive and amino acids. Biotechnol. 1-5.
Hartman HT, Kester DE. 1983. Plant Propagation Principles and Practice. New Jersey (US): Prentice Hall, Inc.
Hutami, S. 2008. Masalah Pencoklatan Pada Kultur Jaringan” J. Agro Biogen 4 (2) : 83-88
Lizawati. 2012. Induksi Kalus Embriogenik dari Eksplan Tunas Apikal Tanaman Jarak Pagar (Jatropha curcas L.) dengan Penggunaan 2,4 D dan TDZ (The Use of 2,4-D and TDZ to Induction Embryogenic Callus from Apical Bud Explant of Physic Nut (Jatropha curcas L.). Fakultas Pertanian, Universitas Jambi: 1(2)
Manpaki SJ, Karti PDM, Prihantoro I. 2017. Respon pertumbuhan eksplan tanaman Lamtoro (Leucaena leucocephala cv. Tarramba) terhadap cekaman kemasaman media dengan level pemberian aluminium melalui kultur jaringan. Jurnal Sain Peternakan Indonesia. 12(1) : 71 – 82
Mugiono, Lilik H, Azri KD. 2009. Perbaikan varietas cisantana dengan mutasi induksi. Jurnal Ilmiah Aplikasi Isotop dan Radiasi 5(2).
Ogita S, Sasamoto H, Yeung EC, Thorpe TA. 2001. The effects of glutamine on the maintenance of embryogenic cultures of Cryptomeria japonica. In Vitro Cell. Dev. Biol. Plant. 37:268-273
Patil G, Patel R, Jaat R, Pattanayak A, Jain P, Srinivasan R. 2009. Glutamine Improves shoot morphogenesis in Chickpea (Cicer arietinum L.). Acta Physiol. Plant.
Peterson G, Smith R. l991. Effect of abscicic acid and callus size on regeneration of American and international rice varieties. Plant Cell Rep 10: 35-38.
Poehlman J. M. dan Sleeper, D. A. 1995. Breeding Field Crops (4th edition). Iowa State Univ. Press. Iowa. pp. 259- 261
Purnamaningsih R. 2002. Regenerasi tanaman melalui ebriogenesis somatik dan beberapa gen yang mengendalikannya. Buletin Agrobio 5(2): 51-58.
Purwantari, N. D., Prawiradiputra, B. R., Sajimin.
2005. Leucaena: taxonomi, adaptasi, agronomi, dan pemanfaatan. di dalam: Lokakarya Nasional Tanaman Pakan Ternak. 2005 Sep 16; Bogor, Indonesia.
Sapsuha Y, Soetrisn D, Kustantinah. 2011. Induksi kalus dan embriogenesis somatik in vitro pada Lamtoro (Leucaena leucocephala). Berita Biologi 10(5).
Shu, Q. Y., Forster, B. P., Nakagawa H. 2012. Plant Mutation Breeding and Biotechnology, Joint FAO/ IAEA Program.
Wang HJ, Wu LH, Wang MY, Zhu YH, Tao QN, Zhang FS. 2007. Effects of amino acids replacing nitrate on growth, nitrate accumulation, and macroelement concentrations in Pak-Choi (Brassica chinensis L.). Pedosphere. 17(5):595-600
Wattimena GA, Mattjik NA. 1992. Pemuliaan tanaman secara in vitro. Dalam Tim Laboratorium Kultur Jaringan. Bioteknologi Tanaman. PAU Bioteknologi, Institut Pertanian Bogor.
Williams EG, Maheswara. 1986. Somatic embryogenesis factors influencing coordinated behaviour of cells as on embryogenic Group. Ann. Bot. 57: 443
462.
Winarto B. 2011. Pengaruh glutamin dan serin terhadap kultur anter Anthurium andreanum cv. Tropical. J.Hort. 21(4): 295 305
Winkel-Shirley 2001. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology. Plant Physiol. Vol. 126: 485-493
Yelnititis (2012). Pembentukan kalus remah dari eksplan daun ramin (Gonystylus bancanus (Miq) Kurz.). Jurnal Pemuliaan Tanaman Hutan. Vol 6 (3): 181 – 194
Yusnita. 2004. Kultur Jaringan. Cara memperbanyak tanaman secara efisien. Jakarta (ID): Agro Media Pustaka.
Zhu LF, Xu C, Zhu ZB, Yang HT, Guo QS, HJ Xu, HJ Ma, GH Zhao. 2014. Impact of TDZ and NAA on adventitious bud induction and cluster bud multiplication in Tulipa edulis. Journal of Chinese Materia Medica 39(16):3030-5
Zulkarnain, Lizawati. 2011. Proliferasi Kalus dari Eksplan Hipokotil dan Kotiledon Tanaman Jarak Pagar (Jatropha curcas L.) pada Pemberian 2,4-D. J Natur Ind 14 (1): 19 -25.
68
Discussion and feedback