Identifikasi Senyawa Fitokimia Kulit Batang Kelor (Moringa oleifera Lamk) Dengan Metode GC-MS dan Uji Toksisitas Terhadap Larva Udang Artemia salina leach
on
Nandur
Vol. 2, No. 1, Januari 2022 https://ojs.unud.ac.id/index.php/nandur
EISSN: 2746-6957 | Halaman 1-9 Fakultas Pertanian, Universitas Udayana
Identifikasi Senyawa Fitokimia Kulit Batang Kelor (Moringa oleifera Lamk) Dengan Metode GC-MS dan Uji Toksisitas Terhadap Larva Udang Artemia salina leach
Antony Lay, I Gede Putu Wirawan*), I Nyoman Wijaya
Program Studi Agroekoteknologi Fakultas Pertanian Universitas Udayana Jl. PB. Sudirman Denpasar, Bali 80232
*)Email: igpwirawan@yahoo.com
Abstract
Kelor (Moringa oleifera) is a plant that grows in tropical climates including Indonesia. All parts of this plant can be used as medicine and other natural products. The purpose of this study was to determine the bioactive compounds contained in moringa stem bark and the level of toxicity expressed by an LC50 value of less than 1.000 ppm so that it can be used as traditional medicine and other natural products. Identification of bioactive compounds in moringa stem bark using the GC-MS analysis method and toxicity test on Artemia salina Leach shrimp larvae using the Brine Shrimp Lethality Test (BSLT) method. Based on the results of the analysis using GC-MS showed that moringa bark extract contains 14 bioactive compounds. The highest bioactive compounds in the 3 peaks were secondary metabolites in the form of phenols and monoterpenoids. The toxicity test of moringa bark extract against Artemia salina Leach larvae showed that the higher the concentration, the higher the percentage of mortality of Artemia salina Leach, so that the calculated LC50 value of moringa bark extract was toxic, which was 149,689 ppm.
Keywords: Moringa stem bark, GC-MS, Toxicity, Artemia salina Leach
Tanaman kelor merupakan salah satu anggota keluarga Moringaceae yang tumbuh didaerah beriklim tropis. Kandungan nutrisi yang cukup tinggi membuat kelor dapat digunakan untuk mengatasi kekurangan nutrisi. Oleh karena itu kelor disebut sebagai pohon ajaib dikarenakan semua bagian tumbuhan kelor bermanfaat bagi kehidupan manusia. Mulai dari daun, kulit batang, biji hingga akarnya, tumbuhan ini sudah dikenal luas sebagai tumbuhan obat. Daun kelor, kulit batang kelor, dan biji kelor biasa digunakan sebagi obat kulit. Sedangkan akar kelor diolah untuk obat luar seperti penyakit beri-beri (Jonni et al., 2008). Berbagai bagian tanaman ini memiliki senyawa-senyawa bioaktif yang dapat digunakan dalam berbagai pengobatan yaitu bertindak sebagai stimulan jantung dan peredaran darah, serta memiliki sifat sebagai antitumor,
antipiretik, antiepilepsi, antiinflamasi, antiulser, antihipertensi, antioksidan, antidiabetik, dan antibakteri (Toripah et al., 2014).
Salah satu bagian tanaman kelor yang mempunyai kandungan potensial lainnya yaitu kulit batang kelor yang telah diketahui mengandung senyawa metabolit sekunder berupa alkaloid, fenol, terpenoid/steroid, flavonoid, dan tanin (Ikalinus, 2015). Penggunaan kulit batang kelor sebagai bahan obat perlu dilakukan analisis senyawa bioaktif menggunakan Gas Chromatography Spektrometer Massa (GC-MS) dan uji toksisitas terhadap larva Artemia saliana Leach sehingga diketahui senyawa bioaktif yang terkandung dalam ekstrak kulit batang kelor serta respon senyawa bioaktif terhadap hewan uji yang dinyatakan dengan hasil perhitungan nilai LC50.
Tempat dilaksanakan penelitian di Laboratorium Sumber Daya Genetika dan Biologi Molekuler Universitas Udayana, Laboratorium Forensik Polresta Denpasar, dan penelitian secara mandiri dirumah. Sampel kulit batang kelor diambil di Kelurahan Pedungan, Kecamatan Denpasar Selatan, Provinsi Bali. Penelitaan ini dilaksanakan sejak bulan Maret hingga Juli 2021.
Bahan-bahan yang digunakan dalam penelitian ini yaitu kulit batang kelor, etanol 96%, telur udang Artemia salina Leach, natrium hidrokarbonat, ragi roti, air tawar, dan garam ikan. Alat-alat yang digunakan yaitu oven, blender, toples, labu erlenmeyer, vacuum rotary evaporator, sendok, botol vial 30 mL, timbangan analitik, kertas saring, gelas ukur, aluminium foil, sentrifuge, GC-MS tipe GC7890B (SN US17213016) MSD 5977B (SNG7078B US1721D001), tisue, gunting, cawan petri, gelas ukur, pipet tetes, micro pipet, pisau, plastik, sendok, corong, camera, dan lampu pijar 25 watt.
Sebanyak 300 g kulit batang kelor kering yang telah halus di masukkan ke wadah toples kaca. Ekstraksi yang dilakukan adalah ekstraksi metode dingin yaitu maserasi dengan menggunakan pelarut etanol 96% sebanyak 3 liter dengan perbandingan 1:10. Maserasi dilakukan sebanyak 4 x 24 jam sambil sesekali dilakukan pengadukan (Senja et al., 2014). Hasil maserasi kemudian disaring menggunakan kertas saring sehingga dihasilkan filtrat dan residu. Filtrat yang diperoleh kemudian dipekatkan menggunakan vacuum rotary evaporator pada suhu 35⁰C hingga diperoleh ekstrak kental berupa pasta (Putriani, 2013).
Identifikasi senyawa bioaktif kulit batang kelor dilakukan pemekatan sampel yang bertujuan untuk menghomogenkan ekstrak pekat dengan pelarut. Ekstrak kental di timbang sebanyak 1 mg dan dilarutkan etanol 96% sebanyak 900 µl. Selanjutnya
dimasukan kedalam alat sentrifuge selama 3 menit dengan pengenceran 30 kali. Setelah itu cairan bening hasil sentrifuge yang sudah homogen tersebut dideteksi, dengan cara pipet 1 µl cairan bening paling atas menggunakan split, lalu dinjeksikan kedalam injector dengan kolom HP-5MS U, ukuran panjang kolom 30 m, diameter kolom 0,25 mm, dan ketebalan kolom fase diam 0,25 µm. analisis sampel ekstrak kulit batang kelor menggunakan gas N2 sebagai carier dan split 1:50. Temperatur oven diatur pada suhu 70°C selama 3 menit, perlahan-lahan temperatur ditingkatkan rata-rata 10°C per menit hingga mencapai suhu 290°C. Suhu 290°C dipertahankan selama 2 menit. Temperatur saat sampel dinjeksi yaitu pada suhu 230°C. selanjutnya senyawa yang terdapat dalam sampel diidentifikasi dengan membandingkan waktu retensi masing-masing puncak kromatografi dengan senyawa yang terdapat didalam database.
Penyiapan larva udang yaitu dengan menetaskan telur artemia dengan larutan air garam. Larutan air garam dibuat dengan cara melarutkan 40 g garam ke 2.000 mL air tawar kedalam toples yang diberikan penerangan menggunakan lampu pijar 25 watt dan diaerasi menggunakan aerator. Kemudian tambahkan natrium hidrokarbonat sebanyak 2g/L agar pH air normal berkisaran 8-9. Selanjutnya telur artemia dimasukkan kedalam larutan air garam sebanyak 1 mg dan akan menetas dalam waktu 24-36 jam. Setelah larva menetas pindahkan kedalam wadah plastik agar cangkang dan larva terpisah. Selama 2-3 hari kemudian larva sudah mencapai instar II berbentuk bulat lonjong dengan panjang sekitar 400 mikron, lebar 170 mikron, dan berat 0,002 mg (Wibowo et al., 2013).
Ekstrak kental kulit batang kelor (Moringa oleifeira) ditimbang sebanyak 50 mg,selanjutnya dilarutkan dalam pelarut etanol 96 % sebanyak 5 mL sehingga diperoleh larutan 10.000 ppm sebagai larutan induk. Selanjutnya untuk membuat konsentrasi 500 ppm, 250 ppm,125 ppm, 50 ppm, dan 10 ppm yaitu dengan mengambil larutan induk menggunakan micro pipet masing-masing sebanyak 250 µl, 125 µl, 62,5 µl, dan 5 µl dan dimasukkan kedalam botol vial. Sedangkan untuk kontrol dibuat dengan memasukan 5 mL larutan air garam kedalam botol vial tanpa penambahan larutan induk (Meyer, dkk., 1982).
Rumus Pengenceran sebagai berikut :
V1.M1 = V2.M2
V1 = Volume Awal V2 = Volume Akhir
M1 = Konsentrasi Awal M2 = Konsentrasi Akhir
-
2.7 Pelaksanaan Uji
Larutan uji dengan konsentrasi, 500 ppm, 250 ppm, 125 ppm, 50 ppm, dan 10 ppm, masing-masing diuapkan dengan cara diangin-anginkan agar pelarutnya hilang. Selanjutnya pipet 1 mL larutan air garam, lalu masukkan kedalam masing-masing botol vial. Setelah itu masukkan larva udang sebanyak 10 ekor yang sehat dan bergerak aktif pada tiap-tiap vial, tambahkan 1 mL suspensi ragi sebagai makanan larva artemia dan tambahkan larutan air garam pada botol vial 500 ppm, 250 ppm, 125 ppm, 50 ppm, dan 10 ppm hingga mencapai 5 mL. Percobaan ini di lakukan replikasi sebanyak 3 kali. Pengamatan kematian larva Artemia salina diihat dari pergerakan larva yang hidup dan larva yang mati (Muaja, 2013).
Jika tidak ada pergerakan pada larva tersebut, maka dihitung kematian pada tiap-tiap konsentrasi menggunakan rumus :
% Mortalitas = Jumlah larva mati x 100% Jumlah larva uji
(Nurhayati et al., 2006)
Data hasil penelitian akan diolah dan disajikan dalam bentuk tabel dan grafik. Data dari uji toksisitas tersebut akan di analisis dengan metode analisis probit dengan persamaan regresi linear menggunakan Microsoft Excel 2010 for Windows. Untuk menentukan nilai LC50 dari log konsentrasi dan persamaan garis lurus y = mx + b yaitu dengan cara mengaktifkan data analysis di menu data dengan memilih regresi setelah itu input nilai y dan x pada jendela data regresi dan didapatkan nilai b (intersep) dan nilai m (slope). Niilai y merupakan nilai probit yang didapatkan dari tabel probit dengan melihat persen kematian masing - masing konsentrasi dan nilai x sebagai log konsentrasi. Selanjutnya susun persamaan nilai y = mx + b. Setelah itu karena yang dicari nilai LC50 maka y diisi dengan 5 karena nilai 5 itu berarti 50% kematian hewan uji yang didapatkan dari tabel probit. Sumbu y dapat dihitung menggunakan rumus y = mx + b
Hasil ekstraksi yang dihasilkan sebayak 700 ml berwarna pekat hijau muda kehitaman. Warna hijau yang dihasilkan disebabkan oleh pelarut etanol yang dapat melarutkan pigmen berupa warna hijau (kholorofil) dari kulit batang kelor. Adanya pengurangan volume filtrat disebabkan karena pelarut etanol mudah menguap dan kemungkinan terbawa dalam residu. Filtrat yang dihasilkan kemudian diuapkan dan dipekatkan menggunakan vacuum rotary evaporator pada suhu 35 °C dengan perputaran 128 rpm. Setelah itu didapatkan ekstrak kental berwarna hitam pekat dengan berat 7,8 gram. Selanjutnya ekstrak kental kulit batang kelor di analisis menggunakan GC-MS.
Hasil spektrometri massa dari senyawa aktif yang terkandung dalam ekstrak kulit batang kelor akan diukur secara otomatis berdasarkan waktu retensi yang dimiliki oleh setiap kandungan senyawa aktif tanaman. Hasil GC ektrak kulit batang kelor dapat dilihat pada Gambar 1.
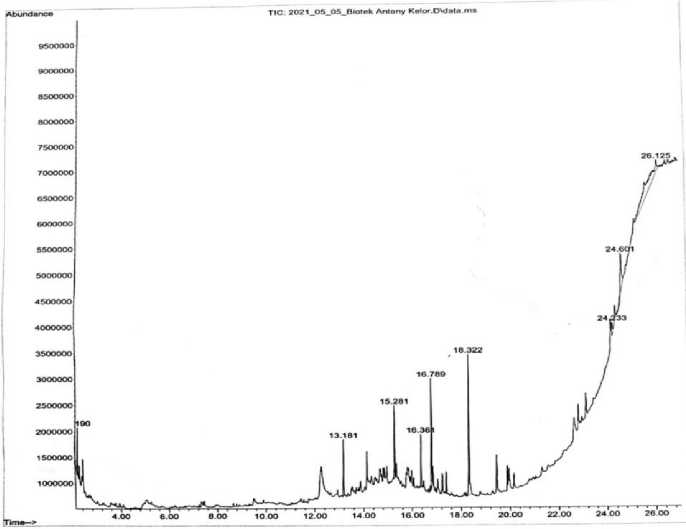
Gambar 1. Kromatogram pemisahan Gas Chromatography ekstrak Kulit batang kelor
Berdasarkan hasil kromatogram terdapat 3 puncak tertinggi yaitu pada peak 7 memiliki waktu retensi 24.233 menit dan persen area 2,07%, peak 8 memiliki waktu retensi 24.601 menit dan persen area 4,92%, dan peak 9 memiliki waktu retensi 26.125 menit dan persen area 33,66%. Berikut senyawa – senyawa yang terdeteksi pada 3 peak tertinggi.
Pada menit 24,233, persen area 2.07 senyawa yang ditemukan yaitu 1-methyl-4phenyl-5thioxo-1,2,4-triazolidin-3-one, Benzo [ h ] quinoline, 2,4-dimethyl-, dan Cylotrisiloxane, hexamethyl-.) Senyawa – senyawa tersebut merupakan senyawa metabolit sekunder golongan fenolik. Menurut Miwa et al., (2006) senyawa-senyawa ini berfungsi sebagai antikanker, antibakteri, dan antioksidan.
Pada menit 24.601, persen area 4.92 ditemukan 3 senyawa dimana terdapat 1 senyawa yang sama pada peak 7. Senyawa tersebut yang di temukan yaitu Phenylacetic acid, 2-(1-adamantyl) ethyl ester, Cyclotrisiloxane, hexamethyl-, dan Tris (tertbutyldimethylsilyloxy) arsane. Senyawa phenylacetic acid, 2-(1-adamantyl) ethyl ester
merupakan senyawa metabolit sekunder golongan fenol yang memiliki fungsi sebagai antikanker dan antiinflamasi (Triodora et al., 2016).
Pada menit 25.125, persen area 33.66 senyawa yang ditemukan pada peak ini yaitu thymol, TMS derivative yang merupakan senyawa metabolit sekunder golongan monoterpenoid yang memiliki fungsi sebagai analgesic, antimikroba, antiinflamasi, dan antikanker (Jack et al., 2006). Selain itu pada peak ini ditemukan senyawa yang sama pada peak sebelumnya yaitu senyawa Tris (tert-butyldimethylsilyloxy) arsane dan Cyclotrisiloxane, hexamethyl-.
Uji toksisitas digunakan sebagai uji pendahuluan pada penelitian yang mengarah pada uji sitotoksik sehingga dapat mengetahui potensi bioaktivitas tanaman. Tingkat toksisitas ditentukan melalui hasil perhitungan nilai LC50 dari aktivitas senyawa yang mempengaruhi kematian larva udang Artemia salina Leach. Menurut Meyer, dkk., (1982) sampel bersifat toksik apabila memiliki nilai LC50 < 1.000 ppm. Berikut hasil uji toksisitas dari berbagai konsentrasi ekstrak kulit batang kelor terhadap larva udang Artemia salina Leach dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh berbagai konsentrasi ekstrak kulit batang kelor (Moringa oleifera) terhadap larva udang Artemia salina Leach
|
Konsentrasi (ppm) |
Perlakuan |
Total Kematian (Ekor) |
Rata-rata Kematian |
Persen kematian (%) | ||
|
Vial I |
Vial II |
Vial III | ||||
|
500 |
9 |
9 |
8 |
26 |
0,8667 |
86,67 |
|
250 |
7 |
5 |
7 |
19 |
0,6333 |
63,33 |
|
125 |
3 |
1 |
4 |
8 |
0,2667 |
26,67 |
|
50 |
1 |
2 |
2 |
5 |
0,1667 |
16,67 |
|
10 |
1 |
2 |
1 |
4 |
0,1333 |
13,33 |
|
0 (Kontrol) |
0 |
0 |
0 |
0 |
0 |
0 |
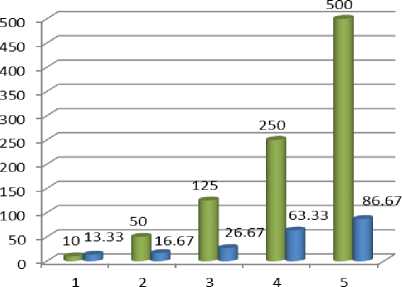
■ Konsentrasi (ppm)
■ Persen kematian(%)
Gambar 2. Diagram Persen kematian Artemia salina Leach
Disajikan pada Tabel 1 dan Gambar 2 kematian tertinggi terdapat pada konsentrasi 500 ppm sebesar 86,67% dan kematian terendah ada pada konsentrasi 10 ppm dengan persentase kematian sebesar13,33%. Pada larutan 0 ppm (kontrol) tidak terdapat adanya larva yang mati, penelitian ini selaras dengan metode BSLT dimana kematian larva udang Artemia salina Leach dipengaruhi akibat ekstrak kulit batang kelor bukan dari pengaruh air laut atau pun faktor lainnya.
Perhitungan nilai LC50 yaitu dengan menggunakan tabel probit. Untuk menentukan nilai probit dapat dilihat dari persen kematian tiap kelompok hewan uji. Setelah itu tentukan log konsentrasi tiap kelompok dan tentukan persamaan garis lurus hubungan antara sumbu y (probit) dengan sumbu x (log konsentrasi) yang diinput melalui menu data analisis regresi sehingga didapatkan nilai b (intersep) dan nilai m (slope). LC50 dihitung dari nilai antilog x pada saat y = 5.
Tabel 2. Nilai Log konsentrasi dan probit setiap konsentrasi
|
Konsentrasi (ppm) |
Log Konsentrasi (X) |
Persen kematian (%) |
Probit (Y) |
|
500 |
2,698 |
86,67 |
6,1077 |
|
250 |
2,397 |
63,33 |
5,3398 |
|
125 |
2,096 |
26,67 |
4,3750 |
|
50 |
1,698 |
16,67 |
4,0299 |
|
10 |
1 |
13,33 |
3,8877 |
|
0 |
0 |
0 |
0 |
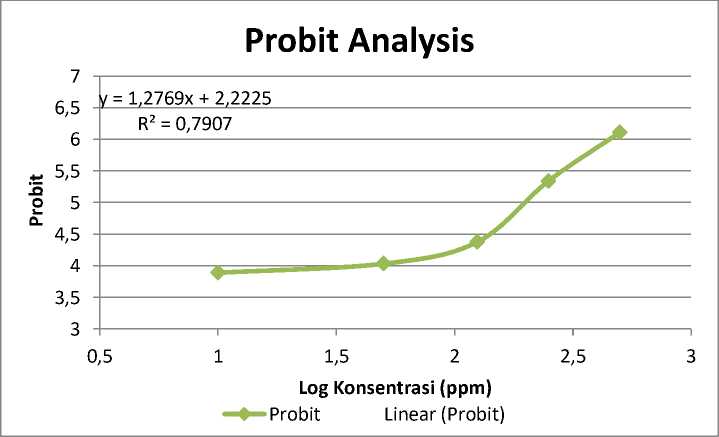
Gambar 3. Grafik Probit Kematian dari berbagai Konsentrasi Ekstrak
Hasil Nilai Log konsentrasi dan probit setiap konsentrasi dapat dilihat pada Tabel 2, hasil analisis probit (Gambar 3) dengan persamaan regresi linear menggunakan Microsoft Excel 2010 for Windows didapatkan nilai b (Intersep) : 2,2225
m (Slope) : 1,2769
Maka, y = mx + b
5 = 1,2769x + 2,2225
X = 5 - 2,2225/1,2769
X = 2.175189913
LC50= Antilog 2.175189913= 149, 689 ppm
Hasil perhitungan nilai LC50 yaitu 149,689 ppm sehingga menunjukkan bahwa ekstrak kulit batang kelor bersifat toksik terhadap larva udang Artemia salina Leach karena nilai LC50 ≤ 1.000 ppm. Dari hasil tersebut ekstrak kulit batang kelor (Moringa oleifera) dapat digunakan sebagai larvasida dan obat karena memiliki kandungan metabolit sekunder yang bersifat toksik dan nilai LC50 ≤ 1.000 ppm. Menurut Albert et al., (2002) senyawa monoterpenoid dapat menyebabkan kematian sel. Didalam sel molekul-molekul itu akan merusak enzim yang ada (DNA-dependent RNA polymerase atau Na+-K+ ATPase) sehingga dapat mengakibatkan kematian sel. Diduga kematian larva udang Artemia salina Leach dipengaruhi oleh senyawa monoterpenoid. Selain senyawa monoterpenoid, senyawa yang diduga menyebabkan kematian larva udang Artemia salina Leach adalah senyawa fenolik. Menurut Cahyadi, (2009) senyawa fenolik bertindak sebagai racun perut yang dapat menghambat daya makan larva. Oleh karena itu bila senyawa ini masuk ke dalam tubuh larva Artemia salina Leach pencernaannya akan terganggu sehingga menyebabkan kematian.
Berdasarkan hasil penelitian, maka dapat disimpulkan bahwa kulit batang kelor (Moringa oleifera) mengandung 2 kelompok senyawa metabolit sekunder yaitu fenol, dan monoterpenoid yang terdiri dari 14 jenis senyawa kimia, sedangkan hasil uji toksisitas terhadap larva udang artemia menunjukkan semakin besar konsentrasi yang digunakan, maka semakin besar persen kematiannya sehingga dapat digunakan sebagai larvasida dan bersifat toksik terhadap larva udang Artemia salina Leach yaitu sebesar 149,689 ppm sehingga dapat digunakan sebagai obat.
Daftar Pustaka
Ikalinus, R., K. Wisyaatuti Setiasih. (2015). Skrining fitokimia ekstrak etanol kulit batang kelor. Jurnal Indonesia Medicius Veterinus. 4 (1): 71-79.
Jonni, M.S. (2008). Cegah Malnutrisi dengan Kelor. Penerbit Kanisius. Yogyakarta. Hal. 13-93.
Jack. (2006). Synthesis of Antidiabetic Flavonoids and Their Derivative. Medical Research. Page. 180.
Meyer, B.N., N.R. Feerigni, J.E. Putnam, L.B. Jacobson, D.E. Nicholas, J.L. McLaughlin. (1982). Brine shrimp a convenient general bioassay for active plant constituents. Plant Med. Vol. 45:31-34.
Miwa, K.,T. Miyashita, K. Oyama, T. Ohta, and T. Fujimura. (2006). Role of Cyclooxygenase-2 in the Carcinogenesis of gastrointestinal track cancer; A Review and Report of Journal of Gastroenterology. 12(9) : 1336-1345.
Muaja, A. D., H.S.J. Koleangan, dan M.R.J. Runtuwene. (2013). Uji toksisitas dengan metode BSLT dan analisis kandungan fitokimia ekstrak daun sayogik (Saurauia bracteosa) dengan metode soxhletasi. Jurnal MIPA. Unsrat. Vol 2 (2): 115-118
Nurhayati, N., Abdulgani, R. Febrianto. (2006). Uji toksisitas ekstrak Alvaresii terhadap Artemia salina Leach. sebagai studi pendahuluan potensi anti kanker. Skripsi. Program Studi Biologi FMIPA Institut Teknologi Sepuluh November. Surabaya. 1- 9.
Putriani, R.I.K.A. (2013). Skrining fitokimia dan aktivitas antioksidan ekstrak rumput laut Sargassum duplicatum dan Turbinaria ornata dari Jepara. Universitas Diponegoro. Semarang. 2 (1): 3-10.
Senja, R. S., E. Issusilaningtyas, A. K. Nugroho, dan E. P. Setyowati. (2014). The comparison of extraction method and solvent variation on yield and antioxidant activity of Brassica oleracea L. var. capitate f. rubra Extract. Traditional Medic Journal. 19 (1): 43-48.
Triodora, H., R. Ayik, O. Ika. (2016). Sintesis asam 2-(2-(n-(2,6-diklorofenil)-4fluorobenzamida) fenil) asetat sebagai kandidat obat penghambat COX (siklooksigenase). Fakultas Farmasi Universitas Jember. Kalimantan. Jember. 1 (1) : 1-10.
Toripah, S.S., J. Abidjulu, dan F. Wehantouw. (2014). Aktivitas antioksidan dan kandungan total fenolik ekstrak daun kelor (Moringa oleifera Lamk). Program Studi Farmasi FMIPA Universitas Samratulangi. Manado. Vol. 1(2): 6-9.
9
Discussion and feedback