Eksplorasi Agens Hayati Rizoplan Sebagai Pengendali Jamur Fusarium oxysporum f.sp. cubense
on
Nandur
Vol. 2, No. 1, Januari 2022 https://ojs.unud.ac.id/index.php/nandur
EISSN: 2746-6957 | Halaman 10-20 Fakultas Pertanian, Universitas Udayana
Eksplorasi Agens Hayati Rizoplan Sebagai Pengendali Jamur Fusarium oxysporum f.sp. cubense
I Gusti Made Wira Kesuma Jaya*), Khamdan Khalimi, Ni Wayan Suniti
Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Udayana Jl. P.B. Sudirman Denpasar Bali 80231
*)Email: gungade.wira@gmail.com
Abstract
Fusarium wild or wilt disease that attacks banana plants is caused by the pathogenic fungus Fusarium oxysporum f.sp. cubense This disease is difficult to control because it lasts a long time in the soil by forming chlamydospores. Currently, the control of this disease is still using synthetic fungicides, but this method can cause damage to the ecosystem. Biopesticide is one of the environmentally friendly control of plant pathogens because biopesticides use biological agents. The purpose of this study was to export rhizoplan bacteria from banana plant roots which have antifungal activity against F. oxysporum f.sp. cubense. The results showed that rhizoplan bacteria were able to inhibit the growth of Fusarium oxysporum f.sp. cubense fungal colonies on potato dextrose agar (PDA) media with an inhibitory percentage of 90.90% when compared to the control. The results of the bacterial filtrate test of rhizoplan at a concentration of 50% were able to inhibit the growth of the fungus Fusarium oxysporum f.sp. cubense with an inhibitory percentage of 92.72%.
Keywords: fusarium, rhizoplan bacteria, Fusarium oxysporum f.sp. cubense
Indonesia merupakan negara yang mempunyai keanekaragaman flora yang tinggi, berbagai macam tanaman terdapat di Indonesia. Salah satunya adalah tanaman pisang. Tanaman pisang (Musa spp.) merupakaan tanaman hortikultura yang mempunyai nilai ekonomis yang tinggi. Menurut Suastika dan Kamandalu (2005) bahwa tanaman pisang bagi masyarakat Hindu Bali mempunyai manfaat serba guna, tidak hanya buahnya yang digunakan sebagai representasi buah-buahan pada sesajen, tetapi juga daunnya, anakannya serta batangnya sangat berguna untuk menunjang kehidupan sehari-hari. Tanaman pisang juga kaya akan nilai gizi. Buah pisang mengandung gizi cukup tinggi, kolesterol rendah serta vitamin B6 dan dan vitamin C yang tinggi. Kandungan gizi pada 1 buah pisang mengandung kalium sebesar 0,9 gram , 27 gr karbohidrat, 14 gr gula, dan 105 kalori. Pisang juga merupakan sumber karbohidrat, vitaminn A dan C, serta mineral. Tanaman pisang juga dapat diolah menjadi produk olahan dan bagian tananam lainnya dapat dimanfaatkan untuk bahan industri seperti pasta gigi. Seiring dengan bertambahnya jumlah penduduk dan meningkatnya kesadaran masyarakat akan pentingnya gizi, maka
tanaman pisang sangat berpotensi untuk dikembangkan. Namun demikinan, pengembangan pisang di Indonesia tidak mudah.
Ada beberapa kendala dalam mengembangkan pisang di Indonesia yaitu pola pembudidayaan yang belum jelas dan teratur, kurangnya penerapan teknologi budidaya pisang secara benar pada tingkat petani, kultivar pisang yang di tanam masih beragam, ketersediaan dan penggunaan bibit pisang yang sehat dari kultivar unggul masih terbatas, dan penyebaran hama dan penyakit tanaman pisang yang cukup luas di sentra produksi pisang. Salah satu penyakit penting tanaman pisang adalah penyakit layu. Penyakit layu pertama kali ditemukan di daerah Panama pada akhir tahun 1980. Daerah penyebarannya meliputi Amerika Tengah, Malaysia, Thailand, Philipina, Myanmar, India, Srilanka, Kepulauan Fiji, Australia, Selandia Baru, Zaire, Afrika, Afrika Selatan, Indonesia, dan Tiongkok. Di Bali, penyakit ini pertama kali ditemukan di bagian Barat pulau Bali yaitu di Kabupaten Jembrana yang menyerang sebagian besar pisang kultivar kepok, pisang raja dan pisang susu. Pada tahun 1998 penyakit ini sudah menyebar di semua daerah tingkat II di Bali dengan tingkat serangan antara sedang sampai berat (Fakultas Pertanian Universitas Udayana, 1999).
Menurut Sudana (2004) bahwa penyakit layu yang menyerang tanaman pisang di Bali disebabkan oleh dua jenis patogen yaitu jamur Fusarium oxysporum f.sp. cubense Race 1 dan bakteri Ralstonia solanacearum Biovar-2. Kedua patogen ini dijumpai pada batang tanaman sakit secara bersamaan atau sendiri-sendiri. F. oxysporum umumnya menyerang tanaman sejak umur tanaman muda sedangkan R. solanacearum, gejala penyakitnya lebih jelas tampak saat tanaman sudah berbuah, dan buahnya busuk. Penyakit ini sangat sulit dikendalikan sebab berada di dalam tanah dan menyerang jaringan empulur batang pisang melalui luka akar atau terinfeksi, sehingga daun menjadi layu. (Rosmahani 1999). Menurut Sulyanti et al. (2020) beberapa jenis penyakit yang sering dijumpai dari tanaman pisang yaitu Layu Fusarium dengan gejala khasnya daun menguning, layu dan kering dimulai dari daun yang tertua, bercak daun hitam munculnya bercak hitam kecil yang dikelilingi warna kuning kemudian melebar, Layu Bakteri munculnya garis-garis coklat pada tulang daun, Cordana munculnya bercak bulat telur kemudian melebar, Bunchy top ditandai dengan munculnya garis-garis hijau yang terputus-putus pada tulang daun pisang. F. oxysporum merupakan jamur penyebab penyakit layu yang merupakan penyakit utama dalam budidaya pisang. Penyakit ini sulit dikendalikan karena F. oxysporum bertahan lama dalam tanah dengan membentuk klamidospora (Sarimole at.el 2014). F. oxysporum menginfeksi melalui akar lateral atau cabang-cabang pendek akar, lalu melakukan penetrasi ke dalam jaringan pengangkutan dan berkembang luas di dalam xilem (Brown dan Ogle, 1997). Oleh karena itu perlu upaya pengendalian yang efektif dan ramah lingkungan. Salah satu cara dalam mengendalikan penyakit layu adalah dengan memanfaatkan bakteri yang berperan sebagai agen hayati terhadap F. oxysporum.
Beberapa penelitian melaporkan bahwa bakteri rizoplan dapat digunakan sebagai agens hayati terhadap jamur. (Saylendra et.al 2018) melaporkan bahwa bakteri Pseudomonas aureofaciens dan Pseudomonas cepacia mampu menghambat jamur
Phytium ultimum, Fusarium graminearium, Fusarium culmorum, Fusarium moniliforme, dan Fusarium nivale. Berdasarkan penelitian Mavingui dan Heulin, 1994) bahwa bakteri Bacillus polymyxa menghambat jamur Gaeumannomyces graminis var tritici. Cazorla et al. (2007) melaporkan bahwa Bacillus subtilis strains B. polymyxa menghambat jamur Fusarium oxysporum, jamur Phytopthora cinnamomi, jamur Pythium ultimum, jamur Rosellinia necatrix, jamur Rhizoctonia solani, jamur Scerotium rolfsii.
Penelitian ini dilaksanakan di Laboratorium penyakit tumbuhan, Program Studi Agroekoteknologi Fakultas Pertanian, Universitas Udayana, Denpasar dari bulan Januari sampai bulan Mei 2021.
Bahan yang digunakan dalam penelitin F. oxysporum fsp. cubense koleksi Laboratorium Biopestida, Fakultas Pertanian, Universitas Udayana, bakteri antagonis yang diperoleh dari 10 sampel akar tanaman pisang yang sehat, Akuades, hand spray, Agar, Air, Alkohol 70%, kentang sukrosa, media Potato Dextrosa Agar (PDA), media Potato Dextrose Broth (PDB), nistatin dan levo floxacin,
Alat yang digunakan pada penelitian ini adalah Erlenmeyer, kapas, autoclave, laminar flow cabinet, masker, hand glove, timbangan, pisau, panci, kompor gas, beaker glass, cawan Petri, penjepit, sendok, kain kasa, tabung reaksi, labu, api Bunsen, cork borer, jarum ose, aluminium foil, saringan, plastik, alat tulis, kertas label, dan kamera.
Isolasi bakteri merupakan suatu proses memisahkan suatu bakteri dari habitatnya atau lingkungannya di alam dan menumbuhkannya sebagai biakan murni dalam medium buatan. dilakukan dengan metode sterilisasi permukaan yaitu bagian permukaan akar disterilisasi menggunakan alkohol 70%, selanjutnya diletakkan di atas tissue, setelah kering akar dipotong ± 0,5 cm, kemudian diletakkan di permukaan media PDA dan diinkubasi pada suhu ruang selama 2 hari. Koloni yang muncul di sekitar akar selanjutnya disubkultur ke media yang baru untuk diremajakan agar dapat digunakan untuk pengujian berikutnya.
Jamur F. oxysporum fsp. cunbense yang digunakan dalam penelitian ini diperoleh dari koleksi Labolatorium Biopestisida, Fakultas Pertanian, Universitas Udayana. Peremajaan jamur F. oxysporum fsp. cunbense dilakukan dengan cara mengambil koloni jamur dengan menggunakan cork borer dengan diameter 5mm, lalu koloni tersebut diletakkan menggunakan jarum ose pada cawan Petri yang sudah berisi 10 ml media potato dextrose agar (PDA) dan kemudian diinkubasi selama 7 hari pada suhu ruang.
Selanjutnya peremajaan dari bakteri rizoplan dilakuakan setelah 10 sampel akar tanaman pisang yang sehat terdapat 1 bakteri akar yang di duga memiliki daya hambat yang paling kuat sebagai agens hayati. Selanjutnya dilakukan pembiakan kembali isolat rizoplan yang telah di uji daya hambatnya, pada media PDA baru. Biakan ini diinkubasi selama 2 hari pada suhu ruang dan siap digunakan.
-
2.3.3 Uji Daya Hambat Bateri rizoplan Terhadap Pertumbuhan Jamur F.
oxysporum fsp. cubense Secara in vitro
Isolat bakteri rizoplan hasil isolasi dari akar tanaman pisang yang sehat selanjutnya diuji kemampuannya untuk menghambat pertumbuhan jamur F. oxysporum fsp. cubense secara in vitro. Pengujian daya hambat bakteri rizoplan terhadap pertumbuhan F. oxysporum fsp. cubense dilakukan dengan, 2 perlakuan yaitu isolat bakteri rizoplan dan F. oxysporum fsp. cubense dan perlakuan kontrol (isolate jamur F. oxysporum fsp. cubense tanpa isolate bakteri rizoplan ), setiap perlakuan diulang 10 kali. Pengujian ini dimulai dengan menuangkan 10 ml media PDA yang masih encer kemudian cawan Petri digoyang – goyangkan untuk meratakan PDA, kemudian diamkan hingga media PDA memadat.
Selanjutnya uji daya hambat dilakukan dengan cara menginokulasikan isolat jamur F. oxysporum fsp. cubense dengan diletakkan di tengah – tengah cawan Petri selanjutnya inokulasikan isolat bakteri rizoplan mengapit pada keempat sisi dengan jarak masing – masing 2 cm dari isolat jamur F. oxysporum fsp. cubense sedangkan untuk perlakuan kontrol dilakukan dengan menginokulasikan isolate F. oxysporum fsp. cubense di tengah-tengah cawan Petri tanpa diapit bakteri rizoplan. selanjutnya perlakuan diinkubasi pada suhu ruang hinnga kontrol memenuhi cawan Petri.
Persentase daya hambat bakteri ditentukan dengan rumus:
Daya hambat (%) =
Iuas koloni kontrol - luas koloni perlakuan
x 100%........(1)
luas koloni kontrol
Pengamatan luas koloni jamur mulai dilakukan pada satu Hari Setelah Inokulasi (HSI).
Pembuatan filtrat bakteri diawali dengan membuat media PDB yang akan digunakan sebagai media biakan bakteri rizoplan. Bahan untuk membuat PDB adalah 200 g kentang dan 20 g dextrose. Kentang direbus dengan air, kemudian air rebusan kentang disaring menggunakan kain kasa atau saringan sebanyak 1000 ml kemudian campurkan 20 g dextrose, selanjutnya tuang ke dalam Erlenmeyer ukuran 250 ml lalu disterilkan menggunakan autoclave pada suhu 121°C dengan tekanan 1,5 atm selama 20 menit. Setelah disterilisasi media PDB dibiarkan hingga dingin.
Berikutnya membuat suspensi bakteri dengan menginokulasikan 3 ose isolat bakteri rizoplan kedalam tabung reaksi yang berisi 10 ml air steril kemudian di vortex selama 3 menit atau sampai suspensi tercampur rata (tidak ada gumpalan isolat bakteri). Selanjutnya di dalam laminar flow cabinet 1 ml suspensi bakteri rizoplan dimasukkan
kedalam Erlenmeyer yang berisi 250 ml media PDB yang sebelumnya telah didinginkan. Kemudian kultur bakteri rizopaln tersebut dikocok menggunakan shaker dengan kecepatan 100 rpm selama 14 hari.
Setelah di shaker, kultur disentrifugasi dengan kecepatan 450 rpm selama 15 menit. Kemudian supernatan disaring menggunkan kertas saring membrane millipore 0.45 μm. Penyaringan dilakukan didalam laminar flow cabinet sehingga tidak terjadi kontaminasi. Setelah disaring filtrat dapat digunakan, bila tidak langsung digunakan filtrat bakteri disimpan pada freezer.
-
2.3.5 Uji Daya Hambat filtrate Bakteri rizoplan terhadap pertumbuhan F. oxysporum fsp. cubense Secara In Vitro
Pengujian daya hambat filtrat terhadap pertumbuhan jamur F. oxysporum fsp. cubense dilakukan dengan lima konsentrasi yaitu: 10%, 20%, 30%, 40%, dan 50%. Untuk membuat konsentrasi 10% dilakukan dengan menuang 1 ml filtrat kedalam cawan Petri dan ditambahkan 9 ml media PDA kemudian cawan Petri digoyang – goyangkan untuk mencampur filtrat bakteri dengan PDA. Isolat jamur F. oxysporum fsp. cubense yang telah diremajakan dipisahkan mengunakan cok borer diameter 4 mm kemudian diambil dengan jarum ose lalu diletakkan di tengah – tengah cawan Petri yang telah berisi filtrat dan PDA yang telah memadat. Pengujian ini dilakukan dengan menggunakan rancangan acak Kelompok (RAK) dengan 6 perlakuan yaitu kontrol, filtrat konsentrasi 10%, konsentrasi 20%, konsentrasi 30%, konsentrasi 40%, dan konsentasi 50%. Setiap perlakuan dibuat 4 kali ulangan Selanjutnya perlakuan diinkunbasi selama 7 hari pada suhu ruang. Luas koloni jamur dihitung pada 7 hari setelah inokulasi dan dibandingkan dengan setiap perlakuan.
Data kemudian dianalis secara statistik dengan ANOVA (Analysis of Varians). Apabila terdapat perbedaan yang nyata dilanjutkan dengan uji beda nyata terkecil (BNT) taraf 5% sementara untuk uji filtrate dilanjutkan dengan uji beda rata-rata Duncan’s Multiple Range Test (DMRT) taraf 5%.
-
3. Hasil dan pembahasan
-
3.1 Isolasi dan Uji Daya Hambat Bakteri Rizoplan terhadap pertumbuhan jamur F. oxysporum f.sp. cubense
-
Berdasarkan hasil isolasi dan uji daya hambat isolat bakteri rizoplan terhadap jamur F. oxysporum f.sp. cubense, didapatkan 1 isolat bakteri rizoplan yang memiliki potensi sebagai agens hayati terhadap jamur F. oxysporum f.sp. cubense dari 15 isolat yang diuji, isolat tersebut adalah Rzp10 (Tabel 1).
Tabel 1 Hasil seleksi bakteri rizoplan dalam menghambat pertumbuhan jamur F.
oxysporum f.sp. cubense
|
No |
Isolat bakteri rizoplan |
Tempat Pengambilan Sampel |
Daya hambat |
|
1 |
Rzp1 |
Badung, Jimbaran |
- |
|
2 |
Rzp2 |
Badung, Jimbaran |
- |
|
3 |
Rzp3 |
Badung, Kedonganan |
- |
|
4 |
Rzp4 |
Badung, Kedonganan |
- |
|
5 |
Rzp5 |
Badung, Kedonganan |
- |
|
6 |
Rzp6 |
Badung, Jimbaran |
- |
|
7 |
Rzp7 |
Badung, Jimbaran |
- |
|
8 |
Rzp8 |
Badung.Kedonganan |
- |
|
9 |
Rzp9 |
Badung, Jimbaran |
- |
|
10 |
Rzp10 |
Badung, Kedonganan |
+ |
|
11 |
Rzp11 |
Denpasar selatan |
- |
|
12 |
Rzp12 |
Denpasar Selatan |
- |
|
13 |
Rzp13 |
Denpasar Selatan |
- |
|
14 |
Rzp14 |
Denpasar Selatan |
- |
|
15 |
Rzp15 |
Denpasar Selatan |
- |
Keterangan:
Rzp: bakteri Rizoplan
(+): bakteri rizoplan memiliki daya hambat terhadap jamur F. oxysporum f.sp. cubense, (-): bakteri rizoplan tidak memilki daya hambat terhadap jamur F. oxysporum f.sp. cubense.

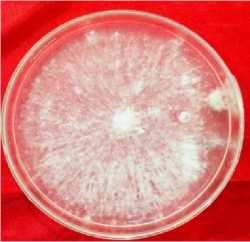
Gambar 1. Bakteri rizoplan Rzp10
-
3.2 Uji Daya Hambat Bakteri Isolat Rzp10 Terhadap Pertumbuhan Jamur F. oxysporum f.sp. cubense Secara In Vitro
Berdasarkan hasil uji daya hambat bakteri isolat Rzp10 terhadap pertumbuhan jamur F. oxysporum f.sp. cubense menunjukkan bahwa bakteri isolat Rzp10 mampu menekan pertumbuhan koloni jamur F. oxysporum f.sp. cubense. Hal ini ditunjukkan dengan rendahnya nilai luas koloni jamur F. oxysporum f.sp. cubense dan tingginya persentase daya hambat bakteri rizoplan isolat Rzp10. dengan diperoleh nilai rata- rata luas koloni F. oxysporum f.sp. cubense pada perlakuan dengan bakteri rizoplan sebesar
340,40 mm2 persentase daya hambat sebesar 90,90% jika dibandingkan dengan kontrol dengan luas sebesar 3617,00 mm2 (Tabel 2).
Tabel 2. Luas koloni F. oxysporum f.sp. cubense dan daya hambat bakteri rizoplan
terhadap pertumbuhan F. oxysporum f.sp. cubense pada pengamatan 7 hsi
|
Perlakuan |
Luas Koloni (mm2) |
Persentase Daya Hambat (%) |
|
Kontrol |
3617,00 a |
- |
|
Isolat Rzp10 |
340,40 b |
90.90% |
|
BNT 5% |
438,61 |
Keterangan: Nilai yang diikuti huruf sama pada masing- masing perlakuan pada kolom yang sama menunjukkan berbeda tidak nyata berdasarksn uji BNT 5%
Hasil penelitian menunjukkan bahwa bakteri rizoplan menghambat pertumbuhan F. oxysporum f.sp. cubense melalui mekanisme antibiosis. Hal ini terlihat dari terbentuknya zona bening antara jamur patogen F. oxysporum f.sp. cubense dan agens hayati bakteri rizoplan seperti (Gambar 2).
A
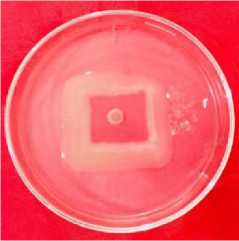
B
Gambar 2. Hasil uji daya hambat bakteri rizoplan terhadap pertumbuhan F. oxysporum f.sp. cubense pada pengamatan 7 hsi
Keterangan: (A) perlakuan Kontrol jamur F. oxysporum f.sp. cubense (B) perlakuan F. oxysporum f.sp. cubense dan bakteri isolat Rzp10.
Pertumbuhan koloni jamur F. oxysporum f.sp. cubense tanpa perlakuan dengan bakteri isolate Rzp10 tersebut sangat baik karena nutrisinya tercukupi. Sedangkan, pertumbuhan koloni jamur F. oxysporum f.sp. cubense pada perlakuan bakteri isolate Rzp10 terhambat karena adanya interaksi antagonis dengan bakteri isolate Rzp10 (Gambar 2). Adanya area zona bening yang jelas pada perlakuan menunjukkan bahwa bakteri rizoplan dapat menghasilkan metabolit sekunder, seperti antibiotik dan enzim. Senyawa antibiotik yang dihasilkan oleh bakteri rizopalan mampu menghambat pertumbuhan patogen. Dewi (2015) menunjukkan bahwa ada area yang jelas antara
patogen dan bakteri antagonis, kita dapat melihat kriteria keefektifan hasil uji antagonis dalam screening secara in vitro.
Para ilmuwan saat ini bayak meneliti Mikroorganisme kitinolitik yang memiliki kemampuan sebagai agen pengendali hayati penyakit tumbuhan yang disebabkan oleh jamur patogen (Gohel et al. 2006). Pada umumnya jamur memiliki dinding sel yang mengandung senyawa kitin. Kehadiran mikroorganisme kitinolitik di tanah terutama pada rhizoplane dan filoplane tanaman dapat melindungi tanaman dari infeksi jamur. Kitin yang terdapat pada dinding sel jamur patogen mampu dilisiskan oleh mikroorganisme kitinolitik sehingga dapat mengurangi terjadinya infeksi penyakit. Kitinase adalah enzim hidrolitik yang mampu mendegradasi kitin yaitu polimer dari b-1,4 N-setil-Dglukosamin. Menurut Nwe et al. (2011) senyawa ini terdapat banyak di alam dan dapat dijumpai pada kerangka insekta, krustase dan dinding sel jamur. Pendapat ahli (Matsumoto 2006) juga mengungkapkan bahwa proses degradasi kitin di alam dilakukan oleh beberapa jenis jamur, bakteri, aktinomisetes dan tumbuhan. Mikroorganisme dengan kemampuan kitinolitik diyakini mampu berperan mengendalikan serangan jamur perusak tanaman dengan menjadikan kitin sebagai sumber karbon dan nitrogen, sehingga diduga bakteri rizoplan mampu merusak dinding sel jamur patogen F. oxysporum f.sp. cubense yang mengandung kitin dan akhirnya akhirnya menyebabkan pertumbuhan sel jamur menjadi terhambat.
-
3.3 Uji Daya Hambat Filtrat Bakteri Isolat Rzp10 Terhadap Pertumbuhan F. oxysporum f.sp. cubense Secara In vitro
Hasil uji daya hambat filtrat isolate bakteri Rzp10 terhadap F. oxysporum fsp. cubense secara in vitro menunjukkan bahwa filtrat rizoplan Rzp10 mampu menekan pertumbuhan jamur F. oxysporum f.sp. cubense. Masing – masing perlakuan menunjukkan hasil yang berbeda terhadap pertumbuhan jamur Foxysporum f.sp. cubense pada pengamatan 7 HSI. Semakin tinggi konsentrasi filtrat bakteri rizoplan maka semakin tinggi persentase daya hambat yang dihasilakan. (Tabel 3).
Tabel 3. Persentase Daya Hambat Filtrat isolate Bakteri Rzp10 terhadap Jamur F.
|
oxysporum f.sp. cubense | ||
|
Perlakuan / Konsentrasi Filtrat |
Luas Koloni (mm2) |
Daya Hambat (%) |
|
10% |
3.175,75 b |
50,04 |
|
20% |
2.228,50 c |
69,94 |
|
30% |
1.137,50 d |
82,10 |
|
40% |
763,75 e |
87,98 |
|
50% |
454,25 f |
92,72 |
|
Kontrol |
6.358,00 a |
- |
|
Keterangan: Nilai yang diikuti huruf sama menunjukkan berbeda tidak nyata berdasarkan uji | ||
DMRT taraf 5%.
Hasil penelitian menunjukkan bahwa filtrat isolate bakteri Rzp10 mampu menghambat pertumbuhan jamur F. oxysporum f.sp. cubense Persentase daya hambat tertinggi ditunjukkan pada perlakuan dengan konsentrasi filtrat 50% dengan luas koloni sebesar 454.25 mm2 dan persentase daya hambat sebesar 92,72%, konsentrasi 40% dengan luas koloni sebesar 763,75 mm2 dan persentase daya hambat sebesar 87,98% konsentrasi 30% luas koloni sebesar 1.137,50 mm2 dengan persentase daya hambat 82,10% dan konsentrasi 20% dengan luas koloni sebesar 2.228,50 mm2 dan persentase daya hambat sebesar 69,94%. Sedangkan persentase daya hambat terendah pada perlakuan filtrat 10% dengan luas koloni sebesar 3.175,75 mm2 dengan persentase daya hambat sebesar 50,04%, jika dibandingkan dengan luas koloni kontrol sebesar 6.358,00 mm2 pada pengamatan 7 HSI. Hal ini menunjukkan filtrat isolat Rzp10 mampu menghambat pertumbuhan koloni jamur patogen (Gambar 3).
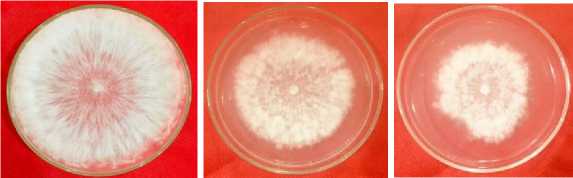
A B C
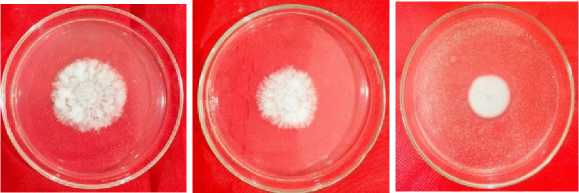
D E F
Gambar 3. Hasil uji daya hambat filtrat isolate bakteri Rzp10 terhadap F. oxysporum f.sp. cubense pada pengamatan 7 HSI
Keterangan: (A) Perlakuan Kontrol, (B) Perlakuan filtrat bakteri rizoplan konsentrasi 10%, (C) Perlakuan filtrate bakteri rizoplan konsentrasi 20%, (D) Perlakuan filtrate bakteri rizoplan konsentrasi 30%, (E) Perlakuan filtrate bakteri rizoplan konsentrasi 40%, (F) Perlakuan filtrate bakteri rizoplan konsentrasi 50%
Menurut Djohari et.al (2019) kategori persentase daya hambat yang sangat kuat yaitu lebih besar dari 75%, kategori kuat dengan presentase daya hambat antara 50-75%, kategori sedang dengan persentase daya hambat 25%-50%, kategori lemah dengan persentase daya hambat <25% dan tidak ada daya hambatannya kemampuan (0%). Berdasarkan hal tersebut, kemampuan bakteri rizoplan isolat Rzp10 dalam menghambat jamur F. oxysporum termasuk dalam kategori sangat kuat, dikarenakan memiliki persentase daya hambat sebesar >75% pada konsentrasi 30% - 50%. dikategori kuat dengan persentase daya hambat antara 50%-75%, kategori sedang yaittu kosentrasi 10%-
20% dengan daya hambatnya 25-50%. Wibisono et al. (2014) menambahkan bahwa standart kualitas uji daya hambat agens hayati yang baik yaitu memiliki kemampuan penghambatan ≥70% secara in vitro, sehingga isolat Rzp10 memiliki potensi sebagai agens antagonis yang dapat dimanfaatkan. Adanya mekanisme antibiosis dimana bakteri menghasilkan senyawa antifungi yang mampu menekan pertumbuhan jamur. Senyawa metabolit sekunder yang dihasilkan bakteri rizoplan yang terdapat pada filtrat bersifat fungistatik, dimana dikatakan mampu menghambat pertumbuhan jamur patogen akan tetapi tidak menyebabkan kematian sel jamur patogen. Kemampuan daya hambat filtrat bakteri rizoplan terhadap pertumbuhan jamur F. oxysporum f.sp. cubense, diduga karena kemampuannya dalam menghasilkan senyawa metabolit sekunder seperti senyawa antijamur dan antibiotik. Senyawa antijamur yang dihasilkan berupa enzim kitinase, protease, dan glukanase, dimana enzim tersebut memiliki kemampuan untuk mendegradasi dinding sel jamur patogen. Enzim ekstraseluler telah diketahui sebagai salah satu mekanisme rizobakteri dalam menghambat pertumbuhan patogen (Chernin dan Chet, 2002).
Berdasarkan hasil penelitian yang dilakukan diperoleh kesimpulan bahwa didapatkan satu agens hayati dari rizoplan akar pisang yang sehat yaitu bakteri isolat Rzp10 yang mampu menekan pertumbuhan jamur F. oxysporum f.sp. cubense dengan persentase daya hambat sebesar 90,90% jika dibandingkan dengan kontrol. Filtrat bakteri isolate Rzp10 konsentrasi 10 – 50% mampu menghambat pertumbuhan jamur F. oxysporum f.sp. cubense dengan persentase daya hambat berkisar antara 50,04% sampai 92,72%.
Daftar Pustaka
Brown, J., & H., Ogle. (1997). Fungal diseases and their control. Plant Pathogens and Plant Diseases. APPS, Australia, 1(4), 443-467.
Cazorla, F. M., D., Romero, A., Pérez‐García, B.J.J., Lugtenberg, A.D., Vicente & G., Bloemberg. (2007). Isolation and characterization of antagonistic Bacillus subtilis strains from the avocado displaying biocontrol activity. Journal of applied microbiology, 103(5), 1950-1959
Chernin, L., and L. Chet. 2002. Microbial enzymes in biocontrol of plant pathogens and pests, p. 171-225. In R. G. Burns and R. P. Dick (ed.), Enzymes in the environment: activity, ecology, and applications. Marcel Dekker, New York, N. Y
Dewi, N. (2015). Uji Antagonis Bakteri Rizosfer Pisang terhadap Cendawan Patogen Thizoctonia solani (Doctoral dissertation, Universitas Islam Negeri Alauddin Makassar).
Djohari, M., W.Y., Putri, & E., Pratiwi. (2019). Isolasi Dan Uji Aktivitas Daya Hambat Ekstrak Etanol Biji Pinang (Areca catechu L.) Terhadap Bakteri Pada Lidah. Jurnal Riset Kefarmasian Indonesia, 1(3), 177-188.
Fakultas Pertanian Universitas Udayana. 1999. Penelitian Penyakit Layu Tanaman Pisang Tersebar di 9 (sembilan) Dati II Bali. Laporan Hasil Penelitian. Fakultas Pertanian, Universitas Udayana Denpasar Bali.
Gohel, V., A., Singh, M., Vimal, P., Ashwini, & H.S., Chhatpar. (2006). Bioprospecting and antifungal potential of chitinolytic microorganisms. African Journal of Biotechnology, 5(2), 54-72.
Matsumoto, K.S. 2006. Fungal Chitinases, In: Guevara-Gonzales R.G and Torres-Pacheco I (Eds). Advances in Agricultural and Food Biotechnology. Reseach Signpost, India. 289-304.
Mavingui, P., & T., Heulin. 1994. In vitro chitinase and antifungal activity of a soil, rhizosphere and population of Bacillus polymyxa. Soil Biology and Biochemistry, 26(6), 801-803.
Nwe, N, T., Furuike, & H., Tamu. 2011. Chitin and Chitosan from Terrestrial Organisms. In; Kim S-K (Ed) Chitin, chitosan, oligosaccharides and their derivatives: biological activities and applications. New York: CRC Press Taylor & Francis Group
Rosmahani, L. 1999. Pengelolaan Hama dan Penyakit Pisang Cavendish. Buletin Teknologi dan Informasi Pertanian. BPTP Karangploso Malang. Vol. 2(1):1-5
Sarimole, E., M., Martosupono, H., Semangun, & J.C., Mangimbulude. (2014). Manfaat jarak pagar (Jatropha curcas) sebagai obat tradisional. In Prosiding Seminar Nasional Raja Ampat (pp. 9-12).
Saylendra, A., T.B., Rusbana, & L., Herdiani. (2018). Uji antagonis Pseudomonas sp. asal endofit perakaran padi terhadap penyakit blas (Pyricularia oryzae) secara in vitro. Agrologia, 4(2).
Suastika, I.B.K., & A.A.N.B., Kamandalu. 2005. Penggunaan Biopestisida Persada dan Pestisida Nabati dalam Uji Adaptasi Pengendalian Penyakit Layu Pisang di Provinsi Bali. Bali. Balai Pengkajian Teknologi Pertanian Bali.
Sudana, IM. 2004. Identifikasi Patogen Penyebab Penyakit Layu Pisang dan Tingkat Patogenisitasnya pada Beberapa Jenis Pisang Lokal. AGRITROP (Jurnal Ilmu-Ilmu Pertanian) Fakultas Pertanian Universitas Udayana Denpasar. Vol 23(3):82-87.
Sulyanti, E., Habazar, T., Husin, E. F., Nasir, N., & Dharma, A. (2020). Penapisan Isolat fungi mikoriza Arbuskular indigenus rizosfer pisang sebagai induser ketahanan tanaman pisang cavendish terhadap layu Fusarium (Fusarium oxysporum f. s.p. cubense). JURNAL AGROTROPIKA, 16(1).
Wibisono, Y., Savitri, D., Dewi, S. R., & Putranto, A. W. (2014). Ekstrasi Senyawa Fenolik Dari Bawang putih (Allium sativum L.) Untuk Agen Anti-Biofouling Pada Membran. Jurnal Ilmiah Rekayasa Pertanian dan Biosistem, 8(1), 100-109.
20
Discussion and feedback