Isolasi Bakteri Selulolitik dari Buah Kopi Robusta (Coffea canephora) dan Uji Kemampuan Degradasi pada Buah Kopi
on
Nandur
Vol. 1, No. 1, Januari 2021 https://ojs.unud.ac.id/index.php/nandur
EISSN: 2746-6957 | Halaman 46-55 Fakultas Pertanian, Universitas Udayana
Isolasi Bakteri Selulolitik dari Buah Kopi Robusta (Coffea canephora) dan Uji Kemampuan Degradasi pada Buah Kopi
Merlyna Rosalia*), Wayan Adiartayasa, I Gede Putu Wirawan
Program Studi Agroekoteknologi Fakultas Pertanian Universitas Udayana Jl. PB. Sudirman Denpasar, Bali 80232
*)Email: merlynarosalia39@yahoo.com
Abstract
Coffee fruit contains high cellulose and lignin. Cellulose is the most abundant polysaccharide found in plants, cellulose in nature forms crystals so that cellulose is difficult to degrade. Cellulose can be broken down using cellulase enzymes produced by microorganisms. One of the microorganisms capable of producing cellulase enzymes which are used to hydrolyze cellulose into simpler products, namely glucose, is cellulolytic bacteria. The purpose of this study was to identify bacterial isolates that ferment in coffee cherries. The isolation results obtained 97 bacterial colonies that grew, based on observations of color, shape, edges, and surface, they could be grouped into four groups of bacterial isolates named M1, M2, M3, and M4 bacterial isolates, with each cellulolytic index (IS) of 3,00; 0,75; 2,00 and 3,00. The results of the gram stain test obtained one gram-negative bacterial isolate (M2 rod-shaped) and three grampositive bacterial isolates (M1 in the form of a focus, M3 and M4 in the form of a rod). Bacterial isolates M1 and M3 degraded the earliest coffee cherries with an average of 2.66 days after inoculation and no later than 6 day after inoculation in M2M4 and M3M4 bacterial isolates. The ability to degrade bacterial isolates in coffee cherries was obtained 2 - 5.34 days faster than the control.
Keywords: coffee fruit, cellulolytic bacteria, degradation
Buah kopi di Indonesia memiliki kualitas dan kuantitas yang baik di pasar dunia.Hal ini dapat dilihat dari semakin meningkatnya volume dan nilai ekspor buah kopi Indonesia.Tingginya volume ekspor buah kopi Indonesia juga diiringi oleh luasan lahan kopi yang semakin meningkat.Pengolahan buah kopi secara kering memerlukan waktu cukup lama karena adanya proses penjemuran buah. Pengolahan kopi dengan fermentasi dapat membantu petani lebih cepat dalam pengolahan pasca panen buah kopi. Proses fermentasi dibutuhkan starter sebagai mikroba yang akan ditumbuhkan dalam substrat. Kemampuan mikroorganisme untuk tumbuh dan bertahan sangat bergantung pada kemampuan mikroba beradaptasi terhadap kondisi lingkungan yang berubahubah
selama proses fermentasi berlangsung (Lacroix, 2007). Fermentasi merupakan suatu proses terjadinya perubahan kimia pada suatu substrat organik melalui aktivitas enzim yang dihasilkan oleh mikroorganisme (Suprihatin, 2010). Bakteri selulolitik adalah salah satu mikroorganisme yang mampu menghasilkan enzim selulase yang digunakan untuk menghidrolisis selulosa menjadi produk yang lebih sederhana yaitu glukosa (Meriyandini et al., 2009). Glukosa digunakan sebagai sumber karbon dan energi bagi pertumbuhan bakteri selama proses fermentasi berlangsung.
Buah kopi mempunyai kandungan selulosa dan lignin yang tinggi pada kulit buah kopi (Corro et al., 2014). Selulosa termasuk polisakarida terbanyak yang ditemukan pada tanaman, selulolsa di alam membentuk kristal sehingga selulosa sulit mengalami degradasi (Sonia dan Kusnandi, 2015).Selulosa dapat dipecah menggunakan enzim selulaseyang dihasilkan oleh bakteri selulolitik(Nurfitriani dan Eko, 2017), sehingga sangat cocok untuk dilakukan produksi dan uji aktivitas enzim selulase kasar dari bakteri selulolitik. Penelitian ini bertujuan untuk mendapatkan isolat bakteri selulolitik yang berpotensi sebagai stater pada proses pengupasan buah kopi dan dapat mempercepat atau memperpendek pada proses fermentasi buah kopi.
Waktu penelitian adalah bulan Januari sampai dengan April 2021. Penelitian dilaksanakan di Laboratorium Bioteknologi Pertanian, Fakultas Pertanian Universitas Udayana. Sampel buah kopi diperoleh dari Desa Dalang,Kecamatan Selemadeg Timur, Kabupaten Tabanan.
Bahan-bahan yang digunakan dalam penelitian adalah kulit buah kopi robusta, media carboxymethyl cellulose (CMC), yeast ekstrak, agar, nistatin, etanol 95%, alkohol 70%, aquades, H2O2 3%, NaCl, KNO3, K2HPO4, CaCl2, MgSO4, FeSO4, Reagen Congo Red 0,1%, glukosa, kristal violet, lugol, safranin. Alat-alat yang digunakan dalam penelitian ini, cawan petri, tabung reaksi, plastik wrap, micro pipet, autoklaf, pipet tetes, pinset, colony counter, object glass, microskop, jarum ose, laminar air flow, blue tip, neraca analitik, elenmeyer, vortex, magnetic stirrer, sendok pipih, spatula, hot plate, lemari pendingin, gelas beker, lampu bunsen, gelas ukur, botol film, botol semprot, sarung tangan, masker, inkubator, serta alat dokumentasi.
Media Carboxy Methyl Cellulose (CMC) dibuat dalam 100 ml dengan komposisi 1 g CMC; 0,02 g MgSO4.7H2O; 0,075 g KNO3; 0,05 g K2HPO4; 0,002 g FeSO4.7H2O; 0,004 g CaCl2.2H2O; 0,2 g ekstrak kamir; 1,5 g agar-agar bakto, dan 0,1 g glukosa). Bahan yang telah tercampur selanjutnya disterilisasi dalam autoclave pada suhu 121oC selama 15 menit.
Sampel kulit buah kopi dihancurkan atau digerus pada mortal pastel sampai halus. Bubuk kulit buah kopi ditimbang sebanyak 5 g kemudian dimasukan kedalam Erlenmeyer 100 ml yang telah berisi45 ml akuades steril dan dishaker hingga homogen.Tahap berikutnya adalah pengenceran bertingkat,dengan mengabil 1 ml suspensi kultur, yang dimasukan dalam tabung reaksi yang sudah terisi 9 ml aquadest steril lalu divortek hingga homogen dan dibuat pengenceran 10-1 sampai 10-8.
Isolasi bakteri dilakukan dengan metode sebar (spread plate) pada media Carboxymethyl Cellulose (CMC) agar sebanyak 15 ml media CMC agar seteril dituangkan ke dalam cawan petri. Setelah media agar padat ditambahkan 0,1 ml sampel dari masing-masing seri pengenceran 10-5 sampai 10-8Isolasi sampel bakteri diinkubasi pada suhu 370C selama 48 jam.
Pemurnian isolat dilakukan dengan menggunakan metode gores yaitu memindahkan koloni yang tumbuh secara terpisah dan berbeda secara warna dan bentuk dengan jarum ose pada medium selulolitik padat yang baru Inkubasi dilakukan dengan suhu 37oC selama 24-48 jam. Koloni tunggal pada cawan petri kemudian diinokulasikan ke media agar CMC miring sebagai stok bakteri menggunakan loop ose.
Pengujian aktivitas selulolitik dilakukan dengan metode Congo Red. Larutan Congo Red dibuat dengan 0,1 g congo-red yang dilarutkan dengan 100 ml akuades, kemudian dituang pada kultur dan dibiarkan selama 15 menit. Larutan kemudian dibuang dan dibilas dengan NaCl 1% selama 15 menit dilakukan sebanyak tiga kali. Pencucian dilakukan dengan tujuan untuk membuang Congo Red yang tidak berikatan dengan polisakarida. Selanjutnya dilakukan inkubasi pada suhu 4oC selama 48 jam untuk menyempurnakan pembentukan zona bening.Daya degradasi selulosa diklasifikasikan berdasarkan nilai indeks selulolitik dengan kategori tinggi apabila nilai IS ≥ 2, kategori sedang apabila nilai IS 1 sampai 2 dan kategori rendah apabila nilai IS ≤ 1 (Choi et al., 2005). Nilai Indeks Selulolitik (IS) dihitung dengan membandingkan nilai diameter zona bening dan nilai diameter koloni bakteri (Nababan et all., 2019).
Indeks Selulolitik =
diameterzonabening(mm) — diameterkoloni(mm) diameterkoloni
Identifikasi isolat bakteri selulolitik meliputi pewarnaan gram. Pewarnaan gram menggunakan metode konvensional yang dilakukan dengancara satu ose bakteri selulolitik digoreskan pada objek glass, lalu difiksasi (ditambah 1 tetesaquadest, lalu dikering anginkan/dilewatkan di atas api kecil), sehingga terbentuknoda. Di atas noda tersebut kemudian diteteskan berturut-turut: pewarna kristalviolet, larutan lugol, etanol
95%, dan safranin. Sebelum meneteskan larutanselanjutnya, suspensi dibiarkan ± 1 menit, lalu dibilas dengan air mengalir. Terakhir,objek glass ditutup dengan deg glass dan diamati di bawah mikrokop. Pengamatandilakukan terhadap bentuk dan warna bakteri selulolitik.Jika warnanya yang terlihat adalah merah berarti bakteri seluloliltik tersebut Gram negatif, sebaliknya jika warna yang terlihat adalah ungu berarti bakteri selulolitik tersebut termasuk Gram positif (Fauzi, 2008).
Uji kemampuan degradasi bakteri pada buah kopi menggunakan rancangan acak lengkap (RAL) dengan 16 perlakuan dan diulang sebanyak 3 kali ulangan maka diperoleh 48 unit percobaan.
Pembuatan suspensi bakteri uji dibuat dengan mengambil 1 ose bakteri sesuai perlakuan lalu dimasukkan ke dalam tabung reaksi yang sudah terisi media CMC cair steril sebanyak 20 ml dan dishaker hingga homogen. Inkubasi suspensi bakteri selama 3 x 24 jam dengan suhu 370C. Uji kemampuan degradasi bakteri dilakukan dengan buah kopi.Buah kopi bersih dimasukan ke dalam petri yang terisi media agar.Petri yang terisi buah kopi ditambahkan larutan suspensi bakteri selulolitik sebanyak 2 ml diteteskan secara merata di atas permukaan buah kopi dan diinkubasi pada suhu 370C. Pengamatan dilakukan setiap 1 x 24 jam dan amati perubahan yang ditimbulkan. Pengamatan berhenti dilakukan bila perlakuan kotrol mengalami perubahan warna coklat kehitaman.
Analisis data dari penelitian ini meliputi hasil isolasi bakteri selulolitik kulit kopi robusta, seleksi bakteri selulolitik dengan mengukur zona bening congo red, identifikasi morfologi bakteri selulolitik secara deskriptif, dan uji kemampuan degradasi bakteri pada buah kopi menggunakan rancangan acak lengkap (RAL). Data yang diperoleh dianalisa secara statistik mengunakan metode analysis of varians (ANOVA) taraf 5% dan apabila terdapat perbedaan yang nyata dilanjutkan dengan uji Duncans Multiple Range Test (DMRT) taraf 5%.
Hasil isolasi bakteri selulolitik dari fermentasi buah kopi robusta yang tumbuh pada media CMC (Carboxy Methil Cellulase) selama 7 x 24 jam. Didapatkan 97 koloni bakteri pada pengenceran 10-8yang terdiri 38 koloni bakteri berwarna putih kekuningan, 16 koloni berwarna bening, 18 koloni bakteri berwarna putih, dan 25 koloni bakteri berwarna kekuning-kuningan, kemudian dikelompokan menjadi 4 kelompok yang diberi nama isolat bakteri M1, M2, M3, dan M4 disajikan pada Tabel 1.
Tabel 1. Hasil Pengelompokan Koloni Bakteri dari Buah Kopi
|
Isolat |
Morfologi | ||||
|
Kode |
Jumlah |
Warna |
Bentuk |
Tepi |
Permukaan |
|
M1 |
38 |
Putih kekuningan |
Bulat |
Utuh (entire) |
Melengkung |
|
M2 |
16 |
Bening |
Tak beraturan |
Berombak (undulate) |
Rata |
|
M3 |
18 |
Putih |
Bulat |
Utuh (entire) |
Datar timbul |
|
M4 |
25 |
Kekuning-kuningan |
Bulat |
Berombak (undulate) |
Datar timbul |
Isolasi merupakan proses pengambilan bakteri dari lingkungan atau medium asal yang ditumbuhkan di media buatan sehingga diperoleh biakan murni (Singleton dan Sainsbury, 2006). Tujuan isolasi mikroba yaitu memisahkan satu jenis mikroba dengan mikroba lain yang berasal dari berbagai macam mikroba dengan cara menumbuhkannya pada media padat, sel-sel mikroba akan membentuk koloni sel yang tetap pada tempatnya (Sabbathini et all., 2017) sehingga mempermudah saat mengambil isolat sebagai biakan murni.
Hasil permurnian isolat bakteri dari buah kopi robusta dilakukan terhadap 4 isolat bakteri terpilih menggunakan media CMC dengan metode gores (Gambar 1). Hasil pemurnian keempat isolat bakteri berbeda secara morfologi warna, bentuk, tepi, dan permukaan (Tabel 1).
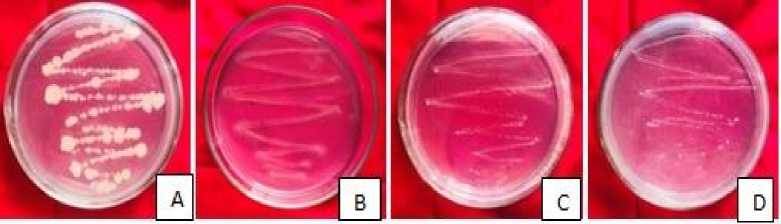
Gambar 1. Permurnian isolat bakteri menggunakan metode gores. (A) Isolat bakteri M1, (B) isolat bakteri M2, (C) Isolat bakteri M3, dan (D) Isolat bakteri M4.
Metode gores digunakan karena metode ini dapat memperkecil jumlah mikroba yang tumbuh pada goresan sehingga mempermudah untuk diamati. Menurut Murtius (2018) metode gores dikombinasikan dengan penggunaan media selektif memiliki komposisi yang memudahkan pertumbuhan kelompok mikroba tertentu sehingga dapat menghambat pertumbuhan kelompok mikroba lainnya.
Hasil uji bakteri penghasil enzim selulase dilakukan pada keempat isolat bakteri M1, M2, M3, dan M4 yang telah dimurnikan. Zona bening akan terbentuk pada keempat isolat bakteri dengan meneteskan larutan congo red dan dibilas menggunakan NaCl 1 M. Zona bening yang telah terbenrtuk dilakukan pengukuran diameter zona bening dan diameter koloni (Gambar 2).

Gambar 2. Hasil pengujian aktivitas selulolitik pada 4 isolat bakteri buah kopi dengan metode congo red 0,1 %. Isolat bakteri M1 (A), M2 (B). M3 (C). dan M4 (D)
Indeks selulolitik isolat bakteri yang memiliki kategori nilai indeks selulolitik (IS) tinggi yaitu kode isolat bakteri M1 memiliki diameter zona bening 8 mm dengan diameter koloni 2 mm, dan kode isolat bakteri M4 memiliki diameter zona bening 4 mm dengan diameter koloni 1 mm. Kode isolat yang memiliki kategori nilai IS sedang adalah kode isolat bakteri M3 dengan diameter zona bening sebesar 3 mm dan diameter koloni 1 mm, sedangkan yang memiliki kategori nilai IS rendah yaitu kode isolat bakteri M2 dengan diameter zona bening 7 mm dan diameter koloni 4 mm (Tabel 2).
Tabel 2. Hasil Pengujian dan Pengukuran Aktivitas Enzim Selulase pada Isolat Bakteri M1, M2, M3, dan M4
|
Kode Isolat bakteri |
Diameter Zona bening (mm) |
Diameter Koloni (mm) |
Indeks Selulolitik (IS) |
Keterangan |
|
M1 |
8 |
2 |
3,00 |
Tinggi |
|
M2 |
7 |
4 |
0,75 |
Rendah |
|
M3 |
3 |
1 |
2,00 |
Sedang |
|
M4 |
4 |
1 |
3,00 |
Tinggi |
Zona bening yang terbentuk pada media agar CMC dapat terlihat jelas melalui pencucian menggunakan NaCl 1 M. Congo red merupakan garam natrium dari benzidinediazobis-1 naphthylamine-4 asam sulfonat sehingga pewarna ini akan larut dan tercuci oleh garam natrium lain, seperti NaCl (Murtiyaningsih dan Hazmi, 2017). Media CMC yang terhidrolisis oleh enzim selulase jika digenangi oleh pewarna congo red tidak akan terwarnai, interaksi ini berlangsung secara non-kovalen.Congo red dijadikan indikator terjadinya degradasi β-D-glukan dalam media agar (Hartanti, 2010).
Uji Pewarnaan gram dari keempat isolat bakteri buah kopi dengan kode isolat bakteri M1 merupakan gram positif karena warna yang dihasilkan biru keungunan dengan berbentuk bulat (Gambar 3 A). Kode isolat M2 termasuk gram negatif karena setelah di uji pewarnaan gram memiliki warna kemerahan dengan berbentuk batang (Gambar 3 B), sedangkan kode isolat M3 dan M4 termasuk bakteri gram positif karena setelah di uji pewarnaan gram memiliki warna keunguan dengan berbentuk batang (Gambar 3 C dan 3 D). Pewarnaan mikroorganisme pada dasarnya adalah prosedur mewarnai mikroorganisme menggunakan zat warna yang dapat menunjukkan struktur tertentu dari mikroorganisme yang diamati.
Interaksi antara sel bakteri dengan kristal violet akan semakin kuat dengan ditambah lugol, ketika dicuci dengan alkohol bakteri gram positif akan tetap mengikat kompleks kristal violet lugol sehingga menjadi berwarna ungu. Bakteri gram negatif akan kehilangan kompleks kristal violet lugol karena lapisan peptidoglikan pada bakteri gram negatif lebih tipis sehingga menjadi tidak berwarna. Safranin yang berwarna merah ketika ditambah maka bakteri gram negatif akan menyerapnya berbeda dengan bakkteri gram positif yang tidak menyerap pewarna lagi (Hidayat, 2011).
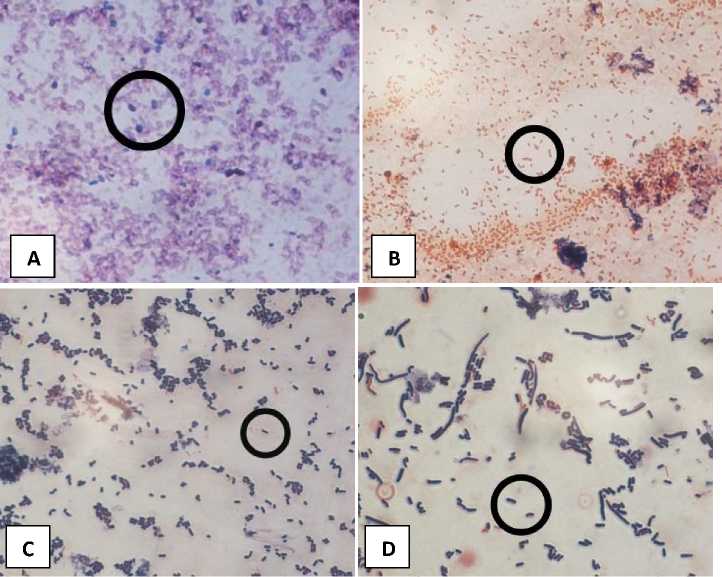
Gambar 3. Hasil Uji Pewarnaan Gram Isolat Bakteri Buah Kopi. (A) Isolat bakteri M1 gram positif berbentuk cocus (B) Isolat bakteri M2 gram negatif berbentuk batang (C) Isolat bakteri M3 gram positif berbentuk batang dan (D) Isolat bakteri M4 gram positif berbentuk batang.
Uji pewarnaan gram bertujuan untuk mempermudah melihat bakteri secara mikroskopik, memperjelas ukuran dan bentuk bakteri, melihat struktur dalam bakteri seperti dinding sel, dan menghasilkan sifat-sifat kimia bakteri dengan zat warna (Bulele et al., 2019).
Hasil uji kemampuan degradasi bakteri selulolitik pada buah kopi dengan pengamatan perubahan warna coklat gelap dan keluarnya cairan. Uji degradasi buah kopi selama 10 hari dengan 16 perlakuan dan 3 kali ulangan. Isolat bakteri mengalami perubahan warna pada buah kopi menjadi coklat paling awal terjadi 1 hari setelah inokulasi (hsi) pada ulangan pertama M1, M3, M1M2 sedangkan yang paling lambat terjadi 8 hsi pada ulangan ketiga M2, M3M4 dan 10 hsi pada ulangan ketiga pada kontrol (lampiran 2). Rata-rata hari perubahan warna pada buah kopi paling awal 2,66 hsi terdapat pada isolat bakteri M1, M3, dan paling lambat 6 hsi pada M2M4, M3M4, dan pada kontrol 8 hsi (Tabel 3). Kemampuan degradasi isolat bakteri pada buah kopi diperoleh lebih cepat 2 sampai dengan 5,34 hari dibandingkan dengan kontrol.
Menurut Pamungkas (2010) jumlah mikroba yang bersifat selulolitik akan mempercepat daya degradasi (perombakan) bahan baku. Kecepatan degradasi pengomposan tidak hanya ditentukan oleh kelimpahan mikroorganisme tapi juga ditentukan jumlah bahan yang dikomposkan, jika jumlah substrat/bahan seimbang dengan jumlah mikoorganisme yang terlibat dalam pengomposan maka pengomposan akan berlangsung cepat (Triwibowo, et all., 2015).
Tabel 3. Hasil Uji Kemampuan Degradasi empat isolat bakteri dari buah kopi robusta
pada buah kopi
|
No |
Perlakuan/ Isolat Bakteri |
Ulan I |
gan (Hari) II |
III |
Total |
Rata-rata (Hari) | |
|
1. |
M1 |
1 |
3 |
4 |
8 |
2,66 |
a |
|
2. |
M2 |
2 |
4 |
6 |
12 |
4,00 |
a b |
|
3. |
M3 |
1 |
3 |
4 |
8 |
2,66 |
a |
|
4. |
M4 |
2 |
3 |
5 |
10 |
3,33 |
a b |
|
5. |
M1M2 |
1 |
3 |
5 |
9 |
3,00 |
a b |
|
6. |
M1M3 |
4 |
4 |
6 |
14 |
4,66 |
a b |
|
7. |
M1M4 |
3 |
5 |
7 |
15 |
5,00 |
a b |
|
8. |
M1M2M3 |
4 |
4 |
6 |
14 |
5,66 |
b c |
|
9. |
M1M2M4 |
4 |
5 |
7 |
16 |
5,33 |
a b c |
|
10. |
M1M3M4 |
3 |
3 |
5 |
11 |
3,66 |
a b |
|
11. |
M1M2M3M4 |
3 |
4 |
6 |
13 |
4,33 |
a b |
|
12. |
M2M3 |
3 |
4 |
6 |
13 |
4,33 |
a b |
|
13. |
M2M4 |
4 |
6 |
8 |
18 |
6,00 |
b c |
|
14. |
M2M3M4 |
3 |
5 |
6 |
14 |
4,66 |
a b |
|
15. |
M3M4 |
4 |
6 |
8 |
18 |
6,00 |
b c |
|
16. |
Kontrol |
6 |
8 |
10 |
24 |
8,00 |
c |
Keterangan: Angka-angka yang diikuti oleh huruf yang sama menunjukkan berbeda tidak nyata
pada uji Ducan taraf 5%.
Berdasarkan karakteristik warna, bentuk, tepi koloni bakteri didapatkan 97 koloni bakteri dan dikelompokkan menjadi 4 kelompok isolat bakteri yaitu, M1, M2, M3, dan M4. Hasil uji gram diperoleh isolat bakteri M1, M3, dan M4 adalah gram positif dan isolat bakteri M2 adalah gram negatif, sedangakan bentuk sel isolat bakteri M1 berbentuk kokus dan isolat bakteri M2, M3, dan M4 berbentuk batang. Isolat bakteri M1 dan M4 memiliki nilai indeks selulolitik tinggi, isolat bakteri M3 sedang, isolat bakteri M2 rendah, dan kemampuan uji degradasi paling awal 2,66 hsi pada (isolat bakteri M1 dan M3) dan paling lambat 6 hsi pada (isolat bakteri M2M4 dan M3M4). Isolat bakteri buah kopi mampu mendegradasi lebih cepat 2 - 5,34 hari dibandingkan kontrol.
Daftar Pustaka
Bulele, T., F.E.S. Rare., dan J. Porotu’o. (2019). Identifikasi Bakteri denga Pewarnaan Gram pada Penderita Mata Luar di Rumah Sakit Mata Kota Manado.Jurnal e-Biomedik, 7(1).
Choi, Y.W., I.J. Hodgkiss., and K.D. Hyde. (2005). Enzyme Production by Endophytes of Brucea Javanica. J Agric Tech, 1: 55-66.
Corro, G., U. Pal, and S. Cebada. (2014). Enhanced biogas production from coffee pulp through deligninocellulosic photocatalytic pretreatment. Energy Science and Engineering 2(4): 177-187.
Fauzi, M. (2008). Isolasi dan Karakterisasi Bakteri Asam Laktat Biji Kopi Luwak (Civet Coffe). Jurusan Teknologi Hasil Pertanian. Fakultas Teknologi Pertanian. Universitas Jember.
Hartanti. (2010). Isolasi dan Seleksi Bakteri Selulolitik Termofilik dari Kawah Air Panas Gunung Pancar, Bogor. Skripsi FMIPA IPB, Bogor.
Hidayat, H. (2011). Karakterisasi Molekuler BAL dengan Gen 16s rRNA Penghasil Enzim Protease yang Berpotensi sebagai Probiotik dari Fermentasi Markisa Kuning di Sumatra Barat. Padang. Universitas Andalas.
Lacroix, C. (2007). Fermentation technologies for the production of probiotics with high viability and functionality. Current Opinion in Biotechnology, 18: 176-183.
Meryandini, A., W. Widosari, B. Maranatha, T. C. Sunarti, N. Rachmania, dan H.
Satria. (2009).Isolasi bakteri selulolitik dan karakterisasi enzimnya. Makara Sains 13(1): 33-38.
Murtiyaningsih, H., dan M. Hamzi. (2017). Isolasi dan Uji Aktivitas Enzim selulase pada Bakteri Selulolitik Asal Tanah Sampah. Agrotrop 10(2): 293-308.
Murtiyus, W.S. 2018. Modul Pratek Dasar Mikrobiologi. Universitas Andalas. Padang Sumatra Barat.
Nababan, M., I.B.W. Gunam., dan I.M.M. Wijaya. (2019). Produksi Enzim Selulase Kasar Dari Bakteri Selulolitik. Jurnal Rekayasa dan Manajemen Agroindustri, 7(2): 190-199.
Nurfitriani, S dan H. Eko. (2017). Dekomposisi Kulit Kopi Oleh Bakteri Selulolitik Yang Diisolasi Dari Timbunan Kulit Kopi Di Perkebunan Kalibendo, Jawa Timur.Jurnal Tanah dan Sumberdaya Lahan 4(2): 503-514.
Pamungkas, D., E. Marhaeniyanto., A. Wea., dan K. E. Suhana. (2010). Subtitusi Rumput Gajah denga Tumpi Jagung dan Kulit Kopi terhadap Penampilan Sapi Peranakan Ongole. Buana Sains, 10(1): 29-39.
Sabbathini, G.C., S. Pujiyanto., dan P. Lisdiyanti. (2017). Isolasi dan Identifikasi Bakteri Genus Sphingomonas dari Daun Padi (Oryza sativa) di Area Persawahan Cibinong. Jurnal Biologi. 6(1): 59-64.
Sonia, N.M.O dan J. Kusnadi. (2015). Isolasi dan karakterisasi parsial enzim selulase dari isolatbakteri OS-16 asal padang pasir Tengger-Bromo. Jurnal Pangan dan Agroindustri 3(4): 11-19.
Suprihatin. (2010). Teknologi Fermentasi. Surabaya: UNESA Pres
Triwibowo, M.B., Suratno., dan Sulifa. (2015). Pengaruh Pemberian Bioaktivator Effective Microorganism 4 (EM-4) terhadap Kecepatan dan Kualitas Pembuatan Kompos serta Pemanfaatan sebagai Bahan Ajar Bioteknologi Di SMA. Pancaran, 4(2): 11-20.
55
Discussion and feedback