Estimasi Simpanan Karbon pada Padang Lamun di Kawasan Pantai Karang Sewu, Gilimanuk, Bali
on
JMRT, Volume 3 No 1 Tahun 2020, Halaman: 40-46
JOURNAL OF MARINE RESEARCH AND TECHNOLOGY
journal homepage: https://ojs.unud.ac.id/index.php/JMRT
ISSN: 2621-0096 (electronic); 2621-0088 (print)
aProgram Studi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Universitas Udayana, Bali, Indonesia
*Corresponding author email : gede.hendrawan@unud.ac.id
ARTICLE INFO
ABSTRACT
Article history:
Received: September 24th 2019
Received in revised form: October 27th 2019
Accepted: February 05th 2020
Available online: February 28th 2020
Keywords: Seagrass Carbon Stock Karang Sewu Coastal Area
The growth of the industrial sector in many countries which is relatively fast can increase emissions from greenhouse gases (GHGs) such as carbon dioxide (CO2) in the atmosphere. One of the aspects in reducing carbon gas is by maintaining forests and oceans to store carbon. One of the marine resources that is quite potential as storing CO2 gas is sea grass beds. Sea grass has a major role, namely as a carbon sink in the ocean or known as the Blue Carbon and is used for photosynthesis. The purpose of this study was to determine the carbon stocks in sea grasses at the top of the substrate (leaves), the bottom of the substrate (roots and rhizome) and on each type of sea grass obtained at Karang Sewu Beach. Determination of sampling points is as many as 6 stations and for sea grass sampling was carried out by purposive random sampling, referring to the density of sea grass which is assumed to represent or describe the condition of these waters. This research applied the dry ashing method that was carried out by crushing the sample components at 500˚C. The results showed carbon deposits on the top of the substrate (leaves) of 0.01 tons, and on the bottom of the substrate (rhizomes and roots) of 0.02 tons. The yield of carbon stocks at the bottom of the substrate was higher than the top of the substrate due to the presence of organic matter, which is stored on the substrate into a carbon absorption factor at the bottom of the sea grass under the substrate.
2020 JMRT. All rights reserved
Pergerakan dibidang industry dibeberapa Negara yang sangat cepat dapat meningkatkan emisi dari Green House Gases (GHGs) atau Gas Rumah Kaca (GRK). Sedangkan atmosfer lebih banyak menerima karbondioksida (CO2) akibat dari pembakaran bahan bakar fosil dari kendaraan bermotor dan mesin industri (Houghton et al., 2001). Banyaknya karbondioksida yang berada di bumi dan tersimpan dilaut sebanyak 93% sehingga laut memiliki peran penting dalam siklus karbon melalui proses fotosintesis (Nelleman et al., 2009). Adapun beberapa ekosistem dilaut yang memiiki potensi dalam penyerapan karbon dari atmosfer melalui proses fotosintesis yaitu fitoplankton yang tak dapat dilihat dengan mata telanjang atau mikroskopis maupun beberapa ekosistem yang hidup dilaut seperti ekosistem mangrove, seagrass beds, dan juga salt marsh atau rawa air payau. Penyerapan karbon pada ekosistem tersebut dapat menyerap kurang dari ½ % dari luas laut di seluruh dunia, ketiga ekosistem tersebut dapat menyimpan setengah dari karbon laut ke sedimen dasar laut (Kawaroe, 2009).
Adapun sumberdaya laut yang mempunyai potensi yang cukup tinggi dalam penyerapan karbon atau gas CO2 diatmosfer yaitu ekosistem padang lamun (Seagrass beds). Seagrass sendiri memiliki peranan yang utama yaitu sebagai penyerap CO2 dilautan (Carbon sink) atau yang biasa dikenal dengan sebutan karbon biru atau Blue carbon dan dimafaatkan dalam proses fotosintesis (Kawaroe, 2009). Seagrass melakukan
proses fotosintesis yang kemudian akan menghasilkan organic matter dari bahan anorganik yang akan dibantu oleh sinar matahari (Supriadi et al., 2012). Output yang dihasilkan oleh lamun melalui proses fotosintesis pada saat penyerapan karbon akan disimpan oleh lamun dalam bentuk biomass yang disimpan pada bagian atas substrat (daun) dan bagian bawah substrat (rhizoma dan akar) (Supriadi et al., 2012). Seagrass beds sendiri dapat menyimpan karbon dengan rata-rata 0,21 ton/ha dengan spesies yang memiliki peran penting dalam penyerapan karbon yaitu Enhalus acoroides (Graha, 2015).
Adapun potensi yang dimiliki oleh padang lamun pada bagian bawah substrat (rhizoma dan akar) yaitu peluang dalam penyerapan karbon akan tersimpan lebih lama dan akan tetap bertambah ketika ekosistem tersebut masih tetap terjaga dari kerusakan alam maupun non alam, sedangkan pada bagian atas substrat (daun) biasanya akan dimanfaatkan pada siklus rantai makanan (Rusman et al., 2014). Kennedy et al., (2009) juga menyatakan bahwa kandungan karbon dibawah substrat akan tersimpan disedimen walaupun tunas pada lamun tersebut telah mati, sedangkan karbon diatas substrat hanya akan tersimpan jika tunas lamun masih tetap hidup. Peluang simpanan karbon lamun akan berbanding lurus dengan luas area lamun yang dimiliki oleh suatu perairan, semakin besar luas lamun maka peluang penyimpanan karbonnya pun akan semakin tinggi juga (Setiawan, 2012).
Salah satu daerah habitat ekosistem lamun yaitu di Pantai Karang Sewu. Pantai Karang Sewu merupakan bagian dari Taman Nasional Bali Barat dan menjadi bagian dari zona
pemanfaatan dengan adanya ekosistem mangrove dan padang lamun. Padang lamun dapat hidup di berbagai jenis substrat, salah satunya yaitu pasir, pecahan karang dan pasir berlumpur. Seperti yang dikemukakan oleh Yunitha (2015) bahwa penyerapan karbon organik dipengaruhi oleh besaran butiran substrat, karena butiran substrat yang lebih besar menurunkan kemampuan substrat tersebut menyerap karbon organik. Di perairan Bali ditemukan 8 spesies lamun menurut Yusup (2014), yaitu spesies Enhalus acoroides, Thalassodendron ciliatum, Cymodocea rotundata, Cymodocea serrulata, Halodule uninervis, Syringodium isoetifolium, Halopila ovalis dan Thalassia hemprichii.
Penelitian mengenai estimasi simpanan karbon pada padang lamun masih sangat sedikit dilakukan di Bali terutama pada daerah Bali bagian barat. Oleh karena itu, pentingnya dilakukan penelitian mengenai estimasi total simpanan karbon pada padang lamun di kawasan Pantai Karang Sewu, Gilimanuk, Bali.
Penelitian kali ini dilakukan mulai dari bulan Maret 2019 yaitu mencakup pengambilan data lapangan dan pengolahan sampel di laboratorium. Pengambilan sampel dilakukan di Pantai Karang Sewu, Gilimanuk. Pengolahan sampel biomassa dilakukan di Laboratorium Ilmu Kelautan, Fakultas Kelautan dan Perikanan dan pengolahan sampel dengan metode pengabuan dilakukan di Lab Tanah, Fakultas Pertanian.
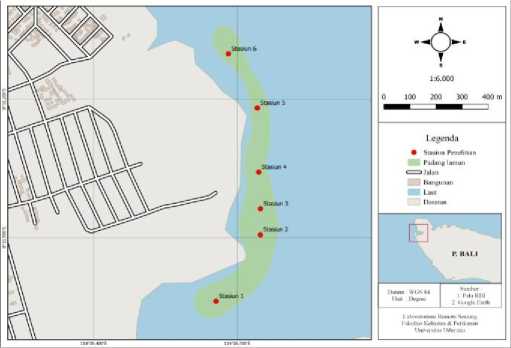
Gambar 1. Peta Lokasi Penelitian
bantuan sekop dan pisau hingga kedalaman penetrasi akar. Rhizome yang berada diluar transek akan dipotong agar mempermudah proses pengambilan sampel yang berada didalam transek. Setelah sampel dicuplik, kemudian dimasukkan kedalam plastik sampel lalu disimpal dalam coolbox.
-
2.3 . Pengolahan Sampel
-
2.3.1 Biomassa Lamun
-
Biomassa lamun dihitung dengan mengeringkan lamun menggunakan dry oven pada suhu 60˚C dalam waktu 24 jam dilaboratorium. Sebelum dikeringkan sampel lamun dipisahkan menjadi 2 bagian yaitu bagian daun, rhizoma dan akar berdasarkan jenisnya pada setiap stasiun. Setelah dikeringkan kemudian semua contoh lamun ditimbang dengan menggunakan neraca analitik. Kemudian berat kering sampel dihitung untuk mendapatkan nilai biomassa.
-
2.3.2 Kandungan Karbon
Untuk mencari kandungan karbon yaitu dengan menggunakan metode pengabuan. Sampel lamun yang telah dikeringkan, kemudian dikeringkan kembali kedalam dry oven selama 2 jam. Bersihkan cawan sebelum digunakan, kemudian timbang cawan sebagai cawan kosong. Masukkan sampel kering kedalam cawan sebanyak 2 gram dan ditimbang sebagai berat cawan + sampel. Sampel kemudian diletakkan kedalam tanur listrik dalam waktu 6 jam dengan suhu 500o sampai sampel berubah menjadi abu dengan ditandai warna putih ke abu-abuan lalu dicatat sebagai berat cawan + abu. Diharapkan sampel yang diambil cukup untuk memenuhi kebutuhan dari uji labortorium yang dilakukan.
-
2.4 Analisis Data
-
2.4.1. Kerapatan Lamun
-
Skala yang dapat digunakan untuk kerapatan lamun dibagi menjadi 5 kategori guna sebagai acuan dalam pengambilan data dilapangan menggunakan transek kuadran. Adapun rumus yang digunakan dalam menghitung kerapatan lamun yaitu sebagai berikut (Ira et al., 2013):
Di = ∑ ni/Ai (1)
dimana Di adalah kerapatan lamun jenis-I (tegakan/m2), ni adalah jumlah total tegakan spesies (tegakan), A adalah luas daerah yang disampling (m2).
-
2.2. Metode Pengambilan Sampel
Penelitian yang telah dilakukan pada kali ini dimana, penentuan titik sampling yaitu sebanyak 6 stasiun penelitian. Untuk pengambilan sampel lamun dilakukan dengan menggunaka metode secara purposive random sampling dengan pengulangan sebanyak 3 kali pada tiap stasiunnya, dimana mengacu pada keberadaan lamun yang dianggap dapat mewakili perhitungan persamaan kerapatan, biomassa dan total simpanan karbon. Pengambilan sampel kerapatan dilapangan dilakukan dengan menggunakan transek kuadran 1x1m2 yang kemudian dibagi kedalam 25 sub petak dengan ukuran 20x20cm, sedangkan pengambilan sampel biomassa lamun hanya pada sub peta berukuran 20x20 cm. Bersamaan pada saat dilakukannya pengambilan sampel lamun dilakukan juga pengukuran parameter lingkungan yaitu salinitas, pH air, pH tanah dan oksigen terlarut. Pengambilan sampel lamun hanya diambil pada sub petak 20x20 cm dengan cara mencuplik menggunakan
Tabel 1. Skala kondisi padang lamun berdasarkan kerapatan (Amran, 2009 in Nurzahraeni, 2014)
|
Skala |
Kerapatan (tegakan/m2) |
Kondisi |
|
5 |
≥625 |
Sangat Rapat |
|
4 |
425-624 |
Rapat |
|
3 |
225-424 |
Agak Rapat |
|
2 |
25-224 |
Jarang |
|
1 |
<25 |
Sangat Jarang |
-
2.4. 2 Biomassa dan Kandungan Karbon
Biomassa lamun dihitung dengan cara menghitung berat kering lamun kemudian dibagi luas area transek kuadran dengan menggunakan persamaan menurut Santoso et al. (2018):
B = W / A (2)
dimana B adalah Biomassa Lamun (gbk/m2), W adalah Berat Kering Lamun (gbk), dan A adalah Luas Area (m2).
Hasil dari perhitungan yang didapat selanjutnya akan digunakan kedalam persamaan kadar abu dan juga kadar bahan organik. Persamaan yang akan digunakan untuk menghitung kadar abu pada jaringan lamun yaitu menggunakan metode pengabuan (Huriawati, 2016):
Kadar Abu = x 100% (3)
Setelah mengetahui kadar abu, kemudian menghitung kadar bahan organik dengan cara menghitung pengurangan berat kering pada saat pengabuan dengan menggunakan perhitungan (4):
Kadar Bahan Organik = [(b- a)-(c- a)1 χ 100% (4)
(b-a)
dimana a adalah berat cawan, b adalah berat cawan + berat sampel dan c adalah berat cawan + berat abu.
Sesudah diketahui nilai kadar abu dan bahan organik, kemudian menghitung persamaan kandungan karbon dengan persamaan sebagai berikut (Helrich, 1990):
i BahanOraanik
Kandungan Karbon = (5)
dimana 1,724 adalah konstanta nilai bahan organik.
Pantai Karang Sewu merupakan bagian dari Teluk Gilimanuk yang terletak di Br. Arum, desa Gilimanuk, Kec. Melaya, Kabupaten Jembrana. Pantai ini termasuk dalam kawasan Taman Nasional Bali Barat (TNBB). Pantai Karang Sewu memiliki keindahan yang cukup unik karena hanya ada endapan lumpur yang mulai mengeras berwarna hitam menyerupai tebing yang rendah. Jenis substrat di Pantai Karang Sewu di dominasi oleh endapan lumpur yang menyerupai tanah dan pasir putih yang bercampur endapan lumpur. Pantai Karang Sewu menjadi bagian dari zona pemanfaatan dengan adanya ekosistem mangrove dan padang lamun yang hidup berdampingan. Ekosistem lamun pada Pantai Karang Sewu hidup secara bergerombol tidak membentuk hamparan padang lamun dengan kondisi gerombolan lamunnya yaitu monospesies. Aktivitas manusia di Pantai Karang Sewu hanya ditemukan pada stasiun 1, 4 dan 5 yaitu sebagai tempat bersandarnya kapal nelayan dan kapal patroli milik Taman Nasional Bali Barat sedangkan pada stasiun 2,3 dan 6 aktivitas manusia hanya ditemukan hanya didarat seperti berwisata atau menikmati pemandangan disekitar pantai. Pantai Karang Sewu berada di Teluk Gilimanuk mengakibatkan stasiun penelitian hanya terkena pasang surut pada stasiun 1, 2, dan 3 saja, sedangkan pada stasiun 4, 5 dan 6 yang mendekati mulut teluk masih digenangi oleh air laut.
Dari hasil pengukuran parameter lingkungan pada tiap stasiun penelitian di Pantai Karang Sewu didapatkan bahwa kualitas perairan unutk oksigen terlarut (Dissolved Oxygen), pH air, pH tanah dan salinitas (Tabel 2). Hasil Dissolved oxygen yang didapatkan pada lokasi penelitian yang sekitar 8.2-8.6 (mg/L). Menurut Odum (1971) menyatakan bahwa kadar oksigen yang terdapat didalam air laut akan bertambah dengan semakin rendahnya suhu dan berkurang dengan semakin
tingginya salinitas. Nilai Dissolved oxygen yang didapatkan di lokasi penelitian sudah termasuk kedalam kategori aman, Barus (2004) menyatakan bahwa, nilai Dissolved oxygen (DO) disuatu perairan lebih baik berkisar antara 6-8 mg/L.
Nilai derajat keasaman (pH) disuatu perairan memang sangat dipengaruhi oleh dekomposisi tanah dan perairan tersebut serta dipengaruhi oleh keadaan lingkungan sekitarnya (Argandi, 2003). Sedangkan nilai pH air di Pantai Karang Sewu yaitu berkisar antara 7 sampai 7.8. Sedangkan nilai pH tanah di Pantai Karang Sewu berkisar antara 6.5 – 7.1. Menurut Riry et al. (2018) nilai pH normal tanah untuk tumbuhan yaitu 5.6-7.
Hasil pengukuran salinitas di Pantai Karang Sewu memiliki nilai 31-32 ‰ sehingga sudah mendekati salinitas yang optimum untuk perkembangan ekosistem lamun seperti yang dinyatakan oleh KEPMEN LH No.51 Th 2004. Dari nilai tersebut dapat juga diperkuat oleh Hilman et al. (1989) bahwa kisaran salinitas yang sesuai yaitu berkisar 24-35 ‰ sehingga cukup mendukung kehidupan komunitas lamun, karena berada pada kisaran salinitas yang cocok untuk pertumbuhan lamun. Di perairan Indonesia yang termasuk iklim tropis, menyebabkan nilai salinitas meningkat dari arah barat ke timur dengan kisaran antara 30-35 ‰.
Jenis substrat yang ditemukan di Pantai Karang Sewu yaitu terdapat 2 jenis yaitu pasir dan pasir berlumpur. Menurut Newmaster et al. (2011), bahwa lamun dapat hidup pada substrat berlumpur, berpasir, tanah liat maupun substrat dengan pecahan-pecahan karang serta pada celah-celah batu. Substrat pasir dan pasir berlumpur merupakan jenis substrat yang umum ditinggali oleh lamun. Jenis substrat juga dapat mempengaruhi penyerapan karbon organik. Seperti yang dikemukakan oleh Yunitha (2015) bahwa penyerapan karbon organik dapat dipengaruhi oleh besaran butiran pada substrat, karena semakin besar butiran substrat dapat menurunkan kemampuan substrat tersebut menyerap karbon organik. Hal ini juga diperkuat oleh pernyataan Handayani et al. (2016), yang mengatakan bahwa semakin halus tekstur substrat maka semakin memungkinkan lamun dapat bertumbuh dan berkembang dengan baik karena memudahkan lamun untuk menancapkan akarnya kedalam susbstrat dan memudahkan lamun untuk dapat menyerap untur-unsur hara yang ada pada substrat sedimen.
|
Tabel 2. Parameter perairan di Pantai Karang Sewu | |||||
|
Stasiun |
DO (mg/L) |
pH Air |
pH Tanah |
Salinitas (‰) |
Jenis Substrat |
|
1 |
8.6 |
7 |
6.8 |
31 |
Pasir |
|
2 |
8.2 |
7 |
7 |
31 |
Pasir |
|
3 |
8.2 |
7.5 |
6.5 |
32 |
Berlumpur Pasir |
|
4 |
8.4 |
6.5 |
6.5 |
32 |
Pasir |
|
5 |
8.4 |
7 |
6.5 |
31 |
Pasir |
|
6 |
8.4 |
7.8 |
7.1 |
31 |
Pasir |
|
Berlumpur | |||||
-
3.2 Kerapatan Lamun
Dari hasil penelitian yang telah dilakukan didapatkan 3 spesies lamun di Pantai Karang Sewu, Gilimanuk yaitu Enhalus acoroides, Thalassia hemprichii dan Halodule uninervis. Pada stasiun 1 hanya ditemukan satu jenis lamun yaitu Enhalus
acoroides dengan jumlah tegakan yaitu 80 tgk/m2 dan total nilai kerapatan yaitu 27 tegakan/m2 dengan kondisi lamun jarang.
Pada stasiun 2 terdapat dua jenis lamun yang ditemukan yaitu Enhalus acoroides dan Thalassia hemprichii dengan jenis yang mendominasi yaitu Enhalus acoroides dengan jumlah tegakan yaitu 70 tgk/m2 dan jenis Thalassia hemprichii yaitu 27 tgk/m2 dan total nilai kerapatan yaitu 32 tegakan/m2 dengan kondisi lamun jarang. Pada stasiun 3 ditemukan dua jenis lamun yaitu Enhalus acoroides dan Thalassia hemprichii dengan jenis Thalassia hemprichii yang mendominasi dengan jumlah tegakan yaitu 300 tgk/m2 dan Enhalus acoroides yaitu 31 tgk/m2 dengan total nilai kerapatan yaitu 110 tegakan/m2 dengan kondisi lamun jarang. Pada stasiun 4 terdapat satu jenis lamun yang ditemukan yaitu Enhalus acoroides yang mendominasi dengan jumlah tegakan yaitu 100 tgk/m2 dan total nilai kerapatan yaitu 33 tegakan/m2 dengan kondisi lamun jarang. Pada stasiun 5 terdapat dua jenis lamun yaitu Enhalus acoroides dan Halodule uninervis dengan jenis Halodule uninervis yang mendominasi dengan jumlah tegakan yaitu 148 tgk/m2 dan Enhalus acoroides yaitu 32 tgk/m2 dengan total nilai kerapatan yaitu 60 tegakan/m2 dengan kondisi lamun jarang. Pada stasiun 6 terdapat satu jenis lamun yang ditemukan yaitu Enhalus acoroides yaitu dengan jumlah tegakan yaitu 106 tgk/m2 dengan total nilai kerapatan yaitu 35 tegakan/m2 dengan kondisi lamun jarang.
Dari total kerapatan jenis lamun dari seluruh transek penelitian dimana transek 1 memiliki nilai kerapatan terkecil dikarenakan morfologi dari jenis Enhalus acoroides lebih besar jika dibandingkan dengan jenis lamun Thalassia hemprichii dan Halodule uninervis. Menurut Waycott et al. (2004), Enhalus acoroides merupakan tanaman yang kuat serta memiliki daun yang panjang dengan permukaan yang halus dan memiliki rhizoma yang tebal. Adanya perbedaan spesies lamun dan kerapatan lamun pada tiap stasiun lokasi penelitian dapat diduga ada hubungan dengan kemampuan adaptasi pada setiap spesies jenis lamun tersebut pada kondisi perairan dan lingkungan yang berbeda-beda. Jenis Halodule uninervis ditemukan hanya di stasiun 5 diduga karena Halodule uninervis merupakan lamun yang umumnya ditemukan pada kedalaman 0-3 meter dan biasanya tumbuh pada substrat berpasir (Carruthers et al., 2007). Adapun tabel kerapatan lamun di Pantai Karang Sewu yaitu : Tabel 3. Kerapatan lamun di Pantai Karang Sewu
Transek Jenis Lamun Rata-Rata
Kuadrat Kerapatan Kondisi
(1 x 1 m2 ) E. T. H. (tegakan/m2)
acoroides hemprichii uninervis
-
1 24 - - 27 Jarang
-
2 - 27 - 32 Jarang
-
3 - 147 - 110 Jarang
-
4 32 - - 33 Jarang
-
5 - - 81 60 Jarang
23
6
38
35
Jarang
45
-
3.3 Biomassa Lamun
Biomassa dapat didefinisikan sebagai bahan biologi yang berasal dari suatu organisme atau makhluk hidup. Menurut Supriadi (2014), bahwa biomassa merupakan total jumlah materi hidup diatas permukaan suatu tanaman atau pohon dan pada beberapa jenis tanaman, biomassa dapat dihitung melalui berat kering tanaman tersebut. Berdasarkan hasil perhitungan yang telah dilakukan menunjukkan bahwa total nilai biomassa yang diperoleh pada umumnya lebih banyak ditemukan lamun jenis Enhalus acoroides dan Thalassia hemprichii walaupun nilai kerapatan jenis ini tidak sebanyak lamun jenis Halodule uninervis yang memiliki morfologi yang lebih kecil.
Rata-rata biomassa lamun per-kuadran (m²) yaitu diperoleh dari 6 stasiun, dimana biomassa tertinggi terdapat pada stasiun 3 karena pada stasiun tersebut ditemukan lamun jenis Enhalus acoroides dan Thalassia hemprichii yang memiliki morfologi lebih besar, sehingga biomassa yang didapatkan lebih tinggi. Sedangkan biomassa lamun terendah terdapat pada stasiun 1. Menurut penelitian yang dilakukan oleh Supriadi (2012) menyatakan bahwa rata-rata biomassa dibawah substrat lebih dari tiga kali lipat dibanding biomassa pada bagian atas substrat. Pernyataan tersebut sesuai dengan hasil nilai biomassa yang telah didapatkan pada penelitian kali ini. Grafik biomassa pada bagian atas (daun) substrat dan bagian bawah (rhizoma dan akar) susbstrat dapat dilihat pada gambar dibawah ini :
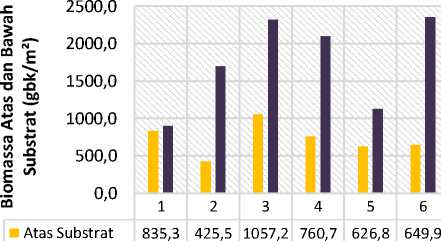
■ Bawah Substrat 903,7 1698,1 2318,4 2098,4 1130,8 2357,3
Gambar 2. Biomassa Atas (daun) dan Bawah (rhizoma dan akar) Substrat di Pantai Karang Sewu
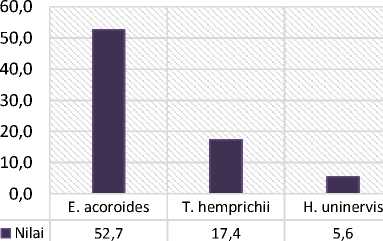
Dari hasil perhitungan biomassa yang telah dilakukan didapatkan bahwa nilai biomassa individu lamun tertinggi terdapat pada lamun jenis Enhalus acoroides yaitu dengan nilai biomassa mencapai 52,7 gram berat kering (gbk)/individu. Hal ini diduga karena Enhalus acoroides merupakan jenis lamun dengan morfologi lamun lebih besar daripada jenis lamun lain yang ditemukan di Pantai Karang Sewu. Kemudian nilai biomassa pada individu jenis lamun Thalassia hemprichii yaitu mencapai 17,4 gram berat kering (gbk)/individu dan nilai biomassa individu jenis lamun terendah terdapat pada lamun jenis Halodule uninervis dengan nilai biomassa mencapai 5,6 gram berat kering (gbk)/individu. Jenis Halodule uninervis merupakan jenis pembuka (pionir) dengan ukuran morfologi lebih kecil dibandingkan dengan jenis Enhalus acoroides dan Thalassia hemprichii. Namun berdasarkan nilai biomassa terhadap jenis lamun yang lebih mendominasi yaitu jenis Enhalus acoroides mempunyai nilai biomassa yang lebih tinggi
dibandingkan Halodule uninervis. Menurut Ferawati et al. (2018), besarnya nilai biomassa yang dimiliki oleh Enhalus acoroides dikarenakan memiliki ukuran morfologi yang lebih besar dan tebal baik pada bagian daun, rhizoma maupun akar, sebaliknya pada jenis lamun lainnya yang memiliki ukuran morfologi yang lebih kecil sehingga dapat mempengaruhi kandungan biomassa dari lamun tersebut. Biomassa padang lamun memiliki peran penting pada siklus karbon pada lamun. Semakin besar ukuran morfologi yang dimiliki oleh lamun, maka jumlah individu yang dimiliki lamun tersebut pada suatu luasan tertentu akan berkurang (Fauziyah, 2004).
100%
80%
60%
40%
20%
0%

Atas Substrat Bawah Substrat
Jenis Lamun
Gambar 3. Biomassa Individu Jenis Lamun di Pantai Karang Sewu
-
3.4 Kadar Abu dan Bahan Organik
Setelah dilakukan perhitungan dengan menggunakan persamaan kadar abu (3.3) dan bahan organik (3.4) pada metode pengabuan bagian atas (daun) substrat dan bagian bawah (rhizoma dan akar) substrat (Gambar 4). Hasil nilai dari kadar abu pada bagan atas (daun) substrat mempunyai persentase yang lebih rendah yaitu 37% dan kandungan bahan organik yaitu sebesar 63%. Sedangkan pada hasil kadar abu bagian bawah (rhizoma dan akar) substrat yaitu sebesar 87%. Nilai kadar abu pada atas (daun) dan bawah (rhizoma dan akar) substrat merupakan hasil dari penguapan selama proses pengabuan yang menandakan bahwa terdapat mineral matter yang terdapat pada sampel lamun. Sisa dari hasil berat kering sampel yang telah melalui proses penguapan pada saat pengovenan menggunakan tanur listrik dapat berupa mineral matter (Handayani, 2016). Menurut Riniatsih (2015), kerapatan lamun juga dapat dipengaruhi oleh organic matter, dimana jika kerapat dan morfologi lamun semakin tinggi maka akan semakin banyak organic matter yang akan terikat pada dasar perairan. Tingginya nilai bahan organik pada bagian bawah substrat karena pada bagian bawah substrat bahan organik akan tetap tersimpan pada sedimen sehingga sedimen dapat mengikat bahan organik lebih banyak dan diserap oleh akar maupun rhizoma dibandingkan pada lamun bagian atas substrat.
Kadar Abu ■ Bahan Organik
Gambar 4. Kadar Abu dan Bahan Organik Atas (daun) dan Bawah (rhizoma dan akar) Substrat di Pantai Karang Sewu
-
3.5 Kandungan Karbon
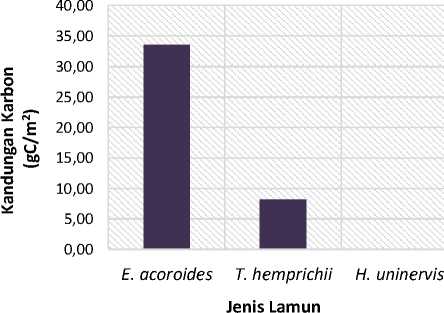
Kandungan karbon pada lamun menggambarkan seberapa besar lamun tersebut dapat mengikat CO2 dari udara. Kandungan karbon sendiri dapat diartikan sebagai banyaknya karbon yang mampu diserap oleh lamun dalam bentuk biomassa. Karbon lamun dalam bentuk biomassa tersimpan selama lamun itu masih hidup (Carruthers et al., 2007). Berdasarkan perhitungan kandungan karbon dengan menggunakan metode pengabuan, didapatkan bahwa kandungan karbon tertinggi terdapat pada jenis Enhalus acoroides dengan nilai kandungan karbon yaitu 33.61 gC/m2, kemudian Thalassia hemprichii dengan nilai kandungan karbon yaitu 8.25 gC/m2 dan kandungan karbon terendah yaitu lamun jenis Halodule uninervis dengan nilai sebesar 0.01 gC/m2.
Menurut Widyasari et al. (2010), kandungan karbon juga berkaitan erat dengan tingginya nilai biomassa yang didapat. Dari hasil kandungan karbon yang didapat pada penelitian ini memiliki hasil yang berbanding lurus dengan penyataan dari Yuniawati (2014), mengatakan jika semakin tinggi kandungan biomassa yang dimiliki lamun, maka kandungan karbonnya pun akan semakin tinggi juga.
Gambar 5. Kandungan Karbon Lamun Per Jenis di Pantai Karang Sewu
Dari hasil analisis dengan menggunakan metode pengabuan didapatkan rata-rata kandungan karbon pada lamun bagian atas substrat (daun) dan bawah substrat (rhizoma dan akar) (Gambar 6). Rata-rata hasil kandungan karbon tertinggi didapatkan pada bagian bawah substrat (rhizoma dan akar) dengan nilai yaitu 8.01 gC/m2 dan rata-rata kandungan karbon
pada bagian atas substrat (daun) yaitu 2.47 gC/m2. Hasil yang telah didapatkan pada penelitian kali ini sudah sesuai dengan penelitian yang dilakukan oleh Putra et al. (2017) yaitu, kandungan karbon pada bagian bawah substrat lebih tinggi dibandingkan dengan bagian atas substrat. Menurut Kennedy et al. (2009) mengatakan bahwa kandungan karbon dibawah substrat akan tetap tersimpan disedimen walaupun tumbuhan lamun tersebut telah mati, sedangkan kandungan karbon diatas substrat hanya akan tersimpan ketika tunas lamun masih dalam keadaan hidup.
yang dikatakan oleh Yunitha (2015) bahwa penyerapan karbon organik sangat dipengaruhi oleh besaran butiran substrat, karena semakin besar butiran substrat akan menurunkan kemampuan substrat tersebut mengikat karbon organik.
Hal ini sesuai dengan pernyataan yang disampaikan oleh Christon et al. (2012) bahwa besarnya biomassa lamun pada substrat yang lebih kecil (halus) disebabkan oleh efek positif terhadap sistem penyerapan nutrient, sebaliknya substrat yang lebih besar (kasar) akan menurunkan penyerapan nutrient dan kandungan bahan organik sehingga mempengaruhi besar kecilnya simpanan karbon yang terserap oleh lamun.
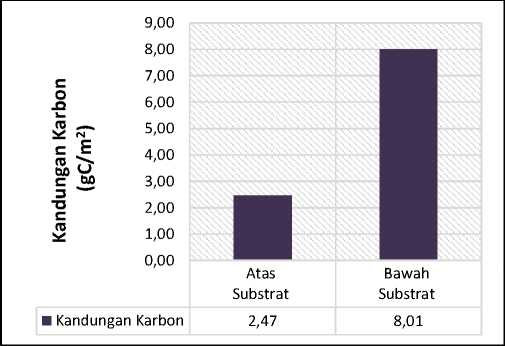
Gambar 6. Kandungan Karbon Atas (daun) dan Bawah (rhizoma dan akar) Substrat di Pantai Karang Sewu
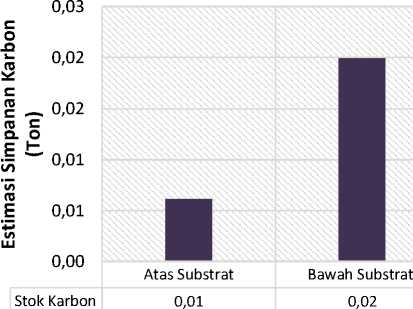
Gambar 7. Total Simpanan Karbon Atas (daun) dan Bawah (rhizoma dan akar) Substrat di Pantai Karang Sewu
-
3.6 Estimasi Total Simpanan Karbon
Pada perhitungan stok karbon dikatakan bahwa, padang lamun yang memiliki kerapatan lebih tinggi belum tentu memiliki nilai stok karbon atau biomassa yang tinggi juga, karena adanya perbedaan morfologi daun yang bervariasi dari berbagai jenis lamun yang selanjutnya akan mempengaruhi nilai kerapatan masing-masing lamun (Irawan, 2017). Total simpanan karbon yang didapatkan pada penelitian kali ini yaitu hasil dari rata-rata perhitungan stok karbon yang kemudian dikonversi ke luasan area lamun yang didapatkan pada saat pengambilan data untuk mendapatkan estimasi total simpanan karbon pada keseluruhan Pantai Karang Sewu. Dengan luas total padang lamun di Pantai Karang Sewu yaitu 12.4 Ha.
Berdasarkan dari jenis lamun, pendugaan kontribusi simpanan karbon terbanyak disumbangkan oleh spesies lamun Enhalus acoroides . kontribusi ini juga dapat dilihat dari kaitan antara nilai kerapatan lamun, biomassa dan juga kandungan karbon yang dapat dijelaskan bahwa disetiap stasiun ditemukan lamun jenis Enhalus acoroides. Setelah dikonversi ke luasan area lamun (m2) maka hasil perhitungan stok karbon didapatkan bahwa estimasi total simpanan karbon pada bagian atas substrat (daun) lebih kecil daripada bagian bawah substrat (rhizoma dan akar). Estimasi total simpanan karbon pada bagian atas substrat (daun) yaitu 0.01 ton atau sebesar 24% sedangkan pada bagian bawah substrat (rhizoma dan akar) yaitu sebesar 0.02 ton atau sekitas 76% (Gambar 7) dengan total estimasi simpanan karbon pada padang lamun di Pantai Karang Sewu yaitu sebesar 0.03 ton. Tingginya estimasi simpanan karbon pada bagian bawah substrat dikarenakan pada bagian bawah substrat tidak begitu dipengaruhi oleh faktor lingkungan dibandngkan dengan simpanan karbon atas substrat (daun) karena dipengaruhi oleh faktor lingkungan seperti suhu dan paparan sinar matahari (Supriadi, 2012). Adanya bahan organik yang terendap pada substrat juga berpengaruh sebagai faktor penyerapan karbon pada lamun bagian bawah substrat (rhizoma dan akar). Seperti
Berdasarkan penelitian yang telah dilakukan, maka diperoleh kesimpulan sebagai berikut yaitu simpanan karbon pada bagian atas substrat (daun) yang didapatkan yaitu sebesar 0.01 ton. Rendahnya simpanan karbon pada bagian atas substrat (daun) dikarenakan pada bagian atas substrat (daun) dipengaruhi langsung oleh faktor lingkungan seperti suhu dan paparan sinar matahari. Sedangkan simpanan karbon pada bagian bawah substrat (rhiozma dan akar) yaitu 0.02 ton. Tingginya simpanan karbon pada bagian bawah substrat (rhizoma dan akar) dikarenakan bagian bawah substrat tidak terlalu dipengaruhi oleh faktor lingkungan. Serta adaya bahan organik yang terendap pada substrat juga berpengaruh sebagai faktor penyerapan karbon pada lamun bagian bawah substrat.
Ucapan Terima Kasih
Penulis mengucapkan terima kasih kepada Bapak Hari Santoso selaku staff bidang Konservasi di Taman Nasional Bali Barat (TNBB) yang telah memberikan saran serta masukan dan ijin selama penelitian berlangsung, Pak Sukadi selaku pengawas lapangan yang membantu pada saat pengambilan data di lapangan.
Daftar Pustaka
[MENLH]. 2004. Keputusan Menteri Negara Lingkungan Hidup Nomor 51 Tahun 2004 (Lampiran 3) tentang Baku Mutu Air Laut. Jakarta.
Argandi, G. 2003. Struktur Komunitas Lamun di Perairan Pangerungan, Jawa Timur (Skripsi). Program Studi Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Barus, T.A. 2004. Pengantar Limnologi Studi Tentang Ekosistem Air Daratan. Medan: USU Press.
Carruthers, T.J.B. 2007. Halodule uninervis. In: IUCN 2011. IUCN Redlist of Threatened Species.
Christon, C., Djunaedi, O. S, dan Purba , N. P. 2012. Pengaruh Tinggi Pasang Surut Terhadap Pertumbuhan dan Biomassa Daun Lamun
Enhalus acoroides di Pulau Pari Kepulauan Seribu Jakarta. Jurnal Perikanan dan Kelautan. 3(3), 287-294.
Ferawati R, Julius N, Yahya R. 2018. Biomassa dan Penyerapan Karbon oleh Lamun Enhalus acorodes di Pesisir Teluk Gunung Botak Papua Barat. Jurnal Sumberdaya Akuatik Indopasifik. Vol 2. No: 2.
Handayani, D.R., Armid., Emiyarti., 2016. Hubungan kandungan nutrien dalam substrat terhadap kepadatan lamun di Perairan Desa Lalowaru Kecamatan Moramo Utara. 1(2): 2503-0396.
Helrich K. 1990. Method of Analysis of the Association of Official Analytical Chemists, Fifteenth Edition. Virginia: Wilson Boulevard. 771 hal.
Hilman, K., D.J. Walker., A.W.D. Larkum., and A.J. Mc Comb. (1989). Productivity and Nutrients Limitations on Seagrass. Biology of Seagrass. Netherland: Elsevier Science Publishers.
Huriawati F, Yuhanna WL, Mayasari T. 2016. Pengaruh Metode Pengeringan Terhadap Kualitas Serbuk Seresah Enhalus acoroides dari Pantai Tawang Pacitan. Bioeksperimen: Jurnal Penelitian Biologi. Volume 2, No. 1: 35-43.
Houghton, J. T., Y. Ding, D. J. Griggs, M. Noguer, P. J. V. Linden, X. Dai, K. Maskell, and C. A. Johnson, editors. 2001. Climate change 2001: the scientific basis: contribution of Working Group I to the third assessment report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge; New York.
Ira, Oetama D, Juliati. 2013. Kerapatan dan Penutupan Lamun pada Daerah Tanggul Pemecah Ombak di Perairan Desa Terebino Propinsi Sulawesi Tengah. Aquasains: Jurnal Ilmu Perikanan dan Sumberdaya Perairan. Volume 2, No. 1:89-96.
Irawan, A. 2017. The Carbon Stock and Potential Uptake of Seagrass Beds in The Nothern and Eastern Part of Bintan Island. Oseanologi dan Limnologi di Indonesia, 2(3), 35-48.
Kawaroe, M. 2009. Perspektif Lamun Sebagai Blue Carbon Sink di Laut. (Lokakarya Lamun). Departemen Ilmu dan Teknologi Kelautan. Bogor: Institut Pertanian Bogor.
Kennedy, H. and Bjork, M. 2009. Seagrass Meadows. In: Laffoley D.D.A and Grimsditch G. (Eds). The Management of Natural Coastal Carbon Sinks. Glan: IUCN.
Nellemann, C., E. Corcoran, C. M. Duarte, L. Valdes, C. De Young, L. Fonseca, and G. D. Grimsditch, editors. 2009. Blue carbon: the role of healthy oceans in binding carbon: a rapid response assessment. GRID-Arendal, Arendal, [Norway].
Newmaster, AF., Berg, K.J., Ragupathy, S., Palanisamy, M., Sambandan, K., Newmaster, S.G., 2011. Local Knowladge and conservation
seagrass in the tamil nadu state of India. Journal of Ecthnobiology and Ethnomedicine. 7(1): 3.
Nurzahraeni. 2014. Keragaman Jenis dan Kondisi Padang Lamun di Perairan Pulau Panjang Kepulauan Derawan Kalimantan Timur [Skripsi]. Makassar: Jurusan Ilmu Kelautan Fakultas Ilmu Kelautan dan Perikanan, Universitas Hasanuddin. 68 hal.
Odum, E. P., 1971. Dasar-Dasar Ekologi. Edisi ketiga Gadjah Mada
University Press. Yogyakarta.
Putra IA, Thamrin, Zulkifli. 2017. Potensi Penyimpanan Karbon Pada Lamun (cymodocea serrulata) di Perairan Pulau Poncan Sibolga Provinsi Sumatera Utara. Jurnal Online Mahasiswa. Volume 4, No.2: 1-12.
Riniatsih I. 2015. Distribusi Muatan Padatan Tersuspensi (MPT) di Padang Lamun di Perairan Teluk Awur dan Pantai Prawean Jepara. Jurnal Kelautan Tropis. Volume 18, No. 3: 121-126.
Rusman A, Kepel TL, Afiati RN, Salim HL, Astrid M, Daulat A, Mangindan P, Sudirman N, Puspitaningsih Y, Dwiyanti D, Hutahaean A, 2014. Peran Ekosistem Lamun Sebagai Blue Carbon Dalam Mitigasi Perubahan Iklim, Studi Kasus Tanjung Lesung, Banten. Jurnal Segara. Volume 10, NO. 2: 278-285.
Santoso B, Dharma IGBS, Faiqoh E. 2018. Pertumbuhan dan Produktivitas Daun Lamun Thalassia hemprichii (Ehrenb) Ascherson di Perairan Tanjung Benoa, Bali. Journal of Marine and Aquatic Sciences. Volume 4, No. 2: 278-286.
Setiawan F. 2012. Deteksi Perubahan Padang Lamun Menggunakan Teknologi Penginderaan Jauh dan Kaitannya dengan Kemampuan Menyimpan Karbon di Teluk Banten. Jurnal Perikanan dan Kelautan. Volume 3, No. 3: 275-286.
Supriadi. 2012. Stok dan Neraca Karbon Komunitas Lamun di Pulau Barranglompo Makassar (disertasi). Bogor: Institut Pertanian Bogor.
Supriadi, Kaswadji RF, Bengen DG, Hutomo M. 2012. Produktivitas Komunitas Lamun di Pulau Barranglompo Makassar. Jurnal Akuatika. Volume 3, No. 2: 159-168.
Waycott., M.K. McMahon., J. Mellors., A. Calladine., and D. Kleine. 2004. A Guide To Tropical Seagrass of the Indo-West Pasific. James Cook University, Townsville. 72p.
Widyasari NAE, Saharjo BH, Solichin, Istomo. 2010. Pendugaan Biomassa dan Potensi KArbon Terikat di Atas Permukaan Tanah Pada Hutan Rawa Gambut Bekas Terbakar di Sumatera Selatan. Jurnal Ilmu Pertanian. Volume 15, No 1: 41-49.
Yuniawati, Suhartana S. 2014. Potensi Karbon pada Limbah Pemanenan Kayu Acacia Crassicarpa (Carbon Potential of Waste Timber Harvesting Acacia Crassicarpa). Jurnal Ilmu Lingkungan. Volume 12, No.1: 21-31.
Yunitha, Alpinina. 2015. Kandungan C-Organik pada Lamun Berdasarkan Habitat dan Jenis Lamun di Pesisir Desa Bahoi Kabupaten Minahasa Utara, Sulawesi Utara. [Thesis]. Sekolah Pascasarjana, Institut Pertanian Bogor, Bogor.
Yusup DS, Asy’ari S. 2014. Komunitas Tumbuhan Lamun di Kawasan Perairan Sekitar Denpasar. Prosiding Semiar Nasional Biologi: Biodiversitas dan Bioteknologi Aquatik. Purwokerto, Indonesia, 26 Juni 2010. Hal 26-29.
46
Discussion and feedback