Komposisi dan biodiversitas padang lamun pada daerah konservasi dan non-konservasi di kawasan Sunda Kecil, Indonesia
on
Journal of Marine and Aquatic Sciences 8(1), 1-8 (2022)
Komposisi dan biodiversitas padang lamun pada daerah konservasi dan non-konservasi di kawasan Sunda Kecil, Indonesia
Putu Satya Pratama Atmaja a*, I Ketut Aditya Krisna Laharjana b
a Program Studi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Universitas Udayana, Jalan Raya Kampus Unud, Bukit Jimbaran – Bali 80361, Indonesia
b Program Studi Magister Ilmu Lingkungan, Program Pascasarjana, Universitas Udayana, Jalan P.B Sudirman, Denpasar – Bali 80232, Indonesia
* Penulis koresponden. Tel.: +62-812-3603-4565
Alamat e-mail: satyapratama@unud.ac.id
Diterima (received) 15 Mei 2022; disetujui (accepted) 29 Mei 2022; tersedia secara online (available online) 1 Juni 2022
Abstract
Seagrass is one of the most productive plants in the marine ecosystems. Seagrass meadows provide many ecosystems services for marine organisms, yet there is growing evidence that seagrasses are experiencing declines globally due to anthropogenic threats. Although the study of seagrass in Indonesia has been widely caried out, Bali and Lombok have received little attention. Our study aimed to investigates the biodiversity of seagrass beds among different meadows characteristics in Bali and Lombok. This study was conducted at conservation area and non conservation area in Bali and Lombok, which were consists of total 8 sites. A total of 9 seagrass species were identified in this study, where 8 species found in Bali, both in conservation and non-conservation area, while in Lombok only 5 species found in conservation area and 6 species in non-conservation area. Most common species that found in this study were Enhalus acoroides, Cymodocea rotundata, Thalassia hemprichii, Halodule uninervis, and Halodule pinifolia. Analysis of similarity (ANOSIM) revealed there was no significant differences of seagrass density between sites in Bali and Lombok. Bray-Curtis dendogram showed the highest similarity found between NCA Lombok and CA Lombok (75 %), followed by NCA Bali and CA Bali (45 %). Implications of our study was to provide baseline study about the important of seagrass management, restoration, conservation, and protecting them due to anthropogenic pressure.
Keywords: conservation; seagrass; biodiversity; lesser sunda; ANOSIM
Abstrak
Padang lamun adalah salah satu tumbuhan dengan produktivitas paling tinggi dan memiliki fungsi ekologis yang penting pada ekosistem laut. Walaupun demikian, beberapa studi menunjukkan penurunan diversitas lamun secara global akibat tekanan antropogenik yang cukup tinggi di beberapa wilayah. Meskipun penelitian mengenai lamun sudah banyak dilakukan di Indonesia, namun wilayah Sunda Kecil, terutama Bali dan Lombok belum banyak mendapatkan perhatian. Penelitian ini dilakukan untuk menganalisis komposisi dan biodiversitas padang lamun pada dua karaktersitik daerah yang berbeda di Bali dan Lombok. Sebanyak 9 jenis lamun berhasil diidentifikasi, dengan 8 jenis diantaranya di temukan di Pulau Bali, baik pada daerah konservasi maupun non-konservasi, sedangkan sebanyak 5 jenis ditemukan di daerah konservasi Lombok, dan 6 jenis ditemukan di daerah non-konservasi Lombok. Jenis lamun yang umum dijumpai pada penelitian ini adalah Enhalus acoroides, Cymodocea rotundata, Thalassia hemprichii, Halodule uninervis, and Halodule pinifolia. ANOSIM menemukan bahwa tidak ada perbedaan yang signifikan antar lokasi di Bali dan Lombok. Dendogram Bray-Curtis menunjukkan kesamaan lokasi tertinggi ditemukan antara DNK Lombok-DK Lombok (75%), dikuti oleh DNK Bali-DK Bali (45%). Implikasi dari penelitian adalah sebagai rujukan ilmiah dalam melakukan manajemen, restorasi, konservasi, dan mempertahankan eksistensi lamun dari tekanan antropogenik.
Kata Kunci: konservasi; padang lamun; biodiversitas; sunda kecil; ANOSIM
Tumbuhan lamun merupakan satu-satunya tumbuhan berbunga (Angiospermae) yang hidup terendam di bawah air dan dipengaruhi oleh dinamika pasang surut air laut (El Shaffai, 2011). Tumbuhan lamun membentuk inter-koneksi dengan ekosistem mangrove dan terumbu karang sebagai ekosistem yang penting dalam menjaga keberlangsungan lingkungan pesisir dan laut (Barbier et al., 2011). Secara khusus, ekosistem lamun memiliki peranan dan manfaat yang sangat luas, yakni sebagai produsen primer, habitat biota, penangkap sedimen, pendaur zat hara, dan pembenam karbon di lautan (Gillis et al., 2014; Huxham et al., 2018; Lin et al., 2018; Potouroglou et al., 2017).
Distribusi tumbuhan lamun sangatlah luas, mencakup daerah subtropis hingga tropis, namun hanya daerah Indo-pasifik yang memiliki keanekaragaman lamun yang paling tinggi jika dibandingkan dengan daerah lainnya (Short et al., 2007). Dari jumlah total 60 jenis spesies yang ditemukan di dunia, sebanyak 13 jenis lamun ditemukan di wilayah Indonesia (Fortes et al., 2018; Suharsono, 2018). Kemampuan tumbuhan lamun untuk berkembang biak serta beradaptasi terhadap dinamika pasang surut dan perubahan lingkungan menjadi salah satu kunci luasnya distribusi ekosistem ini.
Wilayah Bali dan Lombok yang merupakan bagian dari kawasan Sunda Kecil merupakan daerah yang memiliki aktivitas antropogenik cukup tinggi, terutama kegiatan pariwisata. Studi
menunjukkan bahwa kegiatan pariwisata yang cukup padat di beberapa daerah di kedua pulau ini memiliki potensi dalam menghambat pertumbuhan ekosistem lamun dan biota asosiasinya (Adyasari et al., 2021; Syukur et al., 2021). Alih fungsi kawasan pesisir yang berbatasan langsung dengan aktivitas antropogenik dapat menyebabkan kerusakan ekosistem lamun (Turschwell et al., 2021).
Melihat pentingnya fungsi ekologis dan manfaat yang diberikan oleh padang lamun bagi ekosistem pesisir dan laut menjadi dasar untuk dilakukannya pemantauan secara berkala mengenai biodiversitas dan kondisi padang lamun di Indonesia. Penelitian ini dilakukan untuk menganalisis biodiversitas padang lamun pada hamparan yang memiliki karakterisitik berbeda, yaitu daerah konservasi dan non-konservasi. Penelitian ini memiliki tujuan untuk menguji hipotesis bahwa daerah konservasi memiliki komposisi dan biodiversitas lamun yang lebih baik dibandingkan dengan daerah non-konservasi, yang berpotensi mendapatkan pengaruh antropogenik yang lebih tinggi.
Pengambilan data penelitian ini dilakukan pada dua pulau, yaitu Bali dan Lombok yang merupakan bagian dari kawasan Sunda Kecil. Terdapat masing-masing 2 lokasi yang menjadi representasi dari daerah konservasi dan non-
Tabel 1
Nama lokasi, kode, kategori, dan koordinat pengambilan data lamun
|
Nama Lokasi |
Kode |
Kategori |
Latitude |
Longitude |
|
Bali | ||||
|
Samuh |
SMH |
DNK |
8°47'11.14"S |
115°13'47.76"E |
|
Shindu |
SND |
DNK |
8°41'1.10"S |
115°15'54.04"E |
|
Labuhan Lalang |
LBL |
DK |
8° 9'11.65"S |
114°31'17.18"E |
|
Teluk Terima |
TTR |
DK |
8° 8'31.68"S |
114°32'20.77"E |
|
Lombok | ||||
|
Tanjung Kelor |
TJK |
DNK |
8°44'24.10"S |
116° 1'32.10"E |
|
Gili Kedis |
GKD |
DNK |
8°43'50.66"S |
116° 1'33.47"E |
|
Gili Lawang |
GLW |
DK |
8°17'39.74"S |
116°42'27.62"E |
|
Gili Sulat |
GSL |
DK |
8°17'39.74"S |
116°42'27.62"E |
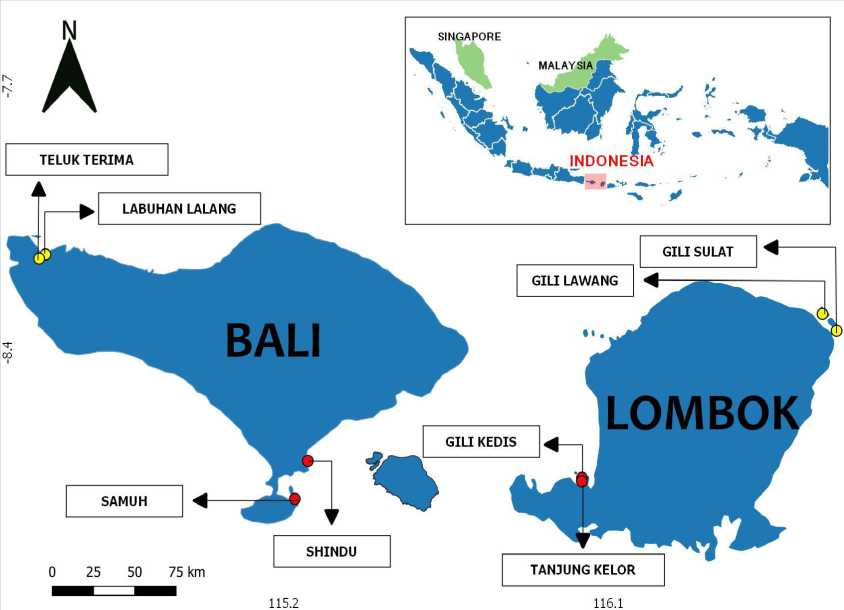
Gambar 1. Peta lokasi penelitian pengamatan padang lamun di Pulau Bali dan Lombok. Nama lokasi, kode, dan kategori tempat penelitian mengacu pada Tabel 1.
konservasi pada pulau Bali dan Lombok (Gambar 1, Tabel 1).
Adapun justifikasi yang membedakan daerah konservasi (DK) dan non-konservasi (DNK) terletak pada proteksi dan pengawasan yang ketat ketika akan memasuki wilayah tersebut. Pada Pulau Bali, daerah konservasi yang diambil adalah pada kawasan Taman Nasional Bali Barat (TTR dan LBL), sedangkan pada Pulau Lombok adalah Kawasan Konservasi Laut Daerah (GLW dan GSL).
-
2.2 Pengambilan data lamun
Pengambilan data lamun dilaksanakan pada bulan Oktober 2019 (Pulau Bali) dan November 2019 (Pulau Lombok). Pengamatan kerapatan dan tutupan padang lamun dilakukan pada saat keadaan surut. Hal ini dilakukan untuk mempermudah penghitungan data lamun (Short & Coles, 2001).
Setiap lokasi penelitian terdiri dari 5 substasiun pengulangan. Masing-masing substasiun berjarak 10 meter dengan yang lainnya. Pada tiap substasiun dilakukan pengambilan dan pengamatan kerapatan dan tutupan lamun menggunakan transek kuadrat 1 m x 1 m sepanjang 100 m ke arah laut yang dibagi ke dalam 4 plot pengamatan.
Kerapatan lamun merupakan jumlah individu (ni) lamun yang dihitung pada suatu area pengamatan (A), menggunakan persamaan sebagai berikut:
≡ (1)
Tutupan lamun diambil berdasarkan komposisi populasi lamun pada transek pengamatan dan ditulis dalam persen (%) sesuai dengan kategorinya (Short & Coles, 2001).
-
2.3 Analisis data
Biodiversitas padang lamun yang ditemukan di masing-masing pulau di analisis menggunakan Shannon-Wiener Index (H’), Evenness Index (E), dan Simpson Index (C). Ketiga indeks tersebut digunakan untuk melihat tingkat keanekaragaman, kesaamaan, dan dominansi dari masing-masing spesies lamun yang ditemukan.
Analysis of Similarity (ANOSIM) digunakan untuk melihat tingkat kesamaan dari kondisi padang lamun di masing-masing lokasi berdasarkan data kerapatannya (Anderson & Walsh, 2013). Nilai R yang dihasilkan pada uji ANOSIM dapat digunakan untuk merepresentasikan tingkat perbedaan pada sampel uji, dimana jika nilai R mendekati satu (1) maka dikategorikan memiliki perbedaan yang kuat satu sama lainnya (Chapman & Underwood, 1999).
Data kerapatan lamun dan tutupan lamun di masing-masing lokasi juga akan di analisis menggunakan indeks similaritas Bray-Curtis, sehingga dapat digambarkan dalam bentuk dendogram berdasarkan persentase kesamaan
yang diklasifikasikan pada suatu lokasi (Bengen, 2000). ANOSIM dan analisis Indeks Bray – Curtis dilakukan menggunakan software PAST 4.03.
Berdasarkan hasil penelitian yang sudah dilakukan, terdapat total 9 jenis lamun dari 2 famili yang memiliki distribusi dan kondisi yang berbeda-beda pada tiap lokasi di Pulau Bali dan Lombok. Dari famili Hydrocharitaceae, jenis lamun yang ditemukan adalah Enhalus acoroides, Thalassia hemprichii, Halophila minor, dan Halophila ovalis. Sedangkan dari famili Potamogetonaceae adalah Cymodocea rotundata, Cymodocea serrulata, Halodule uninervis, Halodule pinifolia, dan Syringodium isoetifolium.
Data kerapatan jenis lamun yang ditemukan pada masing-masing lokasi di Pulau Bali dan Lombok dapat dilihat pada Tabel 2. Berdasarkan tabel tersebut, kerapatan yang dimiliki pada setiap jenis lamun berbeda satu sama lainnya di setiap lokasi. Sebagai perbandingan, SND yang memiliki jenis lamun paling banyak, didominasi oleh jenis H. uninervis (109,1 ± 32,25 ind/m2) dan S. isoetifolium (124 ± 82,41 ind/m2), sedangkan TTR yang tergolong daerah konservasi, didominasi oleh jenis lamun C. rotundata (30,2 ± 13,41 ind/m2).
Matrik data lamun yang ditemukan di Puau Bali dan Lombok berdasarkan kategori lokasi dapat dilihat pada Tabel 3. Jenis lamun paling banyak ditemukan di Pulau Bali, baik pada daerah non-konservasi maupun daerah konservasi
dengan jumlah sebanyak 8 jenis lamun. Sedangkan di Pulau Lombok, pada daerah non-konservasi (6 jenis) terdapat jenis lamun yang lebih banyak dibandingkan dengan daerah konservasi (5 jenis).
Proporsi tutupan jenis lamun pada masing-masing lokasi memiliki nilai yang berbeda-beda satu sama lainnya (Gambar 2). Jenis lamun S. isoetifolium memiliki persen tutupan yang paling tinggi dibandingkan jenis lamun lainnya, pada kedua kategori lokasi di Pulau Bali. Sedangkan jenis C. rotundata menjadi jenis lamun yang memiliki persen tutupan paling tinggi di Pulau Lombok, baik pada daerah konservasi maupun daerah non-konservasi.
Perbandingan komposisi, tutupan, serta nilai kerapatan jenis lamun pada suatu lokasi akan berbeda satu sama lainnya. Hal ini sangat dipengaruhi oleh konsentrasi parameter lingkungan seperti laju sedimentasi, tingkat kekeruhan, cahaya, arus, nitrat, fosfat, serta tingkat grazing pada lokasi tersebut (Adams et al., 2016; Collier et al., 2016; Pattarach et al., 2018). Pada jenis lamun yang sama (S. isoetifolium), kerapatan yang berbeda juga ditemukan pada Pulau Riau (318±17.82 ind/m2) dengan Pulau Talaud (11±2.8 ind/m2) (Kawaroe et al., 2016). Hal ini menandakan bahwa setiap daerah memiliki kondisi padang lamun yang dipengaruhi oleh kondisi lingkungan dan parameter perairan yang berbeda-beda pula.
Selain dikarenakan faktor lingkungan, laju tumbuh rhizome dan kecepatan pergantian daun lamun juga mempengaruhi nilai kerapatan pada tiap jenis lamun dan menjadi kunci penting dalam merencanakan manajemen dan restorasi pada
Tabel 2
Data kerapatan lamun (ind/m2) pada masing-masing lokasi penelitian di Pulau Bali dan Lombok
|
Spesies |
SMH |
SND |
LBL |
TTR |
TJK |
GKD |
GLW |
GSL |
|
EA |
10,4 ± 5,75 |
10,1 ± 2,91 |
6,45 ± 3,48 |
9,35 ± 4,13 |
9,25 ± 3,2 |
7,1 ± 6,91 |
10,6 ± 3,06 |
11,65 ± 4,79 |
|
CR |
8,3 ± 5,87 |
19,5 ± 7,61 |
11,35 ± 5,35 |
30,2 ± 13,41 |
24,9 ± 7,26 |
16,2 ± 8,3 |
24,15 ± 6,5 |
13,95 ± 6,99 |
|
CS |
7,45 ± 4,96 |
9,85 ± 7,35 |
0 |
0 |
0 |
0 |
0 |
0 |
|
HO |
5,9 ± 4,67 |
3,5 ± 4,24 |
5,55 ± 4,77 |
0 |
10,55 ± 2,9 |
4,95 ± 9,17 |
0 |
0 |
|
HU |
109,1 ± 32,2 |
0 |
5,4 ± 7,83 |
5,9 ± 8,5 |
6 ± 8,5 |
0 |
3,95 ± 4,32 |
4,5 ± 5,1 |
|
HP |
50,65 ± 11,74 |
0 |
3,5 ± 5,5 |
0 |
5,75 ± 6,1 |
41,95 ± 40,3 |
5,2 ± 5,5 |
9,35 ± 8,39 |
|
HM |
0 |
0 |
0 |
10,15 ± 14,1 |
0 |
0 |
0 |
0 |
|
SI |
124 ± 82,4 |
0 |
73,4 ± 65,3 |
0 |
0 |
0 |
0 |
0 |
|
TH |
0 |
13,4 ± 6,02 |
14,5 ± 10 |
16,2 ± 12,2 |
12,75 ± 8,5 |
10,05 ± 8,43 |
11,45 ± 6,9 |
20,65 ± 4,49 |
Keterangan: EA = Enhalus acorides, CR = Cymodocea rotundata, CS = Cymodcea serrulata, HO = Halophila ovalis, HU = Halodule uninervis, HP= Halodule pinifolia, HM = Halophila minor, SI = Syringodium isoetifolium, TH = Thalassia hemprichii.
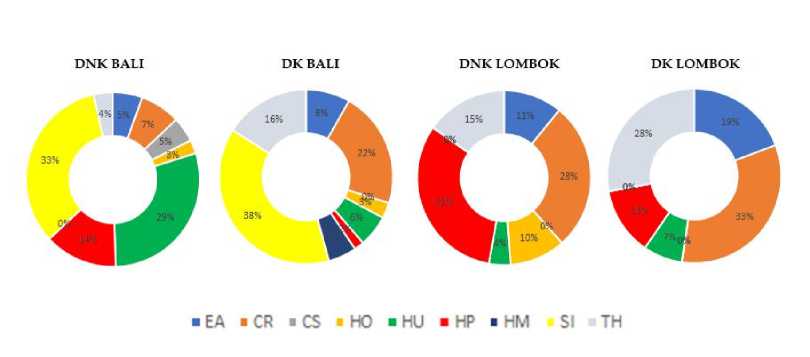
Gambar 2. Proporsi tutupan lamun pada pulau Bali dan Lombok berdasarkan kategori lokasi. Keterangan: EA (Enhalus acoroides), CR (Cymodocea rotundata), CS (Cymodocea serrulata), HO (Halophila ovalis), HU (Halodule uninervis), HP (Halodule pinifolia) HM (Halophia minor), SI (Syringodium isoetifolium), TH (Thalassia hemprichii).
lamun (Vonk et al., 2015). Sebagai perbandingan, E. acoroides memiliki laju tumbuh yang lebih lambat dibandingkan dengan C. rotundata, walaupun secara morfologi E. acoroides memiliki batang dan daun yang lebih besar dibandingkan dengan C. rotundata (Brouns, 1987).
Tabel 3
Matriks data lamun pada setiap lokasi berdasarkan kategori tempat (+ = ditemukan; - = tidak ditemukan)
|
Nama Spesies |
DNK Bali |
DK Bali |
DNK Lombok |
DK Lombok |
|
EA |
+ |
+ |
+ |
+ |
|
CR |
+ |
+ |
+ |
+ |
|
CS |
+ |
- |
- |
- |
|
HO |
+ |
+ |
+ |
- |
|
HU |
+ |
+ |
+ |
+ |
|
HP |
+ |
+ |
+ |
+ |
|
HM |
- |
+ |
- |
- |
|
SI |
+ |
+ |
- |
- |
|
TH |
+ |
+ |
+ |
+ |
-
3.2 Struktur komunitas padang lamun
Struktur komunitas pada suatu lokasi dapat ditentukan dengan melihat nilai indeks ShannonWiener (H’), indeks Evenness (E), dan indeks dominansi (C). Ketiga indeks tersebut digunakan untuk mengetahui kondisi dan kestabilan komunitas pada suatu lingkungan (Kim et al., 2017).
Hasil analisis struktur komunitas dapat dilihat pada Tabel 4. Secara umum kondisi keanekaragaman tergolong sedang (1,491 - 1,706), sedangkan analisis indeks keseragaman Evenness menunjukkan kategori yang tinggi (0,681 – 0,888), dan nilai indeks dominansi tergolong rendah (0,2282 – 0,2329) pada semua lokasi penelitian.
Tabel 4
Struktur komunitas padang lamun di Pulau Bali dan
Lombok berdasarkan kategori lokasi
|
Nilai Indeks |
DNK Bali |
DK Bali |
DNK Lombok |
DK Lombok |
|
H’ |
1,706 |
1,695 |
1,613 |
1,491 |
|
E |
0,6884 |
0,681 |
0,8359 |
0,888 |
|
C |
0,2282 |
0,2329 |
0,2251 |
0,244 |
Keterangan: Indeks Shannon-Wiener (H’), Indeks Evenness (E), dan Indeks Dominansi (C).
Nilai keanekaragaman yang tergolong sedang menunjukkan bahwa kondisi padang lamun di daerah konservasi dan non-konservasi pada Pulau Bali dan Lombok berada dalam kondisi yang labil. Hal ini mengindikasikan bahwa kondisi padang lamun pada daerah tersebut cenderung mudah berubah, sesuai dengan kondisi lingkungan yang mempengaruhi ekosistem lamun tersebut.
Nilai Indeks Evenness pada studi ini di setiap kategori lokasi tergolong tinggi. Hal ini menunjukkan bahwa persebaran nilai kerapatan pada masing-masing jenis lamun cukup merata. Hal yang sama juga ditunjukkan oleh nilai indeks dominansi yang terkategori rendah pada studi ini.
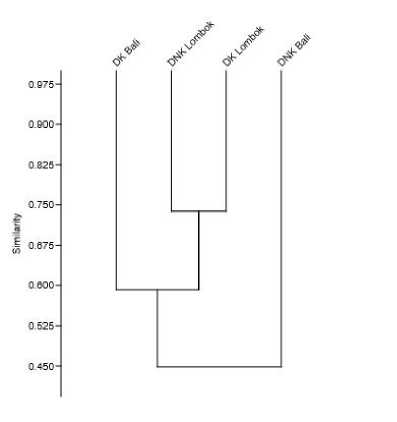
Gambar 3. Dendogram similaritas indeks Bray – Curtis mengenai kondisi lamun pada masing-masing tempat d Pulau Bali dan Lombok berdasarkan kategori lokasi.
Nilai tersebut mengindikasikan bahwa pada setiap lokasi penelitian di Pulau Bali dan Lombok tidak ada spesies lamun yang memiliki dominansi terhadap jenis lainnya, sehingga kondisi komunitas dapat dikategorikan stabil.
-
3.3 Perbedaan kondisi komunitas padang lamun
Tingkat ketidaksamaan dari komunitas padang lamun yang ada di daerah konservasi dan non-konservasi Pulau Bali dan Lombok diuji menggunakan ANOSIM dengan hasil yang ditampilkan pada Tabel 5.
Tabel 5
|
Hasil uji ANOSIM antar lokasi. Perbandingan dibuat berdasarkan uji indeks Bray-Curtis dengan permutasi sejumlah 9999 pada setiap faktor ( p < 0,05) | ||
|
Uji ANOSIM |
R Value |
p |
|
DNK Bali – DK Bali |
0,3849 |
0,087 |
|
DNK Lombok – DK Lombok |
0,3171 |
0,106 |
|
DNK Bali – DNK Lombok |
0,4744 |
0,071 |
|
DK Bali – DK Lombok |
0,508 |
0,063 |
Hasil uji ANOSIM menunjukkan tidak ada perbedaan yang siginifikan dari semua permutasi, baik antar daerah konservasi, ataupun dengan daerah non konservasi, di Pulau Bali dan Pulau Lombok (R value ≤ 0,5, p > 0,05). Hasil tersebut menunjukkan bahwa kondisi komunitas padang
lamun di daerah konservasi dan non konservasi, baik di Pulau Bali ataupun Lombok tidak jauh berbeda satu sama lainnya.
Penggambaran menggunakan dendogram juga mengkofirmasi tidak adanya perbedaan yang signifikan pada komunitas padang lamun antara DK dan DNK, baik di Pulau Bali dan Lombok (Gambar 3). Terdapat 2 kelompok yang terbentuk yaitu DK Bali dan DNK Bali dengan persentase kesamaan 45 %, sedangkan DK Lombok dan DNK Lombok memiliki persentase kesamaan yang paling tinggi dengan nilai 75 %.
Kondisi komunitas lamun yang tidak jauh berbeda belum tentu menggambarkan kondisi yang sama pada biota yang berasosiasi dengan tumbuhan lamun. Hasil uji ANOSIM pada epifit yang tumbuh pada daun lamun di daerah konservasi dan non-konservasi di Pulau Bali dan Lombok menunjukkan hasil yang berbeda signifikan pada kelimpahan mikroalganya, dimana pada daerah konservasi ditemukan lebih banyak epifit dibandingkan dengan yang menempel pada lamun di daerah non-konservasi (Atmaja et al., 2021). Hal tersebut mengindikasikan bahwa ekosistem lamun memiliki peranan yang penting bagi keberlangsungan hidup organisme yang berasosiasi dan memanfaatkan tumbuhan lamun sebagai habitatnya (Ambo-Rappe et al., 2013).
Berdasarkan hasil penelitian yang telah dilakukan, ditemukan total 9 jenis lamun dari 2 famili. Sebanyak 8 jenis lamun ditemukan pada DK dan DNK di Bali, sedangkan pada daerah konservasi
dan non konservasi di Pulau Lombok, secara berturut-turut hanya ditemukan 6 dan 5 jenis lamun.
Biodiversitas dan struktur komunitas padang lamun pada kedua pulau tergolong dalam kategori stabil. Uji ANOSIM dan penggambaran dendogram indeks Bray-Curtis menunjukkan tidak ada perbedaan yang signifikan antara kedua kategori lokasi, baik pada Pulau Bali maupun Lombok. Implikasi dari penelitian ini adalah sebagai bahan rujukan ilmiah dalam melakukan monitoring dan manajemen ekosistem lamun sebagai salah satu ekosistem yang memegang peranan penting bagi lingkungan ekosistem pesisir dan laut.
Adapun saran dari penulis untuk studi lebih lanjut adalah menyertakan parameter biota asosiasi serta kondisi lingkungan pada lokasi penelitian, sehingga penggambaran pentingnya manajemen pada ekosistem lamun dapat dilihat secara menyeluruh.
Ucapan terimakasih
Studi ini terlaksana atas pendanaan penuh oleh Lembaga Pengelola Dana Pendidikan (LPDP), Kementerian Keuangan, Republik Indonesia. Terima kasih kepada Taman Nasional Bali Barat (S.2044/T.16/TU/Kons/10/2019) dan Dinas Kelautan dan Perikanan Provinsi Lombok atas diberikannya akses kepada penulis dalam melakukan penelitian.
Daftar Pustaka
Adams, M. P., Hovey, R. K., Hipsey, M. R., Bruce, L. C., Ghisalberti, M., Lowe, R. J., Gruber, R. K., Ruiz-Montoya, L., Maxwell, P. S., Callaghan, D. P., Kendrick, G. A., & O’Brien, K. R. (2016). Feedback between sediment and light for seagrass: Where is it important? Limnology and Oceanography, 61(6), 1937– 1955. https://doi.org/10.1002/lno.10319
Adyasari, D., Adhiraga, M., Andriany, N., Sabdaningsih, A., Astrid, M., & Dimova, N. (2021). Anthropogenic impact on Indonesian coastal water and ecosystems: Current status and future opportunities. Marine Pollution Bulletin, 171(June), 112689.
https://doi.org/10.1016/j.marpolbul.2021.112689
Ambo-Rappe, R., Nessa, M. N., Latuconsina, H., & Lajus, D. L. (2013). Relationship between the tropical seagrass bed characteristics and the structure of the associated fish community. Open Journal of Ecology, 03(05), 331–342. https://doi.org/10.4236/oje.2013.35038
Anderson, M. J., & Walsh, D. C. I. (2013).
PERMANOVA , ANOSIM , and the Mantel test in the face of heterogeneous dispersions: What null
hypothesis are you testing? Ecological Monographs, 83(4), 557–574.
Atmaja, P. S. P., Bengen, D. G., & Madduppa, H. H. (2021). The Second Skin of Seagrass Leaves: A Comparison of Microalgae Epiphytic Communities Between Two Different Species Across Two Seagrass Meadows in Lesser Sunda Islands. Tropical Life Sciences Research, 32(2), 97–119.
https://doi.org/https://doi.org/10.21315/tlsr2021.32.2.7
Barbier, E., Hacker, S., Kennedy, C., Koch, E., Stier, A., & Silliman, B. (2011). The value of estuarine and coastal ecosystem services. Ecological Monographs, 81(2)(2), 169–193.
Bengen, D. G. (2000). Sinopsis teknik pengambilan contoh dan analisa data biofisik sumberdaya pesisir. PKSPL - IPB.
Brouns, J. J. W. M. (1987). Growth patterns in some indowest-pacific seagrasses. Aquatic Botany, 28(1), 39–61. https://doi.org/10.1016/0304-3770(87)90055-6
Chapman, M. G., & Underwood, A. J. (1999). Ecological patterns in multivariate assemblages: Information and interpretation of negative values in ANOSIM tests. Marine Ecology Progress Series, 180(Clarke 1993), 257–265. https://doi.org/10.3354/meps180257
Collier, C. J., Adams, M. P., Langlois, L., Waycott, M., O’Brien, K. R., Maxwell, P. S., & McKenzie, L. (2016). Thresholds for morphological response to light reduction for four tropical seagrass species. Ecological Indicators, 67, 358–366.
https://doi.org/10.1016/j.ecolind.2016.02.050
El Shaffai, A. (2011). Field Guide to Seagrasses of the Red Sea. In A. Rouphael & A. Abdulla (Eds.), Gland, Switzerland: IUCN and Courbevoie, France …. IUCN and Total Foundation.
https://testportals.iucn.org/library/sites/library/files/d ocuments/2011-057.pdf
Fortes, M. D., Lean, J., Ooi, S., Tan, Y. M., Prathep, A., & Bujang, J. S. (2018). Seagrass in Southeast Asia: a review of status and knowledge gaps , and a road map for conservation. 61(3), 269–288.
Gillis, L. G., Ziegler, A. D., Oevelen, D. Van, Cathalot, C., Herman, P. M. J., Wolters, J. W., & Bouma, T. J. (2014). Tiny Is Mighty: Seagrass Beds Have a Large Role in the Export of Organic Material in the Tropical Coastal Zone. 9(11). https://doi.org/10.1371/journal.pone.0111847
Huxham, M., Whitlock, D., & Githaiga, M. (2018). Carbon in the Coastal Seascape: How Interactions Between Mangrove Forests , Seagrass Meadows and Tidal Marshes Influence Carbon Storage. 101–110.
Kawaroe, M., Nugraha, A. H., Juraij, & Tasabaramo, I. A. (2016). Seagrass biodiversity at three marine ecoregions of Indonesia: Sunda shelf, sulawesi sea, and banda sea. Biodiversitas, 17(2), 585–591. https://doi.org/10.13057/biodiv/d170228
Kim, B. R., Shin, J., Guevarra, R. B., Lee, J. H., Kim, D. W., Seol, K. H., Lee, J. H., Kim, H. B., & Isaacson, R. E.
(2017). Deciphering diversity indices for a better understanding of microbial communities. Journal of Microbiology and Biotechnology, 27(12), 2089–2093. https://doi.org/10.4014/jmb.1709.09027
Lin, J., Huang, Y., Arbi, U. Y., Lin, H., Azkab, M. H., Wang, J., He, X., Mou, J., Liu, K., & Zhang, S. (2018). An ecological survey of the abundance and diversity of benthic macrofauna in Indonesian multispecific seagrass beds. Acta Oceanologica Sinica, 37(6), 82–89. https://doi.org/10.1007/s13131-018-1181-9
Pattarach, K., Titioatchasai, J., Darakrai, A., & Mayakun, J. (2018). Effects of wave exposure and shore level on seagrass abundance and distribution in the intertidal community. Songklanakarin Journal of Science and Technology, 40(6), 1446–1450.
https://doi.org/10.14456/sjst-psu.2018.176
Potouroglou, M., Bull, J. C., Krauss, K. W., Kennedy, H. A., Fusi, M., Daffonchio, D., Mangora, M. M., Githaiga, M. N., Diele, K., & Huxham, M. (2017). Measuring the role of seagrasses in regulating sediment surface elevation. Scientific Reports, September, 1–11. https://doi.org/10.1038/s41598-017-12354-y
Short, F., Carruthers, T., Dennison, W., & Waycott, M. (2007). Global seagrass distribution and diversity: A bioregional model. Journal of Experimental Marine
Biology and Ecology, 350(1–2), 3–20.
https://doi.org/10.1016/j.jembe.2007.06.012
Short, Frederick, & Coles, R. (2001). Global Seagrass Research Method. Elsevier B.V.
Suharsono. (2018). Biodiversitas Biota Laut Indonesia (Issue June 2014). Pusat Penelitian Oseanografi - LIPI.
Syukur, A., Zulkifli, L., Idrus, A. A. L., & Hidayati, B. N. (2021). Species diversity of seagrass-associated bivalves as an ecological parameter to support seagrass conservation along with the Coastal Waters of South Lombok , Indonesia. Biodiversitas, 22(11), 5133–5144. https://doi.org/10.13057/biodiv/d221152
Turschwell, M. P., Connolly, R. M., Dunic, J. C., Sievers, M., Buelow, C. A., Pearson, R. M., Tulloch, V. J. D., Cote, I. M., Unsworth, R. K. F., Collier, C. J., & Brown, C. J. (2021). Anthropogenic pressures and life history predict trajectories of seagrass meadow extent at a global scale. Proceedings of the National Academy of Sciences of the United States of America, 118(45), 1–11. https://doi.org/10.1073/pnas.2110802118
Vonk, J. A., Christianen, M. J. A., Stapel, J., & O’Brien, K. R. (2015). What lies beneath: Why knowledge of belowground biomass dynamics is crucial to effective seagrass management. Ecological Indicators, 57, 259– 267. https://doi.org/10.1016/j.ecolind.2015.05.008
© 2022 by the authors; licensee Udayana University, Indonesia. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/3.0/).
J. Mar. Aquat. Sci. 8: 1-8 (2022)
Discussion and feedback