Komunitas Bakteri yang Berasosiasi dengan Karang Acropora horrida
on
Journal of Marine and Aquatic Sciences 8(1), 44-50 (2022)
Komunitas Bakteri yang Berasosiasi dengan Karang Acropora
horrida
Putu Natalia Sarasvati a, I Dewa Nyoman Nurweda Putra a, Widiastuti a*
a Program Studi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Universitas Udayana, Kampus UNUD Bukit Jimbaran, Bali 80361, Indonesia
* Penulis koresponden. Tel.: +62-812-3633-9523 Alamat e-mail: widiastutikarim@unud.ac.id
Diterima (received) 18 September 2020; disetujui (accepted) 23 Mei 2022; tersedia secara online (available online) 1 Juni 2022
Abstract
Symbiotic corals are not only with zooxanthella but also with various microorganism communities, namely bacteria. The presence of bacteria on the reef acts as a nutrient provider for coral animals. One of the adaptations made by corals to environmental changes is by secreting mucus. Mucus provides living space for various types of bacteria. Acropora coral is one of the largest and most extensive coral builders in coral ecosystems, adaptable, and has a fast recovery rate from coral bleaching. The aimed of this study was to determined the bacterial community associated with A. horrida coral mucus. Bacterial identification was based on observations of colony morphological tests and biochemical tests. The results of this study showed that 6 isolates of A. horrida coral mucus bacteria on average have a round shape with a complete border, flat elevation, and white with a smooth texture. The six bacterial isolates showed negative results where there were no bubbles. The oxidase test results showed 3 negatives with no change in color and 3 positives with a change in color to violet. In the gram staining test, there were 2 gram -negative isolates and 4 gram-positive isolates. Characteristics of the six bacterial isolates associated with A. horrida coral mucus identified include the Micrococcaceae, Lactobacillaceae, Clostridiaceae, and Rhizobiaceae families. It was suspected that these bacteria are opportunistic, where the density will increase if there are pollutants into coral reef ecosystems such as organic matter and nitrogen which can increase their growth.
Keywords: association of bacteria; coral reefs; Acropora horrida; mucus
Abstrak
Karang hidup bersimbiosis tidak hanya dengan zooxanthella tetapi juga dengan berbagai komunitas mikroorganisme yaitu bakteri. Keberadaan bakteri di karang berperan sebagai penyedia nutrient bagi hewan karang. Salah satu adaptasi yang dilakukan oleh karang terhadap perubahan lingkungan yaitu dengan mensekresikan mukus. Mukus memberikan ruang hidup bagi berbagai jenis bakteri. Karang Acropora merupakan salah satu karang pembangun dan terluas di ekosistem karang, mudah beradaptasi dan memiliki tingkat pemulihan yang cepat dari pemutihan karang. Tujuan pada penelitian ini yaitu mengetahui komunitas bakteri yang berasosiasi pada mukus karang A. horrida. Identifikasi bakteri dilakukan berdasarkan hasil pengamatan uji morfologi koloni dan uji biokimia. Hasil penelitian ini menunjukan 6 isolat bakteri mukus karang A. horrida rata-rata memiliki bentuk bulat dengan pinggiran utuh, elevasi datar, dan berwarna putih dengan teksur yang halus. Pada keenam isolat bakteri menunjukan hasil negatif dimana tidak terdapat gelembung. Pada hasil uji oksidase menunjukan 3 negatif dengan tidak ada perubahan warna dan 3 positif dengan adanya perubahan warna menjadi violet. Pada uji pewarnaan gram terdapat 2 isolat gram negatif dan 4 isolat gram positif. Karakteristik dari keenam isolat bakteri yang berasosiasi pada mukus karang A. horrida yang diidentifikasi diantaranya yaitu famili Micrococcaceae, Lactobacillaceae, Clostridiaceae, dan Rhizobiaceae. Diduga bakteri-bakteri tersebut bersifat oportunistik, dimana kepadatannya akan meningkat jika terdapat bahan pencemar ke ekosistem terumbu karang seperti bahan organik dan nitrogen yang dapat meningkatkan pertumbuhannya.
Kata Kunci: asosiasi bakteri; terumbu karang; Acropora horrida; mukus
Karang hidup bersimbiosis tidak hanya dengan dinoflagellata simbion (zooxanthella) tetapi juga dengan berbagai komunitas mikroorganisme (Reshef et al., 2006). Salah satu komunitas mikroba yang berasosiasi dengan karang adalah bakteri. Keberadaan bakteri di karang berperan sebagai penyedia nutrient bagi hewan karang. Menurut Bourne dan Munn (2005), jenis bakteri yang umum terdapat pada mukus karang Acropora yaitu Alphaproteobacteria. Jenis bakteri ini dapat tumbuh pada kondisi nutrien yang rendah seperti di ekosistem terumbu karang. Bakteri Alphaproteobacteria berperan penting dalam metabolisme karang seperti fotosintensis, fiksasi nitrogen, oksidasi ammonia dan methylotrophy (Campagne et al., 2012). Sebagian besar anggota bakteri Alphaproteobacteria merupakan jenis bakteri gram-negatif (Olson et al., 2002). Selain adanya manfaat keberadaan bakteri pada karang, terdapat beberapa bakteri yang dapat mematikan jaringan karang misalnya bakteri flavobacterium (Massinai, 2016).
Menurut Ritchie dan Smith in Ampou dkk. (2015), salah satu adaptasi yang dilakukan oleh karang terhadap perubahan lingkungan yaitu dengan mensekresikan mukus atau mucopolysacharide layer yang mengandung glycoprotein. Ketika karang mengalami stres, hasil sekresi mukus akan mengalami perubahan secara kuantitas. Mukus memberikan ruang hidup bagi berbagai jenis bakteri (Ritchie dan Smith in Ampou dkk., 2015). Dengan demikian, kepadatan dan komunitas bakteri yang bersimbiosis dengan karang juga akan berubah jika terjadi perubahan kondisi lingkungan di ekosistem terumbu karang (Bernhard dan Kelly, 2016). Jika kepadatan bakteri patogen meningkat maka akan menimbulkan penyakit pada karang.
Salah satu penyakit karang yang menginfeksi jaringan karang yaitu Black Band Disease (BBD) (Johan dkk., 2020). Penyakit ini menghancurkan jaringan karang yang pada akhirnya menyebabkan mortalitas. Penyakit ini disebabkan oleh bakteri golongan Cyanobacterium yaitu Phormidium corallyticum (Casamatta et al., 2012).
Karang Acropora merupakan jenis karang pembangun terumbu di ekosistem karang. Karang Acropora memiliki tingkat ketahanan dan pertumbuhan yang tinggi. Menurut Tomascik et al. (1997), Acropora mudah beradaptasi dan memiliki
tingkat pemulihan yang cepat dari pemutihan karang. Salah satu jenis karang yang umum terdapat di perairan Indonesia yaitu A. horrida yang hidup di perairan landai dan laguna dangkal (Wallace et al., 2008). Perubahan lingkungan dewasa ini seperti pencemaran limbah domestik dan pemanasan suhu permukaan laut merupakan beberapa faktor utama pemicu stress pada karang (Salim, 2012). Stress tersebut dapat menurunkan imunitas karang dan meningkatkan pertumbuhan bakteri patogen di mukus karang. Oleh karena itu, komposisi bakteri yang berasosiasi pada mukus karang A. horrida perlu diketahui dalam rangka mitigasi dampak perubahan lingkungan terhadap kesehatan karang tersebut.
Sampel karang A. horrida diperoleh dari karang transplan yang dibudidayaan di perairan Desa Patas, Kecamatan Gerogak, Kabupaten Buleleng, Provinsi Bali. Analisa mikrobiologi dilakukan di Laboratorium Biosains dan Bioteknologi, Universitas Udayana, pada bulan Juli - Agustus 2019.
-
2.2 Alat dan Bahan
Alat yang digunakan pada penelitian ini yaitu sikat gigi (baru), mikropipet, hot plate with magnetic stirrer, timbangan analitik, Erlenmeyer, gelas ukur, tabung reaksi, Autoklaf, laminar air flow, inkubator, cawan petri, lampu Bunsen, jarum ose, cover glass, dan kertas saring 0,45 µm. Bahan yang digunakan yaitu aquades, sampel karang A. horrida, air laut steril, media Nutrien Agar, pewarnaan gram, reagen H2O2, dan Oxidase test trip.
-
2.3 Metode Penelitian
-
2.3.1. Sterilisasi alat
-
Alat-alat yang digunakan terlebih dahulu dibersihkan kemudian dikeringkan dan cawan petri dibungkus dengan kertas buram. Setelah itu, alat-alat yang tahan panas disterilkan dengan menggunakan oven pada suhu 160-180o C selama 2 jam dan alat-alat yang tidak tahan panas disterilkan dengan autoklaf pada suhu 121°C pada tekanan 1 atm selama 15 menit. Alat-alat logam disterilkan
dengan cara dipijarkan pada lampu busen (Kharisma dan Manan, 2012).
-
2.3.2. Pembuatan media
Media yang digunakan untuk pertumbuhan bakteri dari mukus karang yaitu Nutrien Agar (NA). Pembuatan media NA yaitu ditimbang sebanyak 19,5 g, kemudian dilarutkan dengan 250 mL air laut saring sambil diaduk hingga larut, lalu ditambah air laut hingga volume 500 mL. Selajutnya, media NA dimasukan kedalam Erlenmeyer, kemudian ditutup dengan kapas dan alumunium foil yang selanjutnya disterilkan dalam autoklaf dengan suhu 121°C selama 15 menit (Murtius, 2018).
-
2.3.3. Pengambilan sampel mukus karang A. horrida
Pengambilan sampel fragmen karang dilakukan pada tiga koloni karang berbeda dengan pemotongan ukuran fragmen ± 5 cm. Sampel fragmen karang yang didapat kemudian dimasukkan kedalam plastik berisi oksigen dan dimasukkan kedalam cool box yang berisi es kemudian dibawa ke laboratorium. Setelah itu fragmen karang kemudian di bilas menggunakan air laut steril untuk menghilangkan kotoran yang menempel. Air laut steril adalah air laut yang melalui proses penyaring menggunakan kertas saring dengan ukuran 0,45 µm kemudian di autoklaf (Zhang et al., 2015).
-
2.3.4. Pengambilan mukus karang, isolasi, dan pemurnian bakteri
Jaringan mukus karang diperoleh dengan cara menyikat fragmen karang menggunakan sikat gigi dimana fragmen karang sebelumnya telah dibersihkan menggunakan air laut steril. Kemudian sampel mukus masing- masing koloni diambil 10 ml untuk dimasukkan ke dalam 90 ml air laut steril sehingga didapatkan pengenceran 10-1. Cara yang sama diulangi untuk mendapatkan pengenceran 10
-
4. Masing-masing seri pengenceran diambil 1 ml untuk dimasukan ke dalam cawan petri yang telah berisi media kultur NA, untuk selanjutnya dinkubasi pada suhu 37oC selama 24-48 jam.
Isolasi dilakukan untuk mendapatkan bakteri murni dilakukan dengan cara mencuplik masing-masing kultur bakteri dengan karakteristik morfologi berbeda menggunakan jarum ose.
Kemudian, bakteri tersebut diinokulasikan ke
dalam media NA yang baru dengan cara
menggoreskan jarum ose tersebut. Cawan Petri tersebut diinkubasi pada suhu 25oC selama 24 jam untuk mendapatkan isolat kultur bakteri murni (Murtius, 2018).
-
2.3.5. Identifikasi bakteri
Identifikasi bakteri dilakukan berdasarkan hasil pengamatan uji morfologi koloni dan Uji Biokimia. Hasil pengamatan dicocokkan dengan buku determinasi Bergey’s Determinative Bacteriology (Whitman, 2015).
-
1. Uji morfologi
Bakteri dapat ditumbuhkan dalam suatu medium agar dan akan membentuk penampakan berupa koloni. Koloni sel bakteri merupakan sekelompok koloni yang dapat dilihat dengan mata langsung. Penampakan koloni bakteri dalam medium agar menunjukkan penampakan dari bentuk pinggiran, ukuran keseluruhan, dan permukaan koloni. Koloni bakteri dapat berbentuk bulat, tak beraturan dengan permukaan cembung, cekung atau datar serta tepi koloni rata atau bergelombang (Cappuccino dan Welsh, 2019).
-
2. Pewarnaan gram bakteri
Apabila isolat kultur bakteri murni telah diperoleh yang diidentifikasi berdasarkan bentuk, warna, elevasi dan tepi koloni, maka identifikasi isolat dilanjutkan dengan pewarnaan Gram berdasarkan Cappuccino dan Welsh (2019).
Pewarnaan gram dilakukan dengan membuat olesan tipis suspense dari isolat bakteri berumur 24 jam pada gelas objek yang bersih, kemudian kering-anginkan. Setelah kering, difiksasi dengan cara melewatkan bagian bawah gelas objek di atas api bunsen. Selanjutnya hapusan bakteri ditetesi dengan larutan Kristal violet selama 1 menit. Dibilas dengan air kaut steril. Kemudian ditetesi dengan larutan iodine dan dibiarkan selama 1 menit. Dibilas dengan air laut steril. Dibilas dengan alkohol 96% selama 20 detik. Dibilas dengan aquades. Ditetesi dengan safranin selama 45 detik. Kemudian dibilas dengan air laut steril, diletakkan di atas kertas serap (Gambar 1).
Mengamati hasil pewarnaan di bawah mikroskop dengan pembesaran 1000x untuk memperjelas morfologi sel bakteri ditetesi dengan minyak imersi di atas cover glass dan perhitungan
koloni bakteri dengan menggunakan koloni counter. Sel bakteri Gram positif akan berwarna ungu hingga biru, sedangkan bakteri gram negatif akan berwarna merah (Murtius, 2018).
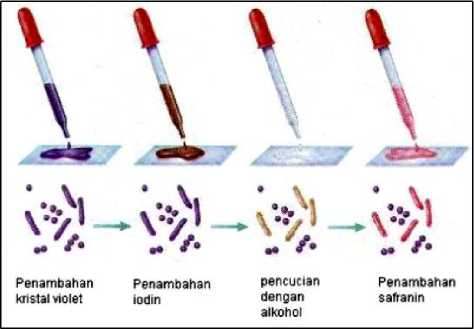
Gambar 1. Tahap Pewarnaan Gram
-
3. Uji biokimia bakteri
Uji Biokimia dengan tujuan untuk mengetahui jenis-jenis bakteri (Cappuccino dan Welsh, 2019). Uji Biokimia pada penelitian ini terdapat 3 uji, yaitu:
-
a. Uji katalase
Isolat mikroba diambil dengan menggunakan jarum ose, diletakkan pada gelas objek, kemudian diberi 2 tetes reagen H2O2 (Hydrogen Peroksida) 3 %. Hasil positif ditandai dengan terbentuknya gelembung atau O2.
-
b. Uji oksidase
Sebanyak satu ose isolat bakteri digoreskan pada kertas Oxidase Test Strip selama 1 menit. Uji positif ditandai dengan perubahan warna menjadi biru violet dan uji negatif ditandai dengan tidak adanya perubah warna pada kertas oxidase test strip (Lay, 1994).
Hasil pengamatan morfologi terdapat enam isolat bakteri dari sampel mucus karang A. horrida ditujukan pada Tabel 1.
Berdasarkan hasil uji morfologi, diketahui bahwa umumnya koloni bakteri berbentuk bulat, kecuali pada isolat E (Tabel 1). Bentuk pinggiran dari lima isolat umumnya utuh, kecuali pada isolat A (Tabel 1). Elevasi koloni bakteri menunjukkan sebagian besar datar (isolat A, D, E, F), sedangkan warna dan tekstur koloni seluruh isolat sama yaitu putih dan halus (Tabel 1).
-
3.2 Hasil Uji Biokimia (Katalase, Oksidase, dan Pewarnaan Gram).
Hasil uji katalase pada isolat-isolat bakteri dari sampel mukus karang A. horrida ditunjukan pada Tabel 2. Pada keenam isolat bakteri menunjukan hasil negatif dimana tidak terdapat gelembung sehingga bakteri tersebut tidak memiliki enzim katalase yang dapat menguraikan H2O dan O2.
Tabel 2
Uji katalase, Uji Oksidase, dan Gram
|
No |
Kode |
Uji Oksidase Uji Katalase |
Gram |
|
1 |
A |
- - |
- |
|
2 |
B |
+ - |
+ |
|
3 |
C |
- - |
+ |
|
4 |
D |
- - |
- |
|
5 |
E |
+ - |
+ |
|
6 |
F |
+ - |
+ |
Hasil uji oksidase pada isolat-isolat bakteri dari sampel mukus karang A. horrida Tabel 2 menunjukan hasil uji oksidase negatif dimana pada warna kertas tidak terjadi perubahan warna sehingga bakteri tersebut tidak terdapat enzim
Tabel 1
Hasil identifikasi morfologi bakteri dari sampel mukus karang A. horrida
|
No. |
Kode isolat |
Bentuk |
Pinggiran |
Elevasi |
Warna |
Tekstur |
|
1 |
A |
Bulat |
Bergerigi |
Datar |
Putih |
Halus |
|
2 |
B |
Bulat |
Utuh |
Cembung |
Putih |
Halus |
|
3 |
C |
Bulat |
Utuh |
Cembung |
Putih |
Halus |
|
4 |
D |
Bulat |
Utuh |
Datar |
Putih |
Halus |
|
5 |
E |
Tidak Beraturan |
Utuh |
Datar |
Putih |
Halus |
|
6 |
F |
Bulat |
Utuh |
Datar |
Putih |
Halus |
oksidase, dan hasil uji oksidase positif menunjukan dengan perubahan warna kertas menjadi biru violet sehingga bakteri tersebut terdapat enzim oksidase yang berfungsi sebagai katalis oksidase reduksi yang melibatkan O2 dengan pemberian atom Hidrogen menjadi air (H2O) atau Hidrogen peroksida (H2O2) (Lay, 1994).
Hasil uji pewarnaan gram isolat bakteri ditunjukan pada Gambar 2 yaitu gram positif dan negatif ditunjukan pada Tabel 2. Berdasarkan hasil uji pewarnaan gram isolat-isolat bakteri diketahui bahwa sebagian besar isolat adalah gram positif (isolat B, C, E, dan F) (Tabel 2). Namun juga ditemukan bakteri negatif (isolat A dan D). Hasil uji pewarnaan gram kemudian diamati melalui mikroskop untuk melihat morfologi isolat bakteri A, B, E dan F yang berbentuk kokus, sedangkan isolat D berbentuk basil dan isolat C berbentuk basil berantai (Gambar 2).
-
3.3 Pembahasan
Berdasarkan hasil uji morfologi koloni dan uji biokimia yaitu bakteri gram negatif, berbentuk coccus, bersifat anaerob dengan katalase negatif, maka isolat A, E dan F diklasifikasikan sebagai anggota bakteri dari famili Micrococcaceae. Menurut Whitman (2015), bakteri dalam famili ini dapat hidup di laut dan berperan sebagai dekomposer bahan organik, heterotofik, aerotolerant, bersifat saprofit hingga menjadi patogen. Beberapa genus
bakteri dari famili Micrococcaceae dilaporkan hidup berasosiasi dengan karang Acropora yaitu genus Micrococcus (Saputri dkk., 2016). Menurut Whitman (2015), genus Micrococcus bersifat heterotrop, dan berperan sebagai dekomposer material organik pada terumbu karang (Ruyitno in Saputri dkk., 2016). Karakteristik tersebut mengindikasikan bahwa bakteri ini bersifat oportunistik dan kelimpahannya di mukus karang A. horrida dapat meningkat jika terdapat peningkatan konsentrasi bahan organik dalam air laut di ekosistem terumbu karang.
Isolat B memiliki karakteristik yaitu bakteri gram positif dengan bentuk kokus, bersifat aerob dan katalase negatif. Bakteri ini memiliki bentuk variasi koloni dari kasar, halus, hingga berlendir. Karakteristik bakteri Isolat B memiliki ciri pada karakteristik famili Lactobacillaceae (Whitman, 2015). Bakteri famili Lactobacillaceae dapat hidup dilingkungan dengan nutrien yang rendah dan membutuhkan karbohidrat sebagai sumber pertumbuhan dimana hasil difermentasikan menjadi asam laktat dan karbodioksida. Beberapa spesies bakteri dari famili Lactobacillaceae cenderung menjadi patogen. Bakteri genus Streptococcus merupakan salah satu dari famili Lactobacillaceae yang diketahui hidup berasosiasi dengan karang Acropora di perairan dangkal (Godoy-Vitorino et al., 2017). Genus Streptococcus diketahui sebagai bakteri patogen yang dihambat oleh antibakteri Pseudomonas pada penyakit
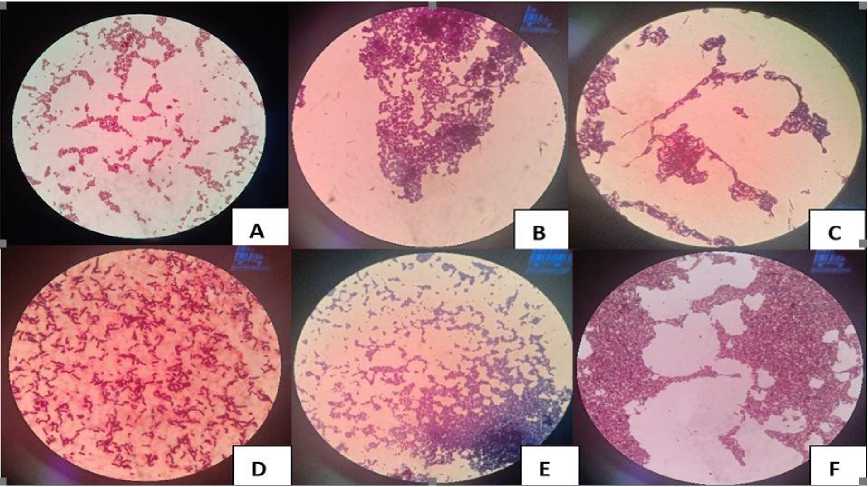
Gambar 2. Hasil Pewarnaan gram isolat bakteri A - F
karang yaitu ulcerative white spots (UWS) atau penyakit bercak putih (Pamungkas dkk., 2014).
Isolat C memiliki karakteristik yaitu bakteri gram positif, anaerob dan katalase negatif, berbentuk batang setelah 48 jam menjadi rantai batang panjang. berdasarkan karakteristik tersebut, isolat C diklasifikasikan sebagai anggota famili Clostridiaceae (Whitman, 2015). Salah satu famili Clostridiaceae yang dilaporkan terdapat di mukus karang keras yaitu genus Clostridium (Pollock et al., 2018), dimana bakteri ini diketahui sebagai pengikat Nitrogen yang dibutuhkan alga simbion karang (zooxanthella) (Setiapermana, 2006). Clostridium diketahui hidup pada jaringan karang sehat maupun yang terinfeksi penyakit, akan tetapi mengalami peningkatan pada jaringan yang terinfeksi penyakit (Daniels et al., 2015).
Isolat D memiliki karakteristik yaitu bentuk bulat putih dengan evelasi datar, gram negatif, berbentuk kokus, bersifat anaerob dan katalase negatif. Karakteristik tersebut merujuk pada karakteristik bakteri dari famili Rhizobiaceae. Salah satu anggota dari famili ini yaitu genus Chromobacterium teridentifikasi pada jaringan karang Acropora yang diduga terinfeksi penyakit Brown Band Disease di Perairan Pulau Barranglompo, Sulawesi Selatan (Massinai, 2016).
Berdasarkan berbagai karakteristik isolat bakteri pada mukus karang A. horrida dapat disimpulkan bahwa terdapat berbagai jenis bakteri yang berasosiasi. Diduga beakteri-bakteri tersebut bersifat oportunistik, dimana kepadatannya akan meningkat jika tersedia bahan atau senyawa yang dapat digunakan untuk metabolisme bakteri-bakteri tersebut, misalnya bahan organik pada genus Micrococcus dan nitrogen pada genus Clostridium. Hidup di ekosistem yang miskin nutrien (oligotrofik) (Soenardjo, 2013), maka peningkatan bahan organik dan nutrien dalam bentuk senyawa nitrogen akan menurunkan daya tahan tubuh karang dan meningkatkan pertumbuhan bakteri oportunistik. Jika kondisi ini berlangsung lama, maka karang akan terinfeksi penyakit yang disebabkan bakteri-bakteri tersebut dan akhirnya dapat berakibat pada kerusakan ekosistem terumbu karang. Dengan demikian, penting untuk menjaga kondisi ekosistem terumbu karang terhindar dari bahan pencemar yang dapat meningkatkan konsentrasi senyawa atau bahan yang dapat memicu pertumbuhan bakteri-bakteri oportunistik tersebut.
Terdapat 6 isolat bakteri yang berasosiasi pada mukus karang A. horrida yang berasal dari 4 famili yaitu Mircococcaceae, Lactobacillaceae, Clostridiaceae, dan Rhizobiaceae. Diduga bakteri-bakteri tersebut bersifat oportunistik, dimana kepadatannya akan meningkat jika terdapat bahan pencemar ke ekosistem terumbu karang seperti bahan organik dan nitrogen yang dapat meningkatkan pertumbuhannya.
Daftar Pustaka
Ampou, E. E., Triyulianti, I., & Nugroho, S. C. (2015). Bakteri asosiasi pada karang scleractinia kaitannya dengan fenomena La-nina di Pulau Bunaken. Jurnal Kelautan Nasional, 10(2), 55-63.
Bernhard, A. E., & Kelly, J. J. (2016). Linking ecosystem function to microbial diversity. Frontiers in Microbiology, 7, 1-2.
Bourne, D. G., & Munn, C. B. (2005). Diversity of bacteria associated with the coral Pocillopora damicornis from the great barrier reef. Environmental Microbiology, 7(8), 1162-1174.
Campagne, S., Damberger, F. F., Kaczmarczyk, A., Francez-Charlot, A., Allain, F. H. T., & Vorholt, J. A. (2012). Structural basis for sigma factor mimicry in the general stress response of alphaproteobacteria. PNAS: Proceedings of the National Academy of Sciences, 109(21), 1405-1414.
Cappuccino, J. G., & Welsh, C. (2019). Microbiology: a laboratory manual. (12th ed.). New York, USA: Pearson.
Casamatta, D., Stanić, D., Gantar, M., & Richardson, L. L.
-
(2012) . Characterization of roseofilum reptotaenium (oscillatoriales, cyanobacteria) gen. et sp. nov. isolated from caribbean black band disease. Phycologia, 51(5), 489-499.
Daniels, C. A., Baumgarten, S., Yum, L. K., Michell, C. T., Bayer, T., Arif, C., Roder, C., Weil, E., & Voolstra, C. R. (2015). Metatranscriptome analysis of the reefbuilding coral orbicella faveolata indicates holobiont response to coral disease. Frontiers in Marine Science, 2, 1-13.
Godoy-Vitorino, F., Ruiz-Diaz, C. P., Rivera-Seda, A., Ramírez-Lugo, J. S., & Toledo-Hernández, C. (2017). The microbial biosphere of the coral acropora cervicornis in northeastern puerto rico. PeerJ, 5, 1-19.
Johan, O., Purwanto, P., Rumengan, I., & Awaludinnoer, A. (2020). Kelimpahan penyakit karang di Kepulauan Ayau dan Asia Kabupaten Raja Ampat. Jurnal Riset Akuakultur, 15(2), 121-128.
Kharisma, A., & Manan, A. (2012). Kelimpahan bakteri Vibrio sp. pada air pembesaran udang vannamei (Litopenaeus vannamei) sebagai deteksi dini serangan
penyakit vibriosis. Jurnal Ilmiah Perikanan dan Kelautan, 4(2), 129-134.
Lay, B. W. (1994). Analisis Mikroba di Laboratorium. Jakarta, Indonesia: PT Raja Grafindo Persada.
Massinai, A. (2016). Laju infeksi penyakit brown band disease dan bakteriasosiasi pada karang Acropora sp. di Pulau Barranglompo, Makassar, Sulawesi Selatan. Jurnal Administrasi dan Kebijakan Kesehatan Indonesia, 2(2), 21-26.
Murtius, W. S. (2018). Modul: Praktek Dasar Mikrobiologi . [online]. http://repo.unand.ac.id/12311/1/Modul%20 Mikrobiologi.pdf, [diakses: 6 Desember 2019].
Olson, J. B., Harmody, D. K., & McCarthy, P. J. (2002). α-proteobacteria cultivated from marine sponges display branching rod morphology. FEMS microbiology letters, 211(2), 169-173.
Pamungkas, Y. P., Sabdono, A., & Wijayanti, D. P. (2014). Aktivitas antibakteri isolat bakteri karang terhadap bakteri yang diisolasi dari karang terserang penyakit ulcerative white spots di perairan Pulau Panjang, Jepara. Journal of Marine Research, 3(3), 254-264.
Pollock, F. J., McMinds, R., Smith, S., Bourne, D. G., Willis, B. L., Medina, M., Thurber, R. V., & Zaneveld, J. R. (2018). Coral-associated bacteria demonstrate phylosymbiosis and cophylogeny. Nature
Communications, 9(4921), 1-13.
Reshef, L., Koren, O., Loya, Y., Zilber‐Rosenberg, I., & Rosenberg, E. (2006). The coral probiotic hypothesis. Environmental Microbiology, 8(12), 2068-2073.
Salim, D. (2012). Pengelolaan ekosistem terumbu karang akibat pemutihan (Bleaching) dan rusak. Jurnal Kelautan: Indonesian Journal of Marine Science and Technology, 5(2), 142-155.
Saputri, R. A., Widyorini, N., & Purnomo, P. W. (2016). Identifikasi dan kelimpahan bakteri pada jenis karang Acropora sp. di reef flat terumbu karang Pulau Panjang Jepara. Saintek Perikanan: Indonesian Journal of Fisheries Science and Technology, 12(1), 35-39.
Setiapermana, D. (2006). Siklus nitrogen di laut. Oceana, 21, 19-31.
Soenardjo, N. (2013). Karakterisasi bakteri yang berasosiasi dengan penyakit pink-blotchdi P. Sambangan, Karimunjawa. Buletin Oseanografi Marina, 2(1), 58-65.
Tomascik, T., Mah, A. J., Nontji, A., & Moosa, M. K. (1997). The Ecology of The Indonesian Seas. UK, London: Oxford University Press.
Wallace, C., Richards, Z., & Suharsono. (2008). Regional distribution patterns of acropora and their use in the conservation of coral reefs in indonesia. J Pesisir dan Lautan, 4(1),40-58
Whitman, W. B. (2015). Bergey's manual of systematics of archaea and bacteria. Hoboken, New Jersey: Wiley Press Room.
Zhang, Y. Y., Ling, J., Yang, Q. S., Wang, Y. S., Sun, C. C., Sun, H. Y., Feng, J. B., Jiang, Y. F., Zhang, Y. Z., & Dong, J. D. (2015). The diversity of coral associated bacteria and the environmental factors affect their community variation. Ecotoxicology, 24, 1467-1477.
© 2022 by the authors; licensee Udayana University, Indonesia. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/3.0/).
J. Mar. Aquat. Sci. 8: 44-50 (2022)
Discussion and feedback