Komposisi Komunitas Bakteri yang Berasosiasi dengan Karang Acropora hyacinthus
on
Journal of Marine and Aquatic Sciences 8 1), 155-162 2022)
Komposisi Komunitas Bakteri yang Berasosiasi dengan Karang Acropora hyacinthus
Trisilia Mulyawati Anggraeni a, I Gusti Ngurah Putra Dirgayusa a, Widiastutia*
a Program Studi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Universitas Udayana, Kampus UNUD Bukit Jimbaran, Bali 80361, Indonesia
* Penulis koresponden. Tel.: +62-812-3633-9523
Alamat e-mail: widiastutikarim@unud.ac.id
Diterima (received) 11 November 2019; disetujui (accepted) 15 Mei 2022; tersedia secara online (available online) 1 Juni 2022
Abstract
Hard coral is the main constituent of the coral reef ecosystem and functions as shelter, nursery, and feeding ground for various marine macro- and microbiotas, such as bacteria in its mucus. Coral as the host may benefit from this partnership or receives detrimental effects since bacteria may turn into parasitic or pathogenic. Coral A. hyacinthus can be transplanted for ornamental coral. However, it is vulnerable to be infected by coral disease due to pathogenic bacteria if the water quality is poor. Therefore, this study was aimed to determined the community composition of bacteria associated with coral A. hyacinthus mucus. Corals A. hyacinthus were collected from the traditional coral transplantation in Patas village, Gerogak District, Buleleng Regency. Mucus were sampled from ± 5 cm fragment from 3 different coral colonies. Isolates were cultured in the Nutrient Agar medium. The identification of bacteria isolates was according to Biochemical Tests for Identification of Medical Bacteria 2nd edition. The identification of the isolates consisted of morphological and biochemical tests. The identification results found 10 isolates that consisted of Micrococcus sp. Pseudomonas sp., Flavobacterium sp. and Vibrio sp. However, the composition varied among the coral colonies.
Keywords: Acropora hyacinthus; bacterial communities; coral mucus
Abstrak
Karang keras merupakan penyusun utama dari ekosistem terumbu karang dan berfungsi sebagai tempat berlindung, berkembangbiak dan mencari makan bagi berbagai makro- dan mikroorganisme laut, salah satunya adalah bakteri yang hidup pada mukus karang. Mukus karang mengandung tidak hanya bakteri yang menguntungkan tetapi juga bakteri yang berpotensi sebagai patogen. Karang A. hyacinthus merupakan salah satu jenis karang yang dibudidayakan karena termasuk komoditas ekspor untuk karang hias, tetapi rentan terjangkit penyakit karang karena bakteri patogen apabila berada pada kualitas perairan yang buruk. Oleh karena itu, penelitian ini bertujuan untuk mengetahui komposisi komunitas bakteri yang berasosiasi pada mukus karang A. hyacinthus. Sampel fragmen karang diperoleh dari 3 koloni karang berbeda dengan ukuran fragmen ± 5 cm. Karang A. hyacinthus berasal dari budidaya karang tradisional di Desa Patas, Kecamatan Gerogak, Kabupaten Buleleng. Isolat bakteri ditumbuhkan pada media Nutrien Agar selama masa isolasi dan pemurnian. Identifikasi isolat bakteri dilakukan dengan uji morfologi dan biokimia Identifikasi bakteri mengacu pada buku identifikasi Biochemical Tests for Identification of Medical Bacteria 2nd edition. Hasil identifikasi bakteri dari ketiga fragmen karang didapatkan 10 isolat bakteri. Hasil identifikasi isolat bakteri menunjukkan bahwa jenis bakteri yang berasosiasi dengan karang A. hyacinthus adalah genus Micrococcus sp., Pseudomonas sp., Flavobacterium sp. dan Vibrio sp. Namun, komposisi jenis bakteri yang terdapat pada masing-masing koloni karang berbeda.
Kata Kunci: Acropora hyacinthus; komunitas bakteri; mukus karang
Terumbu karang merupakan salah satu ekosistem yang memiliki keanekaragaman jenis biota yang
tinggi (Ampou dkk , 2015). Penyusun utama dari ekosistem terumbu karang adalah karang keras (Scleratinia), dengan kerangka yang keras dan bentuk serta ukuran yang beragam, karang keras
berfungsi sebagai tempat berlindung, tempat berkembang biak dan tempat untuk mencari makan bagi berbagai biota laut (Huda dkk., 2012). Selain itu, karang keras juga merupakan habitat bagi berbagai mikroorganisme seperti bakteri, eucariota, archaea dan virus (Rosenberg et al., 2007). Oleh karena itu, karang merupakan suatu Holobion karena merupakan host bagi berbagai mikroorganisme dari tiga domain dan virus (Agustini dkk., 2017). Di antara mikroorganisme tersebut, mikroalga zooxanthellae merupakan simbion karang yang paling dikenal (Chen et al., 2011).
Permukaan jaringan karang dilapisi oleh mukus yang dapat menyediakan habitat pada komunitas bakteri (Rohwer et al., 2002). Selain pada mukus, bakteri juga menempati bagian intraseluler di dalam jaringan dan rangka karang serta air laut di sekitarnya (Agostini et al., 2012; Ainsworth et al., 2015; Marcelino dan Verbruggent, 2016) ). Mukus karang memiliki peran dalam mengatur struktur komunitas bakteri pada karang dan terbukti dapat menghambat pertumbuhan bakteri potensial invasif hingga 10 kali lipat (Ritchie, 2006). Ritchie (2006) menemukan bahwa 20% kultur bakteri dari mukus karang Acropora palmata menunjukkan aktivitas antibiotik. Produksi antibiotik oleh bakteri adalah sarana untuk mengamankan relung dengan mengendalikan populasi mikroba yang bersaing untuk sumber daya yang sama (Nielsen et al., 2000; Rao et al , 2005). Hal tersebut menunjukkan bahwa dalam mukus karang tersebut, tidak hanya terdapat bakteri patogen saja melainkan bakteri yang menguntungkan pun ada bahkan dapat berasosiasi dengan baik (Sabdono, 2011). Manfaat bakteri bagi karang yaitu berperan dalam fiksasi nitrogen, pendegradasi limbah (Sabdono, 2011), dan sebagai penyedia nutrien untuk fotosintesis zooxanthellae (Saputri dkk , 2016).
Komposisi komunitas bakteri dapat berbeda pada jenis karang yang sama dan bervariasi dengan perubahan musim, geografis dan masukan polusi dari pesisir (Zhang et al., 2015). Karang A hyacinthus merupakan salah satu jenis karang yang dibudidayakan karena termasuk komoditas ekspor untuk karang hias, namun rentan terjangkit penyakit karang akibat bakteri patogen apabila berada pada kualitas perairan yang buruk. Oleh sebab itu, perlu dilakukan penelitian untuk mengetahui komposisi komunitas bakteri yang berasosiasi dengan karang A hyachintus
2 1 Waktu dan Tempat
Sampel karang A hyacinthus berasal dari budidaya karang transplan di perairan Desa Patas, Kecamatan Gerokgak, Kabupaten Buleleng. Lokasi pengambilan sampel fragmen karang ditunjukkan pada Gambar 1. Isolasi bakteri, identifikasi bakteri secara morfologi dan uji persumtif dilakukan pada Bulan Mei 2019 di Laboratorium Biosains dan bioteknologi, Universitas Udayana, kemudian dilanjutkan uji biokimia di Laboratorium Mikrobiologi Badan Karantina Ikan dan Pengendalian Mutu (BKIPM), Denpasar
Gambar 1. Lokasi Pengambilan Sampel Fragmen Karang A. hyacinthus
-
2. 2 Alat dan Bahan
Alat yang digunakan pada penelitian ini, antara lain cawan petri, mikropipet dan tip, tabung eppendof, erlenmeyer, vortex, inkubator, laminary flow, autoclaf, air laut steril, media NA, media uji biokimia, tabung reaksi, kertas oksidase, H2O2, jarum ose, mikroskop, kaca preparat, crystal violet, lugol, safranin dan aquades.
-
2 3 Analisis Mikrobiologi
-
2.3.1. Pengambilan Sampel Fragmen Karang A hyacinthus
Sampel fragmen karang A hyacinthus diperoleh dari indukan karang transplan budidaya. Pengambilan sampel fragmen karang dilakukan di tiga indukan karang berbeda dengan ukuran ± 5 cm (Abubakar dkk., 2011). Sampel karang yang digunakan merupakan karang yang sehat yaitu karang yang tidak ada kerusakan pada jaringannya, memiliki warna yang cerah dan tegas (Subhan dkk.,
-
2014) . Sampel fragmen karang tersebut kemudian dimasukkan ke dalam plastik polietilen yang diisi dengan air laut untuk kemudian diletakkan ke dalam cool box. Sampel dibilas menggunakan air laut steril untuk membersihkan kotoran yang menempel (Neulinger et al , 2008; Zhang et al., 2015).
-
2.3.2. Isolasi bakteri
Isolasi bakteri diawali dengan pengenceran sampel (Harpeni, 2007). Pengenceran sampel dimulai dengan proses scrapping yakni menggosok permukaan karang menggunakan sikat gigi (baru) di dalam cawan petri yang berisi 10 ml air laut steril (Prabaswari, 2018). Sampel kemudian diambil 100 µl untuk dimasukkan ke dalam tabung ependof yang berisi 900 µl air laut steril, dari proses tersebut didapatkan pengenceran 10-1. Pengenceran 10-1 diambil 100 µl menggunakan mikropipet kemudian dimasukkan ke dalam tabung reaksi yang bersisi 900 µl air laut steril dan didapatkan pengenceran 10-2. Kemudian, pengenceran 10-2 diambil 100 µl kemudian dimasukkan ke dalam 900 µl air laut steril menggunakan mikropipet dan didapatkan pengenceran 10-3. Masing-masing hasil pengenceran kemudian diambil 100 µl untuk disebar (spread plate) ke dalam cawan petri yang telah berisi media NA. Cawan petri kemudian diinkubasi ke dalam inkubator dengan suhu 37o C selama 24 jam (Huda dkk., 2012). Koloni yang telah tumbuh kemudian dipisahkan sesuai dengan karakteristik berbeda dengan metode streak (Adryan dkk., 2017). Setiap koloni bakteri yang tumbuh kemudian dipisahkan berdasarkan warna, ukuran dan bentuk koloni, serta dimurnikan dengan menggunakan media yang sama (Abubakar dkk., 2011).
-
2.3.3. Pemurnian Bakteri
Pemurnian bakteri dilakukan untuk memisahkan hasil isolasi yang terdiri dari banyak koloni yang berlainan jenis sehingga didapatkan koloni murni pada setiap petri. Pemurnian bakteri dilakukan dengan cara mencuplik hasil kultur yang berusia 24 jam menggunakan ose steril (Adryan dkk., 2017). Masing-masing bakteri yang memiliki karakteristik berbeda dimasukkan kedalam media NA dengan cara gores (streak method) kemudian diinkubasi dengan suhu 37o C selama 1 x 24 jam dan diamati pertumbuhannya (Huda dkk., 2012). Jika terdapat campuran bakteri pada petri tersebut, maka
dilakukan pemurnian kembali hingga mendapat kultur murni (Harpeni, 2007).
-
2.3.4. Identifikasi Bakteri
Isolat bakteri yang telah didapatkan, yang sudah melalui identifikasi secara morfologi kemudian dilakukan identifikasi secara biokimia meliputi pewarnaan gram, H2O2 3%, oksidase, TSIA, OF, SIM dan Nitrat. Identifikasi bakteri mengacu pada buku identifikasi Biochemical Tests for Identification of Medical Bacteria 2nd edition (McFaddin, 1980).
-
2.3.5. Analisis Data
Data komposisi jenis bakteri dianalisis menggunakan metode analisis deskriptif yang dilakukan dengan tujuan utama untuk membuat gambaran atau deskriptif tentang suatu keadaan (Notoadmodjo, 2002).
3. Hasil dan Pembahasan
3 1 Morfologi Bakteri
Tabel 1
Hasil Identifikasi Morfologi Bakteri yang Berasosiasi dengan Karang A. hyacinthus
|
No. |
Isolat |
Bentuk |
Warna |
Elevasi |
|
1 |
AH C1k |
Bulat |
Krem |
Umbunate |
|
2 |
AH C1s a |
Bulat |
Krem |
convex |
|
3 |
AH C1s b |
Bulat |
Putih |
convex |
|
4 |
AH C1b |
Bulat |
Putih |
Flat, raised |
|
5 |
AH C2k a |
Bulat |
Putih |
convex |
|
6 |
AH C2k b |
Bulat |
Krem |
convex |
|
7 |
AH C2s |
Bulat |
Krem |
Umbunate |
|
8 |
AH C2b |
Bulat |
Putih |
convex |
|
9 |
AH C3k |
Bulat |
Krem |
convex |
|
10 |
AH C3s |
Bulat |
Krem |
convex |
dimana, kode: AH: A. hyacinthus, C: koloni 1,2,3: karang, k: kecil, s: sedang, b: besar.
Berdasarkan hasil isolasi dari tiga sampel mukus (koloni) karang, didapatkan sepuluh isolat bakteri. Bentuk koloni bakteri umumnya bulat dengan warna dominan krem (Tabel 1). Warna koloni bakteri yang ditemukan selain warna krem yaitu warna putih susu. Selain dari bentuk dan warna, koloni bakteri juga dibedakan berdasarkan elevasinya. Berdasarkan elevasi, ditemukan tiga jenis elevasi. Bentuk elevasi timbul (convex) merupakan bentuk elevasi koloni bakteri yang paling banyak ditemukan. Bentuk elevasi koloni
bakteri yang ditemukan selain bentuk timbul adalah bentuk elevasi berbentuk tombol (umbunate), dan bentuk elevasi cekung dengan pinggiran timbul ( flat, raised margin)
3 2 Uji Persumtif
Uji ini meliputi uji gram, katalase, oksidase. Uji gram dilakukan menggunakan KOH 3% dan pewarnaan gram. Berdasarkan hasil uji gram menggunakan KOH 3% ditemukan delapan bakteri gram negatif dan dua gram positif yaitu isolat C1s a dan C1s b sedangkan gram negatif yaitu isolat C1k, C2k b, C1b, C2b, C2k a, C3s, C3k, C2s. Uji gram menggunakan KOH 3% dilakukan dengan mengambil koloni menggunakan ose, kemudian digoreskan di atas kaca preparat untuk selanjutnya dicampurkan dengan KOH 3%. Apabila hasil yang ditunjukkan menunjukan campuran menjadi viscus atau lem, menandakan bakteri tersebut merupakan bakteri gram negatif dan sebaliknya untuk bakteri gram positif. Hal ini terjadi karena bakteri gram positif resisten terhadap reagent tersebut. Bakteri gram positif memiliki dinding sel yang tebal (Ampou dkk., 2015), sehingga membuat dinding selnya tidak pecah. Bakteri gram negative larut oleh reagent karena bakteri gram negatif kurang resisten terhadap gangguan fisik, sehingga membuatnya larut dalam reagent (Pelczar dan Chan, 2005). Seperti yang telah dijelaskan sebelumnya, bahwa bakteri gram positif merupakan bakteri yang memiliki dinding sel lebih tebal, oleh sebab itu pada saat pewarnaan gram menggunakan zat warna, penggunaan pereaksi kedua (dekolorisasi), sel bakteri gram positif mempertahankan zat warna ungu dari pereaksi pertama (crystal violet). Bakteri
gram negatif yang memiliki dinding sel lebih tipis, pada saat dekolorisasi dinding selnya akan larut sehingga memudahkan pelepasan zat warna crystal violet dan akan menerima zat warna baru yaitu safranin.
Hasil uji katalase menggunakan H2O2 3% didapatkan keseluruhan bakteri memiliki enzim katalase. Uji katalase dilakukan dengan mengambil koloni bakteri menggunakan ose, kemudian digoreskan di atas kaca preparat untuk selanjutnya ditetesi dengan larutan H2O2 3%. Apabila hasil menunjukan campuran menghasilkan gelembung, menandakan bahwa bakteri tersebut memiliki enzim katalase. Bakteri yang memiliki enzim katalase (katalase positif), merupakan bakteri yang dapat mendegradasi hidrogen peroksida (H2O2) menjadi air dan O2. Hidrogen peroksida bersifat toksik terhadap sel karena bahan ini menginaktivasikan enzim dalam sel, oleh sebab itu mikroorganisme yang hidup dalam sel harus menguraikannya (Huda dkk., 2012)
Hasil uji oksidase menggunakan kertas oksidase didapatkan bahwa isolat bakteri C1k, C2k b, C1b, C3s dan C2s tidak dapat menghasilkan enzim oksidase. Uji Oksidase dilakukan dengan mengambil koloni bakteri menggunakan ose, kemudian digoreskan di atas kertas oksidase. Kertas oksidase adalah kertas yang sebelumnya telah direndam dengan larutan N,N,N',N'-Tetramethyl-1,4-phenylenediammonium dichloride for synthesis yang berfungsi sebagai reagent untuk mengetahui apakah bakteri menghasilkan enzim oksidase atau tidak. Semua hasil uji biokimia isolat bakteri yang berasosiasi dengan A hyacinthus dirangkum pada Tabel 2.
Tabel 2
Hasil uji persumtif dan uji biokimia isolat bakteri yang berasosiasi dengan karang A hyacinthus
|
Isolate |
Gram |
Sel |
Katalase |
Oksidase |
OF |
SIM |
TSIA |
Nitrat |
Bakteri | |
|
Indol Motil |
Butt |
Slant | ||||||||
|
C1k |
- |
R |
+ |
+ |
F |
- + |
A |
A |
- |
Flavobacterium sp. |
|
C1s a |
+ |
C |
+ |
- |
F |
- + |
Alk |
A |
+ |
Micrococcus sp. |
|
C1s b |
+ |
C |
+ |
- |
F |
- + |
Alk |
A |
+ |
Micrococcus sp. |
|
C1b |
- |
R |
+ |
+ |
F |
- + |
A |
A |
+ |
Pseudomonas sp. |
|
C2k a |
- |
R |
+ |
- |
F |
- + |
A |
A |
- |
Pseudomonas sp. |
|
C2k b |
- |
R |
+ |
+ |
O |
- + |
Alk |
Alk |
+ |
Vibrio sp. |
|
C2s |
- |
R |
+ |
+ |
F |
- + |
A |
A |
+ |
Flavobacterium sp. |
|
C2b |
- |
R |
+ |
- |
F |
- + |
A |
A |
+ |
Pseudomonas sp. |
|
C3k |
- |
R |
+ |
- |
F |
- + |
A |
A |
+ |
Pseudomonas sp. |
|
C3s |
- |
R |
+ |
+ |
O |
- + |
Alk |
Alk |
- |
Vibrio sp. |
Keterangan kode: AH: Acropora hyacinthus, C: koloni, 1,2,3: karang, k: kecil, s: sedang, b: besar. R: Road (batang), C Coccus (bulat), F: Fermentatif, O: Oksidatif, A: Acid, Alk: Alkali
3 3 Uji Biokimia
Uji ini meliputi TSIA, nitrat, SIM dan OF. Hasil uji TSIA (Triple Sugar Iron Agar) didapatkan hasil beberapa bakteri dapat memfermentasi glukosa sukrosa dan laktosa. Hal ini dapat dilihat dari berubahnya warna media pada butt ataupun slant. Isolat bakteri yang dapat memfermentasi ketiga gula yaitu isolat bakteri C1k, C1b, C2k a, C2s, C2b, dan C3k. Isolat bakteri C1s a dan C1s b adalah bakteri yang dapat memfermentasi glukosa saja. Hal tersebut terjadi karena hasil uji menunjukkan media TSIA hanya berwarna kuning pada bagian butt sedangkan isolat bakteri C2k dan C3s bersifat alkali.
Hasil uji motilitas dan Indol, didapatkan hasil bahwa semua isolat yang didapat bersifat motil dan negatif indol. Hal tersebut dapat dilihat dari pergerakan tusukan biakan bakteri yang menyebar setelah diinkubasi selama 24 jam. Jika bakteri menyebar melewati garis tusukan hal tersebut menandakan bakteri motil posif, sedangkan bakteri negatif indol dilihat dari tidak berubahnya warna pada media yang telah ditetesi oleh reagent
Hasil uji nitrat didapatkan hasil positif pada isolat C1s a, C1s b, C1b, C2k b, C2s, C2b dan C3k sedangkan bakteri isolat C1k, C2k a dan C3s negatif nitrat. Uji nitrat dilakukan untuk mengetahui apakah bakteri dapat mereduksi nitrat (NO3) menjadi nitrit (NO2). Hasil uji OF didapatkan hasil delapan isolat fermentatif C1k, C1s a, C1s b, C1b, C2k a, C2s, C2b, C3k dan dua isolat oksidatif yaitu C2k b, C3s. Uji OF dilakukan untuk mengetahui apakah bakteri bersifat oksidatif atau fermentatif, hal ini dapat diketahui dari berubahnya warna media OF menjadi kuning, media yang berparafin dan tidak berparafin. Parafin digunakan untuk menutup jalan oksigen untuk masuk ke dalam media, karena media ini bersifat semi solid. Jika media OF yang berparafin berwarna kuning hal tersebut menunjukkan bahwa bakteri dapat hidup tanpa oksigen atau anaerob. Apabila media OF yang berapafin berwarna hijau sedangkan yang tidak berparafin berwarna kuning. Hal tersebut menunjukkan bahwa bakteri tersebut bersifat aerob. Hasil uji ditampilkan pada Tabel 2.
3 4 Komposisi Komunitas Bakteri
Gambar 2 menunjukkan bahwa pada koloni karang I, ditemukan 3 jenis bakteri yaitu Pseudomonas sp , Flavobacterium sp , dan Micrococcus sp. dimana
Micrococcus sp merupakan bakteri yang paling banyak ditemukan (20%) sedangkan bakteri Flavobacterium sp dan Pseudomonas sp masing-masing memiliki presentase 10%.
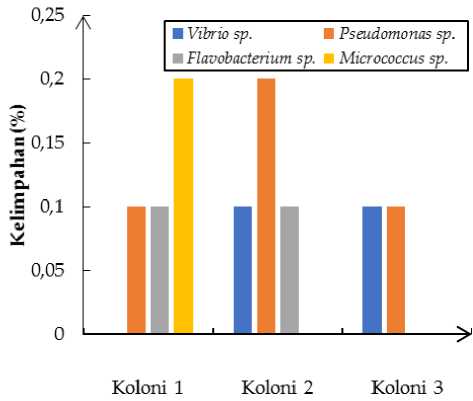
Gambar 2. Komposisi Komunitas Bakteri pada Koloni Karang A. hyacinthus.
Pada koloni II, ditemukan 3 jenis bakteri yaitu Pseudomonas sp., Flavobacterium sp dan Vibrio sp Bakteri genus Pseudomonas sp merupakan genus bakteri yang paling banyak ditemukan pada koloni karang II (20%) sedangkan bakteri Flavobacterium sp. dan Vibrio sp. masing-masing memiliki presentase 10%. Pada koloni III hanya ditemukan 2 jenis bakteri, yaitu Pseudomonas sp dan Vibrio sp dengan presentase kelimpahan koloni sama.
3 5 Pembahasan
Hasil isolasi dan identifikasi bakteri dari ketiga fragmen karang didapatkan 10 bakteri. 8 bakteri gram negatif dan 2 bakteri gram positif. Pada fragmen karang pertama ditemukan 4 koloni bakteri 2 berbentuk coccus gram positif dan 2 berbentuk batang gram negatif. Fragmen karang kedua ditemukan 4 koloni bakteri yang seluruhnya berbentuk batang gram negatif, sedangkan pada fragmen karang ketiga ditemukan 2 koloni bakteri berbentuk batang, gram negatif.
Mukus karang memerangkap semua yang melewatinya, sehingga sangat memungkinkan jika banyak jenis bakteri yang berasosiasi dengan karang. Hal ini sesuai dengan Wild et al. (2004), yaitu mukus karang memerangkap partikel dan mikroba yang lewat di kolom air.
Karakteristik bakteri asosiasi karang keras spesies A hyacinthus yang ditemukan, memiliki hasil uji katalase dan oksidase positif, bersifat anaerob fermentatif, nitrat bisa positif atau negatif, bersifat motil dan indole negatif, Flavobacterium sp hal tersebut sesuai dengan Massinai dkk. (2017), yang menyebutkan bahwa Flavobacterium sp merupakan berbentuk batang, gram negatif. Bakteri ini ada yang motil dan tidak motil, dapat tumbuh secara aerobik dan anaerobik. Pada kondisi aerobik bakteri ini mengoksidasi asam amino, sedangkan pada kondisi anaerobik metabolismenya bersifat fermentatif, energi diproduksi dengan memecah gula menjadi asam organik. Habitatnya pada tanah, air tawar, air asin dan berasosiasi dengan organisme (Massinai dkk., 2017). Bakteri ini ditemukan berasosiasi dengan karang Porites. Bakteri Flavobacterium sp merupakan anggota dari filum Bacteriodetes. Bacteroidetes merupakan filum yang berpotensi sebagai bakteri simbion karang (Taylor et al., 2007). Filum Bacteroidetes merupakan filum bakteri yang ditemukan pada perairan laut, mukus dan jaringan karang (Zhang et al., 2015).
C1s a dan C1s b bakteri Micrococcus sp C1s a dan C1s b uji gram positif, katalase oksidase positif, anaerob fakultatif, motil positif dan sel berbentuk coccus (Mcfaddin, 1980), bakteri Micrococcus sp tersebar luas di berbagai lingkungan baik perairan maupun daratan dan merupakan bakteri yang berfungsi sebagai perombak bahan organik (Saputri dkk., 2016). Bakteri Micrococcus sp. merupakan anggota dari filum Actinomycetes. Actinomycetes merupakan filum yang berpotensi sebagai bakteri simbion karang (Taylor et al., 2007). Bakteri yang dapat memiliki peran baik bagi karang (Nielsen et al., 2000; Rao et al., 2005 dalam Ritchie, 2006). Filum Actinomycetes merupakan filum bakteri yang dapat ditemukan pada perairan laut, mukus dan jaringan karang (Bayer et al., 2013; Zhang et al., 2015).
C2k b dan C3s bakteri Vibrio sp bakteri ini memiliki karakteristik hasil uji gram negatif, katalase oksidase positif, anaerob fakultatif, motil positif dan sel berbentuk batang. C2k b dan C3s karakteristik Vibrio sp menurut (Macfadin, 1980). Menurut Ritchie (2006), bakteri Vibrio sp banyak ditemukan bersimbiosis dengan karang sehat dan secara luas terdapat di lautan tropis.
Hasil uji C1b, C2k a, C2b dan C3k gram negatif, katalase oksidase positif, aerob dan anaerob fakultatif, motil positif dan sel berbentuk batang.
Karakteristik Pseudomonas sp (MacFaddin, 1980). Bakteri ini ditemukan berasosiasi dengan karang keras Acropora sp yang terserang penyakit Black Band Deases (Massinai, 2016). Bakteri ini juga ditemukan berasosiasi dengan karang lunak yang merupakan penghasil enzim ekstraseluler karena mempunyai kemampuan untuk menghasilkan enzim proteolitik, amilolitik, selulolitik, lipolitik, dan antibakteri (Setyati dkk., 2016). Bakteri yang dapat menghasilkan antibakteri merupakan ciri dari bakteri simbion karang yang bermanfaat baik bagi karang, karena produksi antibiotik oleh bakteri adalah sarana untuk mengamankan relung dengan mengendalikan populasi mikroba yang bersaing untuk sumberdaya yang sama (Nielsen et al., 2000; Rao et al., 2005 dalam Ritchie, 2006).
Bakteri yang ditemukan pada ketiga koloni karang A hyacinthus berdasarkan karakteristik morfologi yang berbeda adalah sepuluh bakteri, dari sepuluh bakteri tersebut dilakukan uji biokimia dan didapatkan empat jenis bakteri yaitu Micrococcus sp , Pseudomonas sp , flavobacterium sp , dan Vibrio sp Komposisi jenis-jenis bakteri pada ketiga koloni karang bervariasi walaupun sampel mukus berasal dari Koloni-koloni karang yang berbeda tetapi hidup pada lokasi dengan parameter lingkungan yang sama. Oleh karena itu, variasi komposisi jenis bakteri diduga karena ketidakmampuan penulis dalam mengisolasi atau mengidentifikasi isolat-isolat tersebut pada masing-masing sampel mukus. Pernyataan ini sesuai dengan Zhang et al. (2015) yaitu komposisi komunitas bakteri dapat berbeda pada jenis karang yang sama dan bervariasi dengan perubahan musim, geografis dan masukan polusi dari pesisir.
4. Simpulan
Terdapat 10 isolat bakteri dari 3 koloni karang Acropora hyachintus Berdasarkan hasil identifikasi uji morfologi koloni dan uji biokimia, isolat bakteri menunjukkan karakteristik bakteri genus Flavobacterium sp , Pseudomonas sp , Micrococcus sp , dan Vibrio sp Hasil komposisi bakteri menunjukkan bahwa pada koloni karang I, Micrococcus sp merupakan bakteri yang paling banyak ditemukan (20%) sedangkan bakteri Flavobacterium sp dan Pseudomonas sp. masing-masing memiliki presentase 10%. Pada koloni II, Bakteri genus Pseudomonas sp merupakan genus bakteri yang paling banyak ditemukan pada koloni karang II (20%) sedangkan bakteri Flavobacterium sp
dan Vibrio sp masing-masing memiliki presentase 10%. Pada koloni III ditemukan 2 jenis bakteri, yaitu Pseudomonas sp dan Vibrio sp dengan presentase kelimpahan koloni sama yaitu 10%.
Daftar Pustaka
Abubakar, H., Wahyudi, A. T., & Yuhana, M. (2011). Skrining bakteri yang berasosiasi dengan spons Jaspis sp. sebagai penghasil senyawa antimikroba. Indonesian Journal of Marine Sciences, 16(1), 35-40.
Adryan, A., Widyastuti, R., & Djajakirana, G. (2017). Isolasi dan identifikasi mikroba tanah pendegradasi selulosa dan pektin dari Rhizosfer Aquilaria malaccensis. Buletin Tanah dan Lahan, 1(1), 58-64.
Agostini, S., Suzuki, Y., Higuchi, T., Casareto, B. E., Yoshinaga, K., Nakano, Y., & Fujimura, H. (2012). Biological and chemical characteristics of the coral gastric cavity. Coral Reefs, 31(1), 147-156.
Agustini, M. S., Maria, I., Madyowati, M. K., & Oetami, I. S. (2017). Biodiversitas Plankton Pada Budidaya Polikultur di Desa Sawohan Kecamatan Sedati Kabupaten Sidoarjo. Laporan Penelitian. Surabaya, Indonesia: Fakultas Pertanian, Universitas Dr. Soetomo.
Ainsworth, T. D., Krause, L., Bridge, T., Torda, G., Raina, J. B., Zakrzewski, M., Gates, R. D., Gamino, J. L. P., Spalding, H. L., Smith, C., Woolsey, E. S., Bourne, D. G., Bongaerts, P., Guldberg, O. H., & Leggat, W. (2015). The coral core microbiome identifies rare bacterial taxa as ubiquitous endosymbionts. The ISME journal, 9(10), 2261-2274.
Ampou, E. E., Triyulianti, I., & Nugroho, S. C. (2015). Bakteri asosiasi pada karang Scleractinia kaitannya dengan fenomena La-Nina di Pulau Bunaken. Jurnal Kelautan Nasional, 10(2), 55-63.
Bayer, T., Neave, M. J., Alsheikh-Hussain, A., Aranda, M., Yum, L. K., Mincer, T., Hughen, K., Apprill, A., & Voolstra, C. R. (2013). The microbiome of the Red Sea coral Stylophora pistillata is dominated by tissue associated Endozoicomonas bacteria. Applied and Environmental Microbiology, 79(15), 4759-4762.
Chen, C. P., Tseng, C. H., Chen, C. A., & Tang, S. L. (2011). The dynamics of microbial partnerships in the coral Isopora palifera. The ISME Journal, 5(4), 728-740.
Harpeni, E. (2007). Eksplorasi bakteri yang berasosiasi dengan karang lunak sebagai alternatif sumber senyawa bioaktif uji hayati antibakteri. Majalah Ilmiah Biologi BIOSFERA a Scientific Journal, 24(3), 113-119.
Huda, C., Salni, & Melki. (2012). Penapisan aktivitas antibakteri dari bakteri yang berasosiasi dengan karang lunak Sarcophyton sp. Maspari Journal, 4(1), 6976.
MacFaddin, J. F. (1980). Biochemical test for identification of medial bacteria. (2th ed.). Baltimore, USA: Waverly Press Inc.
Marcelino, V. R., & Verbruggen, H. (2016). Multi-marker metabarcoding of coral skeletons reveals a rich microbiome and diverse evolutionary origins of endolithic algae. Scientific Reports, 6(1), 1-9.
Massinai, A. (2016). Laju infeksi penyakit Brown Band Disease dan bakteriasosiasi pada karang Acropora sp. di Pulau Barranglompo, Makassar, Sulawesi Selatan. Jurnal Administrasi dan Kebijakan Kesehatan Indonesia, 2(2), 21-26.
Massinai, A., Tahir, A., Jompa, J., & Rantetondok, A. (2017). Bakteri assosiasi di Karang Batu (Skleractinian) yang terinfeksi penyakit tumor (Growth Anomalies) yang berasal dari Pulau Salemo Kabupaten Pangkep. Jurnal Ilmu Kelautan spermonde, 3(1), 7-12.
Neulinger, S. C., Järnegren, J., Ludvigsen, M., Lochte, K., & Dullo, W. C. (2008). Phenotype specific bacterial communities in the cold-water coral Lophelia pertusa (Scleractinia) and their implications for the coral's nutrition, health, and distribution. Applied and Environmental Microbiology, 74(23), 7272-7285.
Nielsen, A. T., Tolker-Nielsen, T., Barken, K. B., & Molin, S. (2000). Role of commensal relationships on the spatial structure of a surface-attached microbial consortium. Environmental microbiology, 2(1), 59-68.
Notoatmodjo, S. (2002). Metodologi Penelitian Kesehatan, Edisi Revisi, Jakarta: Indonesia: PT Rineka Cipta.
Pelczar, M. J. & Chan E. C. S. (2005). Dasar-dasar Mikrobiologi 2. Jakarta, Indonesia: UI-Press, Jakarta.
Prabaswari M. (2018). Identifikasi dan Kelimpahan Bakteri Enterococcus spp. pada Mukus Karang di Perairan Pemuteran, Bali. Skripsi. Denpasar, Indonesia:. Fakultas Kelautan Dan Perikanan, Universitas Udayana.
Rao, D., Webb, J. S., & Kjelleberg, S. (2005). Competitive interactions in mixed species biofilms containing the marine bacterium Pseudoalteromonas tunicata. Applied and environmental microbiology, 71(4), 1729-1736.
Ritchie, K. B. (2006). Regulation of microbial populations by coral surface mucus and mucus-associated bacteria. Marine Ecology Progress Series, 322, 1-14.
Rohwer, F., Seguritan, V., Azam, F., & Knowlton, N (2002). Diversity and distribution of coral-associated bacteria. Marine Ecology Progress Series, 243, 1-10.
Rosenberg, E., Koren, O., Reshef, L., Efrony, R., & Zilber Rosenberg, I. (2007). The role of microorganisms in coral health, disease and evolution. Nature Reviews Microbiology, 5(5), 355-362.
Sabdono A. (2011). Ekobioteknologi strategi untuk konservasi karang rekayasa genetika bakteri karang. Semarang, Indonesia. Diponegoro University Institutional Repository.
Saputri, R. A., Widyorini, N., & Purnomo, P. W. (2016). Identifikasi dan kelimpahan bakteri pada jenis karang
Acropora sp. di reef flat terumbu karang Pulau Panjang Jepara. Saintek Perikanan: Indonesian Journal of Fisheries Science and Technology, 12(1), 35-39.
Setyati, W. A., Habibi, A. S., Subagiyo, S., Ridlo, A., Soenardjo, N., & Pramesti, R. (2016). Skrining dan seleksi bakteri simbion spons penghasil enzim ekstraseluler sebagai agen bioremediasi bahan organik dan biokontrol vibriosis pada budidaya udang. Jurnal Kelautan Tropis, 19(1), 11-20.
Subhan, B., Madduppa, H., Arafat, D., & Soedharma, D (2015). Bisakah Transplantasi Karang Perbaiki Ekosistem Terumbu Karang?. Risalah Kebijakan Pertanian dan Lingkungan, 1(3), 159-164.
Taylor, M. W., Radax, R., Steger, D., & Wagner, M. (2007) Sponge-associated microorganisms evolution,
ecology, and biotechnological potential. Microbiology and Molecular Biology Reviews, 71(2), 295-347.
Wild, C., Huettel, M., Klueter, A., Kremb, S. G., Rasheed, M. Y., & Jørgensen, B. B. (2004). Coral mucus functions as an energy carrier and particle trap in the reef ecosystem. Nature, 428, 66-70.
Zhang, Y. Y., Ling, J., Yang, Q. S., Wang, Y. S., Sun, C. C., Sun, H. Y., Feng, J. B., Jiang, Y. F., Zhang, Y. Z., Wu, M L., & Dong, J. D. (2015). The diversity of coral associated bacteria and the environmental factors affect their community variation. Ecotoxicology, 24, 1467-1477.
© 2022 by the authors; licensee Udayana University, Indonesia. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/3.0/).
J. Mar. Aquat. Sci. 8: 155-162 (2022)
Discussion and feedback