OPTIMASI PCR (Polymerase Chain Reaction) FRAGMEN 724 pb GEN katG MULTI DRUG RESISTANCE TUBERCULOSIS UNTUK MENINGKATKAN PRODUK AMPLIFIKASI
on
Optimasi PCR (Polymerase Chain Reaction) Fragmen 724 pb Gen katG Multi Drug Resistance
Tuberculosis untuk Meningkatkan Produk Amplifikasi (Deniariasih, N.W., Ratnayani, K., Yowani, S.C.)
OPTIMASI PCR (Polymerase Chain Reaction) FRAGMEN 724 pb GEN katG MULTI DRUG RESISTANCE TUBERCULOSIS UNTUK MENINGKATKAN PRODUK
AMPLIFIKASI
Deniariasih, N.W.1, Ratnayani, K.2, Yowani, S.C.1
1Jurusan Farmasi Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Udayana 2Jurusan Kimia Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Udayana
Korespondensi: Ni Wayan Deniariasih
Jurusan Farmasi Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Udayana Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia 80364 Telp/Fax: 0361-703837
Email: deniariasih@gmail.com
ABSTRAK
Deteksi adanya mutasi pada gen katG MDR-TB (Multi Drug Resistance Tuberculosis) yang bertanggung jawab terhadap resistensi isoniazid (INH) dapat dilakukan dengan teknik Polymerase Chain Reaction (PCR). Pada penelitian ini metode PCR digunakan untuk mengamplifikasi fragmen berukuran 724 pb gen katG. Telah dilakukan percobaan pendahuluan, di mana proses PCR berhasil mengamplifikasi fragmen berukuran 724 pb namun masih menghasilkan pita yang sangat tipis yang menunjukkan bahwa proses amplifikasi belum optimal. Oleh sebab itu, penelitian ini bertujuan untuk mengoptimasi proses PCR agar mampu meningkatkan produk amplifikasi sehingga diperoleh pita yang tebal. Produk PCR yang tebal ini cukup memadai untuk proses sekuensing.
Tahap optimasi yang dilakukan dalam proses PCR meliputi penambahan jumlah templat DNA pada formula PCR, variasi suhu annealing, penambahan waktu annealing dan waktu ekstensi. Hasil optimasi menunjukkan penambahan jumlah templat DNA menjadi 1 µL, suhu annealing 56ºC, waktu annealing 1 menit 20 detik, dan waktu ekstensi 2 menit memberikan amplifikasi terbaik karena menghasilkan pita yang tebal dan tidak terjadi mispriming.
Kata Kunci : katG, INH, PCR, optimasi
-
1. PENDAHULUAN
Pada tahun 1995, diperkirakan terdapat 9 juta pasien TB baru dan 3 juta kematian akibat TB di seluruh dunia. Diperkirakan 95% kasus TB dan 98% kematian akibat TB di dunia, terjadi pada negara-negara berkembang (Depkes RI, 2007). Masalah tuberkulosis diperparah dengan adanya kekebalan ganda bakteri Multidrug Resistance (MDR) TB terhadap Obat Antituberkulosis (Lina dkk., 2007). Isoniazid, rifampisin, pirazinamid, etambutol, dan streptomisin merupakan Obat Antituberkulosis (OAT) lini pertama pada pengobatan TB. INH merupakan prodrug yang diaktifkan oleh enzim katalase peroksidase yang dikode oleh gen katG pada M. tuberculosis (Katzung, 2004). Mutasi pada gen katG mengakibatkan M. tuberculosis resisten terhadap INH (Retnoningrum, 2004).
Deteksi adanya mutasi pada gen katG MDR-TB yang bertanggung jawab terhadap resistensi Isoniazid (INH) dapat dilakukan dengan teknik Polymerase Chain Reaction (PCR). PCR merupakan teknik yang digunakan untuk mengamplifikasi sekuens genom spesifik (Arisan et al., 2003). Dalam penelitian ini, metode PCR digunakan untuk mengamplifikasi fragmen berukuran 724 pb gen katG MDR-TB. Pada percobaan pendahuluan proses PCR berhasil mengamplifikasi fragmen berukuran 724 pb namun masih menghasilkan pita yang sangat tipis yang menunjukkan bahwa proses amplifikasi belum optimal. Oleh sebab itu, penelitian ini bertujuan untuk mengoptimasi proses PCR agar mampu meningkatkan produk amplifikasi sehingga diperoleh pita yang tebal.
Tahap optimasi yang dilakukan dalam proses PCR meliputi penambahan jumlah templat DNA pada formula PCR, variasi suhu
annealing, penambahan waktu annealing dan waktu ekstensi.
-
2. BAHAN DAN METODE
-
2.1 Bahan Penelitian
-
Dalam penelitian ini digunakan isolat MDR-TB yang diperoleh dari Instalasi Mikrobiologi Klinik Rumah Sakit Umum Pusat Sanglah Denpasar. Pada tahap isolasi, diperlukan larutan pelisis (GuSCN, Tris-HCl, EDTA dan Triton X-100), suspensi diatom,, etanol 70%, aseton, dan RNase free water. Bahan yang digunakan dalam tahap amplifikasi adalah sepasang primer oligonukleotida, GoTaq® Green Master Mix. Bahan yang digunakan untuk deteksi produk PCR dengan elektroforesis, yaitu gel agarosa 1,5%, TBE (Tris-Boric-EDTA), serta etidium bromida.
-
2.2 Alat Penelitian
Alat yang digunakan meliputi alat-alat gelas yang biasa digunakan dalam laboratorium analisis, vortex, inkubator, freezer, shaker rotator, biological safety cabinet class II, satu set pipet mikro (0,1-10 µL, 10-100 µL, 20-100 µL, 100-1000 µL), tip (10, 20, 100, 200 µL), tabung mikro 1,5 mL, Thermalcycler PCR (merk Veriti), seperangkat alat elektroforesis, serta UV transilluminator (merk Gel Doc BioRad).
-
2.3 Prosedur Penelitian
-
2.3.1 Isolasi DNA dari Isolat MDR-TB
-
Isolasi DNA dilakukan dengan menggunakan metode Boom. Sel bakteri dilisiskan dengan menggunakan larutan bufer lisis yang terdiri dari GuSCN, Tris-HCl, EDTA, dan Triton X-100. Sel yang telah dilisiskan dipresipitasi dengan etanol 70% dan aseton serta disentrifugasi pada kecepatan tinggi. Pelet yang diperoleh dikeringkan dalam waterbath dan ditambahkan RNase free water. Isolat DNA yang diperoleh siap digunakan sebagai templat untuk proses PCR. Seluruh prosedur isolasi DNA dilakukan dalam biological safety cabinet class II (Boom et al., 1990).
-
2.3.2 Amplifikasi Gen katG MDR-TB
Sepasang primer oligonukleotida gen katG yang telah didesain sebelumnya, yaitu KG24F (5’-GAAGTACGGCAAGAAGCTCTC-3’) dan KG60R (5’-CGTGATCCGCTCATAGATCG-3’) digunakan dalam proses PCR. Formulasi
PCR dilakukan dengan mencampurkan H2O, GoTaq® Green Master Mix, primer oligonukleotida, dan templat DNA.
Amplifikasi dilakukan dengan tahap denaturasi awal pada suhu 95ºC selama 15 menit diikuti 40 siklus terdiri dari denaturasi pada suhu 95ºC selama 1 menit, annealing, dan ekstensi pada suhu 72ºC selama 2 menit, serta ekstensi akhir pada suhu 72ºC selama 10 menit. Optimasi suhu annealing dilakukan pada beberapa suhu berdasarkan suhu yang dianjurkan dari program desain primer.
-
2.3.3 Deteksi Produk PCR
Lempeng Produk PCR dideteksi dengan elektroforesis gel agarosa 1,5% b/v (0,52 g agarosa dalam 35 mL buffer TBE 1 kali yang ditambahkan 2,8 µL etidium bromida 10 mg/mL). Larutan agarosa dituangkan ke dalam tray elektroforesis dan dibiarkan mengeras. Setelah mengeras, gel agarosa dipasang dalam chamber elektroforesis dan sisir pada gel dicabut, larutan TBE dituang sampai melebihi permukaan gel. Selanjutnya, 3 µL sampel hasil PCR dimasukkan ke dalam sumur yang terbentuk dari sisir. Kemudian dielektroforesis pada tegangan 65 volt selama 45 menit. Hasil elektroforesis kemudian divisualisasi pada UV transilluminator.
-
3. HASIL
Hasil kondisi optimasi deteksi gen katG isolat MDR-TB dengan teknik PCR dan elektroforesis gel agarosa 1,5% pada gradien suhu annealing (48ºC, 50 ºC, 52 ºC, 54 ºC, 56 ºC, dan 58ºC), waktu annealing 1 menit, waktu ekstensi 1 menit, serta volume DNA sampel 0,5 µL pada formula PCR dapat ditunjukkan oleh Gambar A.1. Kondisi tersebut memperlihatkan adanya pita yang sangat tipis pada suhu 48ºC dan 50ºC. Pada suhu 52ºC, 54ºC, 56ºC, dan 58ºC tidak menghasilkan produk amplifikasi. Berdasarkan hasil optimasi tersebut maka dilakukan optimasi kembali pada suhu annealing yang sama dengan penambahan volume DNA sampel menjadi 1 µL pada formula PCR.
Hasil kondisi optimasi kedua yang ditunjukkan oleh Gambar A.2 memperlihatkan adanya pita pada semua suhu, kecuali pada suhu 58ºC. Dari enam gradien suhu, dilakukan pemilihan suhu annealing optimum yang berdekatan dengan Tm primer. Berdasarkan
program Clone Manager Suite 6, Tm primer disebutkan pada suhu 58ºC namun pada suhu tersebut tidak diperoleh pita DNA sehingga suhu 56ºC digunakan sebagai suhu annealing.
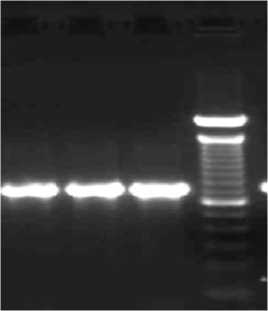
Untuk meningkatkan produk amplifikasi, dilakukan pula penambahan waktu annealing dan waktu ekstensi dalam proses PCR. Dimana waktu awal annealing dan waktu ekstensi yang digunakan yaitu 1 menit. Dalam penelitian waktu annealing 1 menit 20 detik dan waktu ekstensi 2 menit memberikan pita yang lebih tebal yang dapat ditunjukkan oleh Gambar A.3. Pita tersebut dapat digunakan sebagai templat untuk proses sekuensing.
-
4. PEMBAHASAN
Berdasarkan hasil kondisi optimasi deteksi gen katG isolat MDR-TB dengan teknik PCR dan elektroforesis gel agarosa 1,5% pada gradien suhu annealing (48ºC, 50ºC, 52ºC, 54ºC, 56ºC, dan 58ºC), waktu annealing 1 menit, waktu ekstensi 1 menit, serta volume DNA sampel 0,5 µL pada formula PCR yang ditunjukkan oleh Gambar A.1 menghasilkan pita yang sangat tipis hanya pada suhu 48ºC dan 50ºC. Hal tersebut kemungkinan disebabkan karena konsentrasi templat DNA yang kurang dari 1 ng. Konsentrasi templat DNA 1 ng merupakan konsentrasi minimal yang dapat digunakan dalam proses PCR (Bartlett et al., 2003) sehingga dilakukan penambahan volume DNA hasil ekstraksi (sampel) pada formula PCR (Clontech, 1999).
Berdasarkan hasil kondisi optimasi tersebut maka dilakukan optimasi kembali pada suhu annealing yang sama dengan penambahan volume DNA sampel menjadi 1 µL pada formula PCR. Hasil kondisi optimasi kedua yang ditunjukkan oleh Gambar A.2 memperlihatkan adanya pita pada semua suhu, kecuali pada suhu 58ºC. Adanya pita pada suhu 48, 50, 52, 54, dan 56 °C menggambarkan bahwa penambahan volume DNA hasil ekstraksi mampu meningkatkan produk amplifikasi.
Dari lima gradien suhu optimasi yang menghasilkan pita, dilakukan pemilihan suhu annealing optimum yang berdekatan dengan Tm primer. Berdasarkan program Clone Manager 6, Tm primer disebutkan pada suhu 58ºC namun pada suhu tersebut tidak diperoleh pita DNA sehingga suhu 56ºC digunakan sebagai suhu annealing. Selain alasan tersebut,
pada suhu annealing 56ºC tidak menunjukkan adanya mispriming dan berdasarkan penelitian, Tm primer berkisar antara 50-65 ºC (Abd-Elsalam, 2003; Borah, 2011; Handoyo dan Ari, 2000).
Untuk meningkatkan produk amplifikasi, dilakukan pula penambahan waktu annealing dan ekstensi dalam proses PCR. Pemilihan waktu yang optimum tergantung pada templat DNA yang digunakan. Penentuan waktu untuk proses annealing berkaitan dengan panjang primer sedangkan pemilihan waktu ekstensi primer tergantung pada panjang fragmen DNA yang akan diamplifikasi (Handoyo dan Ari, 2000). Waktu awal annealing dan ekstensi yang digunakan dalam penelitian, yaitu 1 menit, namun setelah dilakukan optimasi kembali, waktu annealing 1 menit 20 detik dan waktu ekstensi 2 menit memberikan pita yang lebih tebal Pita tersebut dapat digunakan sebagai templat untuk proses sekuensing yang berguna untuk mengetahui jenis mutasi yang terjadi pada fragmen 724 pb gen katG isolat MDR-TB.
-
5. KESIMPULAN
Berdasarkan penelitian yang telah dilakukan, hasil optimasi gen katG MDR-TB menunjukkan penambahan jumlah templat DNA menjadi 1 µL, suhu annealing 56ºC, waktu annealing 1 menit 20 detik, dan waktu ekstensi 2 menit memberikan amplifikasi terbaik karena menghasilkan pita yang tebal dan tidak terjadi mispriming yang dapat digunakan sebagai templat untuk proses sekuensing.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada teknisi laboratorium Mikrobiologi RSUP Sanglah dan teknisi laboratorium Biologi Molekuler FK UNUD atas bantuan yang telah diberikan sehingga penelitian ini dapat terlaksana dengan baik.
DAFTAR PUSTAKA
Abd-Elsalam, K.A. 2003. Bioinformatic Tools and Guideline for PCR Primer Design. African Journal of Biotechnology. pp. 91-95.
Arisan, S., N-Cem S., Omer O.C., Erbil E. 2003. Polymerase Chain Reaction is a Good Diagnostic Tool for Mycobacterium tuberculosis in Urine
Samples. Journal of Cell and Molecular Biology 2. pp. 99-103.
Bartlett, J.M.S., Stirling D. 2003. PCR Protocols Second Edition. Methods in Molecular Biology. pp. 90-95.
Boom, R., Sol C.J.A., Salimans M.M.M., Jansen C.L. 1990. Rapid and Simple Method for Purification of Nucleic Acid. J. Clin Microbiol. 495-503.
Borah, P. 2011. Primer Designing for PCR. Sci. Vis. Vol. 11 (3). pp: 134-136.
Clontech. 1999. Advantage Genomic PCR User Manual. Clontech Laboratories, Inc.
Depkes RI. 2007. Pedoman Nasional Penanggulangan Tuberkulosis Edisi 2 Cetakan Pertama. Departemen Kesehatan Republik Indonesia.
Handoyo, D. dan Ari R. 2000. Prinsip Umum dan Pelaksanaan Polymerase Chain Reaction (PCR). Unitas. 9:17-29.
Katzung, B.G. 2004. Farmakologi Dasar dan Klinik. Jakarta: Salemba Empat.
Lina, Maria, Budiman Bela, Mukh Syaifudin. 2007. Deteksi Gen Target INH pada DNA Sputum Basil Tahan Asam Positif dengan Teknik Polymerase Chain
Reaction. Maj. Kedokt. Indon. 8:245250.
Retnoningrum, S.D. dan Roga F.K. 2004. Mekanisme Tingkat Molekul Resistensi terhadap Beberapa Obat pada Mycobacterium tuberculosis. Available: “http://acta.fa.itb.ac.id/pdf_dir/issue_29_ 3_2.pdf” [2 Aug 2013]
2072 pb
1500 pb
600 pb
100 pb
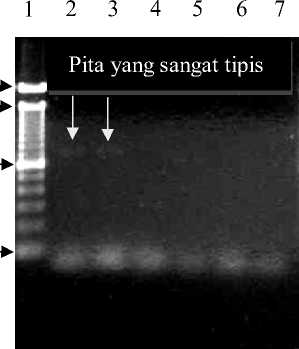
Gambar A.1 Elektroforegram gen katG isolat MDR-TB dengan gradien suhu annealing
Keterangan gambar: 1. 100 bp DNA ladder; 2. Pita DNA pada suhu 48ºC; 3. Pita DNA pada suhu 50ºC; 4. Pita DNA pada suhu 52ºC; 5. Pita DNA pada suhu 54ºC; 6. Pita DNA pada suhu 56ºC; 7. Pita DNA pada suhu 58ºC dengan konsentrasi DNA sampel 0,5 µL dalam formula PCR
1 2 3 4 5 6 7
1500 pb
600 pb
100 pb
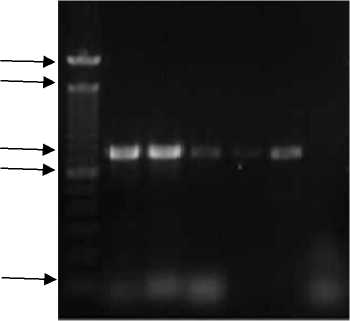
Gambar A.2 Elektroforegram gen katG isolat MDR TB dengan gradien suhu annealing
Keterangan gambar: 1. 100 bp DNA ladder; 2. Pita DNA pada suhu 48ºC; 3. Pita DNA pada suhu 50ºC; 4. Pita DNA pada suhu 52ºC; 5. Pita DNA pada suhu 54ºC; 6. Pita DNA pada suhu 56ºC; 7. Pita DNA pada suhu 58ºC konsentrasi DNA sampel 1 µL dalam formula PCR
1 2 3 4
2072 pb
1500 pb
600 pb
100 pb
Gambar A.3Elektroforegram gen katG isolat MDR-TB pada suhu annealing 56ºC dengan waktu annealing 1 menit 20 detik dan waktu ekstensi 2 menit.
Keterangan gambar: 1, 2, dan 3. Isolat MDR-TB; 4. 100 bp DNA ladder
i Jurnalfarmasiudayana
jurusan Farmasi-Fakultas Mipa-Liniversitas udayana
SUKir Jimsaran - bau * IUJS1) 7MB37 ∙tTOiβ! Liimtfa r∣W^a⅜i⅝⅛⅛l∣ι⅜iUt∣m
SikAipfknyataam
PERSmiJUAH PEMBIMBING
Yang tκπa1ιd2taπgajι di bawah ini, menyatakan bahwa
Aitikel IkngunjuduL
Disusun ⅛h
NIM
Email mahasiswa
: Gplmn PCR f A⅛λ*⅛? φπ ⅛λ⅛γ ) ^bm w ^ ⅛ι ⅛⅛ M ⅝ ftw⅛πte 7⅛r⅛ 4q⅛ ^⅛⅛ ¾⅛lk Λ*,f⅛⅛l
At NBysh Ctinsoaiik DjJDftffiSOiE ⅛⅛t0fl^⅛<wf. OflS
Tdah kami Srtujui Liiuk dipublikasi pada ' Jurnal Fafiiuas,! LMayatia".
Demikian surat pernyataan ini kami bual agar dapat dipergunakan Bcbagsimana IMatitiya
HiLkitJtnbaTjjn ⅛ ^fpLemtwr ι 2⅛* E⅛mbimbing Tligit Akhu
⅛. ⅛⅜∣ fl⅜ ⅛⅝ '⅝⅝τlpt∣.∣⅛.i∣∣.1⅛j Nip ipioiflisdTaiirai r
116
Discussion and feedback