Pengembangan Metode Griess dengan Reduktor Logam Seng Berlapis Tembaga untuk Penetapan Kadar Metabolit Oksida Nitrat dalam Serum
on
Sari, dkk
DOI : https://doi.org/10.24843/JFU.2021.v10.i01.p09
pISSN: 2301-7716; eISSN: 2622-4607
Jurnal Farmasi Udayana, Vol 10, No 1, Tahun 2021, 79 - 85
Pengembangan Metode Griess Dengan Reduktor Logam Seng Berlapis Tembaga Untuk Penetapan Kadar Metabolit Oksida Nitrat Dalam Serum
Sari PMNA1,2, Warditiani NK1, Astuti NMW1, Wirasuta IMAG1,2 1Program Studi Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana, Badung, Bali, Indonesia 80361
2UPT. Laboratorium Forensik Sains dan Kriminologi Universitas Udayana, Badung, Bali
E-mail: nova.armita@unud.ac.id
Riwayat artikel: Dikirim: 22/10/2020; Diterima: 18/11/2020, Diterbitkan: 1/07/2021
ABSTRACT
The recent research concerned in method development for determination of nitric oxide metabolites in serum using spectrophotometry visible based on Griess reaction. The reduction of nitrate to nitrite was performed using copper coated zinc. The method was optimized and validated. The determination of total nitrite in samples was started with deproteinization using ZnSO4 and NaOH. The supernatants were reducted using copper coated zinc, reacted with diazotization and coupling reagents, then incubated. The absorbance was measured using spectrophotometer visible. The optimum reductant mass of copper coated zinc is 1.5 g with reduction time 10 minutes, coefficient variation ≤ 5%. Linierity of analytical method gives a coefficient correlation, r > 0.995. Relative procedural standard deviation was ≤ 5%, precision ≤ 15%, and recovery 85-115%.
Keywords: Griess, nitric oxide, nitrate, nitrite, reductor, serum
ABSTRAK
Telah dilakukan pengembangan metode dan penetapan kadar metabolit oksida nitrat dalam serum dengan metode spektrofotometri sinar tampak. Pengembangan metode pengukuran kadar total nitrit dalam serum dilakukan dengan reaksi Griess yang diawali dengan reduksi nitrat menjadi nitrit dengan reduktor seng lapis tembaga. Metode dioptimasi dan divalidasi. Pengujian sampel diawali dengan deproteinisasi serum menggunakan ZnSO4 dan NaOH, kemudian supernatan direduksi dengan granul seng lapis tembaga,direaksikan dengan reagen pendiazo dan pengkopling, absorbansinya diukur dengan menggunakan spektrofotometer sinar tampak. Data yang dihasilkan diolah secara statitistik. Massa reduktor granul seng lapis tembaga yang optimal adalah 1,5 g dengan waktu reduksi 10 menit, koefisien variansi ≤ 5%. Koefisien korelasi > 0,995 dengan Vx0 ≤ 5%, keseksamaan ≤ 15%, dan kecermatan 85-115%.
Kata Kunci: Griess, nitrat, nitrit, oksida nitrat, reduktor, serum
Nitric Oxide atau Oksida Nitrat (NO) merupakan signaling molecule yang bersifat permeabel terhadap membran sel yang terlibat dalam berbagai proses biologi melalui kemampuannya dalam memodifikasi protein, lemak dan DNA serta mempengaruhi fungsi dan
imunogenesitasnya (Oates, 2010). NO bertindak sebagai intermediet reaktif yang dapat menginduksi autoimunitas selular dan berkontribusi dalam respon imun bawaan yang berkepanjangan, serta dalam kerusakan organ pada penderita Systemic Lupus Erithematosus /SLE. Sementara itu, beberapa studi pada pasien reumatoid artritis (RA)
didokumentasikan mengalami kenaikan sintesis NO endogen yang mengindikasikan bahwa produksi berlebih NO memiliki peranan yang penting dalam patogenesis RA. Peradangan sendi pada RA merupakan sumber NO yang paling mendominasi. Sel T pada pasien RA akan menghasilkan NO 2,5 kali lebih banyak dibandingkan dengan orang normal (Nagy et al, 2010).
Silver (2011) menyatakan bahwa pada kondisi peradangan kronis cenderung terlihat kadar NO yang tinggi, seperti halnya pada keadaan terjadinya sepsis. Tahap awal terjadinya sepsis dikenal sebagai sindrom respons inflamasi sistemik (SIRS). SIRS menunjukkan berbagai macam gejala, yang mana banyak di antaranya tidak bersifat spesifik, sehingga SIRS sulit untuk didiagnosis. Deteksi dini sepsis dapat meningkatkan outcome pasien dengan mengarahkan pemberian terapi antibiotik atau terapi resusitasi cairan.
Sementara itu pada pasien dengan Penyakit Paru Obstruktif Kronis (PPOK), tingkat fractional exhaled nitric oxide (FeNO) dapat berhubungan dengan kebiasaan merokok dan tingkat keparahan penyakit, yang juga berbanding lurus dengan dengan berbagai parameter fungsional sistem pernapasan. FeNO juga meningkat pada pasien dengan eksaserbasi PPOK. Pengukuran FeNO mungkin berguna dalam pengaturan klinis untuk mengidentifikasi tingkat peradangan saluran napas, dan dalam kaitannya dengan penyakit penyerta, seperti hipertensi arteri paru dan penyakit kardiovaskular (Malerba et al, 2014). Dengan demikian dapat dikatakan bahwa NO memiliki peranan yang sangat penting dalam berbagai patogenitas penyakit dan dapat digunakan dalam memprediksi progresifitas dan status suatu penyakit.
Metabolit NO yang jumlahnya paling banyak dan paling stabil adalah nitrit dan nitrat, oleh karena itu paling sering dianalisis
secara kuantitatif (Tatsch et al, 2010). Nitrit dan nitrat digunakan sebagai indeks dari produksi NO secara menyeluruh. Metode yang paling sering dan paling umum digunakan dalam penetapan nitrit adalah dengan reaksi Griess, bahkan sudah banyak kit yang beredar di pasaran yang didasarkan pada reaksi Griess hanya saja harganya relatif mahal dan reduktor yang digunakan masih memiliki keterbatasan, antara lain kestabilan, biaya, massa dan waktu reduksi yang lama.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini meliputi granul cadmium (Cd) (Analar), granul seng (Zn) (Analar), H2SO4 (Merck), glisin (Sigma), NaOH (Merck), sulfanilamid (Merck), HCl (Merck), n-naftiletilendiamin (NED) dihidroklorida (Fluka), standar NaNO2 (Merck), ZnSO4 (Merck), CuSO4 (Merck) dan air bebas ion.
Alat yang digunakan dalam penelitian meliputi alat-alat gelas yang umum digunakan dalam laboratorium kimia klinik, neraca analitik (Mettler Toledo), alat sentrifugasi (Sigma 203), lemari es, pH meter (Mettler Toledo), shaker (Super Mixer), tabung vakutainer dan instrumen spektrofotometer UV-Visible (Hitachi U 2900).
Metode
1. Penyiapan Granul Kadmium dan Seng
Granul kadmium dan seng dipotong menjadi serpihan yang lebih kecil. Disimpan dalam larutan H2SO4 0,1 M. Granul ini stabil untuk disimpan selama 9 bulan.
Sebanyak 0,75 g glisin dalam labu ukur 50 mL dilarutkakn dengan sedikit air, lalu digenapkan sampai dengan 50 mL kemudian
diatur pH-nya dengan larutan NaOH 2 M. Dibuat segar.
Pereaksi diazotasi adalah larutan sulfanilamid dalam HCl 3 M. Sebanyak 0,5 g sulfanilamid dalam labu ukur 50 mL dilarutkan dengan sedikit HCl 3 M hangat, lalu digenapkan sampai dengan 50 mL. Disimpan pada suhu 0o-8o Penyiapan Pereaksi Kopling
Sebanyak 10 mg n-naftiletilendiamin dalam labu ukur 50 mL dilarutkan dengan sedikit air, lalu digenapkan sampai dengan 50 mL. Disimpan pada suhu 0o-8o C.
Sebanyak 0,5-1,5 g granul dicuci tiga kali menggunakan air. Kocok granul selama 2 menit dalam larutan CuSO4 5 mM dalam dapar glisin. Keringkan, kemudian cuci granul tiga kali dengan dapar glisin. Setelah digunakan, granul dicuci dan disimpan dalam larutan H2SO4 0,1 M. Granul dapat digunakan lagi dengan mengulang prosedur deposit dengan CuSO4.
Sebanyak 250 µL larutan simulasi air bebas ion dengan konsentrasi nitrit 50 µM dipipet ke dalam tabung reaksi, ditambahkan 1 mL air bebas ion. Kemudian 0,5 mL larutan dipindahkan ke tabung reaksi lainnya. Kemudian ditambahkan reduktor berupa granul Zn atau granul Cd yang sudah diaktivasi. Massa reduktor Zn-Cu/Cd-Cu divariasikan dari 0,5-1,5 gram. Sampel direduksi dengan Zn-Cu selama 10 menit dan dengan Cd-Cu selama 90 menit. Kemudian dipindahkan ke dalam tabung, direaksikan dan diinkubasi pada kondisi optimumnya. Kemudian diukur absorbansinya. Optimasi untuk waktu reduksi dilakukan dengan memilih salah satu reduktor yang memberikan hasil reduksi yang lebih baik
dengan massa yang optimum. Sampel direduksi dengan rentang waktu 5-90 menit.
Validasi metode dilakukan terhadap nitrit dan nitrat dalam air bebas ion, serum kontrol dan serum. Validasi terdiri atas penetapan linieritas, rentang, keseksamaan dan kecermatan menggunakan metode yang telah dioptimasi. Penetapan linieritas dan rentang dibuat dengan konsentrasi 10-100 µM.
Sebanyak 250 µL larutan simulasi air bebas ion yang mengandung 80% (10µM nitrit dan 30 µM nitrat), 100% (15 µM nitrit dan 35 µM nitrat) dan 120% analit (20 µM nitrit dan 40 µM nitrat) dimasukkan ke dalam tabung reaksi. Masing-masing level dibuat empat tabung, ke dalam setiap tabung ditambahkan 1 mL air bebas ion. Kemudian dipindahkan, dan direduksi dengan 1,5 granul Zn-Cu selama 10 menit. Ke
dalamnya kemudian ditambahkan baku
tinambah dengan konsentrasi 10-60 µM. Sampel selanjutnya direaksikan dan
diinkubasi selama 30-40 menit. Kemudian diukur absorbansinya. Absorbansi yang
diperoleh kemudian diekstrapolasi melewati sumbu y = 0. Kadar sampel dapat ditentukan dan dihitung % perolehan kembalinya.
-
8. Penentuan Kadar Total Nitrit dalam Serum Kontrol dengan Metode Baku Tinambah
Sebanyak 250 µL larutan simulasi serum kontrol yang mengandung 80% (10µM nitrit dan 30 µM nitrat), 100% (15 µM nitrit dan 35 µM nitrat) dan 120% analit (20 µM nitrit dan 40 µM nitrat) dimasukkan ke dalam tabung sentrifuga. Masing-masing level dibuat empat tabung. Selanjutnya diproteinisasi dengan 0,5 mL ZnSO4 dan 0,5 mLNaOH dan disentrifugasi dengan kecepatan 5000 rpm selama 10 menit. Kemudian direduksi dengan 1,5 granul Zn-Cu selama 10 menit. Ke dalamnya kemudian
ditambahkan baku tinambah dengan konsentrasi 10-60 µM. Sampel selanjutnya direaksikan dan diinkubasi selama 30-40 menit. Kemudian diukur absorbansinya. Absorbansi yang diperoleh kemudian diekstrapolasi melewati sumbu y = 0. Kadar sampel dapat ditentukan dan dihitung % perolehan kembalinya.
Penentuan kadar NO di dalam matriks biologi dilakukan secara tidak langsung melalui pengukuran metabolit utamanya berupa nitrit dan nitrat. Nitrit bersifat kurang
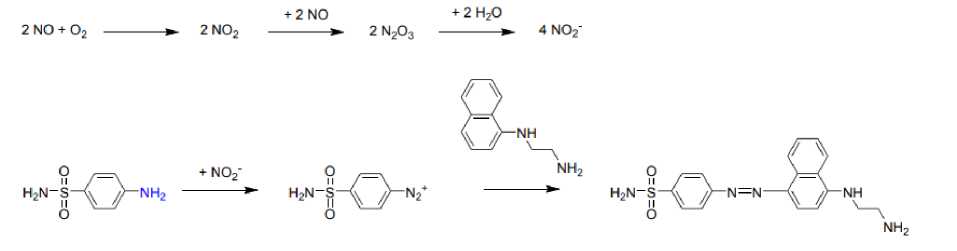
Gambar 1. Reaksi Diazotasi dan Kopling (Schatzschneider, 2017)
stabil dan di dalam darah akan cepat berubah menjadi nitrat. Pada penelitian ini, reaksi yang digunakan adalah reaksi Griess, yaitu untuk menentukan kadar nitrit, dengan demikian nitrat yang dihasilkan harus terlebih dahulu direduksi menjadi nitrit. Metode Griess didasarkan pada reaksi nitrit yang dihasilkan oleh autoksidasi NO dengan sulfanilamida menghasilkan garam diazonium, yang selanjutnya bereaksi dengan
n-1-naphthylethylenediamine
menjadi
pewarna azo yang dapat diukur secara spektroskopi ultraviolet/visible (Schatzschneider, 2017).
Hasil optimasi reduktor dapat dilihat pada tabel 1 di bawah berikut.
Tabel 1. Optimasi Massa Reduktor
Massa % Perolehan Kembali dengan granul Cd % Perolehan Kembali dengan granul Zn lapis
granul lapis Cu (n = 6) Cu (n = 6)
|
(gram) |
Rata-rata |
SD |
KV |
Rata-rata |
SD |
KV |
|
0,5 |
28,874 |
12,586 |
43,591 |
20,966 |
1,7835 |
8,507 |
|
1 |
73,414 |
19,373 |
26,389 |
41,490 |
10,364 |
24,979 |
|
1,5 |
102,966 |
12,828 |
12,459 |
93,793 |
2,883 |
3,074 |
Keterangan: SD: standar deviasi; KV: koefisien variansi; Cd: kadmium; Zn: seng; Cu: tembaga
Validasi metode dilakukan pada beberapa parameter yaitu penentuan rentang dan linieritas, batas deteksi dan kuantitasi,
keterulangan nitrit intra dan antar hari, keterulangan pengukuran nitrit intra dan antar hari, serta penentuan akurasi total nitrit.
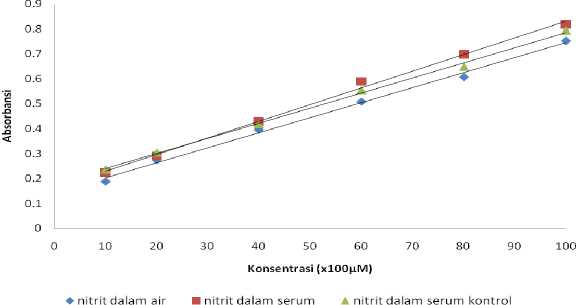
Gambar 2. Kurva Kalibrasi Nitrit
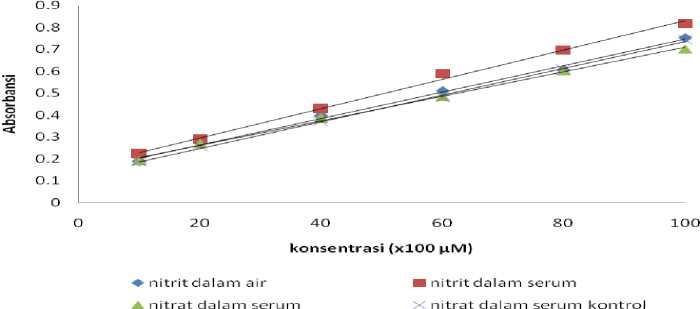
Gambar 3. Kurva Kalibrasi Nitrat
Tabel 2. Linieritas, Batas Deteksi dan Kuantitasi Nitrit
|
NITRIT |
NITRAT | ||||
|
Parameter |
Air bebas ion |
Serum kontrol |
Serum |
Nitrat dalam serum |
Nitrat dalam serum kontrol |
|
Persamaan |
y = 0,601.10-2 x + 0,143 |
y = 0,578.10-2x + 0,193 |
y = 0,669.10-2 x + 0,161 |
y = 0,558.10-2 x + 0,151 |
y = 0,608.10-2x + 0,126 |
|
r |
0,998 |
0,997 |
0,998 |
0,998 |
0,999 |
|
LOD (µM) |
6,437 |
5,921 |
6,909 |
5,808 |
4,881 |
|
LOQ (µM) |
21,457 |
19,738 |
23,029 |
19,361 |
16,270 |
|
Vx0 |
4,153 |
3,820 |
4,970 |
3,747 |
3,149 |
Keterangan: LOD = limit of detection; LOQ = limit of quantitation; Vxo = variansi; µM = mikro molar
Tabel 3. Keterulangan Nitrit Intra dan Antar Hari
|
Pengulangan |
Intra hari |
Antar hari | ||||
|
80% |
100% |
120% |
80% |
100% |
120% | |
|
Rata-rata |
0,247 |
0,314 |
0,360 |
0,246 |
0,313 |
0,358 |
|
Standar deviasi |
0,004 |
0,004 |
0,007 |
0,001 |
0,004 |
0,006 |
|
Koefisien variansi |
1,683 |
1,388 |
1,953 |
0,406 |
1,332 |
1,536 |
Tabel 4. Akurasi Total Nitrit
|
Air bebas ion |
Serum kontrol | |||||
|
Kadar |
Rata-Rata (%) (n = 3) |
Standar deviasi |
Koefisien variansi (%) |
Rata-Rata (%) (n = 3) |
Standar deviasi |
Koefisien variansi (%) |
|
80% (40µM) |
110,28 |
3,99 |
3,62 |
97,10 |
1,10 |
1,13 |
|
100% (50µM) |
113,11 |
1,37 |
1,22 |
91,27 |
0,87 |
0,95 |
|
120% (60µM) |
106,41 |
2,18 |
2,05 |
106,45 |
2,71 |
2,55 |
Nitrit terlebih dahulu direaksikan dengan pereaksi diazotasi, yang dalam keadaan asam akan menghasilkan garam diazonium. Intermediet ini kemudian direaksikan kembali dengan pereaksi kopling berupa n-naftiletilendiamin untuk membentuk senyawa azo yang berwarna keunguan. Dari hasil pengukuran didapatkan bahwa panjang gelombang maksimum larutan simulasi nitrit adalah 540 nm. Adapun reaksi yang terjadi dapat dilihat pada Gambar 1 di bawah berikut.
Metode standar untuk reduksi nitrat menjadi nitrit adalah dengan menggunakan enzim nitrat reduktase dan kadmium lapis tembaga. Pada metode ini reduksi dilakukan dengan 2,5-3 gram granul kadmium dengan waktu reduksi 75-90 menit. Batas deteksi dari metode ini adalah 2-250µM dengan koefisien variansi 4,7-9%. Pada metode ini reduksi nitrat dilakukan dengan menggunakan logam seng yang dilapisi tembaga dan dibandingkan dengan kadmium lapis tembaga. Reduksi nitrat menjadi nitrit dengan logam sangat tergantung pada massa dan luas permukaan logam yang digunakan.
Logam seng bersifat lebih reaktif dari kadmium untuk itu pada metode ini dicoba untuk menggunakan logam seng dengan massa yang lebih sedikit (0,5-1,5 g) dengan ukuran granul yang lebih besar (0,2-0,4 g), yang kemudian dibandingan dengan metode kadmium lapis tembaga. Tabel 1 menunjukkan bahwa reduksi nitrat dengan
menggunakan seng lapis tembaga pada massa 1,5 gram memiliki keterulangan yang lebih baik dan % perolehan kembali yaitu > 90%.
Penentuan linieritas, rentang, batas deteksi dan batas kuantitasi nitrit dan nitrat dilakukan menggunakan larutan simulasi air bebas ion, dalam serum kontrol dan dalam serum dengan rentang konsentrasi 10-100 µM. Pada rentang konsentrasi tersebut, nitrit dan nitrat memiliki linieritas yang baik, di mana pada ketiga larutan masing-masing persamaan regresi memberikan koefisien korelasi yang lebih besar dari 0,995.
Pada gambar 2 di atas menunjukkan bahwa dalam ketiga larutan, nitrit memiliki profil kurva kalibrasi yang hampir sama. Besar koefisien variansi regresi nitrit yang diperoleh sebesar 4,15%; 3,82% dan 4,97% dalam air bebas ion, serum kontrol dan dalam serum. Sementara itu untuk nitrat Besar koefisien variansi regresi yang diperoleh sebesar 3,75% dan 3,15 dalam serum dan serum kontrol. Nilai ini lebih rendah dari yang dipersyaratkan yaitu ≤ 5%. Adapun batas deteksi dan kuantitasi metode ini lebih rendah dari kadar nitrit total pasien normal.
Keterulangan metode dilakukan pada tiga level dengan tiga kali pengulangan yang masing-masing dilakukan intra dan antar hari. Hasil yang diperoleh menunjukkan bahwa metode yang digunakan memiliki keterulangan yang baik, yang mana pada
masing-masing pengujian besarnya nilai koefisien variansi adalah ≤ 15%.
Penentuan kecermatan (akurasi) dilakukan dalam air bebas ion dan dalam serum kontrol dengan metode baku tinambah. Penentuan kecermatan ini dilakukan pada 3 level masing-masing dengan tiga kali pengulangan.
Penentuan akurasi dilakukan pada dua jenis sampel simulasi, yaitu pada air bebas ion dan pada serum control. Masing-masing sampel simulasi dibuat dalam tiga level konsentrasi yaitu 80%, 100% dan 120%.
Hasil yang diperoleh adalah metode yang dikembangkan memenuhi ketentuan kecermatan yaitu pada rentang 85-115%.
Massa reduktor granul seng lapis tembaga yang optimal adalah 1,5 g dengan waktu reduksi 10 menit, koefisien variansi ≤ 5%. Koefisien korelasi > 0,995 dengan Vx0 ≤ 5%, keseksamaan ≤ 15%, dan kecermatan 85-115%.
Malerba, M., Radaeli, A., Olivini, A., Damiani, G., Ragnoli, B., Montuschi, P., Ricciardolo, F.L.M. (2014). Exhaled Nitric Oxide as a Biomarker in COPD and Related Comorbidities. Hindawi Publishing Corporation
BioMed Research International,
Volume 2014.
http://dx.doi.org/10.1155/2014/271918.
Nagy, G., Koncz, A., Telarico, T.,
Fernandez, D., Ersek, B., Buzas E., Perl, A. (2010). Central Role of Nitric Oxide in The Pathogenesis of Rheumatoid Arthritis and Systemic Lupus Erythematosus. Arthritis Research & Therapy, 12:210.
Oates, J.C. (2010). The Biology Of Reactive Intermediates In Systemic Lupus Erythematosus. National Institute of Health, Autoimmunity, 43(1): 56–63. doi:10.3109/08916930903374683.
Schatzschneider, U. (2017). Inorganic and Organometallic Transition Metal Complexes with Biological Molecules and Living Cells. Elsevier Inc. http://dx.doi.org/10.1016/B978-0-12-803814-7.00006-X.
Silver, J.H. 2011, Nitrite and Nitric Oxide as Potential Diagnostic Markers in Acute Vascular Diseases. Journal of Neurology & Neurophysiology. DOI: 10.4172/2155-9562.S1-005
Tatsch, E., Bochi, G.V. , da Silva Pereira, R., Kober, H., Agertt, V.A., de Campos, M.M.A., Gomes, P., Duarte, M.M.M.F., Moresco, R.N., 2011, A Simple and Inexpensive Automated Technique for Measurement of Serum Nitrite/Nitrate, Clinical Biochemistry, 44, 348-350.
85
Discussion and feedback