PENGGUNAAN MOLEKUL CETAKAN ATENOLOL DAN MONOMER AKRILAMID PADA SINTESIS MOLECULAR IMPRINTING POLYMER
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 16 (1), JANUARI 2022
DOI: https://doi.org/10.24843/JCHEM.2022.v16.i01.p02
p-ISSN 1907-9850
e-ISSN 2599-2740
PENGGUNAAN MOLEKUL CETAKAN ATENOLOL DAN MONOMER AKRILAMID PADA SINTESIS MOLECULAR IMPRINTING POLYMER
U. Mardiana1 dan S. Nuraisyah2
1Program Studi DIII Teknologi Laboratorium Medis, Sekolah Tinggi Ilmu Kesehatan Bakti Tunas Husada, Tasikmalaya, Indonesia
2Program Studi S1 Farmasi, Sekolah Tinggi Ilmu Kesehatan Bakti Tunas Husada, Tasikmalaya,
Indonesia
*Email: ummy.mardiana@stikes-bth.ac.id
ABSTRAK
Dalam beberapa kompetisi cabang olahraga, obat golongan antihipertensi seperti atenolol sering disalahgunakan penggunaannya oleh atlet yang membutuhkan ketenangan dan konsentrasi penuh sebagai doping. Saat ini teknik pemisahan yang banyak dilakukan untuk identifikasi atenolol salah satunya menggunakan sorben Molecular Imprinted Polymer (MIP). Tujuan dari penelitian ini adalah untuk mensisntesis MIP menggunakan molekul cetakan atenolol dan monomer akrilamid. Pelepasan molekul cetakan dilakukan dengan metode ekstraksi menggunakan pelarut methanol. Identifikasi kadarnya diukur menggunakan High Performance Liquid Chromatography (HPLC) dan dilakukan sampai dengan konsentrasi yang terukur di bawah nilai LOD. Hasilnya menunjukkan bahwa kadar atenolol hasil pelepasan kembali sebesar 8,88 ppm. Sementara nilai LOD dan LOQ yang dihasilkan masing-masing sebesar 11,184 ppm dan 37,282 ppm. MIP dikarakterisasi menggunakan Fourier Transform Infrared (FTIR) dan spektrum NIP (Non Imprinted Polymer) dan MIP yang dihasilkan memiliki pola yang sama dan diidentifikasi pada daerah bilangan gelombang 1500-500cm1. Kekuatan desorpsi antara MIP dan NIP telah diidentifikasi dan diperoleh data bahwa nilai AUC MIP lebih besar daripada nilai AUC NIP dengan nilai % terelusi sebesar 733,74%. MIP tersebut diaplikasikan pada tablet atenolol yang beredar di pasaran menggunakan eluen klorofom dan nilai perolehan kembali sebesar 53,33%.
Kata kunci: atenolol, doping, FTIR, HPLC, Molecular Imprinted Polymer (MIP).
ABSTRACT
Antihypertensive drugs like atenolol are frequently used as doping in many sports competitions by athletes who require calmness and full of concentration. Molecular Imprinted Polymer (MIP) sorbent is currently the most widely used separation technique for atenolol identification because of its high selectivity for atenolol adsorption. The aim of this research was to synthesize MIP using atenolol molecules and acrylamide monomer. The extraction using methanol was applied to release the imprinted molecules. The concentration of etenolol was measured by High Performance Liquid Chromatography (HPLC) that was carried out until the atenolol concentration was below the detection limit (LOD). The results showed that the concentration of atenolol released was 8.88 ppm. Meanwhile, the LOD and LOQ values were 11,184 ppm and 37.282 ppm, respectively. The Fourier Transform Infrared (FTIR) was used to characterize the MIP. The FTIR spectrum of NIP (Non Imprinted Polymer) and MIP showed the same pattern at the wave number range of 1500-500cm-1. The strength of desorption of MIP and NIP was determined, and data was gathered showing that the AUC MIP value was bigger than the AUC NIP one, with a percentage eluted value of 733.74 %. The MIP was applied to the commercially available atenolol tablets using chloroform eluent resulted in a recovery value of 53.33 %.
Keywords: atenolol, doping, FTIR, HPLC, Molecular Imprinted Polymer (MIP).
PENDAHULUAN
Olahraga merupakan alat pemersatu bangsa dilihat dari segi pertandingan dan perlombaan yang mempertemukan antar negara untuk meraih prestasi dan membanggakan nama suatu negara dimata
dunia (Amran, 2018). Beban berat menjadi seorang pemenang yang berada di pundak atlet dapat berakibat fatal. Para atlet dapat menggunakan berbagai cara yang dilarang dalam peraturan kompetisi demi mencapai target yang diinginkan, salah satunya melalui penggunaan Doping (Herdiawan, 2013).
Para atlet seringkali menyalahgunakan doping karena secara umum dapat menambah stamina, rasa percaya diri, kekuatan badan, meningkatkan keberanian, sebagai penghilang rasa sakit, meningkatkan ketenangan, mengurangi tangan gemetar, dan menurunkan denyut jantung agar mudah berkonsentrasi (Dewi, 2015). Salah satu contoh doping adalah atenolol. Atenolol terdaftar sebagai doping yang dilarang oleh World Anti Doping Agency (WADA) yang termasuk dalam “The 2018 Prohibited In Particular Sport” jenis doping yang dilarang yaitu beta- bloker seperti acebutolol, alprenolol, atenolol, betaxolol, bisoprolol dan lain-lain (WADA, 2018). Penggunaan atenolol dilarang dalam beberapa kompetisi cabang olahraga, karena senyawa ini bisa menginduksi penurunan denyut jantung dan tremor, serta meningkatkan kinerja umum selama kompetisi. Sehingga atenolol dianggap sebagai senyawa peningkat kinerja yang tidak sportif (Goryński, 2016).
Konsentrasi atenolol sangat kecil dalam cairan biologis manusia, sebagai obat yang digunakan untuk penggunaan jangka panjang maka pemantauan obat perlu dilakukan. Oleh karena itu, penentuan atenolol sebagai obat golongan β-bloker pada cairan biologis manusia, seperti plasma dan urin atau sampel farmasetik sangatlah penting (Gotardo, 2008). Berbagai studi telah banyak dihasilkan untuk identifikasi keberadaan atenolol dan saat ini diperlukan prosedur yang lebih cepat dan handal sehingga dapat menangani jumlah sisa analit yang sering tidak stabil terdapat pada matriks yang sangat kompleks (Yilmaz, 2016). Menurut Hasanah (2015) menjelaskan bahwa Solid Phase Extraction (SPE) merupakan metode ekstraksi konvensional yang memiliki kekurangan dalamhal selektivitas. Peningkatan selektivitas SPE ini telah banyak dilakukan dengan menggunakan teknik Molecular Imprinting Polymer (MIP) yang kemudian gabungan teknik ini dikenal dengan Molecular Imprinted Solid Phase Extraction (MISPE). PenggunaanMIP pada SPE memiliki keuntungan yang tinggi karena dapat menghasilkan ekstraksi yang selektif pada analit dan mengeliminasi matriks sampel (Hasanah, 2015).
Pada penelitian sebelumnya Yilmaz (2016) telah melakukan sintesis MIP dengan atenolol sebagai molekul cetakan, asam akrilat sebagai monomer dan EGDMA (Etilenglikol Dimetakrilat) sebagai cross-linker dengan
rasio perbandingan antara molekul cetakan : monomer : cross linker (1:5:27 mol). Selain itu, Hasanah (2017) telah melakukan sintesis MIP dengan atenolol sebagai molekul cetakan menggunakan komponen asam metakrilat sebagai monomer dan EGDMA sebagai crosslinker dengan rasio perbandingan antara molekul cetakan : monomer : cross linker (1:4:20 mol). Hasil dari kedua penelitian tersebut menggunakan monomer dalam bentuk asam terbukti dapat membentuk MIP. penelitian ini akan dilakukan sintesis MIP dengan atenolol sebagai molekul cetak menggunakan monomer akrilamid. Akrilamid digunakan sebagai monomer fungsional karena akrilamid dapat membentuk ikatan hidrogen antara gugus karbonil dari akrilamid dengan donor proton dari molekul cetakan yang menjadi sisi ikatan yang bertanggung jawab dalam interaksi antara molekul cetakan dan monomer fungsional, ikatan tersebut merupakan ikatan non-kovalen (Hasanah, 2019). Berdasarkan latar belakang di atas selanjutnya akan dilakukan penelitian sintesis MIP dan karakterisasi MIP menggunakan FTIR yang kemudian dilakukan analisis kadar atenolol pada sediaan tablet di pasaran menggunakan High Performance Liquid Cromatografi (HPLC).
MATERI DAN METODE
Alat dan bahan
Bahan-bahan yang digunakan pada penelitian ini adalah atenolol (Sigma- Aldrich); akrilamid p.a; tablet atenolol; etilen glikol dimetakrilat (EGDMA); azobizisobutironitril (AIBN) (Sigma-Aldrich); kloroform p.a; etil asetat p.a; metanol p.a. (Merck); metanol for HPLC; TEA (Trietanolamin); dapar posfat untuk HPLC dan aqua pro injection (API). Sementara alat yang digunakan meliputi: Peralatan yang digunakan adalah Fourier Transform InfraRed (Jasco FTIR 4200), Spektrofotometer UV-Vis (Genesys 10), High Performance Liquid Chromatography (Agilent Technologies 1120 Compact LC), oven (Memmert), Coloum C18, neraca analitik (Melter Toledo), kuvet, sonikator, vortex, botol reagen (Durran), corong, kolom analisis, mikropipet, spatula, mesh 40, mortar dan stemper, dan alat-alat gelas yang umum digunakan di laboratorium kimia.
Sintesis Molecular Imprinted Polymer (MIP)
Molekul cetakan: monomer fungsional: pengikat silang (atenolol: akrilamid: EGDMA) dengan perbandingan 1:4:20 (dalam mmol) telah disiapkan. Di dalam botol reagen atenolol dilarutkan dalam metanol kemudian ditambahkan akrilamid yang telah dilarutkan dalam kloroform lalu dimasukan EGDMA serta AIBN untuk selanjutnya dilakukan sonikasi. Sementara itu, untuk menghilangkan oksigen yang terperangkap dalam botol reagen, larutan kemudian dialiri dengan gas nitrogen dan botol reagen ditutup rapat. Campuran dalam botol reagen dipanaskan selama 7 jam menggunakan oven dengan suhu 60oC. Proses pembentukan kristal yang terbentuk diamati setiap 1 jam dan polimer yang dihasilkan lalu diayak menggunakan ukuran partikel 40 mesh dan selanjutnya ditimbang (Hasanah, 2019).
Sintesis Non Imprinted Polymer (NIP)
Sebagai perbandingan, NIP disintesis dengan komposisi yang sama untuk pembuatan MIP serta metode MIP yang sama, namun tanpa penggunaan atenolol sebagai molekul cetakan.
Pelepasan Molekul Cetakan
Pelepasan molekul cetakan (atenolol) dilakukan terhadap MIP hasil sintesis dengan cara diekstraksi menggunakan metanol dan disonikasi selama 30 menit. Selanjutnya larutan disaring dan filtratnya ditampung untuk dianalisis menggunakan HPLC, sementara residu dikeringkan pada suhu di bawah 60oC. Konsentrasi atenolol pada filtrat dianalisis menggunakanHPLC.
Pembuatan kurva kalibrasi dilakukan dengan mengukur luas area puncak larutan standar atenolol menggunakan HPLC. Larutan induk atenolol dibuat dengan konsentrasi 1000 ppm dengan deret konsentrasi pengenceran 500; 450; 400; 350; 300 dan 250 ppm. Fase gerak yang digunakan yaitu Metanol : TEA (85 : 15 mL) dan dilakukan penambahan buffer fosfat hingga pH 3, fase geraknya bersifat polar. Adapun, fase diam yang digunakan yaitu kolom C18 bersifat non polar, sehingga sistem analisis menggunakan HPLC ini merupakan fase terbalik.
Setelah diperoleh persamaan regresi linear, tahap berikutnya dilakukan penentuan nilai limit deteksi (LOD) yang bertujuan untuk menentukan jumlah terkecil analit dalam sampel yang dapat dideteksi dan masih
memberikan respon signifikan dibandingkan dengan blangko. Sedangkan ditentukannya nilai limit kuantitasi (LOQ) merupakan suatu parameter pada analisis renik dan diartikan sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2012). Nilai LOD dan LOQ dapat ditentukan dengan rumus berikut : a. Batas deteksi (Q)Q = ⅛2 (1)
b. Batas Kuantitasi (Q)Q = 10 Jf (2)
Keterangan :
Q = Batas deteksi dan kuantitasi.
Sy/x atau simpangan baku (sb) = simpangan baku responanalitik dari blangko.
SI = arah garis linear (kepekaan arah) dari kurva antara respon terhadap konsentrasi = slope (b pada persamaan garis y = a+bx).
Kadar atenolol dalam kristal MIP setelah ekstraksi harus berada dibawah nilai LOD. Sementara pelepasan molekul cetakan dikatakan berhasil ditandai dengan hasil spektrum FTIR yang diamati memiliki kesamaan antara MIP dan NIP sebagai pembanding.
Karakterisasi dengan FTIR
Sejumlah sampel yang terdiri dari atenolol, MIP sebelum ekstraksi, MIP sesudah ekstraksi dan NIP yang dihasilkan dikarakterisasi menggunakan FTIR. Sampel disiapkan dengan menggunakan metode pelet KBr dengan perbandingan 1: 9. Setelah dimasukan ke dalam cakram cetakan, dikompresi pada tekanan 20 Psi menggunakan hydraulic press lalu spektrum diukur pada bilangan gelombang 4000-400 cm-1 menggunakan FTIR.
Pengujian Kapasitas Adsorpsi
MIP yang telah dilepas molekul cetakannya dan NIP masing-masing dimasukan ke dalam kolom analisis kemudian ditambahkan 4 mL larutan atenolol dengan 6 variasi konsentrasi yaitu 500; 450; 400; 350; 300; dan 250 ppm. Selanjutnya diinkubasi selama 24 jam pada suhu ruang kemudian filtratnya diambil dan diukur menggunakan HPLC. Kemampuan selektivitas MIP dalam menjerat senyawa atenolol dapat ditentukan dengan nilai Imprinting Factor (IF) dihitung dengan rumus:
IF =Areaundercurve(AUC)MZP (3)
Area Under Curve (AUC)NIP '
Pengujian Kapasitas Desorpsi
NIP dan MIP hasil kapasitas adsorpsi, masing- masing ditambahkan 4 mL pelarut metanol kemudian disonikasi, campuran disaring kemudian diukur AUC filtratnya pada panjang gelombang atenolol. Selanjutnya dibuat kurva antara jumlah atenolol yang terlepas tiap 100 mg polimer terhadap konsentrasi atenolol yang digunakan.
Aplikasi MISPE untuk analisis atenolol pada sampel menggunakan High Performance Liquid Cromatografi (HPLC)
Pada tahap ini, aplikasi MISPE yang dihasilkan diujicobakan pada tablet atenolol yang beredar di pasaran menggunakan MIP dengan monomer akrilamid. 100 mg kristal MIP telah ditimbang dan sebanyak 100 mg tablet atenolol telah disiapkan untuk diekstraksi dengan 80 mL metanol guna menarik atenolol pada tablet. Tahap berikutnya kemudian disonikasi dan disaring, filtrat ditampung dalam vial. Sebanyak 100 mg NIP ditimbang dan dimasukkan kedalam kolom, dan dielusi dengan kloroform, etil asetat dan metanol. Selanjutnya fase loading yaitu memasukkan filtrat hasil ekstraksi dari tablet atenolol, kemudian dilakukan pencucian dengan melewatkankloroform dan etil asetat, dan yang terakhir melewatkan metanol pada kolom. Hasil pengelusian ditampung pada vial dan dilakukan analisis kadarnya menggunakan HPLC (Hasanah, 2019). Pengukuran Konsentrasi Atenolol dengan menggunakan HPLC.
HASIL DAN PEMBAHASAN
Sintesis MIP dan NIP
Sintesis MIP dan NIP dilakukan dengan menggunakan metode ruah. Metode ruah merupakan proses pencampuran semua bahan yang terdiri dari molekul cetakan, monomer fungsional, pengikat silang, inisiator dan pelarut porogen. Berdasarkan hasil optimasi studi literatur komposisi ideal untuk sintesis MIP antara molekul cetakan:monomer fungsional:pengikat silang yaitu 1:4:20 (mol) nilai tersebut dapat menghasilkan interaksi kompleks yang stabil. Atenolol sebagai molekul cetakan yang memiliki peranan penting dalam pembentukan rongga atau pori
yang spesifik akan berikatan secara non kovalen dengan monomer fungsional akrilamid. Hal ini dikarenakan akrilamid dapat membentuk ikatan hidrogen antara gugus karbonil dengan donor proton dari molekul cetakan atenolol yang menjadi sisi ikatan dalam interaksi antara molekul cetakan dan monomer fungsional. Setelah itu, EGDMA digunakan sebagai pengikat silang atau Crosslinker yang dapat mengkopolimerisasi monomer fungsional dengan ikatan kovalen untuk menjamin kekakuan yang tinggi pada matriks polimer (Hasanah, 2019). Tahap berikutnya, digunakan AIBN (azobisisobutironitril) sebagai inisiator karena dapat menginisiasi polimerisasi dengan membentuk radikal bebas pada suhu 60-70OC, sehingga mampu mempercepat reaksi pembentukan polimer. Oleh karena itu, selama proses sintesis berlangsung digunakan suhu 60OC untuk membantu radikal bebas dalam proses polimerisasi. Setelah semua komponen dimasukkan ke dalam botol reaksi, selanjutnya dialiri gas Nitrogen sebelum botol reaksi ditutup rapat untuk menghilangkan adanya gas oksigen yang dapat menyebabkan terbentuknya hidrogen peroksida sehingga akan membuat proses reaksi tidak berjalan dengan baik (Yan dan Row, 2006). Adapun mekanisme yang terjadi dalam proses pembentukan MIP dapat dijelaskan pada Gambar 1.
Setiap langkah dalam proses pencampuran ataupun penambahan bahan divortex dan disonikasi, hal ini supaya interaksi antar molekular dapat lebih mudah dan cepat karena dapat memperbesar luas permukaan bahan. Tahap selanjutnya, dilakukan pengovenan pada suhu 60oC dan pengamatan setiap satu jam. Berdasarkan hasil pengamatan pada jam pertama sudah mulai terbentuk adanaya kristal MIP dan NIP. Pengovenan dilakukan selama 7 jam hingga diperoleh kristal yang benar-benar kering seperti pada Gambar 2. Adanya perubahan menjadi bentuk kristal merupakan penanda telah terbentuknya suatu polimer. Kristal NIP dibuat dengan komposisi yang sama seperti MIP tetapi tanpa adanya penambahan molekul cetakan (atenolol) dan berfungsi sebagai pembanding. Setelah terbentuk kristal dilakukan penggerusan untuk memperkecil ukuran partikel dan memperbesar luas permukaan. Serbuk kristal diayak didapat ukuran partikelnya 60 mesh.
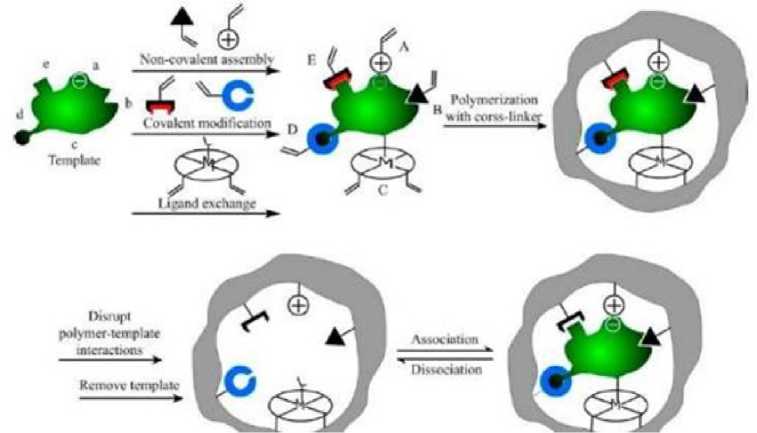
Gambar 1. Proses Pembentukan MIP (Chen, 2015)

Gambar 2. Kristal Hasil Sintesis: (a) NIP dan (b) MIP
Pengukuran Konsentrasi Atenolol dengan menggunakan HPLC
Panjang gelombang maksimum atenolol ditentukan dengan menggunakan Spektrofotometri Ultra Violet (UV) pada
rentang daerah panjang gelombang 200-400nm. Atenolol dilarutkan dalam metanol dan diperoleh absorbansi maksimumnya pada panjang gelombang 275nm, seperti yang tertera pada Gambar 3.
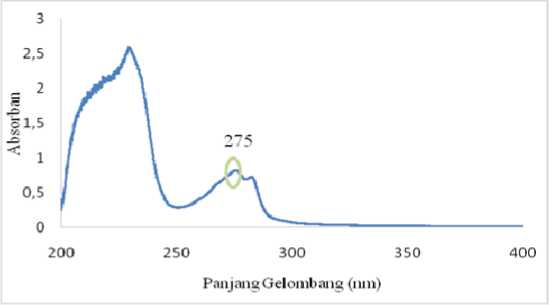
Gambar 3. Kurva penentuan panjang gelombang atenolol (nm)
Persamaan regresi linear standar atenolol yang diperoleh yaitu y = 5,31x + 14,69 dengan R² = 0,999. Hasil perhitungan LOD diperoleh nilai 11,184 ppm yang merupakan nilai terendah analit yang dapat dideteksi dalam suatu instrumen sedangkan untuk LOQ diperoleh nilai 37,282 ppm yang artinya kuantitas terkecil analit yang memenuhi kriteria cermat dan seksama berada pada batasan nilai tersebut.
Karakterisasi MIP
Karakterisasi MIP sebelum pelepasan etenolol dilakukan bertujuan untuk mengamati keberadaan gugus yang menjadi ciri khas atenolol yang merupakan molekul cetakan sehingga harus ditemukan pada MIP sebelum desorpsi. Hal tersebut dapat membuktikan bahwa proses polimerisasi telah berhasil seperti yang terlihat pada Gambar 4.
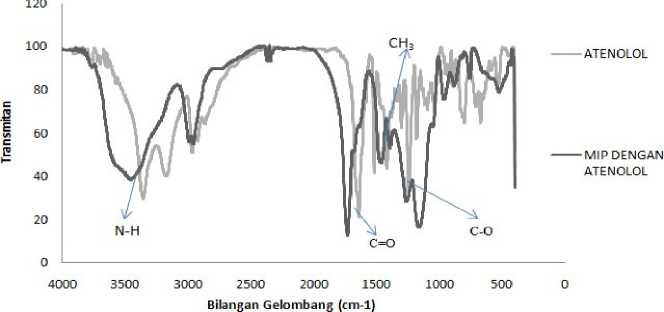
Gambar 4. Spektrum FTIR atenolol dan MIP dengan atenolol
Karakterisasi dengan FTIR dilakukan pada rentang bilangan gelombang 4400-400 cm-1. Gambar 4 menunjukkan bahwa terdapat N-H yang bervibrasi pada bilangan gelombang 3365cm-1 untuk spektra senyawa atenolol, kemudian terjadi pergeseran ke arah bilangan gelombang yang lebih pendek pada MIP sebelum pelepasan atenolol sehingga N-H berada pada bilangan gelombang 3510 cm-1. Gugus N-H dapat membentuk ikatan hidrogen serta gugus tersebut dapat berasal dari senyawa
atenolol dan akrilamid, hal tersebut menandakan bahwa proses polimerisasi sudah berhasil. Ikatan hidrogen terbentuk karena adanya gugus N-H dari atenolol yang berperan dalam donor ikatan hidrogen sedangkan atom oksigen pada gugus karbonil (C=O) dari akrilamid berperan sebagai akseptor ikatan hidrogen.
Berdasarkan literatur kisaran serapan CH3 bending berada pada bilangan gelombang
1470-1430 cm-1 (Coates, 2002). Gugus fungsional CH3 bervibrasi pada bilangan gelombang 1438 cm-1 pada senyawa atenolol dan mengalami pergeseran bilangan gelombang menjadi 1454 cm-1 yang berasal pada MIP sebelum ekstraksi atenolol. Pergeserann tersebut dapat menandakan terbentuknya proses polimerisasi yang ditandai dengan adanya pergeseran bilangan gelombang. Di sisi lain, pada spektrum atenolol teridentifikasi gugus C=O yang berada pada bilangan gelombang 1643 cm-1 sedangkan pada MIP sebelum pelepasan terdapat pada bilangan gelombang 1724 cm-1. Secara teoritis C=O dapat bervibrasi pada rentang bilangan gelombang 1900- 1650 cm-1 (Dachriyanus, 2004). Gugus karbonil (C=O) yang ada tersebut dapat berasal dari atenolol, akrilamid dan EGDMA. Hal tersebut membuktikan bahwa gugus C=O juga dapat berasal dari atenolol. Gugus fungsi C-O memiliki rentang bilangan gelombang 13201210 cm-1, dari spektrum infra red gugus C-O ditemukan pada bilangan gelombang 1269 cm-1 kemudian mengalami pergeseran kearah yang lebih pendek karena pada spektrum MIP sebelum pelepasan molekul cetakan ditemukan pada bilangan gelombang1244 cm-1.
Pelepasan Molekul Cetakan
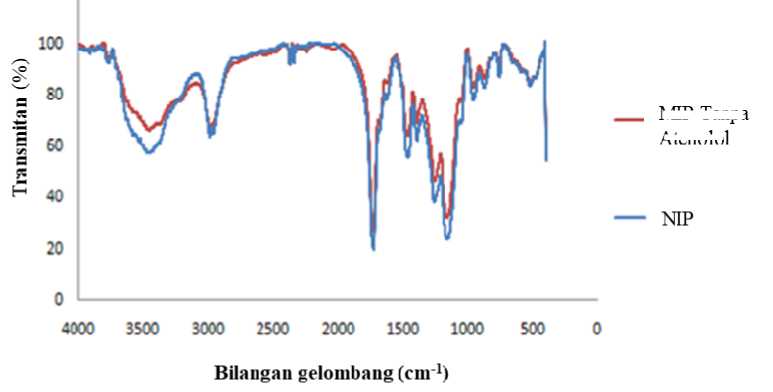
Pelepasan molekul cetakan (desorpsi) telah dilakukan pada MIP. Hal ini dimaksudkan agar dapat membentuk suatu rongga atau pori yang spesifik dengan menghilangkan atenolol dari matriks polimer sehingga dapat mengikat kembali molekul cetakan dengan analog struktural yang spesifik. Pada penelitian ini telah dilakukan proses pelepasan molekul cetakan dengan menggunakan metanol untuk melarutkan atenolol yang terikat dalam MIP. Pelepasan molekul cetakan dinyatakan berhasil apabila keseluruhan atenolol telah terlepas secara sempurna. Pada penelitian ini konsentrasi atenolol yang berhasil terekstrasi sebesar 8,88 ppm dan berada di bawah nilai LOD. Hasil analisis pada pelepasan molekul cetakan dengan menggunakan HPLC harus dilakukan sampai diperoleh konsentrasi atenolol dibawah nilai batas deteksi (LOD). Hal ini diasumsikan bahwa ketika konsentrasinya berada dibawah nilai batas deteksi (LOD) maka atenolol telah terekstraksi secara sempurna. Sementara karakterisasi MIP dan NIP pada tahap ini selanjutnya diidentifikasi menggunakan spektrum FTIR, hasil dapat dilihat pada Gambar 5 berikut ini.
MIP Taiipa
Atenolo
Gambar 5. Spektrum FTIR NIP dan MIP setelah pelepasan atenolol
Spektrum FTIR (Gambar 5) melaporkan bahwa atenolol telah berhasil terdesoprsi dari molekul cetakan, hal ini terlihat dengan munculnya puncak gugus fungsi C=C yang merupakan gugus fungsi spesifik akrilamid pada bilangan gelombang 1550 cm-1.
Berdasarkan literatur kisaran serapan C=C berada pada rentang bilangan gelombang 1675–1500 cm-1 (Dachriyanus, 2004). Selain itu,ditunjukkan pula denganadanya gugus C-N yang merupakan daerah sidik jari akrilamid, secara teoritis C-N memiliki serapan vibrasi
pada bilangan gelombang 1190-1130 cm-1 (Coates, 2002). Berdasarkan analisis spektrum, gugus fungsi C-N untuk NIP bervibrasi pada bilangan gelombang 1143 cm-1, sedangkan pada MIP tanpa molekul cetakan bervibrasi pada bilangan gelombang 1139 cm-1. Melihat kemiripan pola spectrum yang dihasilkan dari MIP setelah proses desorpsi dengan NIP, maka dapat diasumsikan bahwa proses pelepasan
atenolol dari molekul cetakan telah berhasil dilakukan.
Kapasitas Adsorpsi MIP dan NIP
Penentuan kapasitas adsorpsi dilakukan untuk mengetahui kemampuan MIP dalam mengikat kembali senyawa atenolol. Hasil pengamatan dapat dilihat pada Gambar 6.
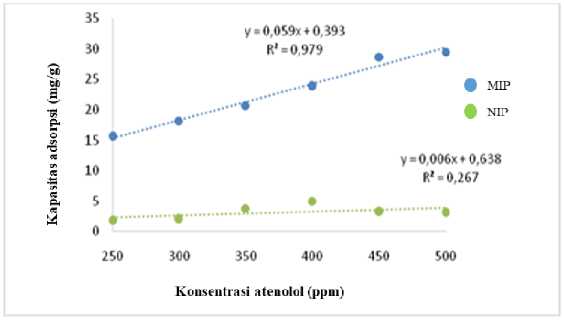
Gambar 6. Grafik hubungan antara kapasitas adsorpsi dengan konsentrasi atenolol
Persamaan linear untuk MIP yang tertera pada Gambar 6 yaitu y = 0,059x + 0,393 dengan R² = 0,979, sedangkan untuk NIP diperoleh persamaan linear yaitu y = 0,006x + 0,638 dan R² = 0,267. Sementara itu, nilai AUC yang diperoleh yaitu sebesar 5676,425 untuk MIP dan 778,25, untuk NIP, maka sesuai dengan persamaan (1) nilai IF yang didapat adalah 7,2. Nilai imprinting factor (IF) yang dihasilkan harus lebih dari 1, hal ini menunjukan bahwa kemampuan MIP lebih selektif daripada NIP (Hasanah, 2019).
Hasil penelitian menunjukkan bahwa
MIP dapat mengadsorpsi etanolol lebih baik daripada NIP.
Kapasitas Desorpsi MIP dan NIP
Kristal MIP dan NIP yang telah digunakan untuk kapasitas adsorpsi dikeringkan dan digunakan kembali dalam penentuan kapasitas desorpsi dan pelarut yang digunakan untuk ekstraksi adalah metanol. Ekstraksi atenolol dilakukan berulang sampai nilai konsentrasi yang diperoleh berada dibawah nilai batas deteksi. Kurva kapasitas desorpsi dapat dilihat pada Gambar 7.
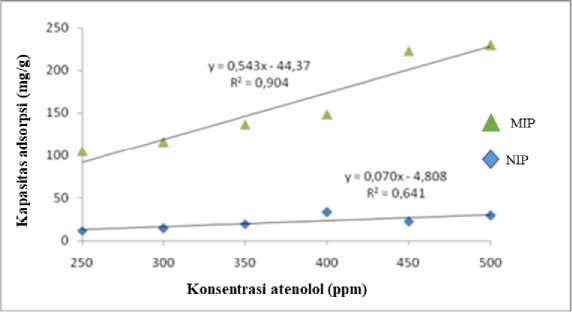
Gambar 7. Grafik hubungan antara kapasitas desorpsi dengan konsentrasi atenolol
Kekuatan desorpsi antara MIP dan NIP dapat dilihat pada Tabel 1 yang menyatakan bahwa nilai luas AUC MIP lebih besar daripada nilai luas AUC NIP. Hal ini berarti bahwa MIP memiliki kekuatan mendesorpsi atenolol lebih baik daripada NIP dengan nilai % terelusi 733,74%.
Tabel 1. Nilai Luas AUC MIP dan NIP pada Pengukuran Kapasitas Desorpsi
AUC MIP AUC NIP % Terelusi
39896,625 5444,82499 733,74 %
Aplikasi MISPE untuk Analisis Atenolol pada Sampel Menggunakan High Performance Liquid Cromatografi (HPLC)
Untuk mengetahui kemampuan MIP sebagai sorben, maka pada penelitian ini telah diujicobakan kinerjanya menggunakan tablet atenolol yang beredar di pasaran sebagai sampel. Filtrat hasil ekstraksi atebolol menggunakan methanol dilewatkan ke MIP untuk diukur konsentrasi atenolol menggunakan HPLC.Persentage perolehan kembali dapat dilihat pada Tabel 2.
Tabel 2. Perolehan Kembali Atenolol Sebagai Sorben
|
Atenolol dalam Variasi Pelarut |
PerolehanKembali Atenolol |
|
Kloroform |
53,33 % |
|
Etil asetat |
7,82 % |
|
Metanol |
3,14 % |
Ekstraksi dilakukan dengan menggunakan sonikator supaya atenolol dalam tablet dapat tertarik ke dalam pelarut metanol. Berdasarkan Tabel 2 diatas persen perolehan kembali atenolol paling banyak terelusidengan pelarut kloroform sebanyak 53,33%.
SIMPULAN
Pembuatan MIP menggunakan molekul cetakan atenolol dan monomer akrilamid telah berhasil disintesis dan dikarakterisasi menggunakan FTIR. Atenolol dan akrilamid sebagai monomer fungsional dapat berinteraksi karena adanya ikatan hidrogen. Konsentrasi atenolol hasil pelepasan
kembali dari molekul cetakan diperoleh kadarnya sebesar 8,88 ppm, sementara nilai LOD dan LOQ yang diukur sebesar 11.184 ppm dan 32, 282 ppm. Salah satu identifikasi keberhasilan pelepasan atenolol dari MIP di buktikan dengan konsentrasi atenolol yang dihasilkan dibawah nilai LOD dan spektrum FTIR dari MIP dan NIP yang dihasilkan memiliki kemiripan. Kekuatan desorpsi antara MIP dan NIP telah diidentifikasi dan diperoleh data bahwa nilai AUC MIP lebih besar daripada nilai AUC NIP dengan nilai % terelusi sebesar 733.74%. Hal ini membuktikan bahwa MIP memiliki kekuatan mendesorpsi atenolol lebih baik dari pada NIP. MIP dengan monomer akrilamid telah dapat digunakan sebagai sorben dan diaplikasikan menggunakan tablet atenolol yang beredar di pasaran dengan perolehan kembali pada pelarut kloroform 53,33%, etil asetat 7,82% dan metanol 3,14%.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada P3M (Pusat Penelitian dan Pengabdian kepada Masyarakat), Sekolah Tinggi Ilmu Kesehatan Bakti Tunas Husada Tasikmalaya, atas dukungan finansial yang diberikan melalui hibah penelitian dosen.
DAFTAR PUSTAKA
Amran, M. A. 2018. Pengaruh pemberian apel hijau terhadap pemulihan otot setelah latihan fisik pada atlet BKMF sepak takraw FIK UNM. Tesis. Fakultas Ilmu Keolahragaan. Universitas Negeri Makasar.
Chen, W., Ma, Y ., Pan, J., Meng, Z ., Pan, G., Sellergren, B.. 2015. Molecularly Imprinted Polymers with Stimuli-Responsive Affinity: Progress and Perspectives. Polymers. 7:1689-1715
Coates, John. 2002. Interpretation of Infrared Spectra, A Practical Approach. Newtown USA: Coates Consulting.
Dachrianus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Lembaga Pengembangan Teknologi Informasi dan Komunikasi (LPTIK) Universitas Andalas Padang.
Dewi, A. K. A. I. 2015. Penyalahgunaan Zat Terlarang (Doping Dan Napza) sebagai
Upaya Peningkatan Stamina dalam Olahraga. Jurnal Pendidikan Kesehatan Rekreasi. 1: 15–19.
Gorynski, K., Kiedrowicz, A., and Bojko, B. 2016. Development of SPME-LC–MS method for screening of eight betablockers and bronchodilators in plasma and urine samples. J of Pharm. and Biomed. Anal. 127: 147–155.
Gotardo, M. A., Tognolli, J. O., Pezza, H. R., dan Pezza. L. 2008. Detection of Propanolol in Pharmaceutical Formulations by Diffuse Reflactance Spectroscopy. Spect. Acta. 69: 11031109.
Hasanah, A.N., Kartasasmita, R.E., Ibrahim, S. 2015. Synthesis and application of Glibenclamide Imprinted Polymer for solid phase extraction in serum samples using itaconic acid as functional monomer. J of Appl. Sci. 15:1288-1296.
Hasanah, A.N., Pratiwi, R., Utari, T.N.D. 2019 . Synthesis of Atenolol-Imprinted Polymers with methyl methacrylate as functional monomer in propanol using
bulk and precipitation polymerization method. J. of Anal. Meth. in Chem. 7: 1-7
Hasanah, A.N., Shendi, S., Mutakin, dan Driyanti, R. 2017. Evaluation Performance of Molecularly Imprinted Polymer Prepared by Two Different Polymerization Method for Atenolol Recognition in Human Plasma. Asian J of Chem. 29(11): 2429-2433.
Herdiawan, R. 2013. Upaya Pencegahan Penyalahgunaan doping Golongan Psikotropika di Kalangan Pemain Sepak Bola. Skirpsi. Fakultas Hukum. Universitas Brawijaya.
Yan, H., Row, K.H. 2006. Characteristic and synthetic approach of moleculary imprinted polymer. Int. J. Mol. Sci. 7: 155-178
Yilmaz, H., dan Basan, H. 2017. Spectrofluorimetric determination of atenolol from human urine using high affinity molecularly imprinted solidphase extraction sorbent. Luminescence. 32: 1391-1397.
19
Discussion and feedback