MODIFIKASI SILIKA GEL DARI ABU LIMBAH HASIL PROSES PEMBAKARAN INDUSTRI BATU BATA DENGAN DIFENILKARBAZON SEBAGAI ADSORBEN SERTA UJI DAYA SERAP TERHADAP ION LOGAM Cr(III) DAN Cu(II)
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 16 (2), JULI 2022 DOI: https://doi.org/10.24843/JCHEM.2022.v16.i02.p14
p-ISSN 1907-9850
e-ISSN 2599-2740
MODIFIKASI SILIKA GEL DARI ABU LIMBAH HASIL PROSES PEMBAKARAN INDUSTRI BATU BATA DENGAN DIFENILKARBAZON SEBAGAI ADSORBEN SERTA UJI DAYA SERAP TERHADAP ION LOGAM Cr(III) DAN Cu(II)
I W. Sudiarta*, I G. D. V. Saputra, dan P. Suarya
Prodi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Jalan Kampus Udayana, Jimbaran, Kuta Selatan, Badung, Bali
*Email: wayansudiarta@unud.ac.id
ABSTRAK
Modifikasi silika gel dari abu limbah proses pembakaran batu bata dengan difenilkarbazon telah dilakukan. Silika gel termodifikasi difenilkarbazon (Si-DPZon) diperoleh dengan cara mendidihkan abu dengan larutan NaOH untuk menghasilkan natrium silikat dan dinetralkan dengan HCl untuk mendapatkan silika gel kemudian dimodifikasi secara fisik dengan ligan. Kajian yang dilakukan meliputi penentuan gugus fungsi adsorben secara spektrofotometer IR, keasaman permukaan dengan metode titrasi asam basa, luas permukaan spesifik dengan metode metilen biru, kondisi optimum adsorpsi (pH, waktu kontak) Cr(III) dan Cu(II) . Hasil FTIR menunjukkan Si-DPZon mengandung gugus fungsi amida (N-H), karbonil (C=O), silanol (Si-OH), siloksan (Si-O-Si) dan aromatik (C-H). Hasil penelitian menunjukkan bahwa Si-DPZon memiliki keasaman permukaan (Kal) sebesar 5,8384 ± 0,2466 mmol/g, jumlah situs aktif 12,3945x1020 atom/g, dan luas permukaan spesifik 12,6886 m2/g. Si-ABB memiliki keasaman permukaan (Kal) sebesar 4,5568±0,2453 mmol/g dengan jumlah situs aktif 27,4410x1020 atom/g dengan luas permukaan spesifik 11,6712 m2/g. Kondisi optimum adsorpsi krom (III) baik Si-DPZon maupun Si-ABB terjadi pada pH 5 dan 15 menit. Kemampuan adsorpsi Cr(III) oleh Si-DPZon pada kondisi pH dan waktu kontak optimum adalah 34,6927 mg/g dengan persentase adsorpsi 86,7317% dan Si-ABB diperoleh pada 34,5445 mg/g dengan persentase adsorpsi 86,3611%. Kemampuan adsorpsi Cu(II) oleh Si-DPZon pada kondisi pH dan waktu kontak optimum adalah 26,49672 mg/g dengan persentase adsorpsi 66,2418% dan Si-ABB diperoleh 24,93210 mg/g dengan persentase adsorpsi 62,3302%.
Kata kunci: adsorpsi, krom (III), tembaga (II), ligan difenilkarbazon, sintesis silika gel.
ABSTRACT
The modification of silica gel, from the waste of the bricks burning process, with diphenylcarbazone has been done. The silica gel modified by diphenylcarbazone (Si-DPZon) was obtained by boiling the ash with NaOH solution to create sodium silicate and neutralized with HCl to get the silica gel, then physically modified with diphenylcarbazone ligand. The study included the determination of the adsorbent functional groups by spectrophotometer IR, surface acidity by acid-base titration method, specific surface area by absorption of methylene blue method, the optimum conditions (pH, contact time) of the adsorption of Cr(III) and Cu(II). FTIR analysis showed that the Si-DPZon contained amide (N-H), carbonyl (C=O), silanol (Si-OH), siloxane (Si-O-Si) and aromatic (C-H) functional groups. The results showed that Si-DPZon had a surface acidity (Kal) of 5.8384 ± 0.2466 mmol/g with the number of active sites of 12.3945x1020 atom/g with a specific surface area of 12.6886 m2/g. Si-ABB had a surface acidity (Kal) of 4.5568±0,2453 mmol/g with the number of active sites of 27.4410x1020 atom/g and with a specific surface area of 11.6712 m2/g. The optimum conditions for adsorption of chromium (III), both Si-DPZon and Si-ABB occurred at pH 5 and 15 minutes. The adsorption ability of Cr(III) by Si-DPZon at the pH and contact time optimum conditions was 34.6927 mg/g with an adsorption percentage of 86.7317% and Si-ABB was obtained at 34.5445 mg/g with the adsorption percentage of 86.3611%. Adsorption ability of Cu(II) by Si-DPZon at the pH and contact time optimum conditions was 26.49672 mg/g with the adsorption percentage of 66.2418% and Si- ABB was obtained at 24.93210 mg/g with the adsorption percentage of 62.3302%.
Keywords: adsorptions, chromium (III), copper (II), diphenilcarbazone ligand, synthesis of silica gel.
PENDAHULUAN
Batu bata merupakan suatu komponen yang banyak dimanfaatkan dalam berbagai sektor
pembangunan karena memiliki struktur yang kuat, pembuatannya relatif mudah dan murah (Hadi, dkk, 2013). Di daerah Gianyar banyak
terdapat industri pembuatan batu bata dengan menggunakan sekam padi, kayu bakar dan minyak tanah sebagai bahan bakar untuk proses pembakaran dengan suhu tinggi (hingga 1000°C) untuk menghemat biaya pembakaran batu bata. Abu hasil pembakaran batu bata memiliki kandungan silika yaitu 80%. Kandungan silika yang tinggi ini berpotensi sebagai bahan baku pembuatan silika gel (Hadi, dkk, 2013).
Penelitian mengenai sintesis dan modifikasi silika gel telah banyak dilaporkan. Kalapathy, dkk. (2000), memproduksi silica murni dari abu sekam padi dengan metode sederhana. Azmiyawati (2004) telah Modifikasi Silika Gel dengan Gugus Sulfonat untuk Meningkatkan Kapasitas Adsorpsi Mg(II). Mahmoud dan Al-Saadi (2007) telah memodifikasi silika dengan difenilkarbazon untuk ektraksi dan prekonsentrasi Cr(III) dan Fe(III) dimana hasil yang diperoleh pada adsorpsi silika termodifikasi ligan difenilkarbazon (Si-DPCZ) terhadap logam Cr(III) adalah 0,350 mmol/g serta aplikasi yang potensial untuk Si-DPCZ bagi ektraksi selektif dan pre-konsentrasi bagi ion logam berat Cr(III) dalam tingkat konsentrasi ppm dan ppb telah dengan sukses ditunjukkan dengan persentase penemuan kembali lebih dari 95% untuk ion logam yang telah diujikan. Nittaya, dan Nuntiya, (2008) telah melakukan preparasi nanosilika dari abu sekam padi dengan metode presipitasi. Ngatijo (2013) mensintesis silika termodifikasi amin dan aplikasinya sebagai adsorben ion Tembaga(II). Sudiarta, dkk. (2013) telah modifikasi silika gel dari abu sekam padi dengan ligan difenilkarbazon. Nopianingsih, dkk. (2015) melakukan sintesis silika gel terimobilisasi difenilkarbazon dari abu sekam padi melalui teknik sol-gel. Asih dan Sudiarta (2016) melaporkan penelitian mengenai adsorpsi Cr(III) pada silika gel termodifikasi difenilkarbazon secara sol-gel. Sudiarta dkk. ( 2018) memodifikasi silika gel melalui reaksi heterogen dengan difenilkarbazon. Sudiarta dkk. (2018) melaporkan penelitian mengenai adsorpsi multi logam berat Krom(III), Timbal(II), dan Tembaga(II) dalam sistem larutan binary oleh silika gel terimobilisasi difenilkarbazida. Huljana dan Rodiah (2019) telah mensintesis silika dari abu sekam padi dengan metode solgel.
Kromium (Cr) adalah salah satu pencemar logam berat yang berasal dari limbah industri tekstil, kertas, elektroplating dan industri lainnya, yang mana kehadirannya dapat merusak lingkungan tanah, udara dan perairan. Pada perairan kromium berada dalam bentuk Cr(III) dan Cr(IV), bila masuk ke dalam tubuh manusia akan terakumulasi di dalam tubuh sehingga menyebabkan kanker paru-paru, kerusakan hati dan ginjal (Kaim dan Schwederski, 1994). Selain logam kromium juga terdapat logam Cu yang dapat mencemari lingkungan. Logam Cu dibutuhkan oleh tanaman, hewan termasuk manusia dengan dosis yang kecil dalam sistem enzim, namun logam Cu yang berlebihan di dalam tubuh manusia memiliki dampak seperti muntah, diare, kram perut dan mual bahkan jika dalam dosis besar dapat menyebabkan gagal ginjal dan kerusakan hati (Jonathan dkk., (2006). Pencemaran logam berat terhadap perairan perlu dicarikan solusi dalam menanggulangi hal tersebut dengan menggunakan adsorben untuk mengurangi pencemaran logam berat yang terjadi
Berdasarkan hal tersebut perlu dilakukan penelitian mengenai pemanfaatan abu limbah hasil pembakaran industri batu bata sebagai sumber silika dalam pembuatan silika gel termodifikasi difenilkarbazon sebagai adsorben logam Cr(III) dan Cu(II).
MATERI DAN METODE
Alat Penelitian
Alat yang digunakan dalam penelitian antara lain peralatan gelas laboratorium, kertas saring Whatman 42, pH meter, ayakan 250 µm dan 106 µm, neraca analitik, Atomic Absorption Spektrofotometer (AA 7000 Shimadzu), Spektrofotometer UV-Vis (Jenway 6105 U.V׀Vis), Spektrofotometer inframerah (IR), oven, furnace dan sentrifuge.
Bahan Penelitian
Bahan yang digunakan antara lain abu pembakaran industri batu-bata yang diperoleh di Desa Tulikup Kabupaten Gianyar Bali, natrium hidroksida (NaOH), asam klorida (HCl), asam nitrat (HNO3), aquades, difenilkarbazon (DPZon), toluena, etanol, dietil eter, metilen biru, asam oksalat (H2C2O4), KCl,
C8H5KO4, Na2HPO4, kromium (III) klorida heksahidrat, CuSO4.
Cara Kerja
Sintesis silika gel dari abu industri batubata
Sebanyak 20 g abu hasil proses pembakaran industri batu bata yang kering direaksikan dengan 250 mL HCl 2 M lalu diaduk selama 1 jam. Campuran tersebut kemudian disaring, residu lalu dibilas dengan aquades sampai netral kemudian dikeringkan dalam oven pada suhu 100 oC sampai kering.
Abu hasil preparasi tersebut ditambahkan 250 mL larutan NaOH 3 M dalam erlenmeyer bertutup 500 mL. Campuran dididihkan sambil diaduk dengan pengaduk magnet pada kecepatan konstan selama 1 jam lalu disaring dengan kertas saring Whatman 42, residu dibilas secara bertahap dengan 100 mL akuades mendidih sehingga diperoleh residu dan filtrat. Filtrat yang mengandung natrium silikat kemudian dinetralkan dengan larutan HCl sampai terbentuk gel. Gel yang terbentuk didiamkan selama 18 jam. Gel yang terbentuk kemudian dihancurkan lalu disentrifugasi dengan kecepatan 2500 rpm selama 10 menit, kemudian supernatant dibuang dan gel dicuci dengan akuadest sampai gel bebas ion klorida dan netral. Gel kemudian dikeringkan dalam oven pada suhu 70oC. Silika gel yang diperoleh kemudian digerus dan diayak dengan ayakan 250 μm dan 106 μm sehingga diperoleh silika gel yang memiliki range ukuran 106-250 µm (Si-ABB) kemudian silika gel tersebut disimpan dalam desikator (Kalapathy, dkk. 2000). Silika gel yang diperoleh dianalisis dengan menggunakan Spektrofotometer Inframerah (IR), spektranya dibandingkan dengan silika gel 60.
Modifikasi Silika Gel dengan Ligan
Difenilkarbazon
Modifikasi silika gel dengan
difenilkarbazon mengikuti penelitian
Trisnawati(2012) yaitu sebanyak 10 mL toluena dan 5 mL etanol ditambahkan 0,12 g (0,50 mmol) difenilkarbazon kemudian diaduk sampai larut sempurna. Kemudian larutan ditambahkan 0,50 g Si-ABB dan diaduk dengan pengaduk magnet selama 4 jam, kemudian disaring, dibilas dengan 5 mL toluena, 5 mL etanol dan terakhir menggunakan 5 mL dietil eter lalu dikeringkan dalam oven pada suhu 60oC (Si-DPZon).
Karakterisasai silika gel
Spektra Inframerah
Masing-masing sebanyak 0,5 g Si-
ABB, Si-DPZon dan silika gel 60 (pembanding) digerus dalam cawan porselin terpisah sampai halus dan dikeringkan pada suhu 60°C dalam oven. Silika gel halus ini kemudian dianalisis dengan spektrofotometer IR dengan metode Pelet KBr. Masing-masing spektra dianalisis untuk mengidentifikasi gugus fungsi utama yang terkandung dalam setiap silica. Bentuk spektra juga dibandingkan untuk mengetahui apakah sintesis dan modifikasi sudah berhasil dilakukan.
Penentuan Keasaman Permukaan Adsorben
Masing-masing sebanyak 0,1 g adsorben Si-DPZon dan Si-ABB yang sudah kering dimasukkan kedalam 3 erlemeyer yang berbeda dengan volume 50 mL kemudian masing-masing erlemeyer ditambahkan 10,0 mL NaOH 0,1 M lalu erlemeyer ditutup rapat dan diaduk selama 1 jam pada temperatur kamar. Perlakuan yang sama juga dilakukan pada larutan blanko yang hanya mengandung 10,0 mL larutan NaOH 0,1 M. Setelah 1 jam larutan disaring menggunakan kertas saring dan residunya dibilas dengan menggunakan aquades. Filtrat ditambahkan 2 tetes indikator pp lalu dititrasi dengan larutan standar HCl 0,1 M yang sudah dibakukan. Keasaman Permukanaan dihiutung menggunakan rumus:
mmol
Kadn ( g ) =
(Vblanko-V1)x MHCl B
(1)
Kadn = keasaman adsorben (mmol/g) Vblanko= volume HCl titrasi blanko (mL) V1 = volume HCl titrasi filtrat (mL) B = massa adsorben (g)
Penentuan Luas Permukaan Adsorben Dengan Metilen Biru
Masing-masing adsorben yang sudah kering diambil 0,1 g lalu ditambahkan kedalam 20,0 mL larutan metilen biru konsentrasi 50 ppm, kemudian diaduk dengan pengaduk magnet dengan variasi waktu kontak yaitu 5, 10, 20, 30, 40, 50 dan 60 menit. Campuran disaring dan filtratnya dianalisis menggunakan spektrofotometer UV-Vis. Nilai absorbansi yang diperoleh dimasukkan kedalam persamaan regresi linier sehingga diperoleh konsentrasi metilen biru pada masing-masing filtrat dengan waktu kontak yang berbeda.
Konsentrasi metilen biru yang terserap ditentukan dengan metode kurva kalibrasi sehingga banyaknya metilen biru yang terserap oleh sampel dapat dihitung dan luas permukaan adsorben juga dapat dihitung.
„ _ Wads . N .a
= Mr ( )
S = luas permukaan adsorben (m2/g)
N = bilangan avogadro (6,022 x 1023 mol-1)
Wads = daya serap metilen biru oleh 1 gram sampel (mg/g)
a = luas penutupan oleh 1 molekul metilen biru (197 x 10-20 m2)
Mr = massa molekul relatif metilen biru (320,5 g/mol)
Wads =
C1-C2 x V x 1 1000 B
(3)
Wads = daya serap metilen biru oleh 1 gram sampel (mg/g)
B = massa sampel yang digunakan (g)
C1 = konsentrasi larutan metilen biru awal
(mg/L)
C2 = konsentrasi larutan metilen biru akhir (mg/L)
V = volume larutan metilen biru yang digunakan (mL)
Penentuan pH Optimum Adsorpsi Cr(III) dan Cu(II)
Masing-masing adsorben Si-DPZon yang sudah kering sebanyak 0,1 g dimasukkan kedalam 5 buah erlenmeyer dengan volume erlenmeyer 50 mL, kemudian ditambahkan 20,0 mL larutan Cr(III) 200 ppm dengan pH larutan 1, 2, 3, 4, dan 5. Pengaturan pH dilakukan dengan penambahan NaOH atau HNO3 dan buffer. Campuran kemudian diaduk dengan pengaduk magnet selama 1 jam. Kemudian campuran disaring dan fitratnya diambil untuk analisis Cr(III) yang tersisa dengan menggunakan spektrofotometer serapan atom (Mahmoud dan Al-Saadi, 2007). Hal yang sama juga dikerjakan menggunakan larutan logam Cu(II). Nilai absorbansi yang diperoleh dimasukkan dalam persamaan regresi linier sehingga diperoleh konsentrasi Cr(III) pada masing-masing filtrat dengan adsorben yang berbeda. Konsentrasi Cr(III) yang diserap ditentukan dengan metode kurva kalibrasi sehingga banyaknya Cr(III) yang terserap dapat dihitung. pH optimum diperoleh dengan
membuat kurva antara pH dan daya serap Cr(III) pada sampel. Hal yang sama dilakukan pada penentuan pH optimum adsorpsi Cu(II) dan juga menggunakan adsorben Si-ABB
Penentuan Waktu Optimum Adsorpsi Cr(III) dan Cu(II)
Masing-masing adsorben Si-DPZon yang sudah kering sebanyak 0,1 g dimasukkan kedalam 8 buah erlenmeyer dengan volume erlenmeyer 50 mL, kemudian ditambahkan 20,0 mL larutan Cr(III) 200 ppm dengan pH optimum yang diperoleh, lalu campuran diaduk menggunakan pengaduk magnet dengan variasi waktu 5, 10, 15, 20, 30, 40, 50 dan 60 menit. Kemudian campuran disaring dan fitratnya diambil untuk analisis Cr(III) yang tersisa dengan menggunakan spektrofotometer serapan atom (Mahmoud dan Al-Saadi, 2007). Hal yang sama juga dikerjakan menggunakan larutan Cu(II). Nilai absorbansi yang diperoleh dimasukkan dala persamaan regresi linier sehingga diperoleh konsentrasi Cr(III) pada masing-masing filtrat dengan adsorben yang berbeda. Konsentrasi Cr(III) yang diserap ditentukan dengan metode kurva kalibrasi sehingga banyaknya Cr(III) yang terserap dapat dihitung. Waktu kontak optimum diperoleh dengan membuat kurva antara daya serap Cr(III) terhadap waktu interaksi (menit), sehingga diperoleh waktu adsorpsi optimum silika gel termodifikasi difenilkarbazon dalam menyerap Cr(III) secara maksimum. Konsentrsi Cr(III) yang terserap oleh adsorben Si-DPzon dan Si-ABB.
Penentuan Kemampuan Adsorpsi Adsorben Si-DPZon Dan Si-ABB
Kemampuan adsorpsi adsorben Si-DPZon dan Si-ABB terhadap logam Cr(III) dan Cu(II) pada kondisi optimum dapat dihitung dengan rumus
, ∙ C1 — C2
%teradsorpsι = —-— x 100% (4)
C1
%teradsorpsi = persentase ion logam yang terserap oleh adsorben (%)
C1 = konsentrasi larutan ion
logam awal (mg/L)
C2 = konsentrasi larutan ion
logam akhir (mg/L)
HASIL DAN PEMBAHASAN
Sintesis Silika Gel dari Abu Pembakaran Batu Bata (Si-ABB)
Sintesis silika gel menggunakan abu pembakaran batu bata sebagai bahan dasar sumber silika diawali dengan mereaksikan abu dengan NaOH 3 M. Pada proses ini silika yang terkandung dalan abu larut ke dalam NaOH menghasilkan larutan natrium silikat, sedangkan oksida – oksida logam lainnya tidak dapat larut dalam basa (Nuryono, 2004). Reaksi yang terjadi pada proses tersebut adalah
SiO2 + 2NaOH ----► Na2SiO3 + H2O
Pada tahap ini dihasilkan produk natrium silikat (Na2SiO3) yang larut dalam air (H2O) sehingga menjadi larutan natrium silikat (Na2SiO3). Pada larutan ini terdapat anion silikat sebagai gugus reaktif dan ion natrium untuk menyeimbangkan muatan. Larutan natrium silikat ini digunakan sebagai prekursor pembuatan silika gel. Pembuatan silika gel dilakukan dengan mengasamkan larutan natrium silikat dengan HCl sampai terbentuk gel. Penambahan asam menyebabkan anion silikat berubah menjadi silanol sehingga ketika silanol bereaksi dengan anion silikat membentuk siloksan, proses ini berlangsung secara berulang sampai terbentuk gel. Gel yang diperoleh dicuci dengan aquades untuk menghilangkan sisa asam dan garam-garam terlarut NaCl. Bebas ion klorida dikonfirmasi dengan uji ion Ag+ dan netral dikonfirmasi dari supernatant dengan pH stik Kemudian silika gel dikeringkan dalam oven pada suhu 70°C sampai berat konstan. Silika gel tersebut digerus untuk mendapatkan silika gel dengan ukuran 106 - 250µm. Silika gel ini digunakan untuk penelitian selanjutnya (Si-ABB).
Modifikasi Secara Fisika (Impregnasi) Silika Gel dengan Ligan Difenilkarbazon (Si– DPZon)
Modifikasi silika gel dengan ligan difenilkarbazon dilakukan dengan
menggunakan silika gel yang sudah diperoleh sebelumnya. Silika gel terlebih dahulu direaksikan dengan asam klorida untuk menghilangkan logam atau oksida logam yang
masih terperangkap dalam silika gel. Selain itu juga untuk mengaktifkan dan menseragamkan pori sehingga memudahkan proses impregnasi. Pada proses modifikasi ini, terjadi interaksi fisika antara difenilkarbazon dengan silia gel melalui reaksi Van der Waals dan juga ikatan hidrogen, seperti yang dilaporkan oleh Mahmoud and Al-Saadi (2007). Spektra IR silika gel-60 (Si-60), silika gel tanpa modifikasi (Si-ABB), dan silika termodifikasi difenilkarbazon (Si-DPzon disajikan pada Gambar 1.
Berdasarkan hasil interpretasi spektra inframerah tersebut dapat dikatakan bahwa sintesis dan modifikasi silika gel dari abu industry batu bata berhasil dilakukan. Hal ini ditandai dengan terdeteksinya serapan gugus hidroksil (-OH) pada kisaran bilangan gelombang 3600-3400 cm-1, gugus silanol (Si-OH) pada kisaran 947-812 cm-1 dan siloksan (Si-O-Si) pada 1055 cm-1 (spektra B Gambar 1, sesuai dengan serapan gugus-gugus fungsi pada silika gel pembanding (spektra A Gambar 1) yaitu 3600-3400 cm-1 untuk gugus –OH, 956802 cm-1 untuk Si-OH dan 1043 cm-1 untuk Si-O-Si. Siloksan, Silanol, dan hidroksil merupakan gugus fungsi utama yang terkandung dalam silika gel.
Interpretasi spektra pada Gambar 1 (C) terdeteksi munculnya pita serapan pada bilangan gelombang ±3637 cm-1 merupakan vibrasi (N-H) dari gugus amida. Gugus (C-H) aromatik muncul pada bilangan gelombang ±3325 cm-1 serta gugus karbonil (C=O) menunjukan pita serapan pada bilangan gelombang 1629 cm-1, yang merupakan gugus-gugus fungsional yang terdapat pada ligan difenilkarbazon sesuai dengan struktur ligan difenilkarbazon dari literatur. Selain itu muncul juga pita serapan –OH yang melebar pada kisaran bilangan gelombang 3600-3400 cm-1, pita serapan silanol (Si-OH) pada bilangan gelombang 945-810 cm-1, dan pita serapan Si-O-Si pada 1066 cm-1, yang merupakan gugus-gugus fungsi utama dalam silika gel. Terdeteksinya gugus-gugus fungsi tersebut melalui pita serapan yang terdapat pada spektra IR siklika gel termodifikasi mengindikasikan bahwa modifikasi secara fisika atau impregnasi silika gel dari abu pembakaran batu bata dengan difenilkarbazon telah berhasil dilakukan.
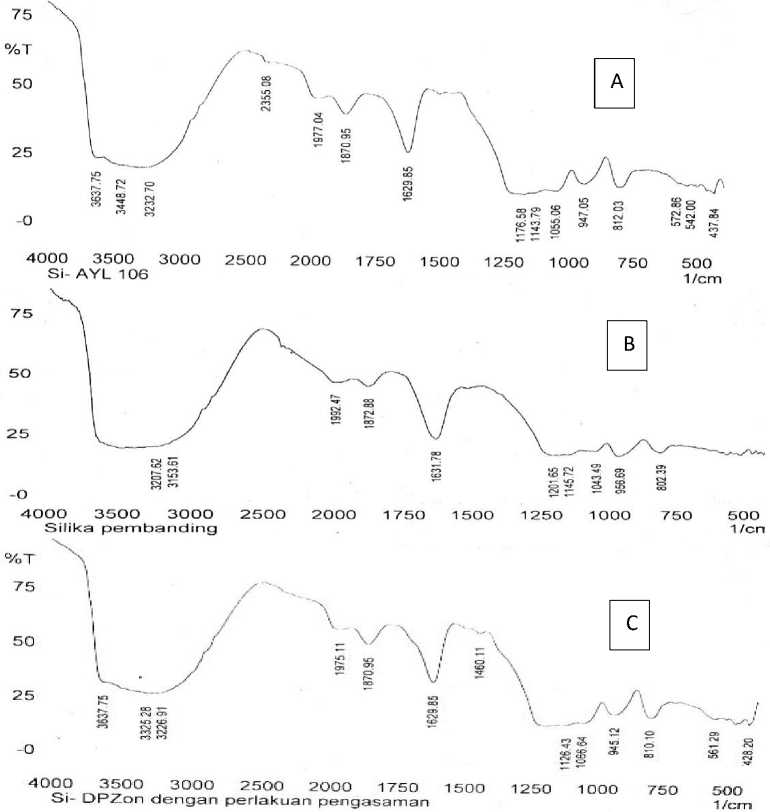
Gambar 1. Spekra Infra Merah (a) Si-60, (b)Si-ABB, dan (c) Si-DPZon
Keasaman Permukaan Adsorben dengan Titrasi Asam Basa
Keasaman permukaan adsorben silika gel termodifikasi ligan ditentukan untuk mengetahui seberapa banyak jumlah mmol situs asam yang terikat pada adsorben setiap gramnya. Keasaman permukaan ditentukan dengan metode titrasi balik titrasi asam basa. Adsorben direaksikan dengan NaOH berlebih dan sisa OH- yang tidak bereaksi diketahui
Luas Permukaan Adsorben dengan Metilen Biru
Luas permukaan adsorben ditentukan dengan metode metilen biru, dimana daya penyerapan metilen biru sebanding dengan luas permukaan adsorben. Luas permukaan adsorben silika gel termodifikasi ligan difenilkarbazon (Si-DPZon) lebih besar
melalui titrasi dengan asam. Hasil penelitian menunjukan bahwa besarnya keasaman permukaan adsorben Si-ABB dan Si-DPZon adalah 4,5568 ± 0,2453 dan 5,8384 ± 0,2466 mmol/g, dengan jumlah situs aktif masing-masing 27,4410 x 1020 dan 35,1588 x 1020 atom/g. Terjadi peningkatan keasaman permukaan dan jumlah situs aktif pada silkca gel termodifikasi difenilkarbazon dibandingkan tanpa modifikasi.
dibandingkan dengan adsorben silika gel tanpa modifikasi (Si-ABB). Luas permukaan adsorben Si-DPZon sebesar 22,3743 ± 0,0000 m2/g. Sedangkan luas permukaan adsorben Si-ABB sebesar 19,8262 ± 0,0024 m2/g. Hal ini kemungkinan disebabkan karena bentuk pori silika gel termodifikasi ligan difenilkarbazon relatif lebih homogen dengan ukuran makropori daripada silika gel tanpa modifikasi sehingga
lebih banyak metilen biru yang dapat teradsorpsi dibandingkan dengan yang tanpa modifikasi.
Kondisi optimum Adsorpsi Ion Logam Cr(III) dan Cu(II) pada adsorben
pH Optimum Adsorpsi Ion Logam Cr(III) dan Cu(II)
Berdasarkan penelitian didapatkan bahwa hubungan antara pH larutan terhadap daya serap Cr(III) dapat dilihat pada Gambar 4.
Berdasarkan Gambar 4 terlihat bahwa pH 5 merupakan pH optimum adsorpsi antara Cr(III) dengan adsorben silika gel termodifikasi difenilkarbazon maupun silika tanpa modifikasi. Pada pH 1-4 daya serap Cr(III) terhadap adsorben lebih sedikit, pH >5 tidak dikerjakan karena pada pH tersebut ion logam sudah mulai membentuk koloid dalam bentuk logam hidroksida (Sudiarta, 2013. Hal ini dipengaruhi oleh perbedaan spesiasi Cr(III) dalam larutan karena pengaruh pH. Spesiasi Cr(III) pada pH berbeda tergantung pada keseimbangan dalam larutannya. Perubahan pH menyebabkan keseimbangan pada larutan juga berubah. Spesies utama akuatik Cr(III) adalah Cr3+, Cr(OH)2+, Cr(OH)2+, dan Cr(OH)3. Pada kondisi asam jumlah kompleks hidrokso logam yang terbentuk lebih sedikit dan jumlah kation
logam bebas lebih banyak. Oleh karena itu, dalam pH asam lebih banyak ion Cr3+ yang dihasilkan daripada ion hidroksida logamnya. Pada pH rendah yaitu pH 1, 2, dan 3 adsorpsi ion Cr(III) rendah karena pada pH yang terlalu rendah dapat mengakibatkan kompetisi antara Cr3+ dan ion H+. Hal ini dikarenakan pada pH rendah permukaan adsorben dikelilingi oleh ion H+. Pada pH 4 sampai pH 6 ion Cr(OH)2+. Hidrolisis ini terjadi 50% pada pH 4 kemudian meningkat sekitar 70% pada pH 4,5 – 5 lalu menurun ke 40% pada pH 6. Kation Cr3+ memiliki kecenderungan yang kuat untuk membentuk senyawa kompleks yang stabil dengan air dan ligan seperti Cr(H2O)63+ yang dapat mendorong proses hidrolisis polimerisasi untuk menghasilkan ion kompleks yang lebih rumit dengan ukuran dan muatan yang lebih lambat. Oleh karena itu Cr(OH)2+ adalah ion yang paling banyak terserap pada kisaran pH 5. Pada pH 1, 2 dan 3, terjadi penurunan Cr(III) yang terserap pada adsorben Si-DPZon dan Si-ABB. Setelah pH optimum tercapai, terjadi penurunan Cr(III) yang terserap pada pH > 5 dan spesies yang dominan pada pH ini adalah ion Cr(OH)3 ditandai dengan terbentuknya endapan (Mahmoud dan Al-Saadi, 2007). Ion Cr(OH)3 ini diduga masuk kedalam pori silika gel dan secara fisika sehingga terjadi penurunan daya adsorpsi dari silika gel.
33
30
27
24
21
18
15

12345 pH
^^^aSi-DPZon Si-Gel tanpa modifikasi
Gambar 4 Pengaruh pH terhadap jumlah Cr(III) yang teradsorpsi pada adsorben Si-DPZon dan Si-ABB
Hubungan antara pH larutan terhadap daya serap Cu(II) pada adasorben Si-DPZon dan Si-ABB dapat dilihat pada Gambar 5. Tingkat keasaman atau pH larutan yang mengandung logam Cu(II) berpengaruh besar terhadap adsorpsi. pH dapat mempengaruhi muatan gugus-gugus fungsional dari permukaan silika gel termodifikasi difenilkarbazon (Si-DPZon) dan silika gel tanpa modifikasi (Si-ABB) yang berperan aktif
dalam proses penyerapan logam berat (Kalapathy, 2000). Demikian halnya perubahan pH dapat mempengaruhi proses adsorpsi, sehingga ion H+ dapat bereaksi dengan gugus fungsi pada sisi aktif permukaan adsorben. Variabel pH larutan merupakan hal penting dalam adsorpsi ion logam karena ion hidrogen merupakan ion yang berkompetisi kuat dengan ion logam.
27
25
23
21
19
17
15
13
11
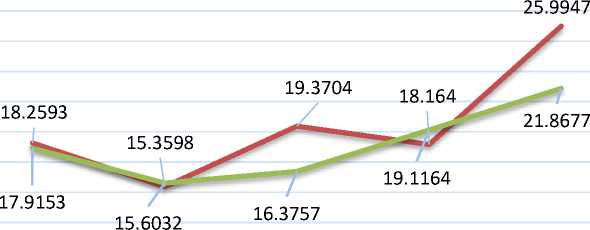
12345 pH
^^^BSi-DPZon Si-Gel tanpa modifikasi
Gambar 5 Pengaruh pH terhadap daya serap Cu(II) pada adsorben Si-DPZon dan Si ABB
Berdasarkan Gambar 5 terlihat bahwa pH 5 merupakan pH optimum adsorpsi antara Cu(II) dengan adsorben silika gel termodifikasi difenilkarbazon maupun silika tanpa modifikasi. Pada pH 1-4 daya serap Cu(II) pada adsorben lebih sedikit, demikian pula pada pH >5 daya serap Cu(II) cenderung konstan dari penelitian sebelumnya (Jonathan dkk., 2006) maka dari itu hanya dilakukan percobaan sampai pH 5. Kereaktifan gugus fungsional mempengaruhi interaksi dengan ion logam pada permukaan adsorben silika termodifikasi difenilkarbazon dan silika tanpa modifikasi (Asih dan Sudiarta, 2016). Mulai dari pH rendah sampai pada pH optimum memberikan peningkatan adsorpsi bagi ion Cu(II) selanjutnya setelah mencapai kondisi optimum maka adsorpsi cenderung stabil. Ion-ion logam dalam larutan sebelum teradsorpsi oleh adsorben terlebih dahulu mengalami hidrolisis, menghasilkan ion H+.
Spesies utama akuatik Cu(II) adalah Cu2+, Cu(OH)+ dan Cu(OH)2. Pada kondisi
asam jumlah kompleks hidrokso logam yang terbentuk lebih sedikit dan jumlah kation logam bebas lebih banyak. Oleh karena itu, dalam pH asam lebih banyak ion Cu2+ yang dihasilkan daripada ion hidroksida logamnya. pH yang terlalu rendah dapat mengakibatkan kompetisi antara Cu(II) dan ion H+. Hal ini dikarenakan pada pH rendah permukaan adsorben dikelilingi oleh ion H+ (karena gugus fungsi yang terdapat pada adsorben terprotonasi). pH yang terlalu rendah mengakibatkan tolakan yang menghalangi kation logam Cu(II) berdekatan ke sisi permukaan adsorben karena dalam kondisi asam permukaan adsorben dapat bermuatan positif akibat terprotonasi. Pada pH 3 sampai 4 ion Cu(II) mulai mengalami peningkatan adsorpi namun belum mencapai kondisi optimum karena masih terdapat ion H+ dan Cu2+ bebas namun sudah mulai terjadinya reaksi hidrolisis yang menghasilkan ion Cu(OH)+. Pada pH 5 merupakan kondisi optimum adsorben dapat menyerap tembaga (Cu). Hal ini dikarenakan tidak adanya
kompetisi ion H+ dengan permukaan adsorben. Permukaan adsorben tidak mengalami protonasi sehingga muatan permukaan adsorben menjadi negatif. Muatan ini yang selanjutnya meningkatkan tarikannya dengan ion Cu(II) yang bermuatan positif. Selain itu reaksi hidrolisis ion Cu(OH)+ terjadi lebih besar pada kondisi pH 5 (Jonathan D, 2006). Setelah pH optimum tercapai, terjadi penurunan Cu(II) yang terserap pada pH >5 dan spesies yang dominan pada pH ini adalah ion Cu(OH)2 yang memungkinkan masuk ke pori-pori adsorben menyebabkan penurunan adsorpsi.
Waktu Kontak Optimum Adsorpsi Ion Logam Cr(III) dan Cu(II)
Penentuan waktu kontak optimum pada proses adsorpsi ion logam Cr(III) dan Cu(II) oleh adsorben silika gel termodifikasi difenilkarbazon (Si-DPZon) dan silika gel tanpa modifikasi (Si-ABB) dilakukan pada kondisi pH 5 dengan beberapa variasi waktu kontak yaitu 5, 10, 15, 20, 30, 40, 50 dan 60 menit. Penentuan waktu kontak optimum ini bertujuan untuk mengetahui dan menentukan waktu Cr(III) atau Cu(II) dapat teradsorpsi secara maksimal oleh adsorben Si-DPZon dan Si-ABB . Waktu kontak optimum adsorben Si-DPZon dan Si-ABB dapat diketahui dengan membuat grafik antara banyaknya Cr(III) dan Cu(II) yang teradsorpsi (mg/g) terhadap waktu interaksi. Waktu kontak optimum adsorpsi tercapai ketika terjadi keseimbangan antara fasa permukaan (adsorbat yang diserap oleh
adsorben) dengan fasa ruah (adsorbat yang tersisa dalam larutan). Pada kondisi ini daya serap adsorbat pada adsorben relatif tetap terhadap waktu kontak (Ngatijo, 2013).
Grafik hubungan antara daya serap Cr(III) terhadap waktu kontak disajikan pada Gambar 6. Berdasarkan data pada Tabel 6 serta Gambar 6 di atas, dapat dilihat bahwa secara umum daya serap Cr(III) mengalami peningkatan diawal adsorpsi seiring dengan bertambahnya waktu interaksi tersebut berlangsung dari selang waktu adsorpsi 5-15 menit. Setelah waktu interaksi 15 menit daya serap Cr(III) cenderung turun naik hingga waktu interaksi 60 menit, tetapi tidak lebih tinggi daya penyerapan Cr(III) dari penyerapan pada waktu 15 menit. Hal ini disebabkan karena setelah mencapai waktu optimum (15 menit), ikatan antara adsorbat ion Cr(III) dengan adsorben silika gel termodifikasi difenilkarazon (Si-DPZon) dan adsorben silika gel tanpa modifikasi (Si-ABB) cenderung lepas karena ikatannya sangat lemah. Mudah lepasnya Cr(III) pada adsorben mengindikasikan bahwa jenis interaksi yang terjadi adalah interaksi fisik. Lemahnya ikatan yang terjadi antara adsorben Si-DPZon dan Si-ABB dengan ion Cr(III) mengakibatkan ketidakstabilan dari daya serap ion Cr(III). Daya serap Cr(III) pada adsorben Si-DPZon dengan waktu optimum 15 menit adalah sebesar 34,6927 mg/g sedangkan daya serap Cr(III) pada adsorben Si-ABB dengan waktu optimum 15 menit adalah sebesar 34,5445 mg/g.
35
34.8
34.6
34.4
34.2
34
34.5012
34.4333
4.470
34.544534.5692
34.4579
34.6927
∕ 34.5568

34.4271
34.5445
34.4147
34.3653
34.2788

34.352934.3962
34.2974
5 10 15 20 30 40 50 60
Waktu
^^MSi-DPZon ^^^^^^BSi-Gel tanpa modifikasi
Gambar 6 Pengaruh waktu adsorpsi terhadap daya serap Cr(III) pada adsorben Si-DPZon dan Si-ABB pada pH 5
Grafik hubungan antara daya serap Cr(II) terhadap waktu kontak disajikan pada Gambar 7. Berdasarkan data pada Gambar 7 dapat diketahui bahwa daya adsorpsi paling efektif untuk penyerapan ion logam Cu(II) pada waktu kontak optimum 15 menit. Daya serap Cu(II) pada adsorben silika gel termodifikasi difenilkarbazon (Si-DPZon) dengan waktu
optimum 15 menit adalah sebesar 26,49672 mg/g sedangkan daya serap Cu(II) pada adsorben silika gel tanpa modifikasi (Si-ABB) dengan waktu optimum 15 menit adalah sebesar 24,93210 mg/g. Hal ini dibuktikan dengan daya ikat ion logam Cu(II) yang sangat tinggi untuk kedua adsorben pada waktu kontak 15 menit.
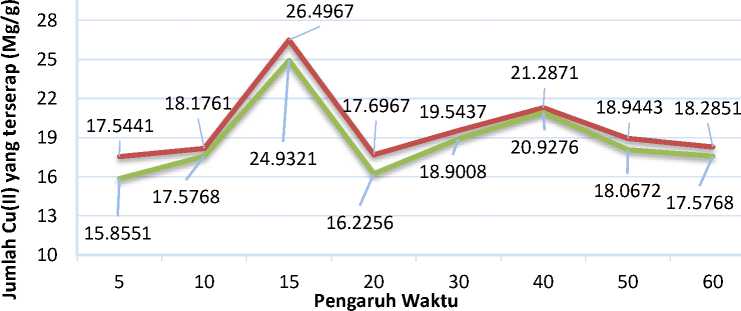
^^^MSi-DPZon Si-Gel tanpa modifikasi
Gambar 7 Waktu kontak optimum adsorpsi Cu(II) pada adsorben Si-DPZon dan Si-ABB pada pH 5
Kemampuan adsorben silika gel termodifikasi difenilkarbazon dan silika gel tanpa modifikasi menyerap ion logam Cr(III) dan Cu(II) pada kondisi adsorpsi optimumnya yaitu sebesar 34,6927 mg/g dengan persentase adsorpsi 86,7317 % untuk adsorpsi Cr(III) pada Silika gel termodifikasi difenilkarbazon sedangkan daya serap Cr(III) pada adsorben silika gel tanpa modifikasi sebesar 34,5445 mg/g dengan persentase adsorpsi 86,3611 %. Adsorpsi logam Cu(II) pada kondisi optimum sebesar 26,49672 mg/g dengan persentase adsorpsi 66,2418 % sedangkan daya serap Cu(II) pada adsorben silika gel tanpa sebesar 24,93210 mg/g dengan persentase adsorpsi 62,3302 %. Silika gel termodifikasi difeniskarbazon mempunyai kemampuan adsorpsi terhadap logam Cr(III) yang lebih besar dibandingkan dengan silika gel tanpa modifikasi. Sedangkan terhadap logam Cu(II), kedua adsorben mempunyai kemampuan adsorpsi relatif sama besar.
SIMPULAN DAN SARAN
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa silica gel termodifikasi difenilkarbazon berhasil dilakukan. Analisis FTIR menunjukkanbahwa Si-DPZon mengandung vibrasi (N-H) dari gugus amida, gugus (C-H)Ar aromatik serta gugus karbonil (C=O) yang berasal dari difenilkarbazon. Gugus –OH, silanol (Si-OH) dan Si-O-Si berasal dari silika gel. Silika gel termodifikasi difenilkarbazon memiliki keasaman permukaan (Kal) sebesar 5,8384 ± 0,2466 mmol/g, jumlah situs aktif sebesar 35,1588 x 1020 atom/g, dan luas permukaan spesifik adsorben silika gel termodifikasi difenilkarbazon (Si-DPZon) 22,3743 ± 0,0000 m2/g.
Adsorpsi logam Cr(III) dan logam Cu(II) pada adsorben silika gel termodifikasi difenilkarbazon (Si-DPZon) optimum terjadi pada pH 5 dan waktu interaksi 15 menit. Kemampuan adsorpsi logam Cr(III) oleh adsorben silika gel termodifikasi
difenilkarbazon (Si-DPZon) pada kondisi optimum yaitu sebesar 34,6927 mg/g dengan persentase adsorpsi 86,7317 %. Sedangkan
Kemampuan adsorpsi logam Cu(II) oleh adsorben silika gel termodifikasi
difenilkarbazon (Si-DPZon) pada kondisi optimum yaitu 26,49672 mg/g dengan persentase adsorpsi 66,2418 %.
Saran
Berdasarkan dari hasil penelititan, maka dapat disarankan agar melakukan penelititan lebih lanjut tentang modifikasi silika gel menggunakan ligan lainnya dan sintesis silika gel dari limbah produksi keramik atau limbah kaca dan uji adsorpsinya terhadap logam berat.
DAFTAR PUSTAKA
Asih, I. A. R. A. dan Sudiarta, I W., 2016, Adsorpsi Cr(III) Pada Silika Gel Termodifikasi Difenilkarbazon Secara Sol-Gel, Cakra Kimia (Indonesian EJournal of Applied Chemistry), Vol. 4, No. 1, p. 24 - 29, Juni 2016.
Azmiyawati, C., 2004, Modifikasi Silika Gel dengan Gugus Sulfonat untuk Meningkatkan Kapasitas Adsorpsi Mg(II), Indonesian Journal of Chemistry, Universitas Gajah Mada, Yogyakarta, 11-17
Hadi, I., Arsa, M., dan Sudiarta, I. W., 2013, Sintesis Silika Gel Dari Abu Sekam Padi dan Abu Limbah Pembakaran Batu Bata Dengan Metode Presipitasi, Jurnal Kimia (Journal of Chemistry), Vol. 7 No. 1.
Huljana, M. dan Rodiah, S., 2019, Sintesis Silika dari Abu Sekam Padi dengan Metode Sol-gel, Prosiding Seminar Nasional Sains dan Teknologi Terapan, Vol. 2 pp. 1-8
Jonathan D. Cuppett, Susan E. Duncan and Andrea M. Dietrich, 2006, Evaluation of Copper Speciation and Water Quality Factors That Affect Aqueous Copper Tasting Response, Chem. Senses 31: 689–69.
Kaim. W., and Schwederski, B., 1994, Bioinorganic Chemistry : Inorganic
Elements in The Chemistry of Life, Jhon Wiley, New York
Kalapathy, U., Proctor, A., dan Shultz, J, 2000, A Simple Metode for Production of Pure Silica from Rice Hull Ash, Bioresource Technology, 73, 257-262
Mahmoud, M., and Al-Saadi, M.S.M., 2007, Silica Physically adsorbed -diphenylcarbazone as a selective solid phase extractor and pre-concentratir for chromium(III) and iron(III), J Saudi Chem. Soc., 2007, Vol. 11, No. 2, p.p 331-340
Ngatijo, 2013, Sintesis Silika Termodifikasi Amin dan Aplikasinya sebagai Adsorben Ion Tembaga (II), Prosiding: Semirata FMIPA Universitas Lampung 2013
Nittaya, T., and Nuntiya, A., 2008, Synthesis and Characterization of Nanosilica from Rice Husk Ash Preparated by Precipitation Method, Journal Department of Industrial Chemistry, Faculty of Science, Chiang Mai Unversity, Thailand
Nopianingsih, N. N. S., Sudiarta, I W., dan Sulihingtyas, W. D., 2015, Sintesis Silika Gel Terimobilisasi Difenilkarbazon Dari Abu Sekam Padi Melalui Teknik Sol-Gel, Jurnal Kimia (Journal of Chemistry), Vol. 9, No. 2.
Sudiarta, I W., Diantariani, N. P., dan Suarya, P., 2013, Modifikasi Silika Gel Dari Abu Sekam Padi Dengan Ligan Difenilkarbazon, Jurnal Kimia (Journal of Chemistry), Vol 7, No. 1.
Sudiarta, I W. dan Suarya, P., 2018, Modifikasi Silika Gel Melalui Reaksi Heterogen Dengan Difenilkarbazon, Cakra Kimia (Indonesian E-Journal of Applied Chemistry), Vol. 6, No.. 2, p. 131-137.
Sudiarta, I W., Suarya, P. dan Widya C.M.P., 2018, Adsorpsi Multi Logam Berat Krom (III), Timbal(II), dan Tembaga(II) Dalam Sistem Larutan Binary Oleh Silika Gel Terimobilisasi Difenilkarbaida, Jurnal Kimia (Journal of Chemistry), Vol. 12, No. 2, p. 159164.
236
Discussion and feedback