MODIFIKASI SILIKA GEL DENGAN AMINOPROPIL TRIMETOKSISILAN (APTMS) DAN APLIKASINYA SEBAGAI ADSORBEN Cr(VI)
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 15 (2), JULI 2021 DOI: https://doi.org/10.24843/JCHEM.2021.v15.i02.p04
p-ISSN 1907-9850 e-ISSN 2599-2740
MODIFIKASI SILIKA GEL DENGAN AMINOPROPIL TRIMETOKSISILAN (APTMS) DAN APLIKASINYA SEBAGAI ADSORBEN Cr(VI)
S. Septhiani
Program Studi Matematika, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indraprasta PGRI, Jakarta, Indonesia
Email: silvia.septhiani@gmail.com
ABSTRAK
Tujuan Penelitian ini adalah untuk mengkaji kemampuan dan kapasitas silika termodifikasi (APTMS) dalam menyerap anion Cr(VI) Silika Gel (SG) yang disintesis dengan cara menambahkan larutan HCl 3M ke dalam campuran natrium silikat (Na2SiO3) dari abu sekam padi sebagai prekursor, sampai dengan pH 7. Proses pembuatan HAS dilakukan dengan menambahkan Aminopropyltrimethoxysilane (APTMS) pada SG hasil sintesis menggunakan metode grafting dengan pelarut toluena dalam sistem refluks. SG dan HAS dikarakterisasi dengan metode spektrofotometri inframerah (FTIR) dan difraksi sinar-X (XRD). Kajian adsorpsi dilakukan menggunakan sistem batch dengan variasi pH, waktu dan konsentrasi ion Cr (VI). Ion logam yang teradsorpsi dianalisis secara kuantitatif dengan metode spektrofotometri Uv-Vis. Model isoterm Freundlich dan Langmuir digunakan untuk menentukan kapasitas dan energi adsorpsi. Mekanisme reaksi dipelajari dalam desorpsi dengan variasi senyawa desorben dan variasi tingkat kebasaan desorben. Aplikasi adsorben dilakukan pada limbah pelapisan krom. pH optimum adsorpsi Cr (VI) yaitu pH 1 untuk SG dan pH 2 untuk HAS. Waktu maksimum adsorpsi SG dan HAS adalah 4 jam dan 30 menit. Studi kinetika adsorpsi menunjukan bahwa adsorpsi Cr (VI) mengikuti model kinetika orde 2 pada SG dan pseudo orde 2 pada HAS. Kapasitas adsorpsi maksimum HAS sebesar 55,8 mg/g dan SG sebesar 7,6 mg/g.
Kata kunci: adsorpsi, Cr(VI), hibrida aminosilika, limbah pelapisan krom, silika gel.
ABSTRACT
The aim of this study was to assess the ability and capacity of modified silica (APTMS) to adsorb Cr(VI) anion. Silica Gel (SG) was synthesized by adding 3M HCl solution into a mixture of sodium silicate (Na2SiO3) obtained from rice husk ash as a precursor, up to pH 7. The process of making HAS was carried out by adding Aminopropyltrimethoxysilane (APTMS) to the SG which was synthesized by grafting method using a solvent (toluene) in the reflux system. SG and HAS were characterized using infrared spectrophotometry (FTIR) and X-ray diffraction (XRD). Adsorption studies were performed using a batch system with variations in pH, time and concentration of Cr (VI) ions. The adsorbed metal ions were analyzed quantitatively using Uv-Vis spectrophotometry. The Freundlich and Langmuir isotherm model was used to determine the adsorption capacity and energy. The optimum pH of adsorption of Cr (VI) was pH 1 for SG and pH 2 for HAS. The maximum time for SG and HAS adsorption was 4 hours and 30 minutes. The adsorption kinetics study showed that Cr (VI) adsorption followed the second order kinetics model on SG and the second order pseudo on HAS. The maximum adsorption capacity of HAS was 55.8 mg/g and SG was 7.6 mg/g.
Keywords: adsorption, amino-silica hybrid, chrome plating wastewater, Cr(VI), silica gel.
PENDAHULUAN
Salah satu logam berat yang sifatnya toksik adalah kromium. Kromium merupakan logam keras berwarna abu-abu yang biasa digunakan oleh industri metalurgi, kimia, refractory (heat resistent application). Senyawa kromium stabil dalam bentuk trivalen dan heksavalen dilingkungan. Krom Cr(VI) bersifat
racun dan berbahaya dan banyak dijumpai dalam bentuk oksida. Dalam sistem perairan Cr(VI) lebih banyak ditemukan (Zhang, 2007). Industri elektroplating, penyamakan kulit, dan indutri tekstil merupakan sumber utama pencemaran kromium ke air permukaan. Limbah ini akan menyebabkan pencemaran serius terhadap lingkungan jika kandungan logam berat yang terdapat di dalamnya melebihi
ambang batas serta mempunyai sifat racun yang berbahaya dan dapat menyebabkan penyakit yang serius bagi manusia apabila terakumulasi dalam tubuh. Baku mutu untuk limbah krom heksavalen adalah 0,5 mg/L sesuai dengan Peraturan Menteri Lingkungan Hidup No 3 tahun 2010. Berdasarkan PP RI nomor 82 tahun 2001, dan World Health Organization (WHO) nilai ambang batas kromium pada air minum adalah 0,05 mg/L.
Adsorpsi lebih banyak dipakai dalam industri dalam pengolahan limbah karena memiliki beberapa keuntungan, yaitu lebih ekonomis dan juga tidak menimbulkan efek samping yang beracun, mudah dioperasikan, mampu menghilangkan bahan-bahan organik serta efisien dibanding dengan metode konvensional lain khususnya dari pandangan ekonomi dan lingkungan. Silika merupakan salah satu adsorben sering digunakan. Sumber silika biasanya adalah pasir kuarsa dan abu sekam padi. Menurut Narsito dkk.(2006) mineral kuarsa dalam pasir memiliki kristalinitas tinggi dan bersifat sangat stabil sehingga peleburan memerlukan temperatur yang tinggi.
Untuk meningkatkan kapasitas adsorpsi terhadap anion maka dalam penelitian ini digunakan 3-aminopropil trimetoksisilan (APTMS) sebagai modifier silika gel dan aplikasinya sebagai adsorben untuk penyerapan anion kromium.
Modifikasi silika secara kimia dapat dilakukan dengan dua proses, dengan organofungsionalisasi, dengan menggunakan agen organik dan dengan inorganofungsionalisasi, modifikasi permukaan dilakukan dengan kandungan organometalik atau logam oksida (Jal dkk., 2004). Modifikasi secara organofungsionalisasi dapat dilakukan secara heterogen dan homogen. Metode heterogen merupakan pengikatan tidak langsung gugus silanol dengan gugus silan dalam pelarut tertentu (grafting). Beberapa penelitian yang dilakukan dalam memodifikasi gugus aktif dari silika gel telah dilakukan oleh Walcarius (2002), Li (2008), dan Kumral (2007) yang menunjukan adanya peningkatan adsorpsi setelah proses modifikasi.
Isoterm adsorpsi
Isoterm adsorpsi merupakan suatu keadaan kesetimbanganyang pada keadaan tersebut tidak terjadi perubahan konsentrasi adsorbat pada permukaan adsorben, sehingga
laju adsorpsi sama dengan laju desorpsi. komponen dengan komponen lainnya dapat terjadi. Adsorpsi fasa padat-larutan umumnya mempunyai kecenderungan mengikuti model isoterm adsorpsi Langmuir.
Isoterm adsorpsi Langmuir didasarkan pada asumsi bahwa permukaan adsorben terdapat situs aktif yang sebanding dengan luas permukaan. Pada setiap situs aktif hanya satu molekul saja yang dapat diadsorpsi dan interaksiantar molekul adsorbat diabaikan
sehingga adsorpsi yang terbentuk adalah lapisan tunggal (monolayer adsorption). Pengikatan adsorbat pada permukaan adsorben dapat berlangsung secara kimia atau fisika tetapi harus cukup kuat untuk mencegah perpindahan molekul teradsorpsi pada permukaan (Oscik, 1982). Model isoterm Langmuir dapat
dinyatakan dalam persamaan:
C _ 1 C
M bK b
(1)
dimana C adalah konsentrasi kesetimbangan, M
adalah jumlah zat yang teradsorpsi per gram adsorben, b adalah kapasitas adsorpsi dan K adalah tetapan kesetimbangan adsorpsi.
Persamaan isoterm Langmuir mengasumsikan bahwa permukaaan adsorben homogen dan adsorpsi bersifat monolayer.
Energi adsorpsi dapat dihitung dengan menggunakan persamaan:
E = -∆G° = -RT∖nK (2) dengan E = energi adsorpsi (kJ/mol), R= tetapan gas universsal (8,314 J/molK), T = temperatur (K).
Persamaan isoterm Freundlich menunjukkan bahwa adsorpsi pada situs aktif permukaan bersifat heterogen dengan potensial adsorpsi yang berbeda. Persamaan isoterm Freundlich dapat dinyatakan dalam persamaan;
InQ = InKf + (lnCe)∕n (3)
Q adalah jumlah ion logam yang teradsorpsi (mmol/g), Kf merupakan konstanta energi ikat yang menunjukkan afinitas atau kapasitas adsorpsi adsorben, Ce merupakan konsentrasi Cr(VI) dalam keadaan kesetimbangan (mmol/L).
METODELOGI PENELITIAN
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah sekam padi. Sekam padi
yang digunakan sebagai sumber silika berasal dari limbah pertanian daerah Gunung Kidul, Yogyakarta. Bahan yang diperlukan untuk pembuatan adsorben adalah: Akuabides ,larutan HCl 3 M, larutan NaOH 4 M dan 1 M, 3-aminopropil trimetoksisilan (Merck) dan H2SO4 5 M. Bahan yang dibutuhkan untuk proses adsorpsi larutan dalam sistem batch meliputi: Larutan standar K2Cr2O7 1000 ppm , buffer 2-7, larutan 1,5-difenilkarbazida, aseton. Larutan yang dibutuhkan dalam aplikasi adsorpsi larutan limbah: larutan standar CrCl3 1000 ppm dan limbah pelapisan krom yang diambil dari daerah Tirtomolo padokan kidul Yogyakarta.
Peralatan
Alat yang digunakan dalam penelitian ini meliputi: spektrofotometer inframerah (Shimadzu FTIR-Prestige 21), Difraktometer sinar-X (Shimadzu 6000), dan
Spektrofotometer UV-Vis. Peralatan yang yang digunakan: Ayakan, tungku pemanas, oven, pengaduk magnetik, timbangan analitik, buchner, pompa vakum, sentrifuge, lumpang dan mortar, corong, serta peralatan gelas dan plastik.
Prosedur Kerja
Sintesis dan karakterisasi adsorben
Silika dari abu sekam padi diekstraksi dengan menggunakan NaOH 4 M, proses ektraksi ini akan menghasilkan larutan natrium silikat yang akan digunakan dalam pembuatan silika gel dan HAS. Sebanyak 100 ml natrium silikat ditambah dengan HCl 3 M tetes demi tetes sambil terus diaduk dengan stirring hot plate. Penambahan HCl dihentikan saat pH sudah mencapai 7. Gel yang terbentuk didiamkan 3 hari. Gel disaring dan cuci dengan akuabides sampai pH netral (pH sama dengan akuabides), keringkan di oven dengan temperatur 70 0C semalaman.
Sebanyak 5 gram silika gel direfluks dan stirer dengan pelarut toluena 50 ml dengan suhu 80 OC selama 30 menit. Setelah 30 menit ditambahkan 6 ml APTMS dan direfluks selama8 jam. Hasil yang diperoleh dicuci dengan toluena. Kemudian hasil yang diperoleh dikeringkan dengan oven 70 oC selama 1 hari. Adsorben yang diperoleh dikarekterisasi dengan menggunakan FTIR dan XRD.
Adsorpsi ion Cr(VI) oleh adsorben
Sebanyak 50 mg adsorben
ditambahkan dalam 20 ml larutan Cr(VI) 10
ppm dalam buffer pH 1, 2, 3, 4, 5, 6, dan 7. Campuran kemudian diaduk selama 2 jam. Kemudian dilakukan proses filtrasi untuk memisahkan adsorben dan filtrat. Kinetika adsorpsi dipelajari dengan melakukan adsorpsi logam Cr(VI) pada pH optimum dengan variasi waktu 1, 3, 5, 15, 30, 60, 120, 240, 480, dan 1440 menit. Isoterm adsorpsi dipelajari dengan melakukanadsorpsi Cr(VI) pada pH dan waktu optimum konsentrasi ion logam yang divariasi 5, 5, 10, 20, 50, 75, 100, dan 150 mg/L. Selanjutnya dipisahkan antara filtrat dengan adsorben. Masing-masing filtrat dianalisis dengan menggunakan spektrofotometer UV-Vis untuk mengetahui jumlah Cr(VI) yang tidakteradsorpsi. Konsentrasi Cr(VI) yang teradsorp dapat dihitung dengan menghitung selisih konsentrasi sebelum dan setelah adsorpsi.
Adsorpsi Cr(VI) dalam limbah pelapisan logam (elektroplating)
Kajian adsorpsi Cr(VI) juga dilakukan pada limbah sesungguhnya. Limbah pelapisan (elektroplating) diambil dari daerah tirtomolo padokan kidul, Bantul Yogyakarta. Langkah pertama menganalisis konsentrasi Cr total dengan menggunakan spektrofotometer serapan atom. Proses adsorpsi dilakukan dengan mengkontakan 50 mg adsorben HAS dengan limbah pelapisan. Setelah proses interaksi filtrat dan endapan dipisahkan dengan kertas saring Whatman 42. Filtrat dianalisis dengan menggunakan spektrofotometer UV-Vis.
HASIL DAN PEMBAHASAN
Pembuatan silika gel dalam penelitian ini dilakukan dengan menggunakan metode yang sama dengan Nuryono (2004), Kalapathy (2002) dan Sakti (2010). Larutan Na2SiO3 hasil destruksi basah-kering abu sekam padi dengan NaOH. Hasil penelitian terdahulu melaporkan bahwa proses sintesis silika dengan cara kering dapat menghasilkan silika sebesar 65%, sedangkan metode basah mampu menghasilkan silika sebear 86,6% (Nuryono, 2004) sedangkan proses presipitasi silika dengan menggunakan larutan HCl sampai dengan pH optimum 7 akan menghasilkan silika sebesar 91% (Kalapathy, 2002).
Proses grafting senyawa APTMS dilakukan dengan mengikuti penelitian yang dilakukan oleh Walcarius (2002). Tahap awal proses grafting adalah mencampurkan silika gel dengan pelarut toluena sampai terbentuk
suspensi, kemudian dilakukan penambahan APTMS tetes demi tetes. Campuran ini kemudian direfluks sampai dengan 8 jam. Proses grafting dilakukan dengan cara merefluks karena interaksi padatan dengan cairan akan jauh lebih sulit dibandingkan interaksi cairan-cairan. Setelah 8 jam filtrat dan residu dipisahkan. Residu dicuci dengan toluena dan kemudian dikeringkan dengan oven pada temperatur 70 oC selama 1 hari.
Karakterisasi
Karakterisasi gugus fungsi
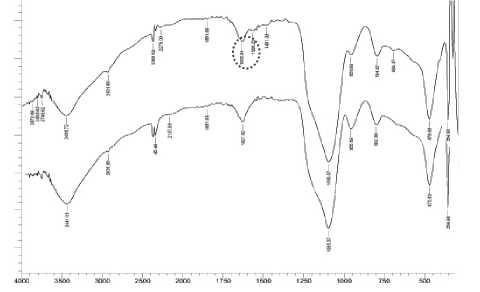
Gambar 1. Spektra IR SG (a), HAS (b)
Gambar 1. menunjukkan pola serapan inframerah gugus fungsional pada silika gel (SG) hasil sintesis yang diintepretasikan sebagai berikut: pita serapan tajam paada bilangan gelombang 3441,01 cm-1 menunjukkan vibrasi ulur O-H pada gugud silanol (Si-OH), pita pada serapan 1627,92 cm-1 merupakan vibrasi tekuk O-H dari Si-OH. Vibrasi N-H pada silika hasil modifikasi ditunjukkan oleh serapan pada bilangan gelombang 3500-3100 cm-1. Serapan gugus N-H ini mungkin tumpang tindih dengan serapan gugus OH dari Si-OH pada bilangan gelombang. Munculnya serapan baru tersebut didukung dengan terjadinya pergeseran serapan dari gugud siloksan. Pita serapan pada bilangan gelombang 1481,33 cm-1 menunjukkan vibrasi ulur dari C-C dari metilen (CH2) dan pita pada bilangan gelombang pada 1566,20 cm-1 menunjukkan vibrasi tekuk N-H amina primer. Bilangan gelombang 694,37 cm-1 dimungkinkan merupakan serapan dari N-H wagging (kibasan) (Stuart, 2004). Pergeseran vibrasi ulur simetris Si-O dari Si-O-Si pada SG 802,39 cm-1 muncul pada bilangan gelombang 794,67 pada HAS dan pita kuat pada 1095,57 cm-1 yang merupakan vibrasi ulur asimetris SiO dan Si-O-Si. Hasil sintesis menunjukan
adanya perubahan spektra Si-O-Si akibat imobilisasi senyawa APTMS membentuk HAS. Karekterisasi hibrida amino silika juga telah dilakukan oleh Li (2008), Sakti (2010) dan Sudjarwo (2011) dan menunjukkan spektra dengan pola serapan yang mirip dan bilangan gelombang yang berdekatan dengan karakteristik hirida amino silika pada penelitian ini
Karakterisasi dengan difraktometer sinar-X
Difraktrogram sinar-X silika gel dan hibrida aminosilika hasil sintesis ditunjukkan pada Gambar 5.2.Dari analisis XRD terlihat hump (undukan) dengan intensitas maksimum dengan puncak melebar pada 2 teta disekitar 22 – 22,4o. Menurut Kalapathy dkk. (2000) pola semacam ini menunjukkan struktur silika yang amorf. Pola difraksi sinar –X untuk SG dan HAS memiliki bentuk yang mirip dan intensitas puncak pada nilai 2θ yang berdekatan. Hal ini menunjukkan bahwa penambahan senyawa aminopropil trimetoksisilan pada silika gel tidak mempengaruhi struktur amorf adsorben yang dibuat.
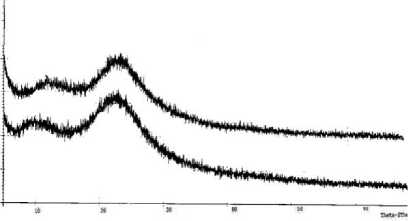
Gambar 2. Spektra XRD SG(a), HAS (b)
Adsorpsi Larutan Cr(VI) Variasi pH
Kenaikan pH menyebabkan Cr(VI) teradsorpsi dengan baik hingga mencapai kondisi optimum pada pH 2. Selanjutnya pada pH medium lebih dari dua terlihat terjadi penurunan adsorpsi oleh HAS. Hal ini disebabkan karena pada kondisi asam konsentrasi ion H+ dalam larutan cukup tinggi, gugus amina (-NH2) pada HAS akan terprotonasi menjadi ion amonium (-NH3+) yang bermuatan positif sehingga memungkinkan terjadi proses tarik menarik antara ion positif dari amonium dengan ion negatif dari spesiasi kromium.. Kenaikan pH menyebabkan penurunan konsentrasi ion postif dalam larutan sehingga gugus amina yang terprotonasipun semakin berkurang. Rendahnya derajat protonasi ini menyebabkan penurunan
peluang anion kromat untuk dapat terikat pada situs aktif, maka jumlah ion Cr(VI) yang teradsorpsi juga semakin menurun.
Kenaikan pH menyebabkan Cr(VI) teradsorpsi dengan baik hingga mencapai kondisi optimum pada pH 2. Selanjutnya pada pH medium lebih dari dua terlihat terjadi penurunan adsorpsi oleh HAS. Hal ini disebabkan karena pada kondisi asam konsentrasi ion H+ dalam larutan cukup tinggi, gugus amina (-NH2) pada HAS akan terprotonasi menjadi ion amonium (-NH3+) yang bermuatan positif sehingga memungkinkan terjadi proses tarik menarik antara ion positif dari amonium dengan ion negatif dari spesiasi kromium.. Kenaikan pH menyebabkan penurunan konsentrasi ion postif dalam larutan sehingga gugus amina yang terprotonasipun semakin berkurang. Rendahnya derajat protonasi ini menyebabkan penurunan peluang anion kromat untuk dapat terikat pada situs aktif, maka jumlah ion Cr(VI) yang teradsorpsi juga semakin menurun.
Pada pH 1 SG lebih dominan dalam bentuk SiOH2+. Muatan positif SG pada pH yang rendah (asam) menyebabkan penyerapan anion Cr(VI) meningkat, karena terjadinya gaya tarik menarik antara ion positif adsorben dan ion negatif dari adsorbat. Kenaikan pH menyebabkan spesies SiOH2+ berubah menjadi SiOH yang bermuatan netral sehingga mengakibatkan gaya tarik antara adsorben dan adsorbat berkurang. Hal ini yang menyebabkan semakin menurunnya adsorpsi pada SG seiring dengan kenaikan pH larutan.
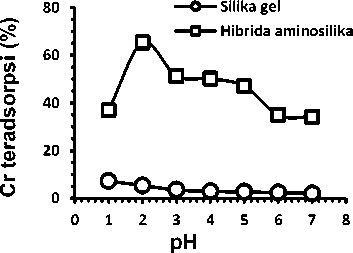
Gambar 3. Pengaruh pH sistem terhadap adsorpsi Cr(VI)
Variasi waktu kontak
Grafik pengaruh waktu kontak terhadap adsorpsi Cr(VI) menunjukkan bahwa adsorpsi oleh ion Cr(VI) oleh HAS efektif pada 30 menit pertama. Data diatas menunjukkan bahwa
adsorpsi ion Cr(VI) terus meningkat sampai dengan tercapai kesetimbangan pada 30 menit. Setelah mencapai waktu optimum 30 menit terlihat terjadi penurunan adsorpsi adsorbat oleh adsorben, hal ini dimungkinkan karena pada menit pertama situs aktif yang dimiliki oleh HAS masih cukup banyak sehingga proses adsorpsi berlangsung cepat pada awal dikontakkan. Namun tidak semua adsorbat yang terikat pada adsorben merupakan ikatan elektrostatik, dimungkinkan adsorpsi fisika juga ikut berperan dalam proses adsorpsi sehingga memungkinkan terjadinya pelepasan kembali adsorbat yang terikat akibat proses pengadukan pada adsorben telah jenuh.
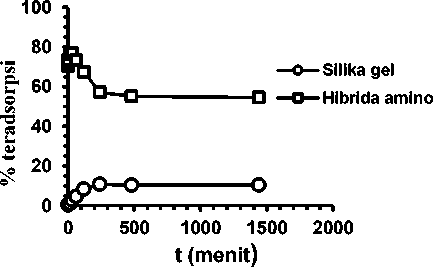
Gambar 4. Pengaruh waktu kontak terhadap adsorpsi Cr(VI)
Kinetika adsorpsi dan hasil perhitungan nilai k masing-masing model kinetika reaksi dan linearitasnya dapat dilihat pada Tabel 1 berikut ini.
Tabel 1. Hasil Uji model kinetika adsorpsi terhadap ion Cr(VI)
|
Model K |
inetika |
Silika gel |
HAS |
|
Orde 1 |
k (min-1) |
- |
8 x 10-3 |
|
R2 |
0,929 |
0,783 | |
|
Orde 2 |
k (min-1) |
2 x 10-3 |
158 x 10-3 |
|
R2 |
0,934 |
0,799 | |
|
Pseudo- |
k (min-1) |
46 x10-3 |
216 x 10-3 |
|
orde 1 |
R2 |
0,862 |
0,425 |
|
Pseudo- |
k (min-1) |
0,59 |
93,37 |
|
orde 2 |
R2 |
0,511 |
0,999 |
Dari data ini diketahui baik adsorpsi dengan menggunakan HAS mengikuti model kinetika pseudo orde 2 dan silika gel mengikuti kinetika orde 2.
Variasi Konsentrasi Adsorbat
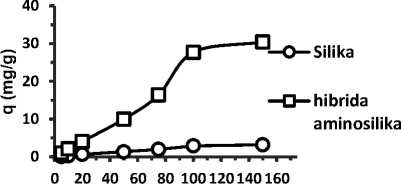
Co (mg/L)
Gambar 5. Pengaruh konsentrasi adsorbat terhadap kapasitas adsorpsi Cr(VI)
Dari data yang disajikan secara umum bahwa kapasitas adsorpsi dari adsorben hibrida amino silika terhadap Cr(VI) cenderung lebih besar dibandingkan dengan adsorben silika gel, kapasitas adsorpsi semakin meningkat dengan naiknya konsentrasi adsorbat. Hal ini disebabkan karena pada adsorben hibrida amino silika memiliki sejumlah situs aktif yang berperan untuk mengikat anion Cr(VI).
Tabel 2. Parameter Langmuir dan Freundlich
|
Adsorben |
Langmuir |
Freundlich | ||||
|
Qmax (mg/g) |
E (kJ/mol) |
R2 |
Kf |
n |
R2 | |
|
Silika gel |
7,57 |
14,02 |
0,63 |
28,3 |
1,13 |
0,99 |
|
Hibrida aminosilika |
55,84 |
16,63 |
0,86 |
1,45 |
1,10 |
0,99 |
Dari data diatas diketahui bahwa kapasitas adsorpsi ion Cr(VI) mengalami peningkatan dengan adanya modifikasi adsorben. Kapasitas maksimum adsorpsi HAS 55,848 mg/g dan 7,547 mg/g silika gel. Kajian isoterm adsorpsi menunjukan bahawa silika gel ataupun HAS cenderung mengikuti isoterm Freundlich, hal ini ditunjukkan dari nilai perbandingan linearitas isoterm Langmuir dan freundlich. Pada pendekatan isoterm Freundlich silika gel dan HAS memiliki nilai linearitas yang baik yaitu dengan nilai R2 0,993 dan 0,997, sedangkan pada pendekatan isoterm Langmuir R2 hasil perhitungan hanya 0,635 silika gel dan 0,861 HAS. Perhitungan energi adsorpsi yang dihasilkan oleh silika gel dan HAS juga relatif kecil. Menurut Adamson (1990) proses adsorpsi kemisorpsi terjadi dengan energi lebih besar dari 20,92, sehingga adsorpsi silika gel dan HAS pada larutan Cr(VI) dapat dikatakan adsorpsi fisika karena besarnya energi kurang dari 20,92 kJ/mol
Adsorpsi limbah lapisan krom
Aplikasi HAS dalam limbah pelapisan krom menunjukan nilai adsorpsi yang cukup
besar yakni sebesar 85% Cr(VI) dalam limbah dapat diserap. Hal ini membuktikan bahwa adsorben HAS memiliki kemampuan adsorpsi yang baik dalam menyerap Cr(VI).
SIMPULAN
Adsorpsi Cr(VI) berlangsung efektif pada pH rendah, hal ini disebabkan karena gugus amin yang ada pada permukaan ada pada permukaan adsorben dapat terprotonasi pada pH rendah. Adsorpsi Cr(VI) berlangsung efektif pada pH 2 pada HAS dan dengan menggunakan SG optimum pada pH 1. Terjadi peningkatan kapasitas adsorpsi Cr(VI) setelah dilakukan modifikasi adsorben dengan APTMS. Kapasitas adsorpsi HAS sebesar 55,8 mg/g dan kapasitas adsorpsi oleh silika gel 7,6 mg/g. Efektivitas adsorpsi Cr(VI) dalam limbah krom dengan menggunakan HAS adalah sebesar 85,2%.
DAFTAR PUSTAKA
Adamson,. W. 1990. Physical Chemitry of Surface. 5th ed. New York: John Wiley and Sons.
Jal, P. K., Patel, S. dan Mirsha, B. K. 2004. Chemical Modification of Silica by Immobilization of Functional Group for Extractive Concentration of Metal Ions. Talanta. 62:1005-1028.
Kalaphaty, U., Proctor, A. and Shultz, J. 2000. A Simple Method For Production of Silica From Rice Hull Ash, Bioresour Technol. 85: 285-289.
Kalapathy, U., Proctor, A., Shultz, B. 2002. An Improved Method for Production of Silica from Rice Hull. Bioresour Technol. 85: 285-289.
Li, J., Miao, X., Hao, Y., Zhao, J., Sun, X., Wang, L. 2008. Synthesis AminoFunctionalization of Mesoporous Silica and Its Adsorption of Cr(VI). J. Colloid and Interface Sci. 309-314.
Narsito, Nuryono. 2006. Imobilisasi Senyawa Amin pada Silika Gel dari Abu Sekam Padi Melalui Proses Sol Gel dan Kinetika Adsorpsi Ion Logam Divalen. Laporan Hasil Penelitian. Direktorat Jendral pendidikan tinggi departemen
pendidikan nasional. UGM.
Ngah W. S. W., Hanafiah, M. A. K. M. 2007. Removal of Heavy Metal Ions From Wastewater by Chemically Modified Plant Waste as Adsorbents, J.Colloid Surf. Sci. Ngah, W.S.W., Kamari A., Fathinathan S., 2006, Adsorption of
Chromium From Aqueous Solution Using Chitosan Beads. Springer. 2: 249-257.
Nuryono. 2004. Pengaruh Konsentrasi NaOH pada Peleburan Abu Sekam Padi Cara Basah, Prosiding Seminar Nasional Hasil Penelitian FMIPA Undip Semarang. 47-51.
Rachdiati, A. 2007. Penggunaan Kitosan untuk Penghilang Krom VI Dalam Air, Jurnal Metalurgi. 2(22).
Sakti, S. C. W. 2010. Sintesis dan Karakterisasi Hibrida AminoSilika Tercetak Ionik Sebagai Adsorben ion Au (III). Tesis. Fakultas MIPA UGM. Yogyakarta.
Stuart, B. 2004. Infrared Spektroscopy Fundamentals and Aplications. New York: John Wiley and Sons.
Sudjarwo, W. A. A., 2011. Teknik Imprinting Sol-Gel dan Grafting Dalam Pembuatan Hibrida AminoSilika untuk Adsorpsi Selektif Logam Transisi. Tesis. FMIPA UGM. Yogyakarta
Tang. S.C.N., Lo I. M. C. 2011. Comparative Study of the Adsorption Selectivity of Cr(VI) onto Cationic Hydrogels with Different Functional Groups. Water, Air & Soil Pollution. 223(4).
Zhang, Chunlong C. 2007. Fundamental of Enviromental Sampling and Analysis. America: Wiley.
Zuryati, UK. 2005. Pembuatan Silika Gel Dari Abu Sekam Padi Menggunakan Asam Sitrat dan Asam Klorida
sertaKarakterisasinya. Skripsi. FMIPA UGM. Yogyakarta.
154
Discussion and feedback