UJI AKTIVITAS ANTIBAKTERIEKSTRAK METANOL KULIT PISANG HIJAU LUMUT (Musa x paradisiaca L.) TERHADAP BAKTERI Staphylococcus aureus dan Escherichia coli SERTA IDENTIFIKASI GOLONGAN SENYAWAMETABOLIT SEKUNDER
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 15 (2), JULI 2021 DOI: https://doi.org/10.24843/JCHEM.2021.v15.i02.p02
p-ISSN 1907-9850
e-ISSN 2599-2740
UJI AKTIVITAS ANTIBAKTERIEKSTRAK METANOL KULIT PISANG HIJAU LUMUT (Musa x paradisiaca L.) TERHADAP BAKTERI Staphylococcus aureus dan Escherichia coli SERTA IDENTIFIKASI GOLONGAN SENYAWAMETABOLIT SEKUNDER
W. S. Rita*, N. K. L. E. Yanti, dan I W.G. Gunawan
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia
*Email: susanah.rita@unud.ac.id
ABSTRAK
Kulit Pisang Hijau Lumut (Musa x paradisiaca L.) merupakan limbah organik yang masih belum banyak dimanfaatkan. Penelitian ini bertujuan untuk menentukan Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM) ekstrak metanol Kulit Pisang Hijau Lumut terhadap bakteri Staphylococcus aureus dan Escherichia coli, serta mengetahui golongan senyawa metabolit sekundernya. Ekstraksi dilakukan dengan metode maserasi, uji aktivitas antibakteri dilakukan dengan metode sumur difusi agar, dan skrining fitokimia dilakukan dengan menggunakan pereaksi pendeteksi wagner dan mayer untuk alkaloid, pereaksi Lieberman-Burchard untuk steroid/terpenoid, MgHCl untuk flavonoid, FeCl3 untuk fenol, dan HCl untuk saponin. Maserasi 1kg kulit pisang hijau menghasilkan ekstrak kental metanol sebanyak 83,45 gram. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak metanol memiliki nilai KHM sebesar 8% dan KBM sebesar 10% terhadap bakteri S. aureus dan KHM sebesar 10% serta KBM sebesar 20% terhadap bakteri E.coli. Skrining fitokimia menunjukkan hasil positif terhadap alkaloid, fenol, flavonoid dan terpenoid.
Kata kunci: kulit pisang hijau lumut, Staphylococcus aureus, Escherichia coli, antibakteri, uji fitokimia.
ABSTRACT
Hijau lumut banana peels (Musa x paradisiaca L.) are organic waste that is still not widely used. This study aimed to determine the Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) of methanol extract against Staphylococcus aureus and Escherichia coli as well as to know the secondary metabolite compounds. Extractions were done by maceration methods, antibacterial activity assay was carried out by agar well diffusion method, and phytochemical screening was performed using secondary metabolite detection reagents such as alkaloids, flavonoids, steroids/terpenoids, phenols, and saponins. Maceration of 1kg of the banana peels produced 83.45 grams of crude methanol extract. The activity assays of methanol extract indicated that the MIC and MBC against S.aureus was 8% and 10%, while against E. coli was 10% and 20%, respectively. The result of phytochemical screening showed that the banana peels were positive for alkaloids, fenols, flavonoids dan terpenoids.
Keywords: banana peels, Staphylococcus aureus, Escherichia coli, antibacterial, phytochemically test.
PENDAHULUAN
Lingkungan tercemar mengakibatkan tumbuhnya bakteri merugikan dan menyebabkan berbagai macam penyakit. Bakteri penyebab penyakit yang paling banyak menyerang manusia adalah Staphylococcus aureus dan Escherichia coli. Staphylococcus aureus termasuk ke dalam bakteri gram positif yang hidup sebagai saprofit di dalam saluran membran tubuh manusia, saluran usus, kelenjar keringat, serta permukaan kulit, sedangkan bakteri Escherichia coli termasuk ke dalam bakteri gram negatif yang dapat menyebabkan
infeksi saluran kencing dan diare (Jawetz et al., 2007).
Beberapa jenis patogen seperti Pseudomonas sp, Klebsganiiella sp, Escherichia coli, Streptococcusβ haemolyticus, Staphylococcus epidermidis, dan Staphylococcus aureus mempunyai resistensi tertinggi terhadap antibiotik jenis amoksisilin, tetrasiklin, ampisilin, kloramfenikol, dan penisilin G (Refdanita dkk, 2004). Hal ini mendorong peneliti untuk mencari agen antibakteri baru untuk menghasilkan obat-obat baru yang lebih aman (Gurib-Fakim, 2006).
Beberapa hasil penelitian telah menunjukkan bahwa tanaman yang dapat digunakan sebagai antibakteri adalah tanaman pisang. Salah satu bagian tanaman pisang yang sesungguhnya juga banyak memiliki manfaat adalah kulit pisang. Banyak peneliti yang sudah melakukan penelitian terhadap berbagai varietas kulit pisang, seperti Ananta dkk. (2018) melaporkan limbah kulit pisang lokal Bali yakni kulit pisang mas, kulit pisang susu, dan kulit pisang kayu yang menunjukkan hasil positif terhadap bakteri S.aureus dan E. coli. Kulit pisang mas menunjukkan aktivitas antibakteri paling aktif. Diameter rata-rata zona bening ekstrak n-butanol kulit pisang mas konsentrasi 10% terhadap bakteri S.aureus sebesar 16,36 mm, dan terhadap bakteri E.coli sebesar 17,15 mm.Penelitian lain dilakukan oleh Wahyuni dkk. (2019) fraksi n-butanol kulit pisang kepok kuning (Musa paradisiaca L.) mampu menghambat bakteri S. aureus dan E. coli dengan nilai Konsentrasi Hambat Minimum (KHM) pada konsentrasi 0,5% untuk bakteri S. aureus dan 0,1% untuk bakteri E. coli dengan diameter hambat masing-masing 6,75 mm dan 7 mm.
Dari berbagai varietas kulit pisang tersebut, terdapat kulit pisang lain yang masih belum diteliti aktivitas antibakterinya yakni kulit pisang hijau lumut. Berdasarkan uji pendahuluan, ekstrak metanol kulit pisang hijau lumut pada konsentrasi 20% dapat menghambat pertumbuhan bakteri S. aureus dan E. coli dengan daya hambat berturut-turut 11,25 dan 9,25 mm. Penelitian ini diharapkan dapat memberikan informasi mengenai aktivitas antibakteri ekstrak metanol kulit pisang hijau lumut (Musa x paradisiaca L.) terhadap bakteri S. aureus dan E. coli serta kandungan golongan senyawa metabolit sekunder dengan metode skrining fitokimia.
MATERI DAN METODE Bahan
Bahan yang digunakan pada penelitian ini adalah kulit buah pisang hijau lumut (Musa x paradisiaca L.) yang diperoleh di kawasan Denpasar, Bali. Bahan kimia yang digunakan adalah metanol (p.a dan teknis), kertas saring, akuades, Nutrient Agar (NA), Nutrient Broth (NB), KMnO4, etanol 70%, Tween 80, kloroform, amonia, H2SO4 pekat, serbuk HgCl2,
serbuk KI, serbuk I2, asetat anhidrat, serbuk Mg, HCl pekat, FeCl3, HCl 2N.
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah pisau, blender, ayakan, neraca analitik, gelas beker, gelas ukur, plastik warp, kain kasa, corong gelas, cawan porselen, oven, spatula, rotary vacum evaporator, penangas air, autoklaf, pipet mikro, batang pengaduk, labu ukur, Laminar Air Flaw (LAF), inkubator, bunsen, jarum ose, cork borer, cawan petri, penggaris, pipet tetes, tabung reaksi.
Cara Kerja
Penyiapan bahan
Kulit pisang hijau lumut matang dibersihkan dan dipotong kecil-kecil lalu dikeringkan tidak dibawah sinar matahari langsung. Setelah kering, kulit pisang diblender kemudian diayak hingga menjadi serbuk.
Penentuan kadar air
Penentuan kadar air dilakukan dengan dipanaskan cawan porselen kosong beserta tutupnya pada suhu 105°C selama 60 menit dan ditimbang. Pemanasan diulang beberapa kali hingga berat konstan (m0). Serbuk kulit pisang dimasukkan sebanyak 2 gram lalu ditimbang (m1) kemudian dipanaskan kembali hingga berat konstan (m2). Persentase kadar air maksimal pada sampel kering adalah 10% (SNI, 1995). Rumus persentase kadar air:
% Kadar Air = m1 - m2 ×100% (1)
m1 - m0
Keterangan :
m0 = Berat cawan + tutupnya
m1 = Berat cawan + tutupnya + sampel sebelum dikeringkan
m2 = Berat cawan + tutupnya + sampel setelah dikeringkan.
Ekstraksi kulit pisang hijau lumut (Musa x paradisiaca L.)
Sebanyak 1 kg sampel serbuk kulit pisang hijau lumut diekstraksi dengan teknik maserasi menggunakan pelarut metanol sebanyak 3 liter. Proses maserasi dilakukan selama 3 kali pengulangan setiap 24 jam (3 x 24 jam) tanpa terkena sinar matahari, lalu disaring menggunakan kain kasa dan kertas saring
hingga filtrat dan ampas terpisah. Filtrat yang diperoleh diuapkan dengan rotary vacum evaporator hingga diperoleh ekstrak kental metanol (ekstrak kasar).
Uji aktivitas antibakteri
Penentuan Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM)
Pengujian aktivitas antibakteri ekstrak metanol kulit pisang hijau lumut (Musa x paradisiaca L.) dilakukan dengan metode sumur difusi agar. Seluruh alat dan bahan yang digunakan disterilisasi terlebih dahulu dengan autoklaf selama 60 menit. Setelah itu, pengujian dilakukan didalam Laminar Air Flaw (LAF).
Suspensi bakteri sebanyak 200 μL dan 10 mL nutrien agar ditambahkan pada cawan petri, diaduk lalu ditunggu hingga memadat. Setelah memadat, dibuat sumur difusi menggunakan cork borer berukuran 0,5 cm yang dipanaskan terlebih dahulu dengan api bunsen kemudian ditekankan pada media sehingga terbentuk sumur difusi.
Ekstrak metanol kulit pisang hijau lumut dengan variasi konsentrasi 100, 75, 50, 40, 30, 20, 15, 10, 8, 6, 5, 4, 3, 2, 1, dan 0% (v/v) serta kontrol negatif (Tween 10%) dan kontrol positif (Amoksisilin 0,03%) diambil sebanyak 20 μL kemudian dimasukkan ke dalam sumur difusi dan diinkubasi selama 24 jam dengan suhu 37oC. Diameter zona bening yang terbentuk diukur menggunakan penggaris dalam satuan milimeter (mm).
Konsentrasi ekstrak terkecil yang mampu menghambat pertumbuhan bakteri ditentukan sebagai Konsentrasi Hambat Minimum (KHM). Ekstrak methanol dengan variasi konsentrasi diinkubasi kembali selama 24 jam dengan suhu 37oC. Ada tidaknya pertumbuhan koloni bakteri pada setiap konsentrasi ekstrak diamati. Konsentrasi ekstrak terkecil yang tidak terdapat pertumbuhan koloni bakteri disekitar diameter zona bening ditentukan sebagai Konsentrasi Bunuh Minimum (KBM). Uji aktivitas antibakteri dilakukan dengan tiga kali pengulangan.
Skrining Fitokimia
Uji Alkaloid
Ekstrak sebanyak 0.1 gram ditambahkan 10 mL kloroform dan ditambahkan beberapa tetes amonia dan beberapa tetes H2SO4 pekat, sehingga terbentuk dua lapisan. Lapisan atas diambil dan dibagi menjadi 2 tabung reaksi, kemudian ditambahkan pereaksi Meyer, dan Wagner. Keberadaan alkaloid ditandai dengan terbentuknya endapan putih pada pereaksi Meyer, dan endapan coklat pada pereaksi Wagner (Harborne, 1996).
Uji Terpenoid dan Steroid
Sebanyak 0,5 gram ekstrak dilarutkan dengan 1 mL metanol, kemudian dipindah ke dalam plat tetes lalu ditambahkan 3 tetes asam asetat anhidrat dan 1 tetes H2SO4 pekat (Uji Lieberman Burchard). Warna merah atau ungu menunjukkan triterpenoid dan warna hijau atau biru menunjukkan steroid (Harborne, 1996).
Uji Flavonoid
Ekstrak dilarutkan dalam metanol, kemudian ke dalam larutan ditambahkan 0,05 gram serbuk magnesium dan ditambahkan HCl pekat. Terbentuk larutan berwarna merah, kuning maupun jingga menunjukkan adanya flavonoid. (Harborne, 1996).
Uji Fenol
Sebanyak 1 mL ekstrak yang sudah dilarutkan dengan metanol kemudian ditambahkan 2 tetes larutan FeCl3 5%. Pembentukan warna hijau atau hijau biru menunjukkan adanya senyawa fenol. (Harborne, 1996).
Uji Saponin
Ekstrak ditambahkan dengan 10 mL aquades kemudian dipanaskan dan dikocok kuat selama 10 detik, apabila terbentuk buih maka ditambahkan 1 tetes HCl 2N dan dikocok kembali. Adanya busa yang stabil setelah penambahan HCl 2N menunjukkan adanya saponin (Harborne, 1996).
HASIL DAN PEMBAHASAN
Uji kadar air dan ekstraksi
Berdasarkan hasil uji kadar air serbuk kulit pisang hijau lumut, dengan 3 kali pengulangan didapatkan persentase kadar air rata-rata sebesar 6,30%. Hasil tersebut mengindikasikan bahwa sampel sudah dapat
digunakan untuk proses berikutnya dikarenakan sudah memenuhi SNI (Standar Nasional Indonesia) yakni persentase kadar air kurang dari 10% (Depkes RI, 1995).
Ekstraksi kulit pisang hijau lumut
Ekstraksi kulit pisang hijau lumut dilakukan dengan metode maserasi. Maserasi 1 kg sampel dengan 3 liter metanol (3 x 1 liter) menghasilkan 83,45 gram ekstrak kental metanol dengan persentase rendemen 8,34%. Semakin tinggi nilai rendemen yang dihasilkan, menandakan nilai ekstrak yang dihasilkan semakin banyak (Armando, 2010).
Hasil yang didapat masih relatif kurang tinggi, hal ini dipengaruhi oleh beberapa faktor seperti ukuran partikel simplisia, maupun jenis pelarut. Menurut Rezki dkk. (2015) faktor lainnya adalah semakin lama waktu kontak pelarut dengan simplisia, semakin banyak ekstrak kental yang dihasilkan. Berhasilnya pemisahan juga bergantung pada kelarutan setiap komponen dalam pelarut (Suryanto, 2012).
Penentuan Konsentrasi Hambat Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM)
Penentuan Konsentrasi Hambat Minimum pada ekstrak kental metanol dilakukan untuk menentukan nilai konsentrasi terendah yang masih dapat menghambat pertumbuhan bakteri yang ditandai dengan terbentuknya diameter zona bening disekitar sumur difusi. Hasil penentuan KHM disajikan pada Tabel 1.
Ekstrak metanol kulit pisang hijau lumut memiliki nilai KHM pada konsentrasi 8% dengan daya hambat 8,12 mm terhadap S. aureus dan 10% dengan daya hambat 6,50 mm terhadap E. coli. Hasil ini mengindikasikan bahwa pada konsentrasi tersebut ekstrak metanol masih dapat menghambat pertumbuhan masing-masing bakteri.
Sementara itu, nilai KBM ekstrak metanol terhadap bakteri S. aureus adalah 10% dengan daya hambat 10,50 mm dan terhadap bakteri E. coli yakni konsentrasi 20% dengan daya hambat sebesar 10,25 mm. Untuk mengetahui ada atau tidaknya perbedaan nyata pada diameter daya hambat yang dihasilkan pada setiap variasi konsentrasi, dilakukan uji
One Way ANOVA menggunakan software IBM SPSS 25.0.
Sebelumnya dilakukan uji normalitas dan homogenitas untuk mengetahui apakah data sudah terdistribusi normal dan bersifat homogen. Hasil uji normalitas disajikan pada Tabel 1. Data pada ekstrak metanol sudah terdistribusi normal, hal ini dikarenakan nilai signifikan (P*) lebih besar dari 0,005. Sementara pada uji homogenitas, didapatkan hasil nilai signifikan data ekstrak metanol terhadap S. aureus sebesar 0,133 dan E. coli 0,077. Hal ini menunjukkan data sudah bersifat homogen atau sejenis dikarenakan nilai signifikan lebih besar dari 0,05.
Selanjutnya dilakukan uji LSD (Least Significant Difference) untuk menentukan adakah perbedaan nyata pada nilai daya hambat pada variasi konsentrasi. Hasil uji LSD dapat dilihat pada Tabel 2. Berdasarkan Tabel 2, didapatkan hasil bahwa terdapat perbedaan yang nyata atau signifikan pada setiap konsentrasi.
Menurut Davis and Stout (1971) kriteria daya hambat pertumbuhan bakteri yakni diameter zona bening ≥ 20 mm dikategorikan sangat kuat, 10-20 mm dikategorikan kuat, 5-10 mm dikategorikan sedang, dan daerah hambatan 5 mm atau kurang termasuk kategori lemah. Sehingga pada penelitian ini, ekstrak kental metanol secara umum dikategorikan kuat dalam menghambat bakteri S. aureus dan E. coli. Berdasarkan Tabel 2, daya hambat semakin besar seiring bertambahnya konsentrasi.
Hal ini sesuai dengan pernyataan Rita et al. (2018) bahwa secara umum, nilai hambat cenderung meningkat dengan meningkatnya konsentrasi ekstrak. Hasil tersebut juga didukung dari penelitian Rita et al. (2019) bahwa ekstrak metanol kulit pisang susu menghasilkan daya hambat yang semakin besar dengan konsentrasi yang semakin meningkat terhadap bakteri S. aureus dan E.coli.
Skrining Fitokimia
Skrining fitokimia dilakukan untuk mengetahui jenis metabolit sekunder apa saja yang terdapat pada ekstrak metanol, dikarenakan umumnya beberapa golongan senyawa metabolit sekunder mampu
menghambat pertumbuhan bakteri. Hasil skrining fitokimia disajikan pada Tabel 3. Ekstrak metanol menunjukkan hasil positif
terhadap alkaloid, fenol, flavonoid, dan triterpenoid.
Tabel 1. Hasil penentuan Konsentrasi Hambat Minimum (KHM) ekstrak metanol terhadap
pertumbuhan S. aureus dan E. coli dan hasil uji normalitas.
|
Konsentrasi (%) |
Daya Hambat (mm) |
P* S. aureus |
P* E. coli | |
|
S. aureus |
E. coli | |||
|
0 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
1 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
2 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
3 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
4 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
5 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
6 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
8 |
8,12 ± 0,02 |
0,00 ± 0,00 |
0,780 |
- |
|
10 |
10,45 ± 0,05 |
6,50 ± 0,05 |
1,000 |
1,000 |
|
15 |
11,00 ± 0,02 |
8,15 ± 0,03 |
1,000 |
0,637 |
|
20 |
12,25 ± 0,12 |
10,25 ± 0,25 |
0,956 |
1,000 |
|
30 |
13,00 ± 0,02 |
11,00 ± 0,02 |
1,00 0 |
0,780 |
|
40 |
14,75 ± 0,25 |
11,75 ± 0,25 |
1,000 |
1,000 |
|
50 |
15,25 ± 0,11 |
13,00 ± 0,02 |
0,900 |
1,000 |
|
75 |
16,37 ± 0,02 |
14,75 ± 0,25 |
0,780 |
1,000 |
|
100 |
17,15 ± 0,05 |
15,50 ± 0,05 |
1,000 |
1,000 |
Keterangan : P* = Data terdistribusi normal pada signifikan (p>0,05)
Tabel 2. Hasil penentuan uji beda nyata data ekstrak metanol terhadap bakteri S. aureus dan E. coli.
|
Konsentrasi (%) |
Daya Hambat Ekstrak Metanol (mm) |
Kategori | ||
|
S. aureus |
E. coli |
S. aureus |
E. coli | |
|
0 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
- |
- |
|
1 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
- |
- |
|
2 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
- |
- |
|
3 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
- |
- |
|
4 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
- |
- |
|
5 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
- |
- |
|
6 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
- |
- |
|
8 |
8,12 ± 0,02 b |
0,00 ± 0,00 a |
Sedang |
- |
|
10 |
10,45 ± 0,05 c |
6,50 ± 0,05 b |
Kuat |
Sedang |
|
15 |
11,00 ± 0,02 d |
8,15 ± 0,03 c |
Kuat |
Sedang |
|
20 |
12,25 ± 0,12 e |
10,25 ± 0,25 d |
Kuat |
Kuat |
|
30 |
13,00 ± 0,02 f |
11,00 ± 0,02 e |
Kuat |
Kuat |
|
40 |
14,75 ± 0,25 g |
11,75 ± 0,25 f |
Kuat |
Kuat |
|
50 |
15,25 ± 0,11 h |
13,00 ± 0,02 g |
Kuat |
Kuat |
|
75 |
16,37 ± 0,02 i |
14,75 ± 0,25 h |
Kuat |
Kuat |
|
100 |
17,15 ± 0,05 j |
15,50 ± 0,05 i |
Kuat |
Kuat |
Keterangan : Angka yang disertai huruf yang berbeda menyatakan nilai yang berbeda nyata berdasarkan LSD (Least Significant Difference) pada taraf 5%
Tabel 3. Hasil skrining fitokimia
|
NO |
Uji Fitokimia |
Pereaksi |
Perubahan warna |
Kesimpulan |
|
1. |
Uji Alkaloid |
Mayer |
Endapan putih |
+ |
|
Wagner |
Endapan coklat |
+ | ||
|
2. |
Uji Fenol |
FeCl3 |
Hijau kehitaman |
+ |
|
3. |
Uji flavonoid |
MgHCl |
Merah bata |
+ |
|
4. |
Uji steroid/triterpenoid |
Lieberman-Burchard |
Merah magenta (triterpenoid) |
+ |
|
5. |
Uji saponin |
Uji busa dan penambahan HCl |
Busa tidak stabil |
- |
Hasil positif alkaloid ditunjukkan dengan adanya endapan putih dengan pereaksi Meyer dan endapan coklatdengan pereaksi Wagner. Endapan putih pada pereaksi Meyer diperkirakan merupakan kompleks kalium-alkaloid. Pembuatan Pereaksi Meyer dibuat dari larutan merkurium(II) klorida dan kalium iodida yang akan bereaksi membentuk endapan merkurium(II) iodida yang berwarna merah, apabila kalium iodida yang ditambahkan berlebih maka akan terbentuk kalium tetraiodomerkurat(II) (Svehla, 1990).
Pasangan elektron bebas yang dimiliki atom nitrogen pada alkaloid dapat digunakan membentuk ikatan kovalen koordinat dengan ion logam. Nitrogen pada alkaloid bereaksi dengan ion logam K+ pada kalium tetraiodomerkurat(II) membentuk kompleks kalium-alkaloid yang mengendap (Ergina dkk., 2014). Reaksi uji alkaloid dengan pereaksi Meyer disajikan pada Gambar 1.
HgCl2 + 2KI ----- HgI2 + 2KCl
HgI2 + 2KI ----- K2[HgI2]
Kalium tetraiodomerkurat(II)
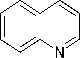
+ K2[Hgi4]
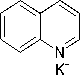
+ K2[HgI4]-
Kalium-Alkaloid endapan
Gambar 1. Reaksi Alkaloid dengan Pereaksi Meyer (Marliana dkk., 2005).
Pada uji dengan pereaksi wagner menghasilkan endapan coklat yang diperkirakan adalah endapan kalium-alkaloid. Pereaksi wagner dibuat dengan mereaksikan iodin dan kalium iodida, ion I- pada kalium iodida bereaksi dengan iodin menghasilkan ion
I3- berwarna coklat. Sementara ion K+ akan bereaksi dengan nitrogen pada alkaloid dan membentuk kompleks kalium-alkaloid dengan endapan berwarna coklat (Marlina dkk., 2005). Reaksi uji alkaloid dengan pereaksi wagner disajikan pada Gambar 2.
I2 + I-
I3-
Coklat
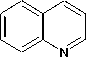
+ KI + I2---”
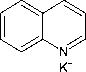
+ I3-
Coklat
Kalium-Alkaloid endapan
Gambar 2. Reaksi Alkaloid dengan Pereaksi Wagner (Marliana dkk., 2005)
Menurut Amalia dkk. (2017) alkaloid dapat sebagai antibakteri dengan cara mengganggu sintesis peptidoglikan sel bakteri sehingga dinding sel tidak terbentuk. Keadaan tersebut menyebabkan sel bakteri mudah mengalami lisis sehingga tidak dapat membentuk koloni dan berujung kematian sel.
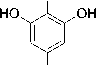
Uji fenol pada ekstrak metanol didapatkan hasil positif dengan perubahan warna saat direaksikan dengan FeCl3. Pereaksi besi (III) klorida dipergunakan secara luas untuk mengidentifikasi senyawa fenol termasuk tanin, dikarenakan tanin merupakan senyawa polifenol (Robinson, 1995).
Perubahan warna hijau kehitaman terjadi akibat pembentukan senyawa komplek antara tanin dengan FeCl3 (Ikalinus dkk., 2015). Reaksi senyawa polifenol dan FeCl3 disajikan pada Gambar 3.
OH
FeCl +
COOH
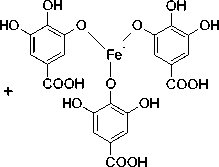
Gambar 3. Reaksi Polifenol dengan
FeCl3(Simaremare, 2014).
Golongan senyawa fenol yang terdapat pada ekstrak metanol dapat sebagai antibakteri dengan mekanisme kerjanya menginaktifasi protein yang terdapat pada membran sel bakteri. Fenol berikatan dengan protein sehingga dapat merusak struktur dinding sel bakteri, sehingga kehilangan bentuk dan juga mengalami lisis sel (Susanti, 2008).
Hasil positif terhadap flavonoid ditandai dengan perubahan warna merah bata dengan pereaksi MgHCl. Menurut Venkataraman (1962) berdasarkan reaksi warna flavonoid, warna merah bata pada ekstrak metanol termasuk ke dalam senyawa flavonoid golongan flavonol.
Warna merah bata disebabkan oleh penambahan logam Mg dan HCl pada uji flavonoid yang bertujuan untuk mereduksi inti benzopiron yang terdapat pada struktur flavonoid dan menghasilkan garam flavilium yang berawarna merah atau jingga (Ergina dkk, 2014). Reaksi uji flavonoid dengan pereaksi Mg-HCl disajikan pada Gambar 4.
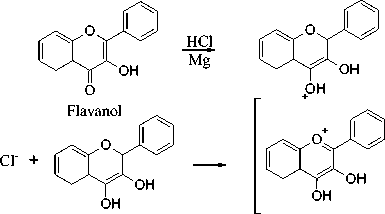
Cl-
+ Cl-
Garam flavilium merah tua
Gambar 4. Reaksi Flavonoid dengan MgHCl (Tiwari et al., 2011).
Menurut Venkataraman (1962) berdasarkan reaksi warna flavonoid, warna merah bata pada ekstrak metanol termasuk ke dalam senyawa flavonoid golongan flavonol.
Flavonoid juga dapat berperan sebagai antibakteri dengan cara merusak dinding sel bakteri.
Dinding sel bakteri terdiri dari lipid dan asam amino, gugus alkohol pada senyawa flavonoid akan bereaksi dengan asam amino sehingga dapat merusak dinding sel bakteri dan menyebabkan kematian sel (Marfuah dkk, 2018).
Flavonoid juga dapat menghambat sintesis asam nukleat dengan cara cincin B pada flavonoid mengalami proses interkalasi yakni menyisipkan cincin B pada susunan basa DNA sehingga basa asam nukleat menumpuk dan menghambat sintesis DNA dan RNA pada bakteri Rahman dkk. (2017).
Perubahan warna merah magenta pada uji dengan pereaksi Lieberman-Burchard menandakan ekstrak positif mengandung terpenoid. Hal ini disebabkan terjadinya reaksi oksidasi pada golongan terpenoid melalui pembentukan ikatan rangkap terkonjugasi (senyawa pentaenilik) (Sriwahyuni, 2010). Mekanisme reaksi terpenoid dengan pereaksi Lieberman-Burchard disajikan pada Gambar 5.
H+/H O

HO
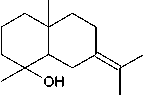
Gambar 5. Mekanisme Reaksi Terpenoid dengan Pereaksi Lieberman-Burchard (Matsjeh, 2006).
Menurut Cowan (1999) mekanisme kerja senyawa terpenoid diduga karena berinteraksi dengan porin (protein transmembran) pada membran luar dinding sel bakteri dengan membentuk ikatan polimer dan merusak porin sehingga permeabilitas dinding sel berkurang, sel bakteri kekurangan nutrisi sehingga pertumbuhan terhambat, sementara itu, uji saponin memberikan hasil negatif yang
mengindikasikan bahwa tidak terdapatnya golongan senyawa saponin pada ekstrak metanol.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang dilakukan dapat disimpulkan :
Ekstrak metanol kulit pisang hiau lumut (Musa x paradisiaca L.) dapat menghambat pertumbuhan bakteri S. aureus dan E. coli dengan KHM konsentrasi 8% dengan daya hambat 8, 12 mm terhadap S. aureus dan 10% dengan daya hambat 6,50 mm terhadap E. coli. Nilai KBM ekstrak metanol terhadap bakteri S. aureus adalah 10% dengan daya hambat 10,50 mm dan terhadap bakteri E. coli yakni konsentrasi 20% dengan daya hambat sebesar 10,25 mm.
Kandungan metabolit sekunder yang terdapat pada ekstrak metanol kulit pisang hijau lumut (Musa x paradisiaca L.) adalah alkaloid, fenol, flavonoid, dan terpenoid.
Saran
Perlu dilakukan pemisahan lebih lanjut ekstrak metanol kulit pisang hijau lumut serta mengidentifikasi senyawa aktif yang berfungsi sebagai antibakteri.
DAFTAR PUSTAKA
Amalia, A., Sari, I., dan Nursanti, I. 2017.
Aktivitas Antibakteri Ekstrak Etil Asetat Daun Sembung (Blumea Balsamifera (L.) DC.) Terhadap Pertumbuhan Bakteri Methicillin Resistant Staphylococcus aureus (MRSA). Prosiding Seminar Nasional Biotik. 8(3): 387-391.
Ananta, I. G., Rita, W.S., dan Parwata, O.A.
2018. Potensi Ekstrak Limbah Kulit Pisang Lokal (Musa sp) Sebagai Antibakteri Terhadap Escherichia coli dan Staphylococcus aureus. Cakra Kimia. 6(1): 21-29.
Armando, R. 2009. Memproduksi 15 Minyak Atsiri Berkualitas. Penebar Swadaya. Jakarta.
Cowan, M. M. 1999. Plant Products as Antimicrobial Agents. Clinical
Microbiology Reviews. 12(4): 564–582.
Davis, W. W., and Stout, T. R. 1971. Disc Plate
Method Of Microbiological Antibiotic
Essay. Journal Of Microbiology. 22(4): 659-665.
Departemen Kesehatan RI. 1995. Farmakope
Indonesia. Edisi Ke-4. Departemen
Kesehatan RI. Jakarta.
Ergina, Nuryanti, S., dan Pursitasari, I.D. 2014.
Uji Kualitatif Senyawa Metabolit Sekunder Pada Daun Palado (Agave angustifolia) yang Diekstraksi Dengan Pelarut Air Dan Etanol. Jurnal Akademika Kimia. 3(3): 165-172.
Gurib-Fakim, A. 2006. Medicinal Plants, Traditions of Yesterday and Drugs of Tomorrow. Molecular Aspects of Medicine. University of Mauritius, Mauritius.
Harborne, J. B. 1996. Phytochemical Methods: A Guide to Modern Technique of Plant Analysis. 2nd Edition. Chapman and Hall. London.
Ikalinus, R., Widyastuti, S.K., dan Setiasih, N.L.E. 2015. Skrining Fitokimia Ekstrak Etanol Kulit Batang Kelor (Moringa oleifera). Indonesia Medicus Veterinus. 4(1) : 71-79.
Jawetz, E., Melnick, J.L., and Adelberg, E.A.
2007. Mikrobiologi Untuk Profesi Kesehatan. Edisi ke-23. a.b Huriawati, Hartanto., Chaerunnisa, Rachman., Alfa, Dimanti., Aryana, Diani. Penerbit Buku Kesehatan. Jakarta.
Madduluri, S., Rao, K., Babu., and Sitaram, B.
2013. In Vitro Evaluation of Antibacterial Activity of Five Indegenous Plants Extract Against Five Bacterial Pathogens of Human. International Journal of Pharmacy and Pharmaceutical Sciences. 5(4): 679-684. Marfuah, I., Dewi, E. N., and Rianingsih, L.
2018. Kajian Potensi Ekstrak Anggur Laut (Caulerpa racemosa) Sebagai Antibakteri Terhadap Bakteri
Escherichia coli dan Staphylococcus aureus. Jurnal Pengolahan dan
Bioteknologi Hasil Perikanan. 7(1): 714.
Marliana, S., Suryanti, dan Suyono. 2005.
Skrining Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule Jacq. Swartz.) dalam Ekstrak Etanol. Jurusan Kimia FMIPA Universitas Sebelas. Surakarta.
Matsjeh, S. 2006. Kimia Hasil Alam : Senyawa Metabolit Sekunder Tumbuhan
Flavonoid, Terpenoid dan Alkaloid. FMIPA UGM. Yogyakarta.
Rahman, F. A., Haniastuti, T., dan Utami, T.W. 2017. Skrining Fitokimia dan Aktivitas Antibakteri Ekstrak Etanol Daun Sirsak (Annona muricata L.) pada Streptococcus mutans ATCC 35668. Majalah Kedokteran Gigi Indonesia. 3(1): 1-7.
Refdanita., Maksum, A., Nurgani A., dan Endang, P. 2004. Pola Kepekaan Kuman Terhadap Antibiotika Di Ruang Rawat Intensif Rumah Sakit Fatmawati Jakarta Tahun 2001–2002. Jurnal Makara Kesehatan. 8(2): 41-48.
Rezki, R. S., Dwimas, A., dan Siswarni, M.Z. 2015. Ekstrak Multi Tahap Kurkumin Dari Kunyit (Curcuma domestica Valet) Menggunakan Pelarut Etanol. Jurnal Teknik Kimia USU. 6(2): 29-34.
Rita, W. S., Retno, K., dan Dira, S.I.M. 2018. Total Phenolic and Flavonoid Content and Antimicrobial Activity of Acorus calamus L. Rhizome Ethanol Extract. Research Journal of Chemistry and Environtment. 22(2) : 65-70.
Rita, W. S., Swantara, I.M.D., and Damayanti, N.L.Y. 2019. Antibacterial Activity of Milk Banana (Musa paradisiaca L.) Peel Methanol Extract and Its Total Flavonoid and Phenolic Contents, Proceeding,
International Conference on Sustainable Agriculture, Food and Energy (SAFE 2019), October 18-21, 2019, Phuket,
Thailand.
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi Ke-4. a.b
Padmawinata, K. ITB Press. Bandung.
Simaremare, E. S. 2014. Skrining Fitokimia Ekstrak Etanol Daun Gatal. Pharmacy. 11(1) : 98-107.
Sineke, F. U., Suryanto, E., dan Sudewi, S. 2016. Penentuan Kandungan Fenolik
Dan Sun Protection Factor (SPF) Dari Ekstrak Etanol Dari Beberapa Tongkol Jagung (Zea Mays L.). PHARMACON Jurnal Ilmiah Farmasi. 5(1): 275-283.
SNI 01-2891-1992. 1992. Cara Uji Makanan dan Minuman. Pusat Standardisasi Industri. Departemen Perindustrian.
Sriwahyuni I. 2010. Uji Fitokimia Ekstrak Tanaman Anting-Anting (Acalypha
Indica Linn) dengan Variasi Pelarut dan Uji Toksisitas Menggunakan Brine Shrimp (Artemia Salina Leach).
(Skripsi). Fakultas Sains dan Teknologi Universitas Islam Negeri (UIN) Maulana Malik Ibrahim. Malang.
Suryanto dan Edi. 2012. Fitokimia Antioksidan. Putra Media Nusantara. Surabaya.
Susanti, D. Y. 2008. Efek Suhu Pengeringan Terhadap Kandungan Fenolik dan Kandungan Katekin Ekstrak Daun Kering Gambir. Prosiding Seminar Nasional Teknik Pertanian. Yogyakarta.
Svehla, G. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Edisi Ke-5. a.b Setiono, L. dan Pudjaatmaka, A.H. PT Kalman Media Pusaka. Jakarta.
Tiwari, Prashant, Kumar, B., Kaur, M., Kaur, G., dan Kaur, H. 2011. Phytochemical Screening and Extraction : A Review. International Pharmaceutica Sciencia. 1(1): 98-106.
Venkataraman, K. 1962. Methods for
Determinating The Structure of
Flavonoid Compound. The Mac Millan Company. New York.
Wahyuni, N. K. D. M., Rita, W. S., dan Asih, I. A. R. A. 2019. Ekstrak Kulit Pisang Kepok Kuning (Musa Paradisiaca L.) Terhadap Bakteri Staphylococcus Aureus Dan Escherichia Coli Serta Penentuan Total Flavonoid Dan Fenol Dalam Fraksi Aktif. Jurnal Kimia. 13(1): 9-15.
139
Discussion and feedback