IDENTIFIKASI GOLONGAN SENYAWA AKTIF ANTIMAKAN DARI DAUN TENGGULUN (Protium javanicum Burm. F.) TERHADAP LARVA Epilachna sparsa L
on
ISSN 1907-9850
IDENTIFIKASI GOLONGAN SENYAWA AKTIF ANTIMAKAN DARI DAUN TENGGULUN (Protium javanicum Burm. F.) TERHADAP LARVA Epilachna sparsa L
M. G. Agus Mandana, Ni M. Puspawati, dan Sri Rahayu Santi
Jurusan Kimia FMIPA Universitas Udayana, Bukit jimbaran
ABSTRAK
Protium merupakan genus terbesar dari keluarga Burseraceae yang secara tradisional telah dimanfaatkan sebagai obat, kosmetik, dan insektisida. Penelitian ini bertujuan untuk mengidentifikasi golongan senyawa aktif antimakan dari daun Protium Javanicum Burm F, yang di Bali dikenal dengan nama tenggulun. Larva Epilachna sparsa (E.sparsa) digunakan sebagai bioindikator untuk uji aktivitas antimakan yang dilakukan baik terhadap crude ekstrak, fraksi maupun isolat. Serbuk kering daun tenggulun (1000 g) diekstraksi dengan metanol sehingga diperoleh ekstrak kental berwarna hijau kehitaman (20,89 g). Ekstrak ini menunjukkan aktivitas antimakan 71,61% pada konsentrasi 0,1% b/v, maka selanjutnya dipisahkan dengan cara difraksionasi sehingga diperoleh fraksi n-heksana, kloroform, dan air. Fraksi kloroform menunjukkan aktivitas antimakan paling tinggi yaitu 89,52%, sedangkan fraksi n-heksana 36,83%, dan air 1,96% pada konsentrasi 0,1% (b/v). Pemurnian fraksi aktif kloroform dilakukan dengan kromatografi kolom silika gel menggunakan campuran pelarut n-heksana : kloroform (3:4) sebagai fase gerak menghasilkan tiga kelompok fraksi (isolat). Isolat yang menunjukkan aktivitas antimakan relatif paling tinggi yaitu 70,53% dan murni diidentifikasi dengan uji fitokimia dan spektroskopi inframerah serta ultraviolet-visibel. Hasil identifikasi menunjukkan isolat aktif antimakan merupakan senyawa golongan triterpenoid dengan gugus fungsi OH; CH3; CH2; C=O, dan C=C serta menyerap sinar UV-Vis pada λmax 245 dan 416 nm.
Kata kunci : Protium javanicum Burm. F, tenggulun, antimakan, triterpenoid, Epilacna sparsa
ABSTRACT
Protium is the main genusl in the family of Burseraceae which has been used traditionally as medicine, cosmetic as well as insecticide. This research aimed to isolate and identify antifeedant active compounds from leaf of Protium javanicum Burm, F which is locally known as tenggulun. Epilachna sparsa (E.sparsa) larvae were used as bioindicator for antifeedant activity assay. The assay was performed both on crude extract, fractions, and isolate. Dried leaf powder of tenggulun (1000 g) was extracted with methanol to yield 20.89 g dark green extract. This extract showed 71.61% antifeedant activity at 0.1% (b/v). This active extract was then fractionated into n-hexane, chloroform and water fractions. The chloroform fraction was the most active which give 89.62% activity at 0.1% (b/v) compared to n-hexane (36.83%), and water fractions (1.96 %). Purification of chloroform fraction was done using silica gel column chromatography with n-hexane : chloroform (3:4) as eluent and three groups of fractions (isolates) were obtained. The most active isolate which showed 70.53% antifeedant activity at 10 ppm was found relatively pure, therefore it was then identified. Based on phytochemical reaction, analysis of infrared spectra and ultraviolet-visible spectra, the antifeedant active isolate was identified as triterpenoid class of compounds which have functional group such as OH, CH3, CH2, C=O, C=C and λmax at 245 and 416 nm.
Keywords : Protium javanicum Burm. F, tenggulun, antifeedant, triterpenoid, Epilacna sparsa
PENDAHULUAN
Setiap tahun, hampir sepertiga dari hasil komuditi pertanian rusak karena hama baik di lahan pertanian maupun pada saat penyimpanan. Pengendalian hama perlu dilakukan agar produksi pertanian tidak terganggu, meskipun pengendalian hama memerlukan biaya yang tidak murah dan sering memberikan dampak yang membahayakan bagi lingkungan sekitarnya (Maria et al., 2003). Pestisida sintesis saat ini, masih merupakan alat yang paling efektif digunakan untuk pengendalian hama karena praktis dalam penggunaanya, mudah diperoleh dan hasilnya segera dapat diketahui. Pestisida ini dalam penggunaannya banyak menimbulkan dampak negatif bagi kesehatan manusia dan lingkungan oleh karena hama-hama menjadi resisten, mematikan parasit dan predator termasuk juga hewan berguna, pencemaran udara dan tanah sehingga banyak terjadi kasus keracunan dan bahkan kematian (Oka, 1993). Untuk itu diupayakan suatu pengendalian hama dan penyakit secara terpadu yang salah satu komponennya adalah pestisida nabati (Oka, 1993).
Pestisida nabati adalah pestisida yang bahan aktifnya berasal dari bagian tumbuhan seperti akar, daun, batang atau buah (Anonim, 2011). Pestisida nabati memiliki beberapa keunggulan yang dapat dikembangkan karena bersifat selektif dan ramah lingkungan. Pestisida nabati dapat dibagi ke dalam dua kelompok yaitu kelompok pengendali pertumbuhan serangga (insect growth regulator) yang mengubah pertumbuhan, perkembangan, dan reproduksi serangga dan kelompok yang mengubah perilaku serangga yang meliputi feromon, penolak (repellent), penarik (attractant), antimakan (antifeedant), stimulant dan, penolak peletakan telur (oviposisi). Feromon dan antimakan dianggap memiliki prospek komersial yang lebih baik (Ruslan et al., 1989).
Senyawa antimakan banyak ditemukan pada berbagai jenis tumbuhan seperti dari famili Meliaceae, Solanaceae, Piperaceae, Legumineceae, Burseraceae dan sebagainya. Protium yang merupakan genus terbesar dari famili Burseraceae secara traditional banyak dimanfaatkan sebagai obat-obatan, kosmetik, dan
insektisida. Beberapa spesies dari genus protium seperti protium bahiaum dan protium heptaphylum diketahui memiliki aktivitas insektisida sebagai penolak serangga (Rudiger et al., 2007). Tenggulun (Protium javanicum Burm. F.) yang merupakan salah satu spesies dari genus protium, secara kemotaksonomi juga diduga mempunyai aktivitas insektisida sebagai penolak serangga sehingga secara tidak langsung tumbuhan akan terlindungi dari serangga hama karena nafsu makan hama sudah dihambat. Uji pendahuluan kandungan kimia daun tenggulun dilaporkan mengandung senyawa dari golongan flavonoid, sterol, terpenoid, kuinon dan tanin (Eniek, 1997).
Hasil uji pendahuluan yang dilakukan pada eksrak metanol menunjukkan daun tenggulun (Protium javanicum Burm. F.) bersifat antimakan dengan persentase aktivitas antimakan 71,61% pada konsentrasi 0,1% (b/v). Untuk itu, dalam penelitian ini akan dilakukan identifikasi golongan senyawa aktif antimakan dari daun tenggulun (Protium javanicum Burm. F.) terhadap larva Epilachna sparsa.
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah daun tenggulun (Protium javanicum Burm. F.) yang diambil dari Bukit Jimbaran, Kabupaten Badung, akuades, kertas saring, metanol teknis dan p.a, n-heksana teknis dan p.a, kloroform, KBr, silika gel GF254, plat KLT gel GF254, silika gel60, asam asetat anhidrat, KOH 10%, NaOH 10%, H2SO4 pekat, HCl pekat, gelatin, pereaksi Meyer, Wagner, Liebermann-Burchard, Wilstatter, Bate Smith-Metalcalfe, Borntrager.
Peralatan
Pisau, blender, neraca analitik, corong, gelas ukur, pipet mikro, pipet tetes, batang pengaduk, botol reagen, tabung reaksi, cawan petri, kuas, kain kasa, penguap putar vakum, desikator, seperangkat alat kromatografi kolom, spektrofotometer UV-Vis MILTON ROY SPECTRONIC 3000 ARRAY, lampu UV 254
nm dan UV 366 nm, spektrofotometer IR SHIMADZU Prestige 21.
Cara Kerja
Daun tenggulun dibersihkan, dipotong kecil-kecil dan dikeringkan di udara terbuka tanpa terkena cahaya matahari secara langsung. Bahan yang telah kering diblender sampai menjadi serbuk. Seberat 1000 g serbuk kering daun tenggulun (Protium javanicum Burm. F.) dimaserasi menggunakan metanol sampai semua senyawa terekstraksi dengan sempurna. Semua maserat ditampung, pelarutnya diuapkan sehingga diperoleh ekstrak kental metanol (crude ekstrak). Crude ekstrak ini kemudian di uji antimakan.
Pemisahan komponen-komponen pada crude ekstrak metanol diawali denga partisi. Crude ekstrak dilarutkan dalam pelarut metanol : air (3:7), kemudian metanolnya diuapkan dan fase air yang tersisa selanjutnya dipartisi dengan n-heksana. Fraksi n-heksana dikumpulkan dan residunya (fase air) dipartisi kembali dengan kloroform sehingga diperoleh fraksi kloroform dan fraksi air. Ketiga fraksi yang diperoleh yaitu fraksi n-heksana, kloroform dan air diuapkan, ditimbang dan diuji aktivitas antimakannya terhadap larva Epilachna sparsa. Fraksi yang paling aktif selanjutnya dipsahkandan dan dimurnikan dengan kromatografi kolom.
Sebelum pemisahan dengan kromatografi kolom, terlebih dahulu dilakukan kromatografi lapis tipis utnuk mencari eluen terbaik yang digunakan pada kromatografi kolom. Pemilihan eluen dilakukan dengan berbagai sistem pelarut dengan polaritas yang berbeda sampai diperoleh sistem pelarut terbaik yang menghasilkan pemisahan noda terbanyak dengan harga Rf yang relatif bejauhan. Kecepatan alir eluen diatur 1 mL/menit dan eluat ditampung setiap 3 mL dalam botol vial. Proses kromatografi dihentikan setelah semua metabolit diperkirakan telah terelusi. Masing-masing eluat yang diperoleh kemudian dianalisis dengan KLT dengan eluen yang sesuai. Eluat yang menunjukkan pola noda dan harga Rf yang sama digabungkan sehingga diperoleh beberapa kelompok fraksi. Semua kelompok fraksi yang diperoleh diuji aktivitas antimakannya, dan fraksi yang paling aktif diuji kemurniannya
dengan KLT menggunakan berbagai campuran eluen dengan polaritas yang berbeda.
Fraksi yang relatif paling aktif dan murni (isolat aktif) diidentifikasi. Identifikasi dilakukan dengan uji fitokimia menggunakan perekasi pendeteksi golongan senyawa dan dengan spektroskopi inframerah (IR) dan ultraviolet-visibel (UV-Vis).
Uji antimakan dilakukan dengan mengambil sedikit ekstrak untuk dibuat konsentrasi 0,1%, 5%, dan 10% (b/v). Larutan uji ini dioleskan merata pada bagian belakang dari media uji (daun kangkung laut) dengan menggunakan kuas pada bagian kiri sedangkan pada bagian kanan diolesi dengan pelarutnya sebagai kontrol, lalu dibiarkan menguap. Pelarut yang digunakan untuk kontrol sesuai dengan pelarut dari ekstrak kentalnya. Daun media uji dimasukkan dalam cawan petri yang sudah diberi kain kasa dan tisu untuk kelembaban, kemudian ditutup dengan cawan petri kecil yang bagian tengahnya diberi lubang berbentuk lingkaran berdiameter 3,5 cm. Larva Epilachna sparsa diletakkan diatas penutup daun yang telah dipuasakan selama empat jam, kemudian dibiarkan selama 24 jam. Perhitungan persentase luas daun yang dikonsumsi dilakukan setelah 24 jam. Uji aktifitas antimakan kelompok fraksi hasil kolom maupun isolat dilakukan dengan cara yang sama, tetapi konsentrasi dari larutan ujinya adalah 10, 40, 80, 100, 200, 400, 800 dan 1600 ppm.
HASIL DAN PEMBAHASAN
Ekstraksi
Hasil maserasi terhadap 1000 g serbuk kering daun tenggulun (Protium javanicum Burm. F.) dengan metanol diperoleh ekstrak kental metanol (crude ekstrak) berwarna hijau kehitaman seberat 20,89 g. Ekstrak kental metanol ini kemudian diuji aktivitas antimakan terhadap E. sparsa dan hasilnya disajikan pada Tabel 1.
Ekstrak metanol menunjukkan aktivitas antimakan yang cukup besar yaitu sebesar 71,61% terhadap larva E. Sparsa pada konsentrasi larutan uji 0,1%, sehingga berpotensi untuk dikembangkan lebih lanjut sebagai
pestisida nabati. Suatu bahan dikatakan bersifat aktif antimakan apabila memiliki persentase antimakan lebih besar atau sama dengan 25%. Untuk pemisahan dan pemurnian senyawa aktif antimakan diawali dengan partisi untuk mengelompokkan senyawa yang terkandung berdasarkan kepolarannya (Fessenden dan Fessenden, 1995).
Partisi
Partisi terhadap 20,89g crude ekstrak metanol menghasilkan fraksi n-heksana (3,68 g), fraksi kloroform (2,55 g), dan fraksi air (9,10 g). Ketiga fraksi diuji aktivitas antimakannya terhadap larva E. sparsa. Hasil uji aktivitas antimakan masing-masing fraksi hasil partisi yaitu fraksi kloroform (K), n-heksana (H), dan air (A) dipaparkan pada Tabel 2.
Fraksi kloroform paling aktif terhadap larva E.sparsa, karena pada konsentrasi 0,1% (b/v) menunjukkan aktivitas antimakan tertinggi yaitu 89,62% di bandingkan dengan fraksi n-heksana 36,83%, dan fraksi air yang hanya 1,
96%. Oleh sebab itu, fraksi kloroform dilanjutkan pada proses pemisahan dan pemurnian menggunakan kromatografi kolom (Anom, 1999).
Kromatografi Kolom
Pemisahan komponen-komponen pada fraksi aktif kloroform dilakukan dengan kromatografi kolom. dengan silika gel 60 sebagai fase diam, dan fase gerak yang digunakan adalah campuran eluen terbaik yang diperoleh dari analisis KLT yaitu kloroform : n-heksana (3:4). Hasil pemisahan terhadap 1 g fraksi aktif kloroform menghasilkan 123 botol eluat. Eluat-eluat yang diperoleh kemudian danalisis dengan KLT dan eluat-eluat yang mempunyai pola pemisahan yang sama yaitu jumlah noda dan harga Rf yang sama digabungkan sehingga diperoleh tiga kelompok fraksi gabungan yaitu fraksi A, B, dan C seperti tertera pada Tabel 3. Fraksi A masih terdiri dari empat noda yang berarti ada 4 komponen, sedangkan fraksi B dan C terdiri dari satu noda.
Tabel 1. Hasil uji aktivitas antimakan ekstrak kental metanol
|
No |
Fraksi |
Konsentarsi %(b/v) |
Aktivitas Antimakan (%) | |||
|
Ulangan 1 |
Ulangan 2 |
Ulangan 3 |
Rata-rata | |||
|
1 |
Metanol |
0,1 |
60 |
100 |
54,83 |
71,61 |
|
5 |
62,62 |
21,57 |
70,37 |
51,52 | ||
|
10 |
100 |
54,84 |
53,47 |
69,44 | ||
Tabel 2. Hasil uji aktivitas antimakan ekstrak kloroform, n-heksana dan air
|
No |
Fraksi |
Konsentarsi %(b/v) |
Aktivitas Antimakan (%) | |||
|
Ulangan 1 |
Ulangan 2 |
Ulangan 3 |
Rata-rata | |||
|
1 |
K |
0,1 |
100 |
68,88 |
100 |
89,62 |
|
5 |
100 |
100 |
100 |
100 | ||
|
10 |
100 |
100 |
100 |
100 | ||
|
2 |
H |
0,1 |
50 |
25 |
35,48 |
36,83 |
|
5 |
100 |
2,56 |
100 |
67,52 | ||
|
10 |
100 |
100 |
100 |
100 | ||
|
3 |
A |
0,1 |
100 |
5,88 |
-100 |
1,96 |
|
5 |
100 |
-26,44 |
45,98 |
39,98 | ||
|
10 |
-100 |
70,15 |
90,91 |
20,35 | ||
Tabel 3. Hasil uji aktivitas antimakan ekstrak kloroform, n-heksana dan air
|
No |
Fraksi |
Berat (g) |
Jumlah noda |
Rf |
|
1 |
A (1-38) |
0,26 |
4 |
0,03; 0,07; 0,12; 0,21 |
|
2 |
B (39-113) |
0,16 |
1 |
0,04 |
|
3 |
C (114-123) |
0,04 |
1 |
0,09 |
Tabel 4. Hasil uji aktivitas antimakan dari fraksi hasil kolom
|
No |
Fraksi |
Konsentarsi (ppm) |
Aktivitas Antimakan (%) | |||
|
Ulangan 1 |
Ulangan 2 |
Ulangan 3 |
Rata-rata | |||
|
1 |
Fraksi A |
1600 |
100 |
100 |
82,22 |
94,07 |
|
(1-38) |
800 |
100 |
100 |
81,53 |
93,84 | |
|
400 |
100 |
90 |
89,01 |
93,00 | ||
|
200 |
100 |
100 |
77,53 |
92,51 | ||
|
100 |
100 |
100 |
61,54 |
87,18 | ||
|
80 |
100 |
100 |
40,26 |
80,09 | ||
|
40 |
100 |
82,86 |
48,57 |
78,09 | ||
|
10 |
72 |
100 |
38,71 |
70,24 | ||
|
2 |
Fraksi B |
1600 |
100 |
100 |
100 |
100 |
|
(39-113) |
800 |
100 |
100 |
95,12 |
98,37 | |
|
400 |
100 |
100 |
88,57 |
96,19 | ||
|
200 |
100 |
93,94 |
90,01 |
94,95 | ||
|
100 |
89,19 |
100 |
84,21 |
91,13 | ||
|
80 |
78,95 |
100 |
72,15 |
83,7 | ||
|
40 |
84,12 |
72,09 |
61,11 |
72,44 | ||
|
10 |
89,83 |
80 |
41,77 |
70,53 | ||
|
3 |
Fraksi C |
1600 |
100 |
88,89 |
85,71 |
91,53 |
|
(114-123) |
800 |
88,57 |
100 |
73,68 |
87,42 | |
|
400 |
100 |
50 |
69,23 |
73,08 | ||
|
200 |
59,19 |
100 |
44,62 |
66,94 | ||
|
100 |
56,52 |
88,89 |
20 |
55,14 | ||
Ketiga kelompok fraksi (A, B, dan C) hasil kromatografi kolom selanjutnya diuji aktivitas antimakannya. Hasil uji aktivitas antimakan fraksi A, B, dan disajikan pada Tabel 4.
Dari hasil uji aktivitas antimakan seperti tertera pada Tabel 4, pada konsentrasi 100 ppm fraksi A menunjukkan aktivitas 87,18%, fraksi B 91,13%, dan fraksi C 55,14%. Meskipun fraksi A dan B pada konsentrasi larutan uji 10 ppm menunjukkan aktivitas yang hampir sama yaitu 70,24% dan 70,53% berurutan, namun fraksi A masih terdiri dari 4 komponen sehingga fraksi B yang terdiri dari satu noda dilanjutkan untuk uji kemurnian.
Hasil uji kemurnian fraksi B yang dilakukan dengan kromatografi lapis tipis dengan berbagai campuran eluen dengan polaritas yang berbeda memberikan satu noda sehingga fraksi B dapat dikatakan relatif telah murni. Fraksi B yang relatif paling aktif dan murni selanjutnya diidentifikasi.
Identifikasi
Identifikasi isolat aktif antimakan (fraksi B diawali dengan uji fitokimia untuk memperoleh informasi mengenai golongan senyawa kimianya sebagai kerangka dasar dari struktur senyawa dalam elusidasi struktur. Hasil uji fitokimia disajikan pada Tabel 5.
Tabel 5. Hasil uji fitokimia terhadap isolat antimakan Fb
|
No |
Uji Fitokimia |
Pereaksi |
Perubahan warna |
Kesimpulan |
|
1 |
Flavonoid |
NaOH 10% HCl - Mg H2SO4 |
Hijau-hijau muda Hijau-hijau muda Hijau-hijau |
Negatif Negatif Negatif |
|
2 |
Triterpenoid |
Libermann – Burchard |
Hijau-keunguan |
Positif |
|
3 |
Steroid |
Libermann – Burchard |
Hijau-keunguan |
Negatif |
|
4 |
Kuinon |
KOH 10% dalam metanol Borntrager |
Hijau-hijau |
Negatif |
|
5 |
Tanin |
Gelatin |
Hijau-hijau |
Negatif |
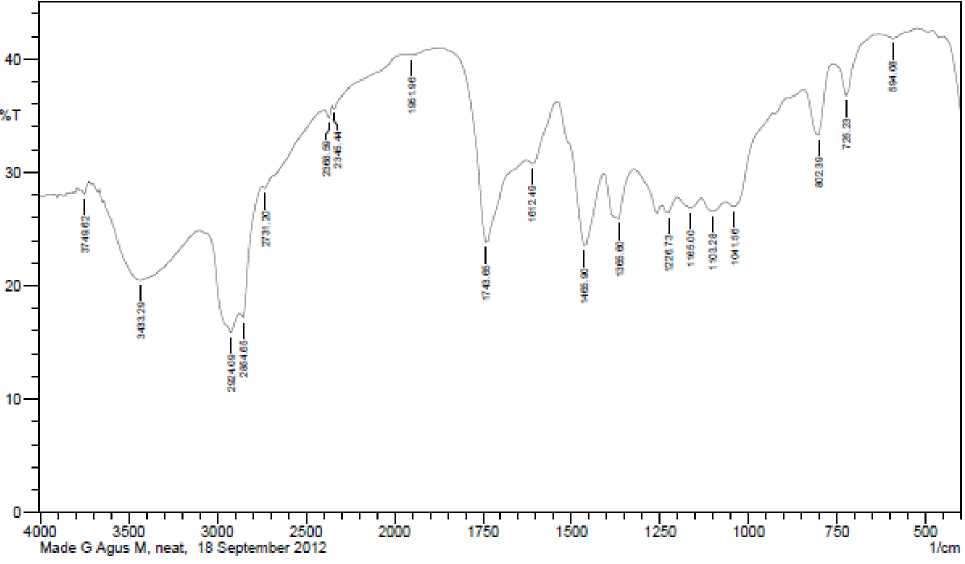
Gambar 1. Spektrum Inframerah dari isolat Fb.
Dari hasil uji fitokimia seperti dapat dilihat pada Tabel 5, isolat aktif antimakan merupakan senyawa golongan triterpenoid karena menunjukkan reaksi positif dengan pereaksi triterpenoid, Libermann-Burchard. Beberapa senyawa aktif antimakan yang diisolasi dari Melia azacadarach (mindi), Azadirachta indica (mimba) (Maria, C, 2003), merupakan senyawa golongan triterpenoid. Senyawa aktif antimakan seperti azadirachtin yang diisolasi
dari Melia azacadarach (mindi) merupakan senyawa golongan terpenoid yang diduga beraksi pada otot usus serangga sehingga otot usus menjadi tegang dan menurunkan motilitasnya akibatnya nafsu makan serangga akan menurun (Segatri Putra, 1989).
Isolat aktif antimakan ini selanjutnya dianalisis sifat fisikokimianya dengan spektrofotometer inframerah dan Ultraviolet-visible. Spektrum inframerah isolat aktif
antimakan ditunjukkan pada Gambar 1, sedangkan data bilangan gelombang, bentuk pita, intensitas, dan penempatan gugus terkait dipaparkan pada Tabel 6.
Hasil analisis spektra inframerah menunjukkan adanya serapan melebar pada daerah bilangan gelombang 3433,29 cm-1 yang merupakan serapan dari gugus OH terikat, dugaan ini diperkuat dengan munculnya serapan pada daerah bilangan gelombang 1226,73 cm-1 yang merupakan serapan dari C-O alkohol. Munculnya pita serapan pada daerah bilangan gelombang 2924,09 cm-1 dan 2854,65 cm-1 diduga adalah serapan dari gugus CH3 dan CH2 yang didukung dengan munculnya serapan pada daerah bending yaitu pada bilangan gelombang 1365,60 cm-1 dan 1465,90 cm-1. Serapan tajam pada daerah bilangan gelombang 1743,65 cm-1 diduga adalah serapan dari gugus karbonil gugus C=O. Pita serapan pada daerah bilangan gelombang 1612,49 cm-1 diduga serapan dari C=C alifatik (Silverstain et al., 1991; Sastrohamidjojo, 1991). Hasil interpretasi dari spektrum inframerah maka isolat diduga mempunyai gugus fungsi –OH, -CH alifatik,
C=O, dan C=C alifatik. Sedangkan hasil analisis spektrum UV-Vis dari isolat dapat dilihat pada Gambar 2 dan data untuk panjang gelombang, absorbansinya dan jenis transisi dapat dilihat pada Tabel 7.
Identifikasi dengan UV-Vis memberikan informasi adanya kromofor maupun auksokarom dalam isolat. Jenis kromofor atau auksokrom dapat diketahui dari energi transisi elektron. Energi transisi elektronik digambarkan dari nilai absorbansi isolat karena absorbansi menggambarkan perbedaan energi elektron dalam keadaan dasar dengan energi elektron tereksitasi (Creswell et al., 1982).
Identifikasi dengan UV-Vis memberikan informasi adanya kromofor maupun auksokarom dalam isolat. Jenis kromofor atau auksokrom dapat diketahui dari energi transisi elektron. Energi transisi elektronik digambarkan dari nilai absorbansi isolat karena absorbansi menggambarkan perbedaan energi elektron dalam keadaan dasar dengan energi elektron tereksitasi (Creswell et al., 1982).
Tabel 6. Data spektrum inframerah dari isolat Fb
|
Bilangan gelombang (cm-1) |
Bentuk Pita |
Intensitas |
Kemungkinan Gugus Fungsi | |
|
Spektra |
Pustaka | |||
|
3433,29 |
3450-3200 |
Lebar |
Sedang |
-OH terikat (stretching) |
|
2924,09 |
2960-2870 |
Tajam |
Sedang |
-CH alifatik (-CH3 stretching) |
|
2854,65 |
2960-2870 |
Tajam |
Sedang |
-CH alifatik (-CH2 stretching) |
|
1743,65 |
1820-1600 |
Tajam |
Kuat |
-C=O karbonil |
|
1612,49 |
1650-1500 |
Tajam |
Lemah |
-C=C alifatik (stretching) |
|
1465,90 |
1500-1400 |
Tajam |
Kuat |
-CH alifatik (-CH2 bending) |
|
1365,60 |
1500-1400 |
Tajam |
Sedang |
-CH alifatik (-CH3 bending) |
|
1226,73 |
1300-1000 |
Tajam |
Sangat lemah |
-C-O alkohol (bending) -C-C (bending) |
|
802,39 |
880-758 |
Tajam |
Kuat |
=CH siklik (bending) |
|
594,08 |
675-400 |
Tajam |
Sangat lemah |
-CH keluar bidang (bending) |
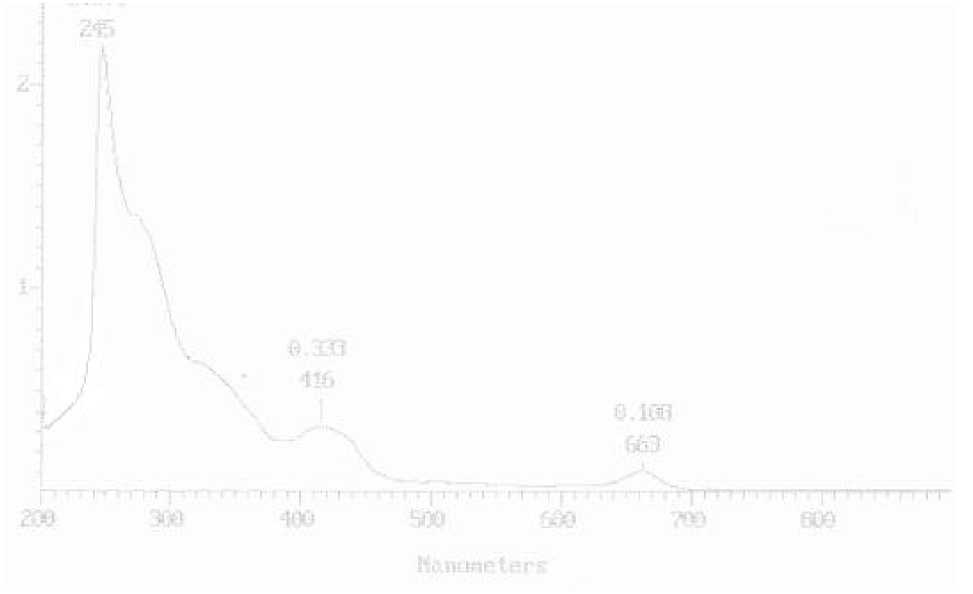
Gambar 2. Spektrum UV-Vis dari isolat Fb
Tabel 7. Data spektrum UV dari isolat
|
No. |
Panjang Gelombang |
Absorbansi |
TransisiElektron |
|
1 |
245 |
2,267 |
* π → π |
|
2 |
416 |
0,346 |
n → σ |
|
3 |
663 |
0,108 |
n → π |
Hasil analisis isolat dengan spektrofotometri UV-Vis menghasilkan tiga serapan utama yang muncul pada panjang gelombang 245; 416 dan 663 nm. Serapan yang terjadi pada panjang gelombang 245 nm dengan absorbansi terbesar kemungkinan disebabkan oleh terjadinya transisi elektronik π → π* yaitu transisi elektron dari gugus taks jenuh seperti kromofor C = C. Dugaan ini diperkuat dari data spektrum inframerah dengan munculnya serapan dari C = C alifatik pada daerah bilangan
gelombang 1612,49 cm-1. Serapan pada panjang gelombang 416 nm kemungkinan disebabkan terjadinya transisi elektronik n → σ* yaitu transisi elektron dari gugus jenuh O-H yang mempunyai elektron non bonding seperti pada auksokrom. Dugaan ini diperkuat dari data spektrum inframerah dengan munculnya serapan dari gugus O=H pada daerah bilangan gelombang 3433,29 cm-1 (Silverstain et al., 1991; Sastrohamidjojo, 1991). Serapan pada panjang gelombang 663 kemungkinan terjadinya
transisi elektronik n → π* yaitu transisi elektron dari suatu gugus tak jenuh yang mempunyai elektron non bonding sperti pada kromofor C = O.
Dari hasil identifikasi, maka dapat disimpulkan isolat aktif antimakan yang diisolasi dari daun tenggulun merupakan senyawa golongan triterpenoid dengan gugus fungsi O-H, C-H alifatik, C=O dan C=C alifatik dan memberikan serapan maksimum pada λmax. 245 dan 416 nm.
SIMPULAN DAN SARAN
Simpulan
Isolat dari daun tenggulun (Protium javanicum Burm. F.) menunjukkan aktivitas antimakan terhadap larva E. sparsa sebesar 70,53%, pada konsentrasi 10 ppm. Identifikasi isolat aktif antimakan menunjukkan isolat adalah senyawa dari golongan triterpenoid yang mempunyai gugus fungsi OH, CH3, CH2, C=O, dan C=C serta memberikan serapan karakteristik UV-Vis pada panjang gelombang, λmax 245 dan 416 nm.
Saran
Perlu dilakukan identifikasi lebih lanjut seperti 1H-NMR, 13C-NMR dan MS untuk menentukan struktur senyawa aktif antimakan daun tenggulun (Protium javanicum Burm. F.) serta perlu penelitian lebih lanjut dilakukan untuk mengetahui potensinya sebagai biopestisida dengan menggunakan bioindikator lainnya yang selektif terhadap hama tertentu pada suatu tanaman.
UCAPAN TERIMA KASIH
Melalui kesempatan ini penulis menyampaikan terima kasih kepada bapak A. A. Bawa Putra, S.Si., M.Si., bapak James Sibarani, S.Si., M.Si., Ph.D., dan ibu A. A. I. A.ayun Laksmiwati, S.Si., M.Si yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Anonim, 2011, Mengenal pestisida nabati,
http://tipspetani.blogspot.com/2011/10/m engenal-pestisida-nabati.html, Diakses
pada tanggal 24 Desember 2011
Anom, I. D. K., 1999, Isolasi dan Identifikasi Senyawa Antimakan terhadap Epilachna sparsa dari Biji Kopsia Priniformis Rchb. F. (Palajiwa), Tesis, Unpad, Bandung
Creswell, C. J., Runquist, O. A., and Campbell, M. M. 1982, Analisis Spektrum Senyawa Organik, a.b Padmawinata, K., ITB, Bandung
Dinas kesehatan Propinsi Dati II Bali, 1983, Usada Bali (Usada Netra, Usada Pengeraksa jiwa), Percetakan Lontar Usada, Denpasar
Eniek Kriwiyanti, 1997, Identifikasi, Struktur Anatomi dan Studi Pendahuluan Golongan Senyawa Kimia Daun Pelengkap Bumbu Lawar dan Betutu, F.MIPA, Universitas. Udayana,
Jimbaran, Bali
Fessenden, R. J. dan Fessenden, J. S., 1995, Kimia Organik, a.b. Aloysius, H.A., Jilid I, Edisi III, Airlangga, Jakarta.
Kubo, I., Taniguchi, M., Chapya, A., and Tsujimoto, K., 1980, An Insect
Antifeedant and Antimicrobial Agent from Plumbago caponensis, Journal of medicinal plant research,
Supplement, 185-187
Maria C. Carpinella, Maria A T. Defago, Graciela Valladares, and Sara M. Palacios., 2003, Antifeedant and Insecticide Properties of a Limonoid from Melia azedarach (Meliaceae) with Potential Use for Pest Management, J. Agric. Food Chem., 51 : 369-374
Mikolajkzak, K. L. and Wiesleder, D., 1988, A Limonoid Antifeedant from Seed of Carapa Procera, J. Nat. prod., 51 (3) : 606-610
Oka, I. N, 1993, Penggunaan, Permasalahan serta Prospek Pestisida Nabati dalam Pengendalian Hama Terpadu, Prosiding Seminar Hasil Penelitian Dalam Rangka Pemanfaatan Pestisida Nabati, Bogor 12 Desember1993
|
Rudiger, A. L., Siani, A. C., and Junior, V. F. 2007. The chemistry and Pharmacology of the South Aerican genus Proteum Burn.f. (Burseraceae). Pharmacogn Rev, 1 : 93 - 104 Ruslan, K., S. Soetarno, dan S. Sastrodihardjo, 1989, Insektisida dari Produk Alami, PAU Bidang Ilmu Hayati, ITB, Bandung Segatri Putra, 1989, Taru Premana, Khasiat Tanam-tanaman Untuk Obat Tradisional, Upada sastra, Denpasar, |
Sastrohamidjojo, H., 1991, Kromatografi, Penerbit Liberty, Yogyakarta. Silverstain, R. M., Basler, G. C, and Morril, T. C., 1991, Spectrometric Identification of Organik Compound, John Willey and Sons, Inc., New York Tjokronegoro, R. K., 1987, Penelusuran Senyawa Kandungan Tumbuhan Indonesia Bioaktif terhadap Serangga, Desertasi, Universitas Padjadjaran, Bandung |
48
Discussion and feedback