PEMURNIAN AMILASE MIKROBA AMILOLITIK DENGAN FRAKSINASI AMONIUM SULFAT DAN AMOBILISASI PADA AGAR-AGAR KOMERSIAL
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 15 (1), JANUARI 2021 DOI: https://doi.org/10.24843/JCHEM.2021.v15.i01.p07
p-ISSN 1907-9850
e-ISSN 2599-2740
PEMURNIAN AMILASE MIKROBA AMILOLITIKDENGAN FRAKSINASI AMONIUM SULFAT DAN AMOBILISASI PADA AGAR-AGAR KOMERSIAL
I N. Wirajana*, R. R. Sirait, dan P. Suarya
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Jimbaran, Bali, Indonesia
*Email : nengah_wirajana@unud.ac.id
ABSTRAK
Peningkatan penggunaan biokatalis amilase membutuhkan pemurnian dan amobilisasi enzim ini untuk berbagai keperluan yang lebih ekonomis. Tujuan penelitian ini adalah menentukan persen kejenuhan amonium sulfat untuk pemurnian amilase mikroba amilolitik dan persen konsentrasi agar-agar komersial terbaik untuk mendapatkan persen efisiensi dan kestabilan tertinggi.Amilase diproduksi dari isolat mikroba amilolitik dengan kode UU1.1. Ekstrak kasar amilase ekstraseluler difraksinasi dengan amonium sulfat dengan tingkat kejenuhan 0-20%, 20-40%, 40-60%, 60-80% dan 80-100%; selanjutnya tiap fraksi dilakukan dialisis dalam buffer fosfat pH 6. Pengukuran aktivitas amilase dilakukan dengan menentukan kandungan gula pereduksi sebelum dan setelah reaksi enzimatis yang diinkubasi pada suhu 37oC pH 6 selama 60 menit dengan metode Dinitrosalicylic acid (DNS). Penentuan kadar protein total setiap fraksi diukur dengan metode Biuret. Aktivitas spesifik amilase ditentukan dari hasil pembagian aktivitas amilase dengan kadar protein total setiap fraksi. Amobilisasi dilakukan pada konsentrasi agar-agar 1%, 2% dan 3% (b/v). Penentuan persen agar-agar terbaik untuk amobilisasi amilase ditentukan dari efisiensi amilase teramobil tertinggi dan kestabilannya. Tingkat kejenuhan amonium sulfat 20-40% atau fraksi 2 diperoleh aktivitas spesifik amilase tertinggi sebesar 6,0 U/mg, yang merupakan tingkat kemurnian amilase tertinggi. Aktivitas amilase tertinggi sebesar3,3 x 10-3 U/mL, diperoleh dari hasil fraksinasi pada tingkat kejenuhan amonium sulfat 40-60% atau fraksi 3, digunakan untuk amobilisasi dalam matriks agar-agar komersial. Amobilisasi amilase dengan efisiensi dan kestabilan tertinggi diperoleh pada konsentrasi agar-agar 3% (b/v), baik untuk ekstrak kasar amilase maupun amilase hasil fraksinasi.
Kata kunci: agar-agar, amilase, amilum, amobilisasi, fraksinasi.
ABSTRACT
Increased use of amylase biocatalysts requires the purification and immobilization of this enzyme for a variety of more economical purposes. The purpose of this study was to determine the percent saturation of ammonium sulfate for the purification of amylolytic microbial amylase and the best percent of commercial agar concentration to obtain the highest percent efficiency and stability. Amylase is produced from amylolytic microbial isolates with the code UU.1.1. Crude extract of extracellular amylase is fractionated with ammonium sulfate with saturation levels of 0-20%, 20-40%, 40-60%, 60-80% and 80-100%; then each fraction was dialyzed in a phosphate buffer 6. The measurement of amylase activity was carried out by determining the reducing sugar content before and after the enzymatic reaction incubated at 37oC pH 6for 60 minutes with the Dinitrosalicylic acid (DNS) method. Determination of total protein content of each fraction was measured by the Biuret method. The specific activity of amylase is determined from the results of the division of amylase activity by the total protein content of each fraction. Immobilization is carried out at 1%, 2% and 3% (w / v) agar concentrations. Determination of the best agar agar for amylase immobilization is determined from the highest immobilized amylase efficiency and its stability. Ammonium sulfate saturation level of 20-40% or fraction 2 obtained the highest specific amylase activity of 6.0 U / mg, which is the highest level of purity of amylase. The highest amylase activity of 3.3 x 10-3 U / mL, obtained from fractionation at 40-60% ammonium sulfate saturation level or fraction 3, was used for immobilization in the commercial agar matrix. Amylase immobilization with the highest efficiency and stability was obtained at a concentration of agar 3% (w/ v), both for crude extracts of amylase and fractionated amylase.
Keywords: agar-agar, amylase, fractionation, immobilization, starch.
PENDAHULUAN
Amilase adalah enzim ekstraseluler yang mendegradasi pati dengan menghidrolisis ikatan glikosidik pada posisi α-1,4 dan menghasilkan glukosa, maltosa, dan dekstrin. Amilase telah digunakan sejak zaman kuno untuk sakarifikasi pati, produksi bir dan produksi keju dari susu. Amilase dapat dikelompokkan menjadi tiga berdasarkan daerah hidrolisis ikatan yaitu α-amilase, β-amilase, dan glukoamilase. Enzim α-amilase (EC 3.2.1.1) menghidrolisis ikatan α-1,4-glikosidik. Enzim β-amilase (EC 3.2.1.2) menghasilkan maltosa dari pati dengan menghidrolisis ikatan glukan-a-1,4. Glukoamilase (EC 3.2.1.3) memecah ikatan glikosidik α-1,4 dan juga ikatan glikosidik α-1,6 (Suriya et al., 2016).
Amilase telah dieksploitasi oleh industri pengolahan pati sebagai pengganti hidrolisis asam dalam produksi hidrolisat pati (Maarel et al., 2002). Amilase berperan sebagai biokatalis hidrolisis amilum atau zat pati menjadi maltosa dan glukosa (Gaman dan Sherrington, 1992). Amilase banyak digunakan dalam industri laundry dan produksi gula karena spesifik dalam memecah amilum (Gupta et al., 2003). Penggunaan enzim dalam hidrolisis lebih baik dibandingkan dengan katalis asam.
Isolasi amilase dari mikroba umumnya dimulai dengan pemisahan sel mikroba penghasil amilase dari media tumbuhnya karena enzim ini merupakan enzim ekstraseluler. Pemisahan sel mikroba dengan enzim ekstraseluler biasanya dilakukan dengan cara sentrifugasi dan filtrasi. Isolasi enzim ekstraseluler relatif lebih mudah dilakukan dari pada enzim intraseluler, yang memerlukan pemecahan sel terlebih dahulu. Pada umumnya pemurnian protein (termasuk enzim) yang banyak dilakukan adalah dengan cara pengendapan. Pengendapan dilakukan dengan menggunakan garam, seperti amonium sulfat, natrium klorida, dan natrium sulfat; atau dengan pelarut organik seperti aseton dan etanol.(Scopes, 1994).
Pemurnian dengan amonium sulfat umumnya dilakukan dengan menambahkan garam amonium sulfat pada konsentrasi tinggi, yang akan mengakibatkan kekuatan ion garam akan meningkat sehingga terjadi interaksi antara ion garam dan air dan mengendapkan enzim (Iswendi, 2010). Kelebihan metode
pemurnian dengan amonium sulfat adalah jarang terjadi denaturasi, meningkatkan stabilitas enzim dan biaya yang rendah (Golunski et al., 2017).
Penggunaan enzim untuk berbagai keperluan tidak ekonomis karena tidak dapat digunakan berulang-ulang. Sifat enzim yang tidak stabil dan larut dalam air menjadi faktor utama enzim tidak dapat digunakan berulang-ulang.Amobilisasi enzim sering dilakukan untuk menanggulangi permasalahan tersebut, sehingga enzim lebih stabil dan dapat digunakan kembali (Brena dan Viera, 2006). Namun kekurangan amobilisasi enzim adalah dapat menurunkan aktivitas enzim setiap pengulangan pemakaian.
Teknik amobilisasi enzim terus mengalami perkembangan dan sudah dimanfaatkan dalam bidang industri. Prakash and Jaiswal (2011), telah melakukan penelitian tentang amobilisasi α-amilase murni ke dalam campuran matriks agar dan agarosa dengan teknik penjebakan (entrapment). Matriks Agar - agar adalah polisakarida berpori yang terdiri dari agarosa dan agaropektin yang mana agarosa merupakan zat yang memiliki kemampuan pembentukan gel yang kuat. Matriks agar-agar ini mudah diperoleh, prosedur amobilisasinya cukup mudah dan harganya murah (Prakash and Jaiswal, 2011).
Pada penelitian sebelumnya telah dilakukan isolasi beberapa mikroba amilolitikdari fermentasi ubi jalar ungu dalam tanah.Pada penelitian ini telah dilakukan isolasi amilase ekstraseluler dan pemurnian dari mikroba amilolitik tersebut dengan metode fraksinasi garam amonium sulfat. Selanjutnya amilase ekstrak kasar dan hasil pemurnian yang menunjukkan aktivitas tertinggi diamobilisasi dengan agar-agar komersial untuk diketahui efisiensi dan kestabilan enzim amobil.
MATERI DAN METODE
Bahan
Bahan penelitian yang digunakan adalah inokulum mikroba amilolitik (diperoleh dari sampel kultur penelitian Wirajana et al. PUPS 2019) dan agar-agar plain komersial (merk Swallow). Bahan kimia yang digunakan berkualitas pro-analysis (p.a), kecuali disebutkan lain, diantaranya adalah amonium sulfat [(NH4)2SO4], amilum, aquades, DNS
(asam 3,5-dinitrosalisilat), natrium kalium tartarat [Kna-Tartarat], fenol, tembaga sulfat pentahidrat (CuSO4.5H2O), BSA (bovine serum albumin), natrium dihidrogen fosfat (NaH2PO4), natrium hidroksida (NaOH), hidrogen klorida (HCl), dinatrium hidrofosfat (Na2HPO4), barium diklorida (BaCl2), alumunium foil, pepton, natrium klorida, yeast extract, membran selofan (Carolina Dialysis Tubing), aquades, glukosa anhidrat dan kertas saring.
Peralatan
Alat gelas yang digunakan dalam penelitian ini adalah gelas Beker, Erlenmeyer, labu ukur, gelas ukur, pipet tetes, tabung reaksi, botol kaca, cawan petri dan batang pengaduk. Alat non gelas yang digunakan adalah tabung effendof, termometer, kuvet, stopwatch, neraca analitik, freezer, inkubator, autoclaf, shacker incubator, penangas air (water bath), micropipet dan tip, vorteks, Laminar flow, pH meter, hotplate dan stirer. Instrumen yang digunakan yaitu sentrifugasi, BioELISA merk Biotek dan spektrofotometer UV-Vis (Single Beam Genesis).
Cara Kerja
Produksi dan Isolasi Amilase
Media starter dan produksi dibuat dengan melarutkan glukosa 1%, tripton 2%, yeast extract 1% dan amilum 1%. Koloni tunggal mikroba amilolitik dengan kode UU1.1 diambil dengan jarum ose steril dipindahkan ke media stater yang volumenya 20 mL dalam Erlenmeyer 100 mL.Selanjutnya diinkubasi ke dalam shaker incubator pada suhu 37C selama 1 hari. Sebanyak 1 mL inokulum mikroba dengan kode UU1.1 dan U3.1 yang sudah tumbuh dipindahkan ke dalam media fermentasi yang volumenya 100 mL dalam Erlenmeyer 500 mL. Media fermentasi ini diinkubasi diinkubasi ke dalam shaker incubator pada suhu 37°C selama tiga hari. Setelah itu, media pertumbuhan disentrifugasi pada kecepatan 5000 rpm selama 20 menit pada suhu 4C untuk memisahkan filtrat dan endapan. Supernatan (ekstrak kasar amilase) disimpan untuk dilakukan fraksinasi dengan ammonium sulfat.
Pemurnian amilase dengan fraksinasi amonium sulfat
Pemurnian enzim amilase dilakukan dengan cara fraksinasi dengan metode salting out (pengendapan) dengan amonium sulfat. Fraksi kejenuhan yang digunakan adalah 0%-20%, 20%-40%, 40%-60% dan 60%-80%. Setiap fraksi dan enzim amilase kasar dilakukan uji aktivitas enzim amilase dengan metode DNS.
Masing-masing fraksi yang terlarut dalam buffer fosfat 0,2 M pH 6 dimasukkan dalam kantung selofan dan kedua ujung kantung diikat dengan benang. Kemudian, fraksi amilase didialisis dengan cara merendam kantung selofan dalam 100 mL larutan buffer fosfat 0,02 M pH 6. Dialisis dilakukan dengan menggunakan pengaduk magnetik dengan kecepatan 100 rpm pada suhu dingin selama 24 jam dimana setiap 8 jam dilakukan pergantian buffer dengan konsentrasi dan pH yang sama.
Amobilisasi amilase
Larutan agar-agar dibuat dengan konsentrasi 1%, 2% dan 3 % b/v dalam buffer fosfat pH 6 sambil dipanaskan pada suhu 100C. Kemudian campuran sebanyak 9 mL didinginkan sampai suhu 40C dan ditambahkan amilase ekstrak kasar atau fraksi amilase dengan aktivitas tertinggi sebanyak 1 mL. Gelas Beker yang berisi campuran agar-agar dan amilase tersebut dipindahkan ke cawan petri dan didinginkan dalam suhu kamar. Setelah padat, campuran agar-agar dan enzim dipotong menjadi kotak-kotak kecil. Kemudian, amilase teramobil dicuci dengan air distilat dingin beberapa kali. Terakhir, amilase amobil disimpan pada suhu 4C. Persen amilase teramobil dapat ditentukan dengan mengukur aktivitas amilase yang akan ditambahkan. Efesiensi amobil atau amilase teramobil dapat diukur dengan persamaan (1).
% enzim teramobil = -[^]-x100% (1)
Keterangan :
A= Aktivitas enzim teoritis yang ditambahkan (enzim awal atau enzim pada saat bebas/belum diamobilisasi)
B = Aktivitas enzim sisa (enzim yang tidak teramobil atau hasil cucian)
Pengukuran aktivitas amilase
Larutan amilum dibuat dengan konsentrasi 1% sebanyak 30 mL. Kemudian, larutan ini dimasukkan dalam tube effendof sebanyak 250 μL dan ditambahkan ekstrak amilase kasar (atau hasil fraksinasi ammonium sulfat) 100 μL. Setelah itu, campuran enzim amilase dan amilum ditambahkan buffer fosfat pH 6 sebanyak 250 μL dan diinkubasi pada suhu 37^ selama 60 menit serta digoyang pelan dengan shaker. Lalu, larutan ditambahkan 100 μL DNS dan dihomogenkan. Tabung reaksi ditutup dengan alumunium foil. Kemudian, campuran dipanaskan dalam air mendidih atau penangas air selama 10 menit sampai larutan berwarna merah kecoklatan. Lalu campuran ditambahkan 100 μL NaK-Tartrat 4% dan didinginkan. Kemudian, campuran ditambahkan aquades hingga volume menjadi 1000 μL dan dihomogenkan. Setelah itu, campuran disentrifugasi dan diukur pada panjang gelombang 490 nm pada BioELISA.
Pengukuran kadar protein
Larutan sampel dipipet sebanyak 1 mL dan dimasukkan dalam tabung reaksi. Lalu, larutan ditambahkan aquades sampai volume total menjadi 4 mL. Kemudian, larutan ditambah 6 mL reagen Biuret dan dihomogenkan. Setelah itu, larutan disimpan pada suhu kamar selama 30 menit sampai berwarna ungu sempurna. Kemudian, larutan disentrifugasi hingga warna merata. Akhirnya, absorbansinya diukur pada panjang gelombang 540 nm dengan spektrofotometer UV-Vis.
HASIL DAN PEMBAHASAN
Produksi, isolasi,dan aktivitas amilase ekstrak kasar
Peremajaan mikroba dalam media padat PDA (Potato Dextrose Agar) diperlukan sebelum dilakukannya produksi enzim. Produksi amilase dari mikroba amilolitik dalam media cair dilakukan pada 2 tahap yaitu tahap perkembangbiakan awal dalam media starter dan produksi enzim dalam media produksi dengan volume yang lebih besar.
Komposisi media cair (starter dan produksi) terdiri atas glukosa 1% (b/v), tripton 2% (b/v), yeast extract 1% (b/v) dan amilum 1% (b/v). Fungsi tripton dan yeast extract yaitu untuk menyediakan senyawa nitrogen dan karbon yang diperlukan sel mikroba, seperti untuk biosintesis protein (Bussaman, 2018).
Sampel mikroba diinkubasi pada kondisi yang umum digunakan untuk mikroba amilolitik tumbuh, yaitu pada suhu 37oC dan pH 6 (Nangin dan Sutisno, 2015). Menurut Ayansina (2017), inkubasi mikroba dilakukan hingga mencapai fase stasioner. Umumnya, enzim sebaiknya diisolasi pada akhir fase logarimik atau awal fase stasioner karena aktivitas enzim pada fase ini tertinggi. Amilase umumnya lebih banyak disekresikan ke luar sel dari mikroba amilolitik, sehingga pada penelitian ini digunakan amilase ekstraseluler yang merupakan supernatan hasil sentrifugasi.Pada penelitian ini, satu unit aktivitas amilase didefinisikan sebagai banyaknya μmol glukosa yang dihasilkan dari hidrolisis media pati oleh 1 mL ekstrak kasar amilase selama masa inkubasi.Aktivitas amilase ekstrak kasar hasil isolasi diperoleh sebesar 3,0 x 10-4 Unit/mL.
Aktivitas amilase hasil fraksinasi dan dialisis
Fraksinasi ekstrak kasar amilase dilakukan pada tingkat kejenuhan garam amonium sulfat 0%-20% (Fraksi 1), 20%-40% (Fraksi 2), 40%-60% (Fraksi 3), 60%-80% (Fraksi 4) dan 80%-100% (Fraksi 5). Untuk meningkatkan kemurnian amilase hasil fraksinasi, terutama dari kandungan garam, maka dilakukan dialisis. Dialisis dilakukan dengan menempatkan amilase terfraksinasi pada kantung selofan yang memiliki cutoff berukuran antara 12-14 kilo Dalton. Pada umumnya ukuran protein amilase berkisar antara 32-150 kilo Dalton (Nangin dan Sutrisno, 2015),sehingga selain garam terlarut juga protein yang berukuran 12-14 kilo Dalton ke bawah dapat dipisahkan dari amilase yang cenderung tertahan di kantung selofan. Aktivitas amilase ekstrak kasar dan hasil fraksinasi dengan amonium sulfat ditunjukan pada Gambar 1.
0,0035 0,003
P 0,0025 & 0,002 ≡ 0,0015 2 o,ooι
0,0005 0


Fraksi 1 Fraksi 2
Hasil Hasii
Dialisis dialisis
Fraksi 3 Fraksi 4 Fraksi 5
Hasil Hasil Hasil
Dialisis Dialisis Dialisis
Esktrak Kasar
■ Esktrak Kasar
SFraksi 1 Hasil Dialisis a Fraksi 2 Hasil dialisis
a Fraksi 3 Hasil Dialisis HFraksi 4 Hasil Dialisis HFraksi 5 Hasil Dialisis
Gambar 1. Aktivitas Amilase Ekstrak Kasar dan Hasil Pemurnian
Gambar 1 menunjukkan bahwa aktivitas amilase hasil fraksinasi dengan amonium sulfat mengalami peningkatan dibandingkan ekstrak kasar amilase. Hasil ini menunjukkan bahwa Fraksi 3 (40-60%) memiliki aktivitas yang lebih tinggi dibandingkan fraksi lainnya sehingga amilase fraksi ini digunakan lebih lanjut dalam proses amobilisasi..Namun dari data aktivitas enzim ini belum bisa menunjukkan tingkat kejenuhan amonium sulfat yang dapat memurnikan protein amilase terbaik. Oleh sebab itu, aktivitas spesifik amilase penting ditentukan untuk mengetahui tingkat kejenuhan amonium sulfat terbaik yang digunakan dalam fraksinasi amilase ekstrak kasar.
Aktivitas spesifik amilase hasil fraksinasi dan dialisis
Data aktivitas enzim dari hasil fraksinasi belum dapat digunakan untuk menentukan fraksi mana yang menunjukkan tingkat kemurnian enzim tertinggi. Aktivitas amilase tertinggi pada fraksi 3 (Gambar 1) hanya menunjukkan bahwa pada fraksi tersebut lebih banyak protein amilase yang terendapkan dibandingkan dengan fraksi lain. Namun kemungkinan protein lain ikut juga mengendap pada fraksi tersebut, terutama protein-protein yang mempunyai tingkat kelarutan yang hampir sama dengan amilase. Apalagi rentang fraksinasi yang digunakan cukup lebar, yaitu 40-60%.Tingkat kemurnian suatu protein, termasuk enzim, dapat diketahui dari besarnya aktivitas spesifiknya.Semakin tinggi aktivitas spesifik suatu enzim, maka
semakin tinggi tingkat kemurniannya (Scopes, 1994).Oleh sebab itu, aktivitas spesifik amilase penting ditentukan untuk mengetahui tingkat kejenuhan amonium sulfat terbaik yang digunakan dalam fraksinasi amilase ekstrak kasar.
Aktivitas spesifik dapat diukur dengan menentukan aktivitas (U/mL) dibagi kadar protein total sampel (mg/mL). Pengukuran kadar protein diperlukan sebagai salah satu variabel penentuan aktivitas spesifik.Penentuan kadar protein total dilakukan dengan metode Biuret, dimana protein akan membentuk kompleks berwarna ungu dengan ion Cu2+ dalam pereaksi Biuret (Bhagavan, 2002). Kadar protein sampel ditentukan dari kurva protein standar. Protein yang digunakan sebagai standar adalah bovine serum albumin (BSA).Aktivitas spesifik amilase dapat ditentukan dari hasil bagi aktivitas amilase dengan kadar protein sampel. Aktivitas spesifik amilase hasil fraksinasi dengan amonium sulfat sebelum dan setelah dialisis dan tingkat kemurniannya terhadap ekstrak kasar ditunjukan pada Gambar 2.
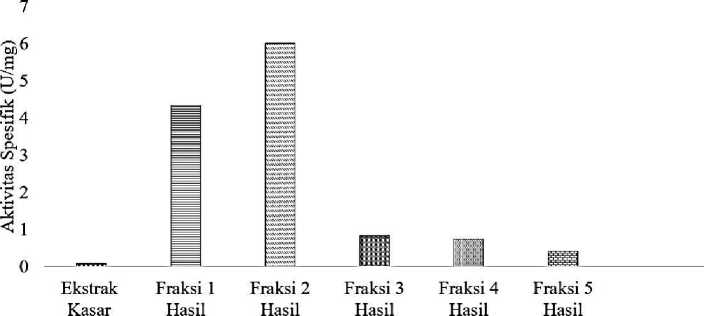
Perbandingan aktivitas spesifik amilase ekstrak kasar dengan terfraksinasi yang ditunjukkan pada Gambar 2 mengindikasikan bahwa tahap fraksinasi amonium sulfat dapat meningkatkan kemurnian amilase. Semakin tinggi aktivitas spesifik suatu enzim merupakan suatu indikator yang menunjukkan tingkat kemurnian enzim yang semakin meningkat (Novák and Havlíček, 2016).Fraksi dengan tingkat kemurnian paling tinggi adalah fraksi 2, dengan aktivitas spesifik sebesar 6,00 U/mg.
Dialisis
Dialisis
Dialisis
DiaIisis
Dialisis
S Ekstrak Kasar
B Fraksi 1 Hasil Dialisis B Fraksi 2 Hasil Dialisis
H Fraksi 3 Hasil Dialisis B Fraksi 4 Hasil Dialisis S Fraksi 5 Hasil Dialisis
Gambar 2. Aktivitas Spesifik Amilase Hasil Pemurnian dan Ekstrak Kasar
Tingkat kemurnian amilase hasil pemurnian terhadap ekstrak kasar dapat dilihat pada Tabel 1. Fraksi 1 hasil dialisis dengan aktivitas spesifik 4,33 U/mg dan fraksi 2 hasil dialisis dengan aktivitas spesifik 6,00 U/mg; serta berturut-turut dengan tingkat kemurnian yang tinggi, yaitu 57,7 dan 80,0 kali dibandingkan dengan amilase ekstrak kasar. Data ini mengindikasikan bahwa amilase pada penelitian ini mulai mengalami pemisahan dari fraksi 0-20% dan 20-40%.Hasil ini sebagai data awal yang sangat penting dalam menentukan strategi pemurnian amilase pada penelitian berikutnya.Penting ditelusuri lebih lanjut dengan melakukan fraksinasi ekstrak kasar amilase pada persen kejenuhan amonium sulfat yang lebih sempit.
Tabel 1. Tingkat Kemurnian Amilase Hasil Fraksinasi terhadap Ekstrak Kasarnya
Tingkat
Kemurnian
|
Sampel |
(kali) |
|
Ekstrak Kasar |
1,0 |
|
Fraksi 1 hasil dialisis |
57,7 |
|
Fraksi 2 hasil dialisis |
80,0 |
|
Fraksi 3 hasil dialisis |
11,1 |
|
Fraksi 4 hasil dialisis |
9,7 |
|
Fraksi 5 hasil dialisis |
5,3 |
Fraksinasi diperlukan untuk meningkatkan aktivitas spesifik amilase pada ekstrak kasar dengan memisahkan pengganggu baik protein dan enzim lainnya dengan pengendapan berfraksi. Penelitian ini telah berhasil melakukan pemurnian amilase dari mikroba amilolitik yang diperoleh dari penelitian sebelumnya, yaitu hasil fermentasi ubi jalar ungu dalam tanah yang diberi kode UU1. Tingkat kemurnian amilase terbaik yang diperoleh adalah pada fraksi 2 atau tingkat kejenuhan amonium sulfat 20-40% dengan 80 kali lebih murni dibandingkan dengan amilase ekstrak kasar dan memiliki aktivitas spesifik 6,00 U/mg.
Amobilisasi Amilase pada Agar-Agar Komersial
Untuk menentukan keberhasilan dalam mengamobilisasi amilase, maka diperlukan penentuan persen efisiensi enzim teramobil. Efisiensi enzim teramobil menunjukkan bahwa amilase dapat teramobilisasi dalam matriks. Efisiensi enzim teramobil juga menentukan kemampuan matriks dalam mengamobilisasi amilase. Hasil perhitungan efisiensi amilase teramobil pada matriks agar-agar ditunjukkan pada Tabel 2.
Tabel 2. Efisiensi AmilaseTeramobil pada
Matrik Agar-agar
|
Sampel |
% Efisiensi |
|
S1 |
10,00 |
|
S2 |
43,33 |
|
S3 |
66,67 |
|
S4 |
59,38 |
|
S5 |
43,75 |
|
S6 |
62,50 |
Keterangan:
S1-= Amilase kasar teramobil pada matriks agar-agar 1%; S2= Amilase kasar teramobil pada matriks agar-agar 2%; S3 = Amilase kasar teramobil pada matriks agar-agar 3%; S4 = Amilase fraksi 3 hasil dialisis teramobil pada matriks agar-agar 1%; S5 = Amilase fraksi 3 hasil dialisis teramobil pada matriks agar-agar 2%; S6 = Amilase fraksi 3 hasil dialisis teramobil pada matriks agar-agar 3%.
Tabel 2 menunjukkan bahwa efisiensi amilase teramobil dalam matriks agar-agar mengalami peningkatan seiring dengan meningkatnya konsentrasi agar-agar yang digunakan. Amilase kasar teramobil paling banyak pada matriks agar-agar 3% (b/v) yaitu sebesar 66,67%; sedangkan amilase fraksi 3 hasil dialisis juga paling banyak teramobil pada matriks agar-agar 3% sebesar 62,50%. Matriks agar-agar 1% lebih lama memadat dibandingkan agar-agar 2% dan 3% pada suhu 40oC. Bentuk matriks 3% lebih stabil dan tidak rentan mengalami kerusakan selama pencucian dibandingkan matriks 1% dan 2% (Prakash, 2013).
Prakash dan Jaiswal (2011) melaporkan persen efisiensi amilase teramobil sebesar 77%
pada matriks agar-agar 4% (b/v). Berdasarkan perbandingan terhadap penelitian tersebut, Efisiensi amilase teramobil yang diperoleh pada penelitian ini relatif cukup baik.Matriks agar-agar 3% menunjukkan persen efisiensi terbaik dalam mengamobilkan amilase, baik amilase kasar maupun hasil pemurnian. Hal ini kemungkinan disebabkan pada matriks agar-agar 3 % memiliki ikatan yang kuat antara komponen agar-agar dan memiliki kapasitas terbesar dibandingkan agar-agar 1% dan 2%. Amilase dapat teramobil lebih banyak pada matriks agar-agar 3%karena enzim lebih cepat terperangkap dalam larutan agar yang cepat memadat. Amilase teramobil kemungkinan lebih sedikit terpengaruh oleh kondisi lingkungan luar dan pengotor/pengganggu lainnya, sehingga enzim lebih stabil.
Kestabilan amilase teramobil ditentukan dengan penggunaan aktivitas amilase teramobil pada setiap penggunaan dan amilase bebas yang lepas dari amilase teramobil (kebocoran) (Prakash et al., 2013). Amilase ekstrak kasar diamobil pada matriks agar 1% (S1), 2% (S2) dan 3% (b/v) (S3); sedangkan amilase hasil fraksinasi dan dialisis (fraksi 3) juga diamobil pada matriks agar 1 % (S4), 2% (S5) dan 3% (b/v) (S6). Setiap amilase teramobil dilakukan pengulangan penggunaan, yaitu penggunaan pertama (A) dan digunakan kembali kedua kalinya (B) dan ketiga kalinya (C). Aktivitas amilase ekstrak kasar teramobil paling tinggi adalah amilase ekstrak kasar yang teramobil pada matriks agar-agar 3%.
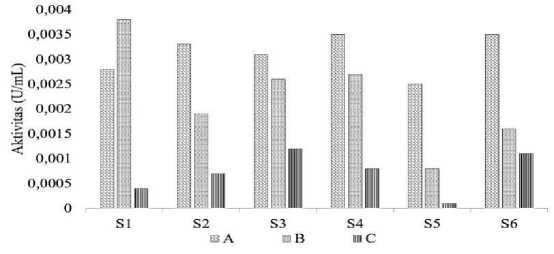
Gambar 3. Aktivitas Amilase Teramobil pada Penggunaan Pertama (A), Kedua (B) dan Ketiga (C)
Keterangan:
S1-= Amilase kasar teramobil pada matriks agar-agar 1%; S2= Amilase kasar teramobil pada matriks agar-agar 2%; S3 = Amilase kasar teramobil pada matriks agar-agar 3%; S4 = Amilase fraksi 3 hasil dialisis teramobil pada matriks agar-agar 1%; S5 = Amilase fraksi 3 hasil dialisis teramobil pada matriks agar-agar 2%; S6 = Amilase fraksi 3 hasil dialisis teramobil pada matriks agar-agar 3%.
Gambar 3 menunjukkan bahwa aktivitas amilase teramobil secara umum mengalami penurunan setiap penggunaan berulang. Penurunan terjadi karena adanya kebocoran amilase pada matriks agar-agar. Hal ini dapat dilihat pada cucian I, cucian II dan cucian III masih ditemukan adanya aktivitas amilase. Pada penggunaan pertama, aktivitas amilase ekstrak kasar teramobil pada matriks agar-agar 3% (b/v) lebih kecil dibandingkan pada matriks agar-agar 2% (b/v). Hal ini mungkin disebabkan amilase masih belum aktif sepenuhnya sehingga kontak antara substrat-enzim hanya terjadi sebagian (Mateo at al., 2007). Sedangkan aktivitas amilase fraksi 3 hasil dialisis teramobil tertinggi pada matriks agar-agar 1% dan 3%. Amilase murni teramobil memiliki aktivitas yang tinggi dibandingkan amilase ekstrak kasar teramobil karena amilase sudah dalam lebih keadaan stabil, dan tidak adanya pengotor.
Menurut Guisan (2006), kestabilan enzim terbaik dapat dilihat dari aktivitas amilase pada penggunaan terakhir. Hal ini karena pada penggunaan terakhir cenderung penurunan aktivitas amilase akan relatif kecil. Pada penggunaan kembali untuk yang ketiga kalinya (C), amilase pada matriks agar-agar 3% (b/v) memiliki aktivitas tertinggi dibandingkan matriks lainnya, sehingga dapat disimpulkan, bahwa matriks agar-agar 3% (b/v) lebih baik dalam memerangkap amilase dibandingkan matriks agar-agar 1% dan 2% (b/v). Jika dilihat dari konsentrasi, matriks agar-agar 3% (b/v) akan lebih baik dalam menahan amilase supaya tidak bocor. Hal ini dapat dilihat dari penurunan aktivitas amilase ekstrak kasar pada matriks agar-agar 1% dan 2% (b/v) yang mengalami penurunan yang lebih besar dibandingkan amilase teramobil pada matriks agar-agar 3% (b/v). Kesimpulannya bahwa matriks agar-agar 3% (b/v) merupakan matriks yang memiliki kestabilan tertinggi dengan kebocoran yang rendah.
Aktivitas amilase ekstrak kasar dan amilase fraksi 3 hasil dialisis teramobil tidak memiliki rentang yang cukup jauh aktivitasnya. Hal ini dapat disimpulkan bahwa amilase ekstrak kasar dapat digunakan sebagai amilase teramobil dibandingkan dengan menggunakan amilase murni yang memerlukan biaya pemurnian yang relatif lebih mahal, meskipun penurunan aktivitas
amilase murni lebih kecil dibandingkan penurunan aktivitas amilase ekstrak kasar. Salah satu cara mengefisiensi penggunaan amilase bebas adalah dengan amilase teramobil. Amilase teramobil yang paling baik digunakan pada matriks agar-agar 3% (b/v) dan tidak memerlukan proses pemurnian amilase karena kemampuan matriks dalam menstabilkan amilase.
SIMPULAN
Persen kejenuhan amonium sulfat untuk mendapatkan amilase mikroba amilolitik UU1.1 dengan tingkat kemurnian paling tinggi adalah 20-40% (fraksi 2), dengan aktivitas spesifik sebesar 6,0 U/mg, dan tingkat kemurnian 80 kali lebih tinggi daripada ekstrak kasar amilase. Pada amobilisasi amilase, konsentrasi agar-agar terbaik untuk amobilisasi ekstrak kasar amilase adalah 3% (b/v), dengan aktivitas amilase amobil sebesar 3,1 x 10-3 U/mL, dan efisiensi amobil sebesar 66,67%. Konsentrasi agar-agar terbaik untuk amobilisasi amilase murni hasil fraksinasi adalah 3% (b/v), dengan aktivitas sebesar 3,5 x 10-3 U/mL, dan efisiensi amobil sebesar 62,5%.
UCAPAN TERIMAKASIH
Penelitian ini merupakan bagian dari Penelitian Unggulan Program Studi yang didanai dari DIPA BLU Universitas Udayana dengan Surat Perjanjian Kerja Nomor: 2005/UN14.2.8.II/LT/2019. Ucapan terima kasih disampaikan kepada Koordinator Program Studi Kimia, Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam, Kepala UPT Laboratorium Forensik, dan Rektor Universitas Udayana atas dukungan dan fasilitas dalam penelitian.
DAFTAR PUSTAKA
Ayansina, A. D. V., Adelaja, A. O., and Mohammed, S.S.D.. 2017.
Characterization of Amylase from Some Aspergillus and Bacillus Species Associated with Cassava Waste Peels. Advances in Microbiology. 7: 280-292.
Bhagavan, N. V. 2002. Medical biochemistry.4th edition. Academic
press. USA
Brena, B. M. and Viera, F. B. 2006. Immobilization of Enzymes A Literature Survey in Methods in Biotechnology: Immobilization of Enzymes and Cells. 2nd Edition. Edited by Guisan, J.M. Humana Press Inc. Totowa, New Jersey.
Bussaman, P., Sa-uth, C., Rattanasena, P. and Chandrapatya, A.. 2018. Modification of Medium Composition for Enhancing the Production of Antifungal Activity from Xenorhabdus stockiae PB09 by Using Response Surface Methodology, International Journal of Microbiology. 1-10
Gaman, P.M., dan Sherrington, K. B.. 1994. Ilmu Pangan Pengantar Ilmu Pangan Nutrisi dan Mikrobiologi. a.b. Murdijati, UGM Press. Yogyakarta
Golunski, S., Silva, M. F., Marques, C. T., Rosseto, V., Kaizer, R. R., Mossi, A. J., Rigo, D., Dallago, R. M., Luccio, M. D., and Treichel, H.. 2017. Purification of inulinases by changing the ionic strength of the medium and precipitation with alcohols. Anais Da Academia Brasileira de Ciências. 89(1): 57–63
Guisan, J. M.. 2006. Methods in
Biotechnology: Immobilization of Enzymes and Cells, 2nd Edition. Humana Press Inc. Totowa, New Jersey
Gupta, R., Gigras, P., Mohapatra, H., Goswami, V. K., & Chauhan, B.. 2003. Microbial α-amylases: a
biotechnological perspective. Process Biochemistry. 38(11): 1599–1616.
Iswendi. 2010. Penentuan aktivitas amilase dari umbi bengkuang (Pachyrrizus arosus L. Urb) hasil ekstraksi dengan etanol dan ammonium sulfat. Jurnal saintek. 2(2): 94-98
Maarel, M. J., Veen, B., Uitdehaag, J. C., Leemhuis and Dijkhuizen. 2002. Properties and applications of starch-converting enzymes of the alpha-amylase family. J Biotechnol. 94(2):137-55.
Mateo, C., Palomo, J. M., Fernandez-Lorente, G., Guisan, J. M., &
Fernandez-Lafuente, R.. 2007.
Improvement of enzyme activity,
stability and selectivity via immobilization techniques. Enzyme and Microbial Technology. 40(6):
1451–1463
Nangin, D., dan Sutrisno, A.. 2015. Enzim amilase pemecah pati mentah dari mikroba : kajian pustaka. Jurnal Pangan dan Agroindustri. 3(3):
1032-1039
Novák, P., and Havlíček, V.. 2016. Protein Extraction and Precipitation in Proteomic Profiling and Analytical Chemistry. 2nd Edition. Edited by Ciborowski and Silberring. Elsevier. USA
Prakash, O. and Jaiswal, N. 2011. Immobilization of a Thermostable -Amylase on Agarose and Agar Matrices and its Application in Starch Stain Removal. World Applied Sciences Journal. 13 (3): 572-577
Prakash, O., Rai1, A. K., Singh, J. and Singh, P. M. 2013. Immobilization of cauliflower myrosinase on agar agar matrix and its application with various effectors. Advances in Biochemistry. 1(3): 51-56
Scopes, R. K.. 1994. Protein purification principle and practice. Third edition. Springer. New York
Suriya, J., Bharathiraja, S., Krishnan, M., Manivasagan, P., and Kim, S.K.. 2016. Marine Microbial Amylases: Properties and Applications. Advances in Food and Nutrition Research. 79(8): 161-177.
Wirajana, I N., dan Bogoriani, N W. 2019. Produksi Amilase dan Selulase dari Fermentasi Ubi Jalar Ungu (Ipomoea batatas L. Poir) dalam Tanah dan Aplikasinya untuk Ekstraksi Antosianin. Laporan PUPS 2019.
49
Discussion and feedback