KARAKTERISASI LEMPUNG BENTONIT TERMODIFIKASI SURFAKTAN DAN PEMANFAATANNYA SEBAGAI ADSORBEN LOGAM Cr DAN Pb PADA LIMBAH CAIR INDUSTRI TEKSTIL
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 15 (1), JANUARI 2021
DOI: https://doi.org/10.24843/JCHEM.2021.v15.i01.p05
p-ISSN 1907-9850
e-ISSN 2599-2740
KARAKTERISASI LEMPUNG BENTONIT TERMODIFIKASI SURFAKTAN DAN PEMANFAATANNYA SEBAGAI ADSORBEN LOGAM Cr DAN Pb PADA LIMBAH CAIR INDUSTRI TEKSTIL
I. A. G. Widihati*, N. P. A. H. Saraswati dan I G. A. K. S. P. Dewi
Program Studi Kimia, Fakultas Matematika dan Ilmu Pegetahuan Alam, Universitas Udayana Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia
*Email: gedewidihati@unud.ac.id
ABSTRAK
Penelitian mengenai karakterisasi lempung bentonit termodifikasi surfaktan dan pemanfaatannya sebagai adsorben logam Cr dan Pb pada limbah cair industri tekstil telah dilakukan. Modifikasi dilakukan melalui metode interkalasi dengan menambahkan 2,9155 gram surfaktan heksadesil trimetil amonium bromida per 10 gram bentonit kemudian ditambahkan dengan 2,0480 gram asam palmitat. Bentonit yang telah termodifikasi dimanfaatkan sebagai adsorben ion Cr3+ dan Pb2+. Penelitian ini bertujuan untuk mengetahui karakteristik bentonit termodifikasi, waktu optimum dan kapasitas adsorpsi terhadap ion Cr3+ dan Pb2+ . Hasil penelitian menunjukan bahwa interkalasi hekasdesil trimetil amonium bromida ke dalam antar lapis lempung bentonit tidak menyebabkan perubahan kristalinitas bentonit. Ikatan antara surfaktan dengan kisi kristal bentonit ditunjukkan dengan vibrasi pada bilangan gelombang 2922,16 dan 2850,97 cm-1 yang merupakan vibrasi dari gugus CH2 amina. Luas permukaan spesifik bentonit termodifikasi ditentukan dengan metode adsorpsi metilen biru dan didapatkan luas permukaan spesifik sebesar 46,180 m2/g. Waktu optimum adsorpsi bentonit termodifikasi untuk ion Cr3+ dan Pb2+berturut-turut 20 dan 10 menit, dengan kapasitas adsorpsi untuk ion Cr3+ dan Pb2+berturut-turut sebesar 0,0277 (84,575%) mg/g dan 0,1350 (87,455%) mg/g.
Kata kunci: adsorpsi, bentonit, interkalasi, limbah cair, logam berat
ABSTRACT
This paper discusses the characterization of surfactant-modified bentonite clays and its application as the adsorbent of Cr dan Pb in textile industry wastewater. The modifications were made through intercalation by the addition of 2.9155 grams of hexadecyl trimethyl ammonium bromide per 10 grams of bentonite and 2.0480 grams of palmitic acid. The aims of the research were to determine the characteristics of modified bentonite, optimum contact time and adsorption capacity of Cr3+ and Pb2+ ions. The results showed that the intercalation of hexadecyl trimethyl ammonium bromide into the interlay of bentonite clay did not cause changes in the bentonite crystallinity. The bond between the surfactant and the bentonite crystal lattice was shown by the vibration at wave numbers of 2922.16 and 2850.97 cm-1 indicating the vibration of the CH2 amine. The specific surface area of the modified bentonite determined by the blue methylene adsorption method was of 46,180 m2/g. The optimum adsorption time of modified bentonite for Cr3+ and Pb2+ ions were of 20 and 10 minutes, respectively with the adsorption capacity of Cr3+ and Pb2+ ions of 0.0277 mg/g (84.58%) and 0.1350 mg/g (87.46%), respectively.
Keywords: adsorption, bentonite, heavy metals, intercalation, wastewater
PENDAHULUAN
Perkembangan Perkembanganj industrij tekstilj saatj ini,j mengalamij peningkatanj yangj cukupj pesat.j Penggunaanj zatj warnaj sintetisj sebagaij bahanj bakuj yangj digunakanj dalamj skalaj besarj dapatj berdampakj bagij lingkungan,j salahj satunyaj pencemaranj lingkungan.j Limbahj cairj merupakanj hasilj sampingj darij industrij
tekstiljyangjmengandungj beberapaj jenisj logamjberatjsepertijtimbalj(Pb),jkromiumj(Cr), kadmiumj(Cd),jkobaltj(Co),jbesij(Fe),jtembag aj(Cu)jdanjsengj(Zn)j(TutyjdanjHerni,j2009). LogamjCrjumumnyajdigunakanjdalamjindustri tekstil,j elektroplating,j penyamakanjkulitj danjpulp,jsedangkanjlogamjPbjumumnyajdigu nakandalamjindustrijbaterai,jcatjtembok,jdan tekstil (Palar,j2008). Dalamjupayajpenanganan
limbahlogamj berat,jadsorpsij denganjmaterial alamberporijmerupakanjsalahjsatujcarajyang seringjdilakukan.
Bentonitj merupakanj salahj satuj materialjalamjberporijsebagaij sumberj dayaj mineralj yangj melimpahj dij Indonesia.j EndapanjbentonitjtersebarjdijpulaujJawa,jSum atera,jSulawesijdanjsebagianjKalimantanjdeng anjcadanganjdiperkirakanjlebihjdarij380j jutajtonj(Riyanto,j1994).j Bentonitj
merupakanj mineralj aluminaj silikatj hidratj yangj termasukj dalamj filosilikat,j atauj silikatj berlapis.j Rumusj kimiaj umumj bentonitj adalahj Al2O3.4SiO2.H2O.
Kandunganj bentonitj terdirij darij 85%j monmorilonite,j illite,j danj kuarsaj (Dewi,j 2015).j Bentonitj memilikij kemampuanj mengembangj (swelling)j yangj cukupj besarj danj kapasitasj tukarj kationj yangj tinggi.j Halj inij menjadikanj bentonitj sebagaij adsorbenj denganj kapasitasj adsorpsij yangj lebihj besarj dibandingkanj denganj yangj lainnya.j Meskipunj bentonitj sangatj bergunaj untukj adsorpsi,j namunj kemampuanj adsorpsinyaj terbatas.j Kelemahanj tersebutj dapatj diatasij melaluij modifikasij bentonitj denganj senyawa-senyawaj organikj menghasilkanj kompleksj yangj dapatj digunakanj sebagaij adsorben,j salahj satunyaj sebagaij adsorbenj ionj Cr3+j danj Pb2+.j
Surfaktanj kationikj sepertij heksadesilj trimetilj ammoniumj bromidaj (HDTMA-Br)j merupakanj senyawaj organikj yangj digunakanj dalamj modifikasij bentonit.j Kationj HDTMA+j akanj menggantikanj kation-kationj padaj ruangj antarlapisanj bentonitj danj mengubahj sifatj permukaanj bentonitj yangj awalnyaj bersifatj hidrofilikj menjadij hidrofobik.j Padajmodifikasij permukaanj bentonitj lebihj lanjutj digunakanj asamj palmitatj melaluij interaksij hidrofobik.j Asamj palmitatj atauj liganj tersebutj akanj membentukj senyawaj kompleksj denganj ionj Cr3+j danj Pb2+j yangj teradsorpsij (Widihati,j 2009).
MATERI DAN METODE
Bahan
Bahan-bahan kimia yang digunakan dalam penelitian ini adalah limbah cair industri tekstil yang diambil dari salah satu pabrik tekstil di daerah Kelungkung, Bali, lempung bentonit, Pb(NO3)2, CrCl3, HNO3
65%, heksadesiltrimetil ammonium bromide (HDTMA-Br), asampalmitat, metilen biru dan akuades.
Peralatan
Peralatan yang digunakan pada penelitian ini adalah seperangkat alat gelas, penggerus porselin, lumpang, ayakan 105 µm, oven, pengaduk magnet, pemanas, kertas saring Whatman 42, pH meter dan timbangan analitik. Peralatan instrument yang digunakan meliputi: XRD-6000, spektrofotometer UV-Visible, spektrofotometer infra merah (FTIR) dan spektrofotometer serapan atom (SSA).
Cara Kerja
Preparasi Sampel limbah cair industri tekstil
Sampel limbah cair industri tekstil di saring dengan menggunakan kertas saring whatman 42 untuk menghilangkan pengotornya. Kemudian ditambahkan beberapa tetes HNO3 65% untuk menurunkan pH pada sampel dan selanjutnya dianalisis menggunakan spektrofotometer serapan atom untuk mengetahui kadar logam awal Cr3+ dan Pb2+ yang terkandung dalam sampel.
Preparasi Bentonit
Sebanyak 100 g bentonit dicuci dengan akuades, kemudian dikeringkan dalam oven pada suhu 100-110 OC. Bentonit yang telah dikeringkan, digerus sampai halus kemudian diayak menggunakan ayakan dengan ukuran 105 µm. Hasil preparasi bentonit dianalisis menggunakan XRD-6000 dan FTIR.
Interkalasi Bentonit dengan HDTMA
Suspensij lempungjdibuatjdenganjcara melarutkanjsepuluhjgramjlempungjbentonitjke dalamj1000j mL akuades,jdiadukjj selamaj5 jam.j Kemudianj2,9155jgramjHDTMA-Br ditambahkan,j diadukj selamaj 24jjam. Selanjutnyajditambahkanj2,0480jgramjasam palmitat,jdiadukjselamaj48jjam.j Kemudian campuranjdisaring,jdicucijdenganjakuadesjdan dikeringkanjdalamjovenjpadajtemperaturj60j 0C.jSetelahjkeringjbentonitjdigerusjdanjdiayak, kemudianj dianalisisj denganj menggunakan jXRD-6000j danjFTIR.
Penentuan luas permukaan dengan metode adsorpsi metilen biru
Ke dalamj 5j buahj Erlenmeyerj 100j mLj masing-masingj dimasukkanj sebanyakj 0,2j
gramj bentonitj danj bentonitj termodifikasi.j Kemudianj ditambahkanj larutanj metilenj biruj 100j mg/L.j Campuranj diadukj denganj masing-masingj denganj waktuj yangj berbedaj yaituj selamaj 10,j 20,j 40,j 50,j danj 60j menit.j Setelahj ituj campuranj disaring,j laluj diukurj absorbansinyaj padaj panjangj gelombangj maksimum.j Nilaij absorbansij yangj diperoleh,j dimasukkanj kej dalamj persamaanj regresij linearj metilenj biru,j sehinggaj didapatkanj konsentrasij metilenj biruj yangj tersisaj dalamj filtratj (Widihati,j 2010).j Luasj permukaanj bentonitj dihitungj denganj rumusj sebagaij berikut:
A × N × σ S = -------- Mr
Keterangan:
S = Luas permukaan spesifik adsorben (m2/g) N= Bilangan Avogadro (6,02 x 1023
molekul/mol)
A = Massa adsorbat teradsorpsi (mg/g) σ= Luas penampang oleh satu molekul metilen biru (1,97 x 10-18 m2/molekul)
Mr = Berat molekul adsorbat metilen biru (319,85 g/mol)
Penentuan waktu optimum
Kej dalamj 5jbuahj Erlenmeyerj100jmL Masing-masingjdimasukkanj0,1jgramjlempung Bentonitj tanpaj termodifikasi.j Padajtiap Erlenmeyerj ditambahkanj masing-masing 10jmLlimbahjcairjindustrijtekstil.j Campuran diaduk jdenganjwaktujyangjberbeda-beda yaitujselamaj10,j 20,j 40,j 60j danj90j menit. Selanjutnyaj disaringjdanj filtratnya diukur denganjspektrofotometerjserapanjatom.jProses serupaj dilakukanj jugaj terhadapjlempung bentonitj termodifikasi. Absorbansij yang terbaca jkemudian jdimasukkanj ke dalam persamaanjregresijsehinggajkonsentrasijlogamj CrjdanjPbjdalamjfiltratjbisajditentukan.jUntukj mengetahui jwaktu joptimum jdibuatjgrafik antarajbanyaknyajionjlogamjyangjteradsorpsij per gramjadsorben jdengan jwaktujyang diberikan.j Waktuj optimumj ditentukanj darij grafikj dimanaj waktuj konsentrasij ionj logamj tertinggij yangj teradsorpsi.
Penentuan kapasitas adsorpsi
Kejdalamjmasing-masingjErlenmeyerj100 mL,jdimasukkanj0,1jgramjlempungjbentonit Tanpajterinterkalasij danjlempung jbentonitj
terinterkalasijHDTMA-Brjdanj asamjpalmitat. Kemudian jditambahkanj10jmLj limbahjcair industrijtekstil. jSelanjutnyaj disaringjdan filtratnya jdiukurj denganjspektrofotometer serapanjatom.j Kapasitasj adsorpsij ditentukan berdasarkanj banyaknyaj zatj terlarutj yang teradsorpsij olehj setiapj gramj adsorbenj pada keadaanj jenuhj Nilaij konsentrasij yang dipeolehj dimasukkanj kej dalamj rumus persentasej penyerapaanj (E)j danj kapasitas adsorpsij (A).
(Ci - C2)
%E = 1 2 × 100%
C1
Dimana: C1 = Konsentrasi awal ion logam (mg/L)
C2 = Konsentrasi ion logam yang tersisa dalam filtrat (mg/L)
Kapasitas Adsorpsi dapat dihitung dengan menggunakan rumus:
A =
Keterangan:
C1 - C2
1000
1 ×V×
B
A = Jumlah Pb atau Cr yang teradsorpsi oleh lempung bentonit (mg/g)
C1=Konsentrasiawal Pb atau Cr (mg/L)
C2= Konsentrasi Pb atau Cr yang tersisa dalam filtrate (mg/L)
V = Volume Pb atau Cr yang digunakan (mL)
B =Berat lempung bentonit (g)
HASIL DAN PEMBAHASAN
Karakterisasi bentonite dengan Difraksi Sinar-X (XRD)
Karakterisasi bentonite menggunakan metode XRD bertujuan untuk mengetahui kristalinitas dan pergeseran jarak antar lapis silikat lempung yang dapat dilihat dari difraktogramnya. Difraktogram bentonit dan bentonite termodifikasi ditunjukkan pada Gambar 1.
Gambar 1. Difraktogram bentonit dan bentonit termodifikasi 31
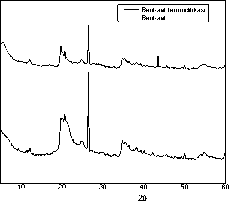
Difraktogram menunjukan modifikasi bentonit dengan interkalasi HDTMA-Br menyebabkan hilangnya puncak pada 2θ= 5,6999o, hal ini kemungkinan disebabkan karena terjadinya perubahan posisi bidang kristal, dimana bidang d001 tidak lagi sama seperti sebelumnya, namun struktur kristal tidak mengalami perubahan. Intensitas yang tinggi dengan puncak yang tajam terdapat pada kedua difraktogram yakni pada 2θ=26,5yang menunjukkan persenyawaan SiO. Interkalasi surfaktan ke dalam antar lapis tidak menyebabkan terjadinya perubahan jarak antar lapis, hal ini mungkin disebabkan oleh surfaktan yang
terinterkalasi tersusun secara horizontal terhadap jarak antar lapis bentonit (Widihati, 2018).
Karakterisasi dengan Spektrofotometer Inframerah (FTIR)
Karakterisasij denganj menggunakanj spektrofotometerj inframerahj dilakukanj untukj mengidentifikasij gugusj fungsij yangj terdapatj dalamj bentonitj danj bentonitj termodifikasij ditunjukkanj padaj Gambarj 2.
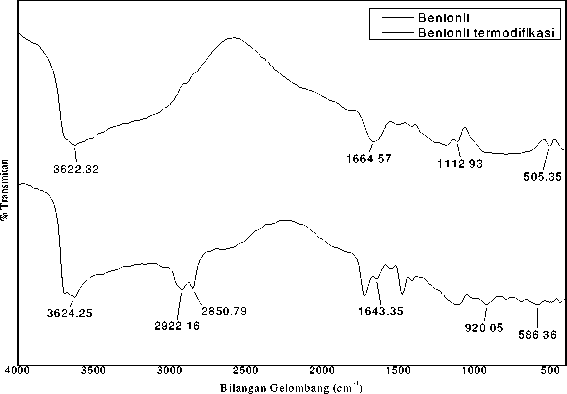
Gambar 2. Sepktra FTIR bentonit dan bentonittermodifikasi
Spektra FTIR menunjukan adanya daerah serapan baru yang diakibatkan oleh interkalasi HDTMA-Br ke dalam ruang antar lapis lempung bentonit. Bilangan gelombang 2922,16 cm-1 dan 2850,97 cm-1 merupakan vibrasi ulur CH2 amina yang menunjukan bahwa bentonit telah berhasil termodifikasi. Berbagai daerah serapan yang terjadi ditampilkan pada Tabel 1 dan 2.
Tabel 1. Serapan bentonite tanpa termodifikasi
|
Gugus fungsi |
Bilangan gelombang cm-1 |
|
Vibrasi ulur O-H |
3622,32 |
|
Vibrasi tekuk -OH |
1664,57 |
|
Si – O - Si |
1112,93 |
|
Vibrasi Si-O |
505,35 |
Tabel 2. Serapan bentonite termodifikasi
|
Gugus fungsi |
Bilangan gelombang cm-1 |
|
Vibrasi ulur O-H |
3624,25 |
|
Vibrasi ulur CH2 amina |
2922,16 dan |
|
2850,97 | |
|
Vibras itekuk -OH |
1643,35 |
|
Vibrasi Al-O |
920,05 |
|
Vibrasi Si-O |
586,36 |
Penentuan luas permukaan spesifik
Adsorpsi metilen biru ini dilakukan pada panjang gelombang 664,20 nm. Tabel 3 menunjukan luas permukaan bentonite termodifikasi lebih tinggi dibandingkan dengan bentonite tanpa modifikasi dengan masing-masing memiliki kapasitas adsorpsi 12,318
mg/g dan luas permukaan spesifik sebesar 46,180 m2/g, sedangkan bentonite tanpa modifikasi memiliki kapasitas adsorpsi 12,450 mg/g dan luas permukaan spesifik sebesar 45,687 m2/g. Luas permukaan spesifik bentonite termodifikasi memiliki luas yang lebih tinggi, hal ini disebabkan oleh munculnya situs-aktif pada bentonit termodifikasi. Situs aktif ini merupakan tempat terikatnya ion logam Cr dan Pb pada permukaan bentonite. Hasil penentuan luas permukaan bentonit dan bentonite termodifikasi dapat dilihat pada Tabel 3.
Tabel 3. Luas permukaan bentonit dan bentonite termodifikasi
|
Adsorben |
kapasitas adsorpsi (mg/g) |
Luas permukaan (m2/g) |
|
Bentonit |
12,318 ± 0,0006 |
45,687 |
|
Bentonit termodifikasi |
12,450 ± 0,0006 |
46,180 |
Penentuan waktu optimum adsorpsi
Pada penelitian ini diperoleh kapasitas adsorpsi bentonite tanpa termodifikasi terhadap
ion Cr3+ dan Pb2+ optimum pada waktu 20 menit. Sedangkan adsorpsi bentonite termodifikasi terhadap ion Cr3+ memiliki waktu yang sama dengan bentonite tanpa termodifikasi, yaitu 20 menit dan ion Pb2+memiliki waktu optimum yang lebih cepat yaitu pada waktu 10 menit. Waktu optimum adsorpsi ion Cr3+ dan Pb2+ oleh bentonit dan bentonite termodifikasi ditampilkan pada Gambar 3 dan kapasitas adsorpsi pada Tabel 4.
Tabel 4. Kapasitas adsorpsi bentonit dan bentonite termodifikasi pada waktu optimum
|
Adsorben |
Adsorbat |
Waktu optimum (menit) |
Kapasitas adsorpsi (mg/g) |
|
Bentonit |
Cr3+ |
20 |
0,0235 ± 0,005 |
|
Pb2+ |
20 |
0,1305 ± 0,006 | |
|
Bentonit termodifi- |
Cr3+ |
20 |
0,0300 ± 0,0007 |
|
kasi |
Pb2+ |
10 |
0,1454 ± 0,01 |
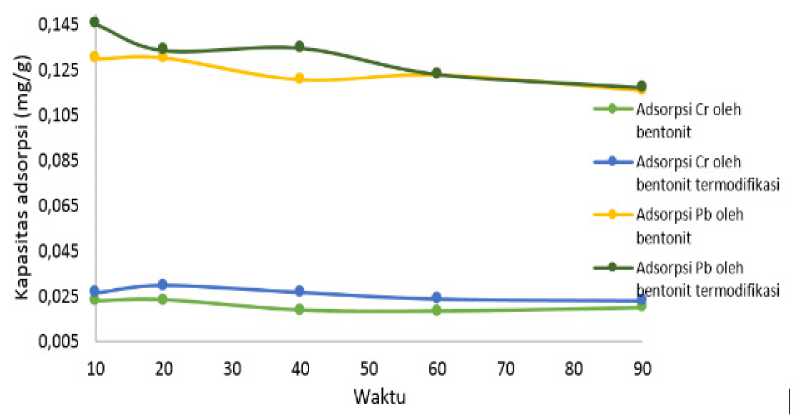
Gambar 3. Kurva pengaruh waktu optimum terhadap adsorpsi ion Cr3+ dan Pb2+
Kapasitas adsorpsi bentonite terhadap ion Cr3+ dan Pb2+
Penentuan kapasitas adsorpsi dilakukan untuk mengetahui kemampuan bentonit dan
bentonite termodifikasi menyerap ion Cr3+ dan Pb2+ pada waktu setimbang. Kapasitas adsorpsi terhadap ion Cr3+ dan Pb2+ditunjukkan pada Tabel 5.
Tabel 5. Kapasitas adsorpsi bentonit dan bentonite termodifikasi terhadap ion Cr3+ dan Pb2+
|
Adsorben |
Ion |
kapasitas adsorpsi (mg/g) |
persentase penyerapan (%) |
|
Bentonit |
Cr3+ |
0,0123 ± 0,0009 |
37,540 |
|
Pb2+ |
0,1230 ± 0,0002 |
79,822 | |
|
Bentonit termodifikasi |
Cr3+ |
0,0277 ± 0,0004 |
84,575 |
|
Pb2+ |
0,1350 ± 0,0006 |
87,455 |
Berdasarkanj dataj tabelj didapatkanj bahwaj bentonitj termodifikasij mempunyaij kapasitasj yangj lebihj besarj dibandingkanj denganj bentonitj tanpaj termodifikasi.j Peningkatanj kapasitasj adsorpsij inij disebabkanj karenaj bentonitj termodifikasij telahj membentukj senyawaj kompleksj denganj surfaktanj HDTMA-Brj melaluij suatuj ikatanj koordinasi.j Kompleksjyangjterbentukjtersebutjdigunakan untukjmenjangkarjasamj palmitatj sebagai ligannyajmelaluijinteraksijhidrofobik.j Ligan-liganj tersebutj kemudian berfungsi sebagai situs aktif yangj mengikatj ionj Cr3+j danjPb2+ (Widihati,j 2009).j Peningkatanj kapasitasj adsorpsijjugaj disebabkanj luasj permukaan Spesifikjbentonitjyangjmeningkat.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian yang telah dilakukan maka dapat disimpulkan bahwa bentonit termodifikasi memiliki luas permukaan sebesar 46,180 m2/g sedangkan bentonit sebesar 45,687 m2/g. Waktu optimum adsorpsi bentonit terhadap ion Cr3+ dan Pb2+ adalah 20 menit, sedangkan untuk bentonit termodifikasi adalah 10 menit. Kapasitas adsorpsi terhadap ion Cr3+ oleh bentonit dan bentonit termodifikasi adalah 0,0123 dan 0,0277 mg/g , sedangkan untuk Pb 2+ sebesar 0,1230 dan 0,1350 mg/g.
Saran
Perlu dilakuan penelitian lebih lanjut mengenai kemampuan adsorpsi bentonite termodifikasi dengan menggunakan surfaktan dan ligan yang berbeda, serta pemanfaatannya sebagai adsorben ion logam lain yang bersifat toksik.
DAFTAR PUSTAKA
Dewi, P.A. 2015. Adsorpsi Ion Logam Pb2+ dan Cu2+ Oleh Bentonit Teraktivitas Basa (NaOH). Jurnal Kimia. 9(2): 235-242.
Palar, H. 2008. Pencemaran dan Toksikologi Logam Berat. PT. Rineka Cipta. Jakarta.
Riyanto, A. 1994. Bahan Galian Industri.
Direktorat Jendral Pertambangan Umum. Pusat Penelitian Pengembangan Teknologi Mineral. Bandung.
Tuty, E. A., dan B. Herni. 2009. Pengolahan Air Limbah Pewarna Sintesis dengan Menggunakan Reagen Fenton. Prosiding Seminar
Nasional Teknik Kimia Indonesia. Bandung.
Widihati, I. A. 2009. Adsorpsi Ion Pb2+ oleh Lempung Terinterkalasi Surfaktan. Jurnal Kimia. 3(1): 2732.
Widihati, I. A. 2010. Karakterisasi Keasaman dan Luas Permukaan Tempurung Kelapa Hijau (Cocos nicifera) dan Pemanfaatmya Sebagai Biosorben Ion Cd2+. Jurnal Kimia. 4(1): 7-14.
Widihati, I. A. 2018. Characterization and Optimization Of Salicylic Acid Bentonite Clay Nanocomposite. Asian Journal of Chemistry. 30(11): 2421-2423.
35
Discussion and feedback