PREPARASI ARANG BAMBU DENGAN METODE KONVENSIONAL, AKTIVASI TERMAL DAN KARAKTERISASI SERTA APLIKASINYA SEBAGAI ADSORBEN LOGAM Pb(II) DAN Cr(III)
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 15 (1), JANUARI 2021 DOI: https://doi.org/10.24843/JCHEM.2021.v15.i01.p08
p-ISSN 1907-9850
e-ISSN 2599-2740
PREPARASI ARANG BAMBU DENGAN METODE KONVENSIONAL, AKTIVASI TERMAL DAN KARAKTERISASI SERTA APLIKASINYA SEBAGAI ADSORBEN LOGAM Pb(II) DAN Cr(III)
M. Manurung*, A. A. B. Putra, dan I. Oktavia
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Jimbaran, Badung, Bali, Indonesia
*Email: manuntun_manurung@unud.ac.id
ABSTRAK
Arang aktif merupakan adsorben multifungsi, dapat menyerap spesi yang bermuatan positif seperti ion logam, molekul netral seperti I2 dan bermuatan negatif. Tujuan penelitian adalah membuat arang aktif dari limbah bambu yang berguna meminimalisir kandungan logam timbal (II) dan krom (III) dari perairan. Pembuatan arang dilakukan secara konvensional menggunakan tong kedap udara dengan pemanasan selama 12 jam. Aktivasi arang dilakukan menggunakan tanur pada suhu 650o C selama 4 jam. Hasil penelitian menunjukkan bahwa aktivasi termal menghasilkan arang aktif lebih baik dibandingkan tanpa aktivasi. Arang yang diaktivasi dan tanpa aktivasi memenuhi SNI 06-3730-1995 tentang arang aktif teknis. Luas permukaan sebesar 494,8178 m2/g, keasaman permukaan sebesar 4,4426 mmol/g, dan kebasaan permukaan sebesar 3,4467 mmol/g. Kondisi optimum adsorpsi terhadap ion logam yaitu waktu kontak 24 jam dan pH 8 untuk Pb(II) dan pH 6 untuk Cr(III). Kapasitas adsorpsi arang aktif sebesar 3,9800 mg/g untuk ion Pb(II) dan 3,9766 mg/g untuk ion Cr(III).
Kata kunci: adsorben, aktivasi, arang aktif, bambu.
ABSTRACT
Active charcoal is a multifunctional adsorbent which can absorb positively charged species such as metal ions, neutral molecules such as I2 and negatively charged. The purpose of this research was to make activated charcoal from bamboo waste useful for minimizing the metal content of lead (II) and chromium (III) from the waters. Making charcoal conventionally used an airtight vat with heating for 12 hours. Activation of charcoal was carried out using a furnace at 650 oC for 4 hours. The results showed that thermal activation produces activated charcoal better than without activation. Activated charcoal and without activation had met SNI 06-3730-1995 regarding technical activated charcoal. The surface area was 494.8178 m2/g, surface acidity was 4.4426 mmol/g, and surface basicity was 3.4467 mmol/g. The optimum conditions for adsorption of metal ions were 24 hours contact time and pH 8 for Pb (II) and pH 6 for Cr (III). The adsorption capacity of activated charcoal was 3.9800 mg/g for Pb (II) ions and 3.9766 mg/g for Cr (III) ions.
Keywords: adsorbent, activation, activated charcoal, bamboo.
PENDAHULUAN
Keberadaan logam berat Ni, Cu, Fe, Cr dan Pb di perairan sebagai polutan telah sejak lama diketahui. Polutan tersebut berasal dari limbah petambangan, pengolahan bijih besi, industri cat, zat warna, elektroplating, baterai dan lainnya. Keberadaannya di dalam perairan berbahaya bagi kehidupan makhluk hidup. Logam berat apabila terakumulasi dalam tubuh dapat menyebabkan gangguan kesehatan,
karena bersifat karsinogenik, dapat menyebabkan mutasi sel, dan dalam waktu lama toksisitasnya tidak berubah (Riani, E et al., 2017).
Berbagai metode telah dilakukan untuk mengurangi kandungan logam berat dalam perairan, salah satunya melalui adsorpsi oleh arang aktif. Arang aktif merupakan senyawa amorf yang diproduksi dari bahan mengandung karbon tinggi. Arang aktif memiliki kapasitas adsorpsi yang baik karena
memiliki permukaan yang luas yaitu berkisar 300 – 3000 m2/g. Arang aktif komersial dibuat dari briket batubara, minyak bumi akibatnya biaya produksi dan harga jualnya cukup mahal (Bhattacharyya dan Gupta, 2007 ; Ahmad, M.A et al., 2014). Oleh karena itu perlu perhatian mencari bahan baku alternatif baru yang murah dan jumlahnya mencukupi. Bahan baku untuk pembuatan arang aktif dapat berasal dari limbah pertanian, seperti bambu, tempurung kelapa, pinang, kayu dan lain – lain (Hesas, R.H et al., 2013; Krismayanti, N et al., 2019). Pembuatan arang secara konvensional dilakukan dengan pemanasan internal briket yang ditanam di dalam tanah dibawah aliran udara terkontrol, dilanjutkan dengan pemanasan eksternal diluar menggunakan peralatan kedap udara, pemanasan dengan gas resirkulasi. Metode lain yang juga dikenal yaitu menggunakan tong kedap udara (Kajina, W et al., 2019).
Pada penelitian ini pembuatan arang aktif menggunakan tong kedap udara. Cara ini dipilih karena mudah dilakukan dan dapat menghasilkan arang dalam skala besar serta bisa diterapkan oleh masyarakat umum. Bahan bakunya berasal dari limbah bambu yang banyak ditemukan di Bali. Limbah bambu dapat berasal dari sisa bangunan, industri kerajinan, atau upacara adat. Arang kemudian diaktivasi secara termal (eksternal) yaitu dengan pemanasan pada suhu yang lebih tinggi (Manurung, M et al., 2019). Selama ini arang produk konvensional belum dikaji secara ilmiah, sehingga sifat-sifatnya tidak diketahui secara pasti. Pada penelitian ini kualitas arang bambu, baik arang tanpa aktivasi dan arang aktivasi akan diperiksa sesuai dengan SNI 063730-1995. Kedua arang bambu yang dihasilkan digunakan sebagai adsorben ion timbal (II) dan krom (III) dari larutan. Dilakukan pula optimasi parameter adsorpsi antara lain waktu kontak, pH, dan konsentrasi awal ion logam dalam larutan.
MATERI DAN METODE
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah tanur, oven, desikator, neraca analitik, cawan porselin, kaca arloji, kertas saring, mortar dan stamper, hot plate, pengaduk magnetik, pH meter, gelas beker, gelas ukur, Erlenmeyer, labu ukur, pipet volume, pipet ukur, pipet tetes, ball filler, spatula, stopwatch, satu set alat titrasi,
Spektrofotometer UV-Vis Shimadzu UV-1800, dan Spektrofotometer Serapan Atom Shimadzu AA-7000. Tong kedap udara (Gambar 1).
Bahan
Bahan yang digunakan untuk penelitian ini adalah limbah batang bambu. Bahan kimia yang digunakan yakni HCl 37%, Pb(NO3)2, CrCl3.6H2O, HNO3(p.a), NaOH(p.a), I2, Na2S2O3, K2Cr2O7, H2C2O4, indikator amilum, indikator fenolftalein, metilen biru, dan akuades.
Cara Kerja
Pembuatan Arang dan Aktivasi Termal

Gambar 1. Tong Kedap Udara
Tong kedap udara yang digunakan pada penelitian ini, terdiri dari dua bagian yaitu badan dan penutup atas. Penutup atas memiliki lubang diameter 10 cm yang berfungsi sebagai tempat cerobong asap. Bagian badan memiliki lubang ditengahnya dengan diameter 10 cm yang berfungsi sebagai cerobong asap. Limbah batang bambu dipotong dengan ukuran 5 x 5 cm kemudian dimasukkan ke dalam badan tong kedap udara. Pada saat pembakaran api yang menyala di dalam tungku akan masuk melalui lubang udara dan membakar batang bambu yang ada didalamnya serta timbul asap yang keluar dari cerobong. Pembakaran dilakukan selama 12 jam dan selama proses diamati asap yang dihasilkan. Pembakaran selesai ditandai dengan asap yang bening keluar dari cerobong. Arang yang terbentuk digerus dengan mortar. Sebagian diaktivasi termal dan sebagian tidak diaktivasi (Bo). Aktivasi termal dilakukan dengan pemanasan arang di tanur pada suhu 650oC selama 4 jam. Arang yang dihasilkan disebut arang teraktivasi termal, atau arang aktif (AT).
Karakterisasi Arang
Prosedur karakterisasi arang mengacu pada Standar Nasional Indonesia 06-3730-1995 tentang arang aktif teknis (SNI, 1995), mencakup beberapa parameter, sebagai berikut:
Kadar air
Ditimbang dengan teliti 2,0 g arang AT dan Bo, selanjutnya masing – masing ditempatkan dalam cawan porselin yang sudah diketahui massanya lalu dikeringkan dalam oven pada suhu 105oC selama 3 jam, hingga diperoleh massa konstan, selanjutnya didinginkan dalam desikator.
Kadar zat mudah menguap
Arang AT dan Bo yang sudah diuji kadar airnya, kemudian dipanaskan di dalam tanur pada suhu 900oC selama 15 menit, selanjutnya didinginkan dalam desikator dan ditimbang.
Kadar abu total
Arang AT dan Bo yang sudah diuji kadar air dan kadar zat mudah menguapnya kemudian dimasukkan ke dalam tanur dan diabukan selama 4 jam pada suhu 650oC, lalu didinginkan dalam desikator. Abu yang terbentuk ditimbang.
Kadar karbon
Kadar karbon terikat (KK) dalam arang AT dan Bo adalah hasil dari proses pengu rangan selain abu, air, dan zat – zat mudah menguap, yang ditentukan dengan rumus :
KK = 100% - (KA + KZMM + KAT)
Adsorpsi terhadap iodin
Ditimbang dengan teliti 0,25 g arang AT dan Bo lalu masing – masing dimasukkan ke dalam Erlenmeyer, kemudian ditambahkan 25 mL larutan iodin 0,1 N. Campuran diaduk selama 15 menit dan kemudian Erlenmeyer ditutup dan disimpan di tempat yang gelap selama 2 jam. Campuran kemudian disaring dan filtratnya dipipet sebanyak 5 mL. Dimasukkan filtrat ke dalam Erlenmeyer bersih dan dititrasi dengan larutan Na2S2O3 0,0962 N hingga
larutan berwarna kuning muda. Sebanyak 1 mL indikator amilum 1% ditambahkan pada filtrat dan titrasi dilanjutkan sampai warna biru tepat hilang. Volume larutan Na2S2O3 yang digunakan dicatat.
Adsorpsi terhadap metilen biru
Ditimbang teliti 0,25 g arang AT dan Bo lalu masing – masing dimasukkan ke dalam Erlenmeyer dan ditambahkan 50 mL larutan metilen biru 2200 ppm. Diaduk dengan pengaduk magnetik dengan variasi waktu 30, 60, 90, 120, 150, 180, 210, 240 menit. Larutan disaring dengan kertas saring, kemudian absorbansi dari filtratnya diukur dengan Spektrofotometer UV-Vis pada Amaks metilen biru. Jumlah metilen biru yang terserap ditetapkan dengan cara kurva kalibrasi.
Situs aktif total arang Keasaman permukaan
Penentuan keasaman permukaan arang diawali dengan menimbang dengan teliti 0,10 g arang AT dan Bo lalu masing – masing dimasukkan ke dalam Erlenmeyer. Ditambahkan 15 mL larutan NaOH 0,0940 M. Campuran diaduk dengan pengaduk magnetik selama 15 menit kemudian ditambahkan 3-4 tetes indikator fenolftalein. Dititrasi dengan larutan HCl 0,0958 M sampai terjadi perubahan warna dari merah muda menjadi tidak berwarna. Volume HCl yang digunakan dalam titrasi dicatat.
Kebasaan permukaan
Penentuan kebasaan permukaan arang diawali dengan menimbang dengan teliti 0,10 g arang AT dan Bo lalu masing – masing dimasukkan ke dalam Erlenmeyer. Ditambahkan 15 mL larutan HCl 0,0958 M. Campuran diaduk dengan pengaduk magnetik selama 15 menit kemudian ditambahkan 3-4 tetes indikator fenolftalein. Dititrasi dengan larutan NaOH 0,0940 M sampai terjadi perubahan warna dari tidak berwarna menjadi merah muda. Volume NaOH yang digunakan dalam titrasi dicatat.
Penentuan Waktu Kontak Optimum
Waktu kontak optimum ditentukan dengan memipet 50 mL larutan logam Pb 30 ppm dan ditambahkan arang AT sebanyak 0,50 gram. Campuran tersebut diaduk dengan pengaduk magnetik selama variasi waktu 1, 2, 4, 6, 8, 10, 12, dan 24 jam. Larutan disaring dan filtratnya ditentukan absorbansinya dengan Spektrofotometer Serapan Atom (SSA). Absorban dimasukkan ke persamaan regresi linier untuk menentukan konsentrasi logam Pb
dalam filtrat. Dibuat kurva antara jumlah logam yang teradsorpsi terhadap waktu, maka waktu optimum dapat ditentukan. Hal serupa dilakukan untuk ion logam Cr dan arang Bo.
Penentuan pH Optimum
Penentuan pH optimum dilakukan dengan mengambil sebanyak 50 mL larutan Pb dan Cr 30 ppm dengan variasi pH 2, 4, 6, 8, dan 10 menggunakan larutan HNO3 dan NaOH. Sampel larutan Pb dan Cr masing – masing ditambahkan arang AT sebanyak 0,50 gram pada Erlenmeyer yang berbeda dan diaduk dengan pengaduk magnetik selama waktu kontak optimum. Larutan disaring dan filtratnya ditentukan absorbansinya dengan SSA. Absorban dimasukkan ke persamaan regresi linier untuk menentukan konsentrasi logam Pb dalam filtrat. Dibuat kurva antara jumlah logam yang teradsorpsi terhadap pH, maka pH optimum dapat ditentukan. Hal serupa dilakukan untuk arang Bo.
Penentuan Kapasitas Adsorpsi Arang AT dan Bo terhadap ion Pb(II) dan Cr(III)
Sebanyak 50 mL larutan Pb dan Cr dengan variasi konsentrasi 5, 10, 20, 30, dan 40 ppm pada pH optimum ditambahkan arang aktif (AT dan Bo) sebanyak 0,50 gram pada Erlenmeyer yang berbeda. Masing – masing campuran diaduk menggunakan pengaduk magnetik selama waktu kontak optimum. Larutan disaring dan filtratnya ditentukan absorbansinya dengan SSA. Absorban dimasukkan ke persamaan regresi linier untuk menentukan konsentrasi ion logam Pb dan Cr dalam filtrat. Banyaknya ion logam Pb(II) dan Cr(III) yang teradsorpsi oleh setiap gram arang aktif dapat ditentukan dengan menggunakan persamaan 1.
qe = m<^ (1)
E= (Co-Ce) χioo% (2)
C0
Keterangan :
qe =kapasitas adsorpsi (mg/g) ε =efisiensi penyerapan (%) V =volume larutan (L)
C0 =konsentrasi akhir ion logam (mg/L) Ce =konsentrasi akhir/setimbang (mg/L) W =massa arang aktif (g)
(Alothman, 2011).
Pola Isoterm Adsorpsi
Pola isoterm adsorpsi ditentukan melalui pengukuran daya adsorpsi tiap gram arang AT dan Bo terhadap ion Pb(II), dan Cr(III) dengan variasi konsentrasi pada kondisi optimum. Pola isoterm adsorpsi diuji ke dalam persamaan isoterm adsorpsi Langmuir dan Freundlich (Kriswiyanti dan Danarto, 2007).
HASIL DAN PEMBAHASAN
Pembuatan Arang Bo dan Arang AT
Sampel batang bambu dibakar dalam tong kedap udara selama 12 jam. Metode ini dipilih karena dapat dilakukan dengan mudah, dan jumlah sampel cukup banyak.Asap yang timbul pada saat awal pembakaran berwarna hitam pekat dan pada akhir pembakaran berwarna putih bening. Asap yang berubah warna menandakan bahwa proses pembakaran telah terjadi artinya sampel batang bambu telah berubah menjadi arang. Digunakan tong yang tertutup rapat untuk meminimalisir kontak langsung antara sampel bambu dengan O2 sehingga proses pengarangan terjadi, bukan pembakaran menjadi CO2 dan H2O. Kondisi fisik batang bambu setelah proses pembakaran berupa arang berwarna hitam, ukuran lebih kecil dari sebelumnya, dan mudah digerus. Dihasilkan arang sebanyak 3,5 kg dari total sampel batang bambu sebanyak 8 kg atau rendemen sebesar 43,75%. Rendemen sebesar ini tergolong tinggi, dibandingkan dengan hasil yang diperoleh Manurung, M et al., (2019), kurang dari 20%, menggunakan tanur dengan suhu terkontrol.
Selama pemanasan/pembakaran dalam tong kedap udara diperkirakan suhunya, tidak terlalu tinggi, sehingga zat pengotor masih menutupi permukaan arang seperti tar, lignin, selulosa dan zat organik lainnya. Terbukti dari kualitas arang Bo, yang memiliki kadar air, kadar zat mudah menguap, kadar abu total yang masih tinggi (Tabel 1). Aktivasi termal arang dalam tanur selama 4 jam pada suhu 650o C, bertujuan untuk menghilangkan pengotor seperti disebutkan sebelumnya yang menutupi pori-pori atau permukaan arang. Pada suhu tersebut yang didukung lamanya waktu pemanasan, terjadi juga proses pemurnian karbon (Manurung. M et al., 2019). Pendapat yang sama dikemukakan oleh Khuluk (2016) yang menyatakan bahwa unsur karbon atau pemecahan ikatan hidrokarbon terjadi pada suhu 500-800oC. Keberhasilan aktivasi
dipengaruhi oleh tingginya suhu, lamanya waktu aktivasi, ukuran partikel, ratio dan jenis aktivator. Waktu aktivasi yang panjang dan suhu yang terlalu tinggi, justru dapat merusak struktur pori (Ahmad et al., 2014; Hartanto dan Ratnawati, 2010).
Karakterisasi Arang AT dan Bo
Berdasarkan Tabel 1, dapat dilihat bahwa arang AT dan Bo telah memenuhi standar SNI-06-3730-1995 tentang arang aktif teknis. Arang aktivasi termal (AT) memiliki kualitas yang lebih baik di semua parameter, dibandingkan arang tanpa aktivasi (Bo). Hal ini sesuai dengan hasil penelitian yang menunjukkan kadar air, kadar zat mudah menguap, kadar abu total, dan kadar karbon terikat dari arang tanpa aktivasi (Bo) lebih rendah dari arang aktivasi termal (AT). Artinya proses aktivasi termal yang diterapkan dalam penelitian ini mampu meningkatkan kualitas dari arang tersebut.
Adsorpsi terhadap iodin
Adsorpsi terhadap iodin diperoleh dari analisis filtrat campuran iodin dan arang aktif. Kereaktifan dari arang aktif dapat dilihat dari kemampuan mengadsorpsi substrat, daya adsorpsi tersebut dapat menunjukkan seberapa besar adsorben dapat mengadsorpsi iodin. Semakin besar nilai angka iod maka semakin besar kapasitas adsorpsi adsorben. Analisis dilakukan dengan titrasi iodometri lalu dihitung adsorpsi arang aktif terhadap larutan iodin dalam mg/g.
Berdasarkan SNI 06-3730-1995 tentang arang aktif teknis, adsorpsi terhadap iodin minimal 750 mg/g. Sesuai dengan Tabel 1, arang aktivasi termal (AT) memiliki adsorpsi terhadap iodin 850,17 mg/g dan arang tanpa aktivasi (Bo) 781,36 mg/g yang berarti sudah memenuhi baku mutu arang aktif. Adsorpsi yang tinggi terhadap I2 menggambarkan bahwa arang aktivasi termal dan tanpa aktivasi mempunyai kemampuan yang baik untuk menjerap molekul kecil, ukuran kurang dari 10 Ᾰ atau 1 nm dan sekaligus menyatakan bahwa arang aktivasi termal dan tanpa aktivasi memiliki mesopori (Pari, 2009).
Adsorpsi terhadap metilen biru
Panjang gelombang maksimum dari metilen biru yang digunakan pada penelitian ini adalah 664,50 nm. Berdasarkan SNI 06-37301995 tentang arang aktif teknis, adsorpsi terhadap metilen biru minimal 120 mg/g. Dapat dilihat pada Tabel 1, adsorpsi arang AT dan Bo masing – masing sebesar 133,41 mg/g dan 120,02 mg/g terhadap metilen biru pada waktu adsorpsi 240 menit yang berbanding lurus dengan luas permukaan adsorben.
Semakin luas permukaan adsorben, semakin besar kapasitas adsorpsinya. Banyaknya metilen biru yang dapat diadsorpsi sebanding dengan luas permukaan arang aktif tersebut. Luas permukaan arang aktivasi termal dan arang tanpa aktivasi berturut-turut sebesar 494,8178 m2/g dan 445,1603 m2/g, pada waktu adsorpsi 240 menit. Kenaikan luas permukaan arang aktif ini disebabkan proses pemanasan berlanjut pada aktivasi termal yang dapat membuka pori – pori dari arang aktif tersebut. Pemanasan pada suhu tinggi selama waktu tertentu dapat meningkatkan luas permukaan (Hartanto dan Ratnawati, 2010; Ahmad, M.,A., et al., 2014).
Situs aktif total
Penentuan jumlah situs aktif dilakukan dengan cara kuantitatif menggunakan metode titrimetri yaitu dengan titrasi asam basa. Situs asam dari arang direaksikan dengan NaOH berlebih dan sisa OH- yang tidak bereaksi dengan situs asam dari adsorben dititrasi menggunakan HCl. Situs basa dari arang direaksikan dengan HCl berlebih dan sisa H+ yang tidak bereaksi dengan situs basa dari adsorben dititrasi dengan NaOH.
Arang tanpa aktivasi (Bo) memiliki jumlah situs asam sebesar 2,1976 x 1021 molekul/g dan jumlah situs basa sebesar 1,5246x1021 molekul/g. Arang aktivasi termal (AT) memiliki jumlah situs asam sebesar 2,6753 x 1021 molekul/g dan jumlah situs basa sebesar 2,0756 x1021 molekul/g. Jumlah situs aktif total merupakan penjumlahan situs aktif asam dan situs aktif basa. Pada Tabel 1, jumlah situs aktif total arang Bo 3,7222x1021 molekul/g dan arang AT sebesar 4,7509x1021 molekul/g. Arang AT memiliki situs aktif yang lebih tinggi dari arang Bo, hal ini dapat mempengaruhi kapasitas adsorpsi ion logam dalam larutan dari kedua jenis arang.
Tabel 1. Hasil Karakterisasi Arang AT dan Tanpa Aktivasi (Bo)
|
Karakteristik |
Arang AT |
Arang Bo |
SNI |
|
Kadar air(%) |
5,54±0,00 |
10,5±0,00 |
Maks . 15 |
|
Kadar zat mudah menguap (%) |
4,76±0,00 |
6,97±0,00 |
Maks. 25 |
|
Kadar abu total (%) |
6,67±0,00 |
9,37±0,00 |
Maks. 10 |
|
Kadar karbon terikat (%) |
83,07±0,00 |
73,16±0,00 |
Min. 65 |
|
Adsorpsi terhadap iodin (mg/g) |
850,17±0,00 |
781,36±0,00 |
Min. 750 |
|
Adsorpsi terhadap metilen biru (mg/g) |
133,41±0,02 |
120,02±0,02 |
Min. 120 |
|
Luas permukaan (m2/g) |
494,8178 |
445,1603 |
- |
|
Situs aktif total (molekul/g) |
4,7509x1021 |
3,7222x1021 |
- |
Waktu Kontak Optimum
Optimasi waktu kontak dilakukan dengan variasi waktu adsorpsi dari 1, 2, 4, 6, 8, 10, 12, dan 24 jam, dengan konsentrasi ion Pb(II) dan Cr(III) 30 ppm.
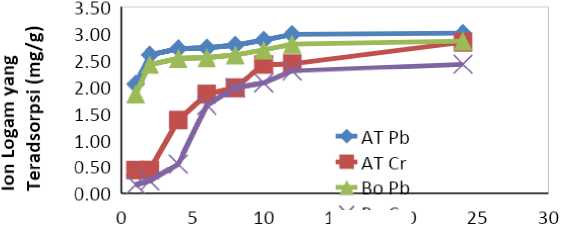
Jumlah massa ion logam Pb(II) dan Cr(III) yang teradsorpsi tiap gram arang AT dan Bo terhadap waktu dapat dilihat pada Gambar 2.
1J÷ Bo Cy0
Waktu (jam)
Gambar 2. Kurva Hubungan Waktu Adsorpsi Terhadap Jumlah Ion Logam Terjerap
Gambar 2 menunjukkan jumlah ion logam Pb(II) dan Cr(III) yang teradsorpsi oleh arang AT dan Bo dalam rentang waktu 1 sampai 24 jam. Pada waktu 3-8 jam pertama penjerapan berlangsung cepat, yang ditandai lereng kurva yang tajam. Periode kedua, yaitu 8-10 jam penyerapan melambat dan kurva mulai landai, bahkan periode ketiga dari 12 hingga 24 jam kurva umumnya sudah cenderung mendatar, artinya telah mencapai titik optimum/kesetimbangan. Pada waktu 12 jam dan 24 jam menunjukkan perbedaan daya adsorpsi yang tidak signifikan baik terhadap ion Pb(II) maupun ion Cr(III). Kapasitas adsorpsi arang Bo terhadap ion Pb(II) pada waktu 12 jam dan 24 jam masing-masing adalah 2,7964 mg/g dan 2,8528 mg/g sedangkan arang AT sebesar 2,9782 mg/g dan 2,9982 mg/g. Kapasitas adsorpsi ion Cr(III) pada waktu 12 jam dan 24 jam untuk Bo berturut-turut 2,2931 mg/g dan 2,4186 mg/g sedangkan arang AT sebesar 2,4310 mg/g dan 2,8324 mg/g. Gambar 2 juga menunjukkan bahwa di sekitar 12 jam telah mencapai titik optimum, atau kejenuhan permukaan / kesetimbangan, namun untuk lebih
memastikan waktu adsorpsi diperpanjang hingga 24 jam.
Berdasarkan hasil yang diperoleh diketahui bahwa penambahan waktu adsorpsi hingga 24 jam untuk arang Bo hanya menambah kapasitas adsorpsi 2,0168% terhadap ion Pb dan 5,0979% untuk Cr. Dipihak lain dampak aktivasi menyebabkan kenaikan kapasitas adsorpsi 6,5012% untuk ion Pb(II) dan 6,0137% untuk Cr(III) pada waktu adsorpsi 12 Jam. Penambahan waktu adsorpsi hingga 24 jam untuk arang AT menambah kapasitas adsorpsi 0,6715% terhadap ion Pb(II) dan 16,5117% untuk Cr(III). Jadi terlihat dengan jelas bahwa proses aktivasi dan waktu adsorpsi berpengaruh terhadap kapasitas adsorpsi ion logam dalam larutan.
pH Optimum
Derajat keasaman (pH) merupakan salah satu faktor yang mempengaruhi kapasitas adsorpsi ion logam di dalam larutan. Optimasi pH bertujuan untuk mengetahui nilai pH yang memberikan adsorpsi terbaik dari arang AT dan Bo terhadap ion logam Pb(II) dan Cr(III). Pada
penelitian ini, variasi pH yang digunakan adalah 2, 4, 6, 8, dan 10 yaitu mulai dari pH asam, netral hingga basa. Digunakan konsentrasi Pb(II) dan Cr(III) 30 ppm. Hasil
pengaruh pH terhadap jumlah ion logam Pb(II) dan Cr(III) yang teradsorpsi arang AT dan Bo dapat dilihat pada Gambar 3.
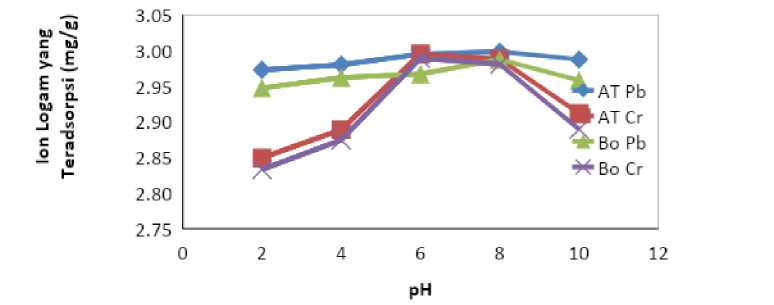
Gambar 3. Kurva Hubungan pH Terhadap Jumlah Ion Logam Terjerap
Gambar 3 menunjukkan bahwa pH optimum arang AT terhadap ion Pb(II) adalah pH 8 dan Cr(III) pada pH 6. Pada pH 2 arang AT dan Bo menunjukkan kapasitas adsorpsi yang terendah. Hal ini terjadi karena pada pH 2, konsentrasi ion H+ dalam larutan cukup tinggi, memudahkan ion tersebut tertarik ke permukaan arang, akibatnya permukaan arang cenderung bermuatan positif yang tentu saja menolak ion Pb(II) dan Cr(III) juga bermuatan positif (Muzakkar dan Ratna, 2012). Kenaikan terjadi seturut dengan perubahan pH mulai dari pH 4 dan mengalami puncaknya di pH 8 untuk ion Pb(II) dan pH 6 untuk ion Cr(III). Pada pH basa ada kecenderungan mengalami penurunan akibat terbentuknya senyawa Pb(OH)2 dan Cr(OH)3 yang membentuk endapan atau koloid yang tidak terjerap oleh adsorben (Ahmad et al., 2014).
Kenaikan pH akan menurunkan jumlah ion H+, sehingga ion H+ yang mengelilingi gugus aktif pada permukaan adsorben berkurang dan gugus aktif mengalami ionisasi sehingga bermuatan negatif (Isagai, 2008). Hasil yang didapatkan menunjukkan hal yang sama antara arang AT maupun arang Bo, ion Pb(II) optimum di pH 8 dan ion Cr(III) optimum di pH 6. Arang AT memiliki kapasitas adsorpsi yang lebih baik dari pada arang Bo untuk ion logam Pb(II) maupun Cr(III).
Kapasitas Adsorpsi Arang AT dan Bo terhadap ion logam Pb(II) dan Cr(III)
Kapasitas adsorpsi arang AT dan ditentukan dengan mengukur daya adsorpsi pada berbagai konsentrasi ion logam Pb(II) dan
Cr(III) pada kondisi optimum. Konsentrasi larutan divariasi dari 5, 10, 20, 30, dan 40 ppm pH 8 untuk ion Pb(II) dan pH 6 untuk ion Cr(III) selama 24 jam. Kapasitas adsorpsi optimum untuk arang AT terhadap ion logam Pb(II) dan Cr(III) berturut – turut sebesar 3,9800 mg/g dan 3,9766 mg/g dari larutan 40 ppm. Kapasitas adsorpsi optimum untuk arang Bo terhadap ion logam Pb(II) dan Cr(III) untuk konsentrasi yang sama yaitu sebesar 3,9764 mg/g dan 3,9738 mg/g
Tabel 2 mengindikasikan bahwa semakin besar konsentrasi logam yang digunakan semakin besar juga kapasitas penjerapan. Hal ini sesuai dengan pendapat para peneliti sebelumnya yang menyatakan bahwa semakin tinggi konsentrasi awal dalam larutan menyebabkan jumlah molekul dalam larutan bertambah, sehingga meningkatkan intensitas interaksi molekul dengan adsorben dan jumlah yang terjerap bertambah (Bhattacharyya dan Gupta, 2007 ; Ningrum et al., 2008).
Kapasitas adsorpsi arang AT terhadap ion Pb(II) lebih besar dibandingkan ion Cr(III). Perbedaan ini terjadi karena ion Pb(II) mempunyai jari – jari ion yang lebih besar dari pada jari – jari ion Cr(III). Besarnya jari-jari ion logam Pb2+ dan Cr3+ berturut-turut adalah 120 pm dan 74 pm. Semakin kecil ukuran molekul/partikel maka gaya van der waals-nya berkurang, dengan demikian intensitas interaksi dengan ion Pb(II) lebih besar dibandingkan ion Cr3+. Kenyataan ini sesuai dengan hasil penelitian yang ditunjukkan oleh massa logam Pb lebih besar dari logam Cr(III) yang terjerap
yaitu yaitu sebesar 3,9800 mg/g dan 3,9766 mg/g. Hal lain yang bisa dilihat dari Tabel 2, yaitu hingga konsentrasi 40 ppm, efisiensi adsorpsi masih di atas 99% artinya kapasitas
adsorpsi masih mungkin bertambah jika konsentrasi awal ion logam dalam larutan dibuat lebih tinggi (Igwe et al., 2005 ; Krismayanti, N et al., 2019
Tabel 2. Kapasitas Adsorpsi Arang Aktif Terhadap Ion Logam Pb(II) dan Cr(III) Pada Berbagai Variasi Konsentrasi
|
Arang AT |
Arang Bo | |||||||
|
Konsentrasi (mg/L) |
Efisiensi Penyerapan (%) |
Kapasitas Adsorpsi (mg/g) |
Efisiensi Penyerapan (%) |
Kapasitas Adsorpsi (mg/g) | ||||
|
Pb(II) |
Cr(III) |
Pb(II) |
Cr(III) |
Pb(II) |
Cr(III) |
Pb(II) |
Cr(III) | |
|
5 |
99,64 |
99,59 |
0,4982 |
0,4979 |
99,64 |
99,59 |
0,4982 |
0,4979 |
|
10 |
99,64 |
99,52 |
0,9964 |
0,9952 |
99,45 |
99,38 |
0,9945 |
0,9938 |
|
20 |
99,55 |
99,52 |
1,9909 |
1,9903 |
99,45 |
99,38 |
1,9891 |
1,9876 |
|
30 |
99,52 |
99,45 |
2,9855 |
2,9834 |
99,45 |
99,36 |
2,9836 |
2,9807 |
|
40 |
99,50 |
99,41 |
3,9800 |
3,9766 |
99,41 |
99,34 |
3,9764 |
3,9738 |
Pola Isoterm Adsorpsi
Berdasarkan nilai R2 yang diperoleh dari uji Isoterm adsorpsi Langmuir dan Freundlich dapat diketahui bahwa adsorpsi Arang AT dan Bo terhadap ion Pb(II) dan Cr(III) cenderung mengikuti persamaan Freundlich, terbukti dari nilai R2 yang mendekati 1 yaitu 0,997 untuk kedua jenis arang (Tabel 3). Hasil ini menyatakan bahwa permukaan arang AT dan Bo adalah heterogen, dan adsorpsi bersifat multilayer (Kriswiyanti dan Danarto, 2007).
Tabel 3. Nilai R2 Pola Isoterm Adsorpsi Ion Pb(II) dan Cr(III)
|
Adsorben |
Langmuir |
Freundlich | ||
|
Pb(II) |
Cr(III) |
Pb(II) |
Cr(III) | |
|
Arang AT |
0,910 |
0,922 |
0,997 |
0,997 |
|
Arang Bo |
0,575 |
0,551 |
0,993 |
0,989 |
Adsorpsi yang terjadi pada penelitian ini adalah adsorpsi fisika karena nilai energi adsorpsi yang diperoleh berdasarkan persamaan isoterm adsorpsi Freundlich adalah <20 kJ/mol, yaitu arang AT terhadap ion logam Pb(II) -4,3029 kJ/mol dan ion logam Cr(III) -4,3503
kJ/mol. Arang Bo terhadap ion logam Pb(II) -7,2146 kJ/mol dan ion logam Cr(III) -7,9008 kJ/mol. Adsorpsi fisika memiliki energi adsorpsi <20 kJ/mol, sedangkan adsorpsi kimia memiliki energi adsorpsi >20 kJ/mol.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian yang dilakukan, dapat disimpulkan bahwa metode konvensional menghasilkan arang dengan kualitas yang cukup baik namun arang bambu yang dibuat dengan aktivasi termal (AT) memiliki karakteristik yang lebih baik dari pada arang tanpa aktivasi (Bo). Waktu kontak optimum terhadap ion Pb(II) dan Cr(III) adalah 24 jam untuk kedua jenis arang dan pH optimum masing-masing adalah pH 8 untuk Pb(II), pH 6 untuk Cr(III). Kapasitas adsorpsi arang AT terhadap ion logam Pb(II) dan Cr(III) berturut – turut sebesar 3,9800 mg/g dan 3,9766 mg/g, sedangkan arang Bo masing – masing sebesar 3,9764 mg/g dan 3,9738 mg/g.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai adsorpsi ion Pb(II) dan Cr(III) menggunakan aktivator kimia untuk peningkatan kapasitas adsorpsi arang aktif.
Perlu dikaji lebih lanjut kapasitas adsorpsi untuk konsentrasi logam yang lebih tinggi.
DAFTAR PUSTAKA
Ahmad, M. A., Herawan, S. G. dan Yusof, A. A. 2014. Effect of Activated Time on The Pinang Frond Based Activated Carbon for Remazol Brilliant Blue Removal. Journal of Mechanical Engineering and Sciences (JMES).7: 1085-1093.
Alothman, Z. A., Habil, M. A., dan Ali, R. 2011. Preparation of Activated Carbon Using the Copyrolysis of Agricultural and Municipal Solid Wastes at a Low Carbonization Temperatur.International Conference on Biology, Environment and Chemistry. 24: 67-72.
Bhattacharyya, K. G., dan Gupta, S. S. 2007. Adsorptive Accumulation of Cd(II), Co(II), Cu(II), Pb(II), and Ni(II) from Waste On Montmorillonite, Influence of Acid Activation. Journal of Colloid and Interface Science. 310: 411-424.
Hartanto, S dan Ratnawati. 2010. Pembuatan Karbon Aktif dari Tempurung Kelapa Sawit dengan Metode Aktivasi Kimia.Jurnal Sains Materi Indonesia. 12(1): 12-16.
Hesas, R. H., Niya, A. A., Daud, M. A, W., Sahu, J. N. 2013. Preparation and Characterization of Activated Carbon from Apple Waste by Microwave-Assisted Phosphoric Acid Activation: Application in Methylene Blue Adsorption. Bioresources 8 (2): 29502966.
Igwe, J. C., Ogunewe, D. N., Abia, A. A. 2005. Competitive Adsorption of Zn(II), Cd(II) and Pb(II) Ions from Aqueous and NonAqueous Solution by Maize Cob and Husk. African Journal of Biotechnology. 4(10): 1113-1116.
Isagai, H. 2008. Adsorption of Zinc (II) and Copper (II) to Shirasu (Pyroclastic flow).Journal Analytical Science. 24:
395-399.
Kajina, W., Junpen, A., Garivait, S., Kamnoet, O., Keeratiisariyakul, P., Rousset, P. 2019. Charcoal Production Processes: An Overview. Journal of Sustainable Energy and Environment.10: 19-25.
Khuluk, R. H. 2016. Pembuatan dan Karakterisasi Karbon Aktif dari Tempurung Kelapa (Cocos Nucifera, L.) sebagai Adsorben Zat Warna Metilen Biru. Skripsi. Universitas Bandar Lampung.
Krismayanti, N., Manurung, M., Suastuti, N. 2019. Sintesis Arang Aktif dari Limbah Batang Bambu dengan Aktivator NaOH sebagai Adsorben Ion Krom(III) dan Timbal(II). Jurnal Kimia (Journal of Chemistry). 7(2): 189-197. Program Studi Kimia, FMIPA, Universitas Udayana. Bukit Jimbaran.
Kriswiyanti, Enny A., dan Danarto, Y. C. 2007. Model Kesetimbangan Adsorpsi Cr Dengan Rumput Laut. Jurusan Teknik Kimia Fakultas Teknik UNS.
Ekuilibrium. 6 (2): 47-52.
Manurung, M., Sahara, S., Sihombing, P. 2019. Pembuatan dan Karakterisasi Arang Aktif dari Batang Bambu Apus (Gigantochloa apus) dengan Aktivator H3PO4. Jurnal Kimia (Journal of Chemistry). 13(1): 16-21, Program Studi Kimia, FMIPA, Universitas Udayana, Bukit Jimbaran.
Muzakkar, M. Z., dan Ratna. 2012. Studi Adsorpsi Ion Logam Timbal (II) dengan Menggunakan Arang Aktif Kulit Biji Jambu Mete. Jurnal Kimia dan Pendidikan Kimia. 1(2) : 132141.
Ningrum, L. P., Lusiana, R, A., Nuryanto, R. 2008. Dekolorisasi Remazol Brilliant Blue dengan Menggunakan Karbon Aktif. Seminar Tugas Akhir S1. Fakultas MIPA, Universitas
Diponegoro. Semarang.
Pari, G. 2009. Laporan Mengikuti 1st Asia Pasific Biochar Conference Gold Coast. Australia. 17-20 Mei 2009. Tidak diterbitkan.
Riani E., Johari H. S., Cordova M.R. 2017. Bioakumulasi logam berat kadmium dan timbal pada kerang kapak-kapak di Kepulauan Seribu.Jurnal
Pengolahan Hasil Perikanan Indonesia. 20(1): 131-142.
Standar Nasional Indonesia. 1995. SNI 063730-1995; Arang Aktif Teknis. Dewan Standarisasi Nasional Jakarta.
58
Discussion and feedback