FOTODEGRADASI ZAT WARNA REMAZOL BRILLIANT BLUE DENGAN BENTONIT TERIMPREGNASI Fe2O3
on
ISSN 1907-9850
FOTODEGRADASI ZAT WARNA REMAZOL BRILLIANT BLUE DENGAN BENTONIT TERIMPREGNASI Fe2O3
Made Arie Kusuma Dewi1*, Iryanti Eka Suprihatin1, dan James Sibarani1
1Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*Email: ariekusuma444@yahoo.com
ABSTRAK
Telah dilakukan penelitian mengenai fotodegradasi zat warna remazol brilliant blue dengan fotokatalis Fe2O3-bentonit dan sinar UV. Penelitian ini bertujuan untuk mengetahui konsentrasi katalis optimum, pH optimum larutan, waktu penyinaran optimum dengan sinar UV, dan efektivitas fotodegradasi zat warna remazol brilliant blue. Penentuan kondisi optimum fotodegradasi remazol brilliant blue dilakukan dengan variasi konsentrasi komposit Fe2O3-bentonit sebesar 50-300 mg untuk 25 mL larutan (b/v). Variasi pH larutan yang diteliti sebesar 4,0-10,0 dan variasi waktu penyinaran selama 1-6 jam. Efektivitas proses fotodegradasi ditentukan dengan memvariasikan konsentrasi larutan yaitu 50-500 ppm. Hasil penelitian menunjukkan bahwa kondisi optimum proses fotodegradasi remazol brilliant blue memerlukan 8 g/L fotokatalis Fe2O3-bentonit, pH larutan 6, dan waktu penyinaran dengan sinar UV selama 3 jam. Fotokatalis Fe2O3-bentonit pada kondisi optimumnya efektif untuk mendegradasi larutan remazol brilliant blue pada konsentrasi rendah.
Kata Kunci : Fotodegradasi, Fe2O3-bentonit, fotokatalis, remazol brilliant blue
ABSTRACT
The research was conducted to observe the photodegradation of remazol brilliant blue textile dye by using photocatalyst Fe2O3-bentonite and UV light. The purposes of this research was to determine the optimum concentration of photocatalyst, the optimum pH solution, the optimum irradiation time using UV light, and the effectivity of photodegradation of remazol brilliant blue textile dye. The optimum conditions photodegradation of remazol brilliant blue were investigated by varying the composite Fe2O3-bentonite mass of 50-300 mg in 25 mL solutions. pH solution of 4,0-10,0 and UV irradiation for 1-6 hours. The effectivity of photodegradation was determined by conducting photodegradation of varied aqueous dye solution concentrations at 50-500 ppm under optimum conditions. The result showed that the optimum conditions of photodegradation of remazol brilliant blue required 8 g/L of photocatalyst, pH solution of 6, and UV irradiation during 3 hours. Fe2O3-bentonite photocatalyst in optimum condition was effective to reduce remazol brilliant blue in low concentration.
Keywords : Photodegradation, Fe2O3-bentonite, photocatalyst, remazol brilliant blue
PENDAHULUAN
Zat warna yang digunakan dalam industri tekstil merupakan senyawa organik yang memiliki struktur aromatik dan bersifat reaktif sehingga sulit terdegradasi secara biologi. Zat warna mengandung gugus kromofor sebagai pembawa warna dan auksokrom sebagai pengikat warna (Mahmoud, 2007). Dalam
industri tekstil zat warna azo remazol brilliant blue merupakan salah satu zat warna yang banyak digunakan. Polutan pewarna dari industri tekstil adalah salah satu sumber pencemar yang mengkontaminasi lingkungan. Beberapa penelitian yang telah dilakukan tentang pengurangan zat warna remazol brilliant blue diantaranya oleh Bokau dkk. (2014) menggunakan membran kitosan-silika pada pH 4
menghasilkan koefisien rejeksi sebesar 88,41%. Sementara Ningrum dkk. (2007) menggunakan karbon aktif adalah pada pH 11 dengan waktu kontak 135 menit untuk menghilangkan remazol brilliant blue sebanyak 88,33% dengan kapasitas adsorpsi 5,880 mg/g.
Proses adsorpsi tidak dapat memecah senyawa yang kompleks menjadi senyawa yang sederhana melainkan hanya memindahkan fase cair dari zat warna menjadi fase padat. Metode fotodegradasi dapat digunakan untuk mengatasi masalah pencemaran zat warna. Melalui fotodegradasi, zat warna akan diuraikan menjadi komponen yang lebih sederhana, sementara logam berat yang ada dalam limbah akan tereduksi sehingga perairan menjadi bebas dari pencemaran (Wijaya, et al., 2006).
Dalam fotodegradasi zat warna akan mendekati permukaan fotokatalis yang kemudian mengalami degradasi dengan bantuan sinar UV. Fotokatalis yang dapat digunakan adalah oksida besi karena sifat magnetnya menjamin pemisahan yang efisien dan dapat digunakan kembali (Bharathi et al, 2009). Daya adsorpsi merupakan kelemahan dari fotokatalis sehingga oksida besi dapat dikombinasikan dengan adsorben yaitu bentonit. Bentonit mempunyai struktur berlapis dengan kemampuan mengembang (swelling) dan memiliki kation-kation yang dapat ditukarkan. Selain itu bentonit memiliki keunggulan lain yaitu keberadaannya melimpah di Indonesia dan harganya yang relatif murah (Iqbalsyah, 2008).
Luas permukaan katalis merupakan salah satu faktor penting, tetapi sisi aktif katalis adalah faktor yang lebih penting dibandingkan dengan luas permukaan katalis. Cara yang digunakan untuk memperbanyak jumlah sisi aktif yaitu dengan melakukan penambahan larutan garam logam pada pengemban katalis yaitu bentonit. Metode penambahan pendukung pada katalis dilakukan dengan metode impregnasi. Impregnasi dilakukan dengan mengadsorpsikan larutan garam logam yang mengandung komponen aktif logam kepada padatan bentonit. Oleh karena itu, dilakukan modifikasi bentonit terimpregnasi Fe2O3 untuk mendegradasi zat warna remazol brilliant blue.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi bentonit, zat warna remazol brilliant blue, 0,2 M FeCl3.6H2O, 0,1 M AgNO3, 0,01 M NaOH, 0,01 M HCl, akua DM dan akuades.
Peralatan
Alat yang digunakan meliputi alat-alat gelas, timbangan analitik, pH meter, pengaduk magnetik, batang pengaduk, pipet tetes, penggerus porselin, lumpang, plastik hitam, kotak irradiasi, oven, ayakan 100 dan 250 µm aluminium foil, kertas saring, lampu Philips TUV 15 W/G15 T8 dengan panjang gelombang 253,47 nm. Analisis dilakukan dengan spektrofotometer UV-Vis 1800 Shimadzu dan spektrofoskopi Fourier Transform Infra Red (FT-IR) Prestige-21 Shimadzu/IR di laboratorium bersama FMIPA Universitas Udayana sedangkan analisis dengan difraktometer sinar X (X-RD) dilakukan di Laboratorium Kimia Analitik Jurusan Kimia FMIPA Universitas Gadjah Mada.
Cara Kerja
Bentonit Terimpregnasi Fe2O3
Bentonit yang sudah bersih dimasukkan sebanyak 10 g ke dalam 500 mL aqua DM dan diaduk dengan pengaduk magnet selama 5 jam. Kemudian ke dalam suspensi dituangkan secara perlahan larutan prekursor logam sebanyak 22,4 gram Fe, sambil diaduk selama 24 jam. Hasilnya dicuci dengan akuades hingga terbebas dari ion klorida setelah diuji dengan larutan AgNO3. Selanjutnya dikeringkan dalam oven pada suhu 110–1200C. Setelah kering digerus sampai halus kemudian diayak menggunakan ayakan berukuran 100 µm. Fotokatalis Fe2O3-bentonit dan bentonit dikarakterisasi dengan menggunakan XRD untuk mengetahui basal spasing d001 dan FTIR untuk mengetahui gugus fungsional.
Luas Permukaan
Metode metilen biru digunakan untuk mengukur luas permukaan dengan adsorpsi metilen biru 50 ppm selama 5, 10, 15, 20, 40, dan 60 menit dengan 0,1 gram katalis.
Penentuan Konsentrasi Fotokatalis Optimum
Penentuan konsentrasi fotokatalis optimum dilakukan dengan memvariasikan jumlah fotokatalis sebanyak 50, 100, 150, 200, 250, dan 300 mg untuk mendegradasi larutan zat warna remazol brilliant blue 50 ppm dengan sinar UV dan pengadukan selama 5 jam. Penentuan pH Optimum Fotodegradasi
Penentuan pH optimum dilakukan dengan memvariasikan pH larutan remazol brilliant blue 50 ppm pada pH 4, 5, 6, 7, 8, 9, dan 10 untuk degradasi dengan jumlah fotokatalis optimum yang telah diperoleh, sinar UV, dan pengadukan selama 5 jam.
Penentuan Waktu Penyinaran Optimum
Penentuan waktu penyinaran optimum dilakukan dengan mendegradasi larutan remazol brilliant blue 50 ppm pada pH optimum, jumlah fotokatalis optimum, waktu irradiasi, dan pengadukan selama 1, 2, 3, 4, 5, dan 6 jam. Penentuan Efektivitas Proses Fotodegradasi
Efektivitas fotodegradasi dibandingkan untuk dua fotokatalis yaitu Fe2O3-bentonit dan Fe2O3 dengan variasi konsentrasi larutan
remazol brilliant blue 50, 100, 200, 300, 400, dan 500 ppm. Jumlah fotokatalis, pH larutan, dan waktu penyinaran yang digunakan adalah kondisi optimum yang telah diperoleh. Kemudian dihitung persentase degradasi yang diperoleh dengan persamaan : (%D) =^¾100%
HASIL DAN PEMBAHASAN
Penentuan basal spacing d001
Pada bentonit menunjukkan adanya refleksi spesifik pada daerah 2θ = 19,31
sedangkan Fe2O3-bentonit menunjukkan 2θ = 19,13. Perubahan sudut yang tidak signifikan ini menunjukkan terjadinya proses impregnasi. Puncak yang menunjukkan kehadiran dari Fe2O3 dalam Fe2O3-bentonit terdapat pada 2θ 24,02; 33,36; 35,30; dan 54,02. Masing-masing
memiliki jarak antar lapis (basal spacing) yaitu 3,70 Å; 2,68 Å; 2,54 Å; dan 1,69 Å sesuai dengan data JCPDS No. 13-534. Hal ini membuktikan bahwa Fe2O3 terdapat dalam komposit Fe2O3-bentonit.
Analisis Spektra Inframerah
Karakterisasi bentonit dan Fe2O3-
bentonit dengan FTIR dilakukan untuk
mengetahui dan mengidentifikasi gugus fungsi yang terdapat dalam komposit tersebut. Hasil analisis spektra infra merah diatas menunjukkan pita serapan bentonit pada bilangan gelombang 3693,68 cm-1; 3624,25 cm-1 yang merupakan serapan -OH. Sedangkan Fe2O3-bentonit menunjukkan pita serapan –OH pada bilangan gelombang 3695,61 cm-1; 3624,25 cm-1. Serapan Si-O-Si pada bentonit dan Fe2O3-bentonit berturut-turut adalah 1112,93 cm-1 dan 1111,00 cm-1. Sedangkan bilangan gelombang 796,6 cm-1 dan 794,67 cm-1 untuk vibrasi OH (regangan) yang terikat Fe3+ dan Al+3. Bilangan gelombang 416,62 cm-1 dan 428,20 cm-1 merupakan vibrasi Fe-O. Vibrasi Fe-O berada pada rentang bilangan gelombang 400-500 cm-1 (Uddin et al.,
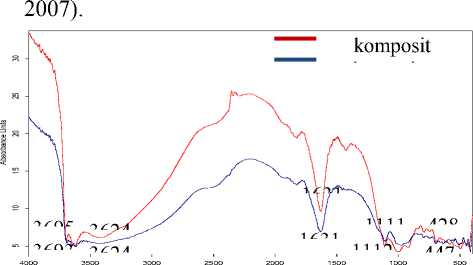
Gambar 1. Spektra FTIR bentonit dan Fe2O3-bentonit
Luas permukaan spesifik adsorben
Luas permukaan adsorben ditentukan melalui metode metilen biru (methylen blue method). Luas permukaan dipengaruhi oleh ukuran partikel/pori, bentuk pori dan susunan pori dalam partikel. Luas permukaan menggambarkan luas permukaan aktif yang dapat kontak dengan reaktan. Hasil pengukuran luas permukaan adsorben tanpa modifikasi (Ao) dan adsorben dengan modifikasi (Aa) yaitu 47,6473 m2/g dan 47,8140 m2/g. Berdasarkan hasil pengukuran menunjukkan bahwa modifikasi bentonit dengan Fe2O3 menghasilkan luas permukaan yang tidak berbeda signifikan dibandingkan dengan bentonit. Hal ini karena adanya proses impregnasi bentonit oleh Fe2O3 yang membuat volum pori total meningkat yang memungkinkan terjadinya peningkatan jumlah situs aktif (Istadi et al., 2015).
Konsentrasi Fotokatalis Optimum Proses Fotodegradasi Remazol Brilliant Blue
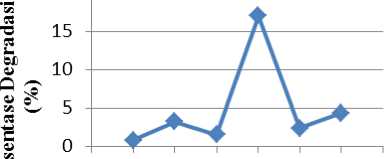
Gambar 2 menunjukkan bahwa semakin banyak jumlah fotokatalis, persen degradasi juga semakin besar. Hal ini disebabkan oleh semakin banyaknya radikal hidroksil dan ion superoksida yang terbentuk. Pada proses tersebut, penyinaran sinar UV mengakibatkan elektron tereksitasi dari pita valensi ke pita konduksi yang menyebabkan terbentuknya radikal hidroksil (•OH). Jumlah fotokatalis optimum yang diperoleh sebanyak 200 mg, sehingga konsentrasi fotokatalis optimum adalah 8 g/L.
20
⅛ O 50 1∞ 150 2∞ 250 3∞ 350
Jumlah katalis (mg)
Gambar 2. Kurva hubungan antara jumlah fotokatalis dan persen degradasi
pH Optimum Proses Fotodegradasi Remazol Brilliant Blue
Gambar 3. Kurva hubungan antara pH larutan dan persen degradasi
Gambar 3 menunnjukkan bahwa fotodegradasi optimum terjadi pada pH 6 dengan persen degradasi terbesar yaitu 74,99%. Persen degradasi kemudian cenderung menurun dengan
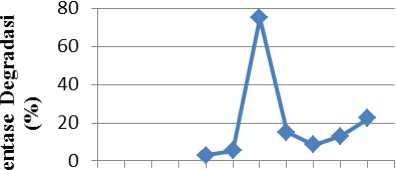
0123456789 10 11 pH larutan remazol brilliant blue
meningkatnya pH dikarenakan pada suasana asam menuju netral, H2O berbentuk H+ dan OH-yang mana OH- jika bereaksi dengan h+ akan membentuk radikal hidroksil (OH•) yang dapat
mendegradasi zat warna. Penurunan persentase degradasi pada suasana basa dikarenakan pada suasana basa H2O hanya berbentuk OH-, dimana dapat juga membentuk radikal hidroksil jika bereaksi dengan h+. Namun, dalam suasana basa sudah terdapat OH- yang dapat menyebabkan pembentukkan radikal hidroksil (OH•) lebih banyak akan tetapi radikal hidroksil tersebut dimungkinkan bisa bergabung kembali menjadi senyawa baru yang ditandai oleh kombinasi radikal bebas yang sama atu berbeda (Ghozali dkk, 2012). Dalam sistem itu sangat mungkin terjadi banyak peristiwa rekombinasi seperti : radikal •H dengan • OH memberntuk molekul air, ecb- dengan •OH membentuk ion OH-, dan lain sebagainya.
Waktu Irradiasi Optimum Proses Fotodegradasi Remazol Brilliant Blue
Dari Gambar 4 dapat dilihat pengaruh waktu irradiasi terhadap persentase larutan remazol brilliant blue yang terdegradasi dimana persentase degradasi meningkat seiring dengan bertambahnya waktu irradiasi sinar UV.
Gambar 4. Kurva hubungan antara waktu dan persentase degradasi
Waktu optimum yang diperoleh adalah 3 jam. Semakin lama waktu irradiasi sinar UV maka semakin banyak foton/energi yang mengenai permukaan Fe2O3 sehingga diperoleh persentase degradasi semakin besar. Penelitian
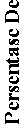
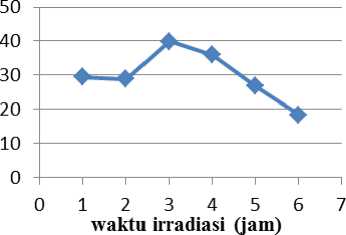
yang dilakukan oleh Diantariani et al., (2016) juga menyebutkan persentase degradasi meningkat pada waktu awal dan menurun setelah bertambahnya waktu fotodegradasi. Proses yang terjadi lebih dominan adsorpsi karena bentonit merupakan adsorben yang baik. Hal ini karena energi foton sinar UV tidak sama atau lebih besar dari energi band gap Fe2O3,
sehingga fotokatalis tidak membentuk hole yang maksimal.
Efektivitas Proses Fotodegradasi Remazol Brilliant Blue
Efektivitas fotodegradasi larutan remazol brilliant blue ditentukan untuk dua fotokatalis, yaitu Fe2O3-bentonit dan Fe2O3. Fotodegradasi dilakukan dalam kondisi optimumnya yaitu fotokatalis sebanyak 200 mg dengan pH optimum 6, dan waktu irradiasi 3 jam. Konsentrasi larutan remazol brilliant blue divariasikan pada 50, 100, 200, 300, 400, dan 500 ppm. Hasil perhitungan ditunjukkan pada Tabel 1.
Berdasarkan perbandingan hasil fotodegradasi antara fotokatalis Fe2O3-bentonit dengan Fe2O3 pada kondisi optimumnya,
fotokatalis Fe2O3-bentonit lebih efektif dalam mendegradasi larutan remazol brilliant blue. Hal ini karena bentonit merupakan adsorben yang berfungsi menarik molekul remazol brilliant blue mendekati fotokatalis yang kemudian didegradasi oleh radikal hidroksil (•OH) yang dihasilkan oleh Fe2O3.
Penurunan persentase degradasi signifikan terjadi pada konsentrasi larutan yang rendah, namun ketika konsentrasi larutan zat warna bertambah maka persentase degradasi menurun. Remazol brilliant blue pada konsentrasi lebih tinggi memiliki molekul lebih banyak yang menyebabkan intensitas sinar UV yang mengenai fotokatalis menjadi berkurang sehingga jumlah OH radikal (•OH) menjadi sedikit dan menyebabkan persen degradasi menjadi lebih kecil (Abdollahi et al., 2001).
Tabel 1. Efektivitas fotodegradasi larutan remazol brilliant blue dengan fotokatalis Fe2O3-bentonit dan
Fe2O3
|
Konsentrasi remazol brilliant blue (ppm) |
Konsentrasi larutan yang terdegradasi (ppm) |
Persentase degradasi (%) | ||
|
Fe2O3-bentonit |
Fe2O3 |
Fe2O3-bentonit |
Fe2O3 | |
|
52,48 |
30,79 |
9,34 |
58,66 ± 2,13 % |
17,79 ± 1,08 % |
|
103,39 |
70,77 |
57,27 |
68,45 ± 0,45 % |
55,39 ± 1,47 % |
|
302,75 |
113,28 |
86,59 |
37,42 ± 1,31 % |
37,42 ± 1,31 % |
|
400,62 |
155,16 |
135,99 |
38,73 ± 1,16 % |
33,95 ± 0,97 % |
|
501,88 |
246,67 |
231,56 |
49,15 ± 2,21 % |
46,14 ± 0,16 % |
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang telah dilakukan maka diperoleh simpulan sebagai berikut :
-
1. Persentase fotodegradasi paling optimum diperoleh pada konsentrasi fotokatalis Fe2O3-bentonit sebanyak 8 g/L, pH larutan 6, dan waktu irradiasi selama 3 jam.
-
2. Fotodegradasi menggunakan fotokatalis Fe2O3-bentonit dan sinar UV pada kondisi optimumnya efektif untuk mendegradasi larutan remazol brilliant blue pada konsentrasi rendah.
Saran
Dari hasil penelitian dan kesimpulan diatas, maka dapat disarankan beberapa hal sebagai berikut :
-
1. Perlu dilakukan analisis lebih lanjut untuk mengetahui produk akhir dari fotodegradasi larutan remazol brilliant blue.
-
2. Perlu dilakukan penelitian fotodegradasi dengan mengaplikasikan langsung pada limbah zat warna industri.
UCAPAN TERIMA KASIH
Terima kasih penulis sampaikan kepada Bapak Prof. Dr. Drs. I Made Dira Swantara, M.Si.,
Ibu Dr. Dra. Ni Made Suaniti, M.Si., dan Ibu Ir. Wahyu Dwijani Sulihingtyas, M.Kes selaku dosen penguji yang telah memberi saran dalam penulisan skripsi ini. Penulis juga mengucapkan terimakasih kepada Ketua Jurusan Kimia FMIPA Universitas Udayana, teman-teman serta semua staf yang membantu sehingga terselesaikannya tugas akhir ini.
DAFTAR PUSTAKA
Abdollahi, Y., Abdullah, A. H., Zainal, Z. and Yuzof, N. A., 2011, Photodegradation of m-cresol by Zinc Oxide under Visible-light Irradiation, International Journal of Chemistry, 3 (3) : 31-43.
Bharathi, S., Nataraj, D., Mangalaraj, D., Masuda, Y., Senthil, K. and Yong, K., 2009, Highly Mesoporous α-Fe2O3 Nanostructures: Preparation, Characterization and
Improved Photocatalytic Performance Towards Rhodamine B (RhB), J. Phys., 43 (1) : 1-9.
Bokau, N. S., Susatyo, E. B. dan Alauhdin, M., 2014, Sintesis Membran Kitosan Termodifikasi Silika Abu Sekam Padi untuk Proses Dekolorisasi, Indo. J. Chem., 3 (1) : 42-49.
Diantariani, N. P., Suprihatin, I. E. dan Widihati, I. A. G., 2016, Fotodegradasi Zat Warna Tekstil Methylene Blue dan Congo Red Menggunakan Komposit ZnO-AA dan Sinar UV, Jurnal Kimia, 10 (1) : 133-140.
Forgacs, E., Cserhati, T., Oros, G., 2004, Removal of synthetic dyes from wastewater: a review, Environ International, 30 : 953971.
Ghozali, A. I., Sugiyo, W. dan Latifah, 2012, Fotodegradasi Zat Warna Remazol Red Menggunakan Katalis α-Fe2O3/Fe3O4 Core Shell Nanostruktur, Indo. J. Chem. Sci., 1(1) : 79-84.
Iqbalsyah, T. M., 2008, Sumber Daya Alam Aceh yang Terabaikan, Citrapustaka Media Perintis, Bandung.
Istadi, I., Prasetyo, S. A. and Nugroho, T. S., 2015, Characterization of K2O/CaO-ZnO Catalyst for Transesterification of Soybean Oil to Biodiesel, Procedia Environmental Sciences, 23 : 394-399.
Mahmoud, A. S., 2007, Influence of Temperature and pH on the Stability and Colorimetric Measurement of Textile Dyes. American Journal of Biotechnology and Biochemistry, Vol 3 : 33-41.
Ningrum, L., Retno. dan Rahmat, N., 2007, Dekolorisasi Brilliant Blue dengan Menggunakan Karbon Aktif, Makalah Penelitian UNDIP, Semarang.
Uddin, M. J., Miran, M. S. and Mollah, M. Y. A., 2007, Electrochemical Synthesis and Characterization of Iron Oxyhydroxide, Journal of the Bangladesh Chemical Society, 20 (1) : 39-45.
Wijaya, K., Sugiharto, E., Fatimah, I., Sudiono, S. dan Kurniaysih, D., 2006, Utilisasi TiO2-Zeolit
Dan Sinar UV Untuk Fotodegradasi Zat Warna Congo Red, Berkala MIPA, 3 : 27-35.
87
Discussion and feedback