MODIFIKASI LEMPUNG BENTONIT TERAKTIVASI ASAM DENGAN BENZALKONIUM KLORIDA SEBAGAI ADSORBEN ZAT WARNA RHODAMINE B
on
ISSN 1907-9850
MODIFIKASI LEMPUNG BENTONIT TERAKTIVASI ASAM DENGAN BENZALKONIUM KLORIDA SEBAGAI ADSORBEN
ZAT WARNA RHODAMINE B
Ni Putu Widya Tironika Dewi1*, I Nengah Simpen1, dan I Wayan Suarsa1
1Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
*E-mail:putuwidyadewi16@yahoo.com
ABSTRAK
Telah dilakukan penelitian tentang modifikasi lempung bentonit yang teraktivasi asam dan terinterkalasi surfaktan sebagai adsorben dalam penyerapan zat warna rhodamine B. Asam yang digunakan untuk aktivasi adalah asam sulfat 1,5 M dan surfaktan untuk interkalasi digunakan surfaktan benzalkonium klorida (BKC) dengan variasi konsentrasi 0,1; 0,5; dan 1% (v/v). Karakterisasi adsorben dilakukan dengan metode difraksi sinar-X untuk menentukan perubahan basal spacing d001 dan spektrofotometer FTIR untuk menentukan gugus fungsional yang terkandung pada adsorben. Hasil penelitian menunjukkan terjadinya perubahan basal spacing d001 untuk adsorben Ao, Aa, Aa0,1, Aa0,5, dan Aa1 secara berturut-turut adalah 17,3312; 17,1642; 16,1432; 16,1680; dan 19,7156 Å. Nilai keasaman permukaan tertinggi dimiliki oleh adsorben Aa0,1 yaitu sebesar 1,8657 ± 0,0111 mmol/g. Sementara nilai luas permukaan untuk adsorben Ao, Aa, Aa0,1, Aa0,5 dan Aa1 secara berturut – turut adalah 89,6888; 90,1982; 90,3896; 90,3110; dan 90,3053 m2/g. Waktu optimum adsorpsi 90 menit dapat mengadsorpsi adsorbat sebanyak 22,0944 mg/g. Kapasitas adsorpsi tertinggi dimiliki oleh adsorben terinterkalasi BKC 0,1% (Aa0,1) yaitu sebesar 10,6905 mg/g, dengan mengikuti model Freundlich dengan koefisien linier (R2) 0,980.
Kata Kunci : lempung bentonit, benzalkonium klorida, rhodamine B, aktivasi asam.
ABSTRACT
This paper disccusses the modification of acid-activated and surfactant intercalated bentonite clay as an adsorbent in the absorption of rhodamine B. A sulphuric acid of 1.5 M was used as the acid-activator whereas benzalkonium chloride (BKC) of various concentrations namely 0.1; 0.5; and 1% were used for the intercalation. The characterization of the adsorbent was carried out by using X-ray diffraction method for determining the changes of basal spacing d001 and FTIR spectrophotometer was applied for determining the functional groups of the adsorbent. The characterization result showed that the changes of basal spacing d001 for Ao, Aa, Aa0.1, Aa0.5 and Aa1 were 17.3312; 17.1642; 16.1432; 16.1680; and 19.7156 Å respectively. The Aa0.1 adsorbent showed the highest surface acidity which was of 1.8657 ± 0.0111 mmol/g. The specific surface area for Ao, Aa, Aa0.1, Aa0.5, and Aa1 were 89.6888; 90.1982; 90.3896; 90.3110 and 90.3053 m2/g, respectively. The optimum time of adsorption was 90 minutes, which can adsorp adsorbate of 22.0944 mg/g. The highest adsorption capacity was shown by 0.1% BKC intercalated adsorbent (Aa0,1) was 10.6905 mg/g following the Freundlich model with a linear coefficient (R2) of 0.980.
Keywords : Bentonit clay, benzalkonium chloride, rhodamine B, acid-activated.
PENDAHULUAN
Perkembangan sektor industri tekstil saat ini semakin pesat dan hal tersebut juga dapat berdampak negatif bagi kehidupan dan lingkungan manusia yang dapat menyebab-kan pencemaran ekosistem air diakibatkan oleh zat warna dari industri tekstil tersebut. Salah satu pewarna sintetik yang berbahaya adalah Rhodamine B karena sifatnya yang toksik terhadap lingkungan. Oleh karena sifatnya yang beracun ini, maka diperlukan upaya untuk menghilangkan zat-zat warna dari air limbah industri agar benar-benar aman untuk lingkungan perairan (Sunardi, 2012).
Proses adsorpsi merupakan salah satu metode alternatif yang digunakan untuk menghilangkan warna tersebut. Selain itu kita ketahui wilayah indonesia mempunyai cadangan tanah lempung yang cukup besar namun, pemanfataannya masih belum optimal. Lempung tersusun dari mineral alumina silikat yang mempunyai struktur kristal berlapis dan berpori. Lempung bentonit merupakan mineral dengan kandungan utama monmorillonit kurang lebih 85%. Lempung bentonit mempunyai kemampuan mengembang (swellability) karena ruang antar lapis (interlayer) yang dimilikinya, dan dapat mengadsorpsi ion-ion atau molekul terhidrat dengan ukuran tertentu (Suarya, 2010).
Pemanfaatan sifat khas montorillonit yang mudah mengembang dan memiliki kapasitas pertukaran ion yang tinggi, maka lempung ini dapat disisipi dengan suatu bahan lain untuk memperoleh sifat fisiko-kimianya lebih baik dibandingkan dengan lempung sebelum dimodifikasi. Metode untuk memodifikasi lempung yang sering digunakan adalah interkalasi. Interkalasi merupakan suatu proses penyisipan spesies kimia secara reversible ke dalam antarlapis suatu struktur yang mudah mengembang (antarlapis silikat montmorillonit) tanpa merusak strukturnya (Tan, 1991).
Interkalasi ke dalam struktur lempung mengakibatkan peningkatan luas permukaan, basal spacing (jarak dasar antarlapis silikat montmorillonit), dan keasaman permukaan yang berpengaruh terhadap daya adsorpsinya. Simpen (2001) menyatakan lempung montmorillonit teraktivasi asam sulfat 1,5 M terpilar TiO2 memiliki luas permukaan dan
keasaman permukaan yang relatif lebih tinggi daripada lempung tanpa dimodifikasi. Penelitian Esati (2008), dinyatakan bahwa lempung yang terinterkalasi BKC ke dalam montmorillonit teraktivasi asam sulfat 1,5 M memiliki luas permukaan dan keasaman permukaan yang tinggi yaitu sebesar 27,7885 m2/g dan 1,0135 mmol/g, dibandingkan dengan lempung tanpa terinterkalasi BKC dan aktivasi asam sulfat 1,5 M memiliki luas permukaan dan keasaman permukaan sebesar 26,2239 m2/g dan 0,5000 mmol/g.
Cadangan lempung yang cukup besar dan dapat mengadsorpsi tersebut, maka dilakukannya modifikasi terhadap lempung sehingga dapat menyerap zat warna rhodamine B. Penelitian ini dilakukan modifikasi lempung bentonit teraktivasi asam sulfat 1,5 M dengan BKC.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi lempung bentonit, benzalkonium klorida (BKC) 50%, zat pewarna rhodamin B, Asam sulfat (H2SO4), BaCl2, AgNO3, NaOH, HCl, indikator pp, asam palmitat, larutan metilen biru, dan aquades.
Peralatan
Alat yang digunakan meliputi labu ukur, pipet ukur, pipet volume, erlenmeyer, gelas ukur, gelas beker, pipet tetes, penggerus porselin, lumpang, ayakan 250µm, oven, pengaduk magnet, pemanas, corong, stopwatch, bola hisap, kertas saring Whatman no.42, timbangan analitik, XRD-6000, Spektrofotometer Inframerah, dan Spektrofotometer uv-vis.
Cara Kerja
Lempung yang sudah bersih dimasukkan sebanyak 100 g ke dalam 500 mL larutan 1,5 M dan diaduk dengan pengaduk magnet selama 24 jam. Kemudian disaring dan dicuci dengan air panas sampai terbebas dari ion sulfat (tes negatif terhadap BaCl2), selanjutnya dikeringkan dalam oven pada suhu 110 – 1200C sampai mendapatkan berat lempung yang konstan dan diayak menggunakan ayakan ukuran 250 µm
kemudian diberi kode (Aa) sedangkan lempung yang tanpa aktivasi diberikan kode (A0).
Lempung hasil aktivasi dimasukkan sebanyak 8 g ke dalam 400 mL akuades dan diaduk dengan pengaduk magnet selama 5 jam. Selanjutnya suspensi ditambahkan sedikit demi sedikit larutan surfaktan BKC dengan konsentrasi 0,1%; 0,5%; dan 1% (v/v), kemudian diaduk dengan pengaduk magnet selama 24 jam, dan lempung diberi kode Aa0,1, Aa0,5, Aa1. Setalah ditambahkan BKC selanjutnya ditambahkan 2 g asam palmitat dan diaduk kembali dengan pengaduk magnet selama 48 jam. Kemudian campuran disaring dan dicuci dengan aquades hingga bebas dari ion klorida (uji negatif terhadap AgNO3). Padatan hasil pencucian (Aa0,1, Aa0,5, Aa1) dikeringkan dalam oven pada suhu 100–1200C. Selanjutnya lempung digerus, dan diayak dengan ayakan 250 μm.
Karakterisasi Ao, Aa, Aa0,1, Aa0,5 dan Aa1 dilakukan dengan menggunakan XRD untuk mengetahui basal spasing d001, Spektrofotometer Inframerah (FTIR) untuk mengetahui gugus fungsional, metode metilen biru untuk mengukur luas permukaan, metode titrasi untuk menentukan keasaman permukaan dan spektrofotometer UV-vis menentukan konsentrasi sisa adsorbat setelah diadsorpsi.
HASIL DAN PEMBAHASAN
Penentuan basal spacing d001
Interkalasi BKC ke dalam ruang antarlapis lempung bentonit ternyata tidak menyebabkan peningkatan jarak antarlapis atau basal spacing d001 lempung, dikarenakan hasil dari difraktogram puncak tidak begeser ke arah 2θ yang lebih kecil. Kemungkinan keadaan ini disebabkan oleh surfaktan BKC yang terinterkalasi terdistribusi ke dalam ruang antarlapis lempung cenderung posisinya
horizontal atau dengan kata lain oligomer BKC tidak membentuk struktur pillar (tiang) sehingga secara signifikan tidak meningkatkan jarak antarlapis (basal spacing d001) lempung. Berikut ini hasil dari pengukuran basal spacing d001 yang dirangkum dalam Tabel 1.
|
Tabel 1. Nilai pergeseran basal spacing d001 adsorben | |||
|
No. |
Adsorben |
2θ (0) |
d (Å) |
|
1 |
Ao |
5,0948 |
17,3312 |
|
2 |
Aa |
5,1444 |
17,1642 |
|
3 |
Aa0,1 |
5,4700 |
16,1432 |
|
4 |
Aa0,5 |
5,4616 |
16,1680 |
|
5 |
Aa1 |
4,4783 |
19,7156 |
Tabel 1 menunjukkan bahwa interkalasi BKC 1% menghasilkan peningkatan jarak antarlapis (basal spacing d001) yang paling besar tetapi tidak berkontribusi terhadap besarnya luas permukaan.
Analisis Spektra Inframerah
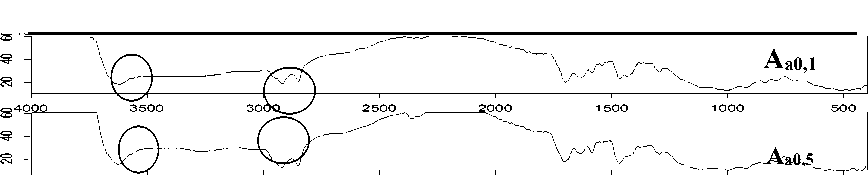
Karakterisasi dari adsorben yang terinterkalasi BKC ke dalam antar lapis lempung dengan FTIR dilakukan untuk mengetahui dan mengidentifikasi gugus fungsi yang terdapat dalam adsorben tersebut. Gambar 1 dapat dijelaskan bahwa terjadi perubahan spektra adsorben Aa0,1, Aa0,5 dan Aa1 dibandingkan dengan adsorben Ao. Pita serapan adsorben Aa0,1 pada bilangan gelombang 2918,30; 2848,86 dan 1465,90 cm-1, yang menunjukkan adanya BKC.
Sedangkan adsorben Aa0,5 pada bilangan gelombang 2920,23; 2850,79 dan 1465,90 cm-1 menunjukkan adanya benzalkonium klorida, dan adsorben Aa1 pada bilangan gelombang 2924,09; 2850,79 dan 1463,97 cm-1 menunjukkan adanya benzalkonium klorida (Farías et al., 2011).
4000 3500 3000 2500 2000 1500 1000 500
4000 3500 3000 2500 2000 1500 1000 a1500
4000 3500 3000 2500 2000 1500 1000500
Ao
Gambar 1. Spektra IR Masing - masing Adsorben Lempung
Luas permukaan spesifik adsorben
Luas permukaan adsorben ditentukan secara metode metilen biru (methylen blue method). Hasil pengukuran luas permukaan spesifik masing-masing adsorben disajikan dalam Tabel 2.
|
Tabel 2. Nilai Luas Permukaan Adsorben | |
|
Adsorben |
Luas permukaan spesifik S (m2/g) |
|
Ao |
89,6888 |
|
Aa |
90,1982 |
|
Aa0,1 |
90,3896 |
|
Aa0,5 |
90,3110 |
|
Aa1 |
90,3053 |
Tabel 2. menunjukkan bahwa terjadi peningkatan luas permukaan spesifik lempung pada interkalasi BKC konsentrasi 0,1% (Aa0,1) mencapai luas permukaan spesifik tertinggi dan nilai luas permukaan menurun pada lempung Aa0,5 dan Aa1. BKC dengan konsentrasi 0,1% kemungkinan membuat pori-pori dalam struktur lempung menjadi lebih teratur. Namun, penambahan BKC sebesar 0,5% dan 1% ke dalam antar lapis lempung silikat diduga telah menutupi pori lempung sehingga membuat pori lempung menjadi tidak teratur, sehingga luas permukaan spesifik lempung menjadi berkurang.
Keasaman permukaan adsorben
Penentuan keasaman permukaan dengan metode titrasi asam – basa. Berikut hasil pengukuran keasaman permukaan adsorben disajikan pada Tabel 3 sebagai berikut.
Tabel 3. Nilai Keasaman Permukaan
|
Adsorben |
Kal Keasaman Permukaan (mmol/g) |
Jumlah Situs aktif (1020 atom/g) |
|
Ao |
0,8105 ± 0,0001 |
4,8808 |
|
Aa |
1,1733 ± 0,0053 |
7,0656 |
|
Aa0,1 |
1,8657 ± 0,0111 |
11,2352 |
|
Aa0,5 |
1,7029 ± 0,0212 |
10,2547 |
|
Aa1 |
1,4816 ± 0,0212 |
8,9222 |
Tabel 3 menunjukkan adsorben Aa0,1 memiliki keasaman permukaan dan jumlah situs aktif yang tinggi yaitu sebesar 1,8657 ± 0,01114 mmol/g dan dengan jumlah situs aktif 11,2352 1020 atom/g. Peningkatan keasaman permukaan yang terjadi pada adsorben tersebut disebabkan oleh pengaktifan lempung dengan asam sulfat. Selain itu, diduga lempung juga mendapatkan sumbangan situs aktif dari surfaktan kationik yang diinterkalasi ke dalam antarlapis lempung, sehingga keasaman permukaan lempung menjadi bertambah.
Waktu setimbang adsorpsi
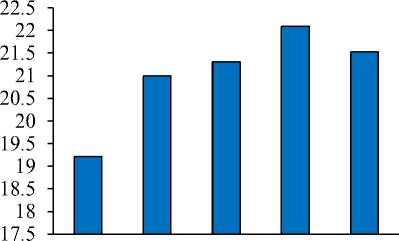
Variasi waktu yang digunakan untuk penentuan waktu adsorpsi optimum yaitu 15, 30, 60, 90 dan 120 menit. Hasil analisis adsorbat dengan spektrofotometer UV-vis didapatkan data adsorbansi dan jumlah adsorbat yang terjerap dengan variasi waktu pada Gambar 2.
Gambar 2 menunnjukkan bahwa waktu adsorpsi optimum yaitu 90 menit yang dapat
mengadsorpsi adsorbat terbanyak yaitu sebesar 22.094 mg/g.
15 30 60 90 120
Waktu Adsorpsi (menit)
Gambar 2. Berat adsorbat yang teradsorpsi
dengan variasi pengadukan 15; 30;
60; 90; dan 120 menit.
Penentuan isoterm adsorpsi dan kapasitas adsorpsi
Isoterm adsorpsi menggunakan model
Langmuir dan Freundlich untuk menyatakan
pola adsorpsi yang terjadi. Isoterm Langmuir menunjukkan bahwa proses adsorpsi terjadi secara kimia yang mana situs aktif lempung akan berinteraksi dengan rhodamine B. Sedangkan isoterm Freundlich merupakan isoterm yang menggambarkan proses adsorpsi secara fisika. Penentuan pola isoterm adsorpsi ditentuan berdasarkan 2 persamaan isoterm adsorpsi yaitu Langmuir dan Freundlich. Hasil dari penentuan persamaan isoterm adsorpsi Langmuir dan Freundlich pada Tabel 4.
Tabel 4 menunjukan bahwa adsorpsi rhodamine B oleh masing-masing adsorben (Ao, Aa, Aa0,1, Aa0,5 dan Aa1) mengikuti persamaan Freundlich kerena memiliki koefisien liniernya (R2) mendekati 1 yaitu 0,980. Hasil dari penelitian untuk kapasitas adsordpsi maksimum didapatkan dari persamaan Freundlich dengan adsorben teraktivasi asam sulfat 1,5 dan terinterkalasi
benzalkonium klorida 0,1 % (Aa0,1) yaitu sebesar 10,6905 mg/g.
Tabel 4. Hasil Persamaan Isoterm Adsorpsi Langmuir dan Freundlich
|
Tipe Adsorben |
Model Langmuir Model Freundlich (mbg/g) R2 n KF (mg/g) R2 |
|
Ao Aa Aa0,1 Aa0,5 Aa1 |
43,4783 0,646 0,7236 0,5333 0,976 166,6667 0,344 1,1481 6,8865 0,948 55,5556 0,872 1,7953 10,6905 0,980 142,8571 0,649 1,1521 5,6105 0,973 62,5 0,612 0,7937 3,3884 0,958 |
Kapasitas adsorpsi tiap–tiap adsorben dipengaruhi oleh sifat fisiko-kimianya, antara lain basal spacing, luas permukaan dan keasaman permukaan. Pernyataan tersebut mendukung bahwa kapasitas
adsorpsi adsorben Aa dan Aa0,1 lebih tinggi daripada adsorben Ao dan adsorben lainnya. Hal ini dikarenakan Aa dan Aa0,1 memiliki sifat fisiko-kimia yang relatif lebih baik daripada adsorben yang lain.
Tabel 5. Perbandingan Karakter Sifat Fisiko-Kimia Adsorben
|
Adsorben |
Basal Spacing d001 (Å) |
Luas Permukaan Spesifik (m2/g) |
Keasaman Permukaan (mmol/g) |
Kapasitas Adsorpsi (mg/g) |
|
Ao |
17,3312 |
89,6888 |
0,8105 ± 0,0001 |
0,5333 |
|
Aa |
17,1642 |
90,1982 |
1,1733 ± 0,0053 |
6,8865 |
|
Aa0,1 |
16,1432 |
90,3896 |
1,8657 ± 0,0111 |
10,6905 |
|
Aa0,5 |
16,1680 |
90,3110 |
1,7029 ± 0,0212 |
5,6105 |
|
Aa1 |
19,7156 |
90,3053 |
1,4816 ± 0,0212 |
3,3884 |
Dalam Tabel 5 dapat dilihat adsorben Aa0,1 memiliki basal spacing d001 yang paling rendah tetapi Aa0,1 memiliki nilai luas permukaan dan keasaman permukaan paling tinggi, sehingga tersedia situs aktif dalam jumlah yang cukup banyak, yang dapat mengikat molekul zat warna dalam jumlah yang relatif lebih banyak dibandingkan adsorben lainnya. Adsorben Aa0,1 juga efektif digunakan sebagai adsorben untuk menyerap zat warna rhodamine B karena memiliki kapasitas adsorpsi lebih tinggi dibandingkan dengan dengan Ao, Aa, Aa0,5 dan Aa1. Fenomena ini sejalan dengan penelitian Esati (2008), bahwa lempung yang teraktivasi asam sulfat 1,5 dan terinterkalasi BKC 0,1% memiliki tingkat kejernihan minyak daun cengkeh hasil adsorpsi yang tinggi, sehingga adsorben tersebut sangat baik digunakan untuk mengadsorpsi minyak daun cengkeh yang kotor.
SIMPULAN DAN SARAN
Simpulan
Dari data yang didapatkan dalam penelitian dan hasil pembahasan dapat diambil beberapa kesimpulan sebagai berikut : (a) Lempung yang memiliki basal spacing d001 tertinggi pada lempung yang teraktivasi asam sulfat 1,5 M terinterkalasi BKC 1% (Aa1), dan lempung teraktivasi asam sulfat 1,5 M terinterkalasi BKC 0,1% mempunyai nilai keasaman permukaan tertinggi dan nilai luas permukaan sfesifik tertinggi yaitu sebesar 1,8657 ± 0,01114 mmol/g dan 90,3896 m2/g dan (b) Adsorben Aa0,1 memiliki kapasitas adsorpsi tertinggi terhadap waktu adsorpsi optimum selama 90 menit dan kapasitas adsordpsi tertinggi dimiliki oleh adsorben teraktivasi asam sulfat 1,5 dan terinterkalasi BKC 0,1 % (Aa0,1) yaitu 10,6905 mg/g dengen mengikuti isoterm
adsorpsi Freundlich dengan nilai koefisien liniernya (R2) 0,980.
Saran
Dari hasil penenlitian dan kesimpulan diatas, maka dapat disarankan beberapa hal sebagai berikut (a) perlu dilakukan analisis luas permukaan spesifik adsorben dengan Gas Sorption Analyzer dan analisis morfologi permukaan dengan Scanning Electron Microscopy (SEM), dan (b) perlu dilakukan penelitian lebih lanjut mengenai jenis interaksi yang terjadi antara adsorben dengan adsorbat.
UCAPAN TERIMA KASIH
Terima kasih penulis sampaikan kepada Dr. Drs. I Made Oka Adi Parwata, M. Si., Dra. Emmy Sahara, M.Sc.(Hons) dan Ir. Wahyu Dwijani Sulihingtyas, M.Kes. serta Jurusan Kimia FMIPA Universitas Udayana dan semua staf yang membantu sehingga terselesaikannya penelitian dan laporan ini.
DAFTAR PUSTAKA
Esati, N. K., 2008, Interkalasi Benzalkonium Klorida ke dalam Montmorillonit Teraktivasi Asam Sulfat dan
Pemanfaatannya untuk Meningkatkan Kualitas Minyak Daun Cengkeh, Skripsi, Universitas Udayana, Bukit Jimbaran.
Farías, T., de Ménorval L. C., Zajac J., and Rivera A., 2011, Benzalkonium chloride and sulfamethoxazole adsorption onto natural clinoptilolite: Effect of time, ionic strength, pH and temperature, Journal of Colloid and Interface Science, 363 : 465475.
Simpen, I. N., 2001, Preparasi dan Karakterisasi Lempung Montmorillonit Teraktivasi Asam Terpilar TiO2, Tesis, Program Pasca Sarjana Universitas Gajah Mada, Yogykarta.
Suarya, P., Bawa, A. A. P., dan Wisudawan, D., 2010, Interkalasi Tetraetil Ortosilikat (Teos) Pada Lempung Teraktifasi Asam Sulfat dan Pemanfaatannya sebagai Adsorben Warna Limbah Garmen, Jurnal Kimia, 4(1):43-48.
Suarya, P., Simpen, I. N., 2009, Interkalasi Benzalkonium Klorida Ke dalam Montmorillonit Teraktivasi Asam dan Pemanfaatannya untuk Meningkatkan Kualitas Minyak Daun Cengkeh, Jurnal Kimia, 3(1):41-46
Sunardi, Irawati U., Sybianti, N. R., 2012,
Sintesis dan Karakterisasi Komposit Kaolin-Tio2 sebagai Fotokatalis untuk Degradasi Zat Warna Rhodamine B, Sain dan Terapan Kimia, Vol.6, No.2, 118-129
Tan, K. H., 1991, Dasar – Dasar Kimia Tanah, Gadjah Mada University Press, Yogyakarta, Hal. 105 – 108.
81
Discussion and feedback