ADSORPSI ION Pb2+ OLEH LEMPUNG TERINTERKALASI SURFAKTAN
on
ISSN 1907-9850
ADSORPSI ION Pb2+ OLEH LEMPUNG TERINTERKALASI SURFAKTAN
I. A. Gede Widihati
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
ABSTRAK
Telah dilakukan penelitian tentang interkalasi lempung bentonit dengan garam ammonium kuartener jenis N Cetyl,N,N,N Trimetil Amonium Bromida yang sebanding dengan kapasitas tukar kationnya yaitu sebesar 8 mmol garam ammonium kuarterner per 10 gram bentonit. Kemudian lempung yang telah terinterkalasi tersebut ditambah asam palmitat dan digunakan sebagai adsorben ion Pb2+.
Sifat kimia fisik hasil modifikasi tersebut dianalisis menggunakan metode difraksi sinar X, spektrofotometer Infra merah. Adsorpsi yang dianalisis meliputi isotherm adsorpsi, waktu setimbang dan kapasitas adsorpsi menggunakan spetrofotometer serapan atom.
Hasil penelitian menunjukan bahwa dengan interkalasi N-Cetyl,N,N,N-Trimetil Amonium Bromida ke dalam antar lapis lempung bentonit menghasilkan peningkatan jarak antar lapis (basal spacing) dari 15,9236Å menjadi 21,0534 Å, situs asam Bronsted pada bilangan gelombang 1419,5 cm-1, dan peningkatan kapasitas adsorpsi dari 1,9565mg/g menjadi 4,0263 mg/g.
Kata Kunci : interkalasi, bentonit, garam ammonium kuarterner, adsorpsi
ABSTRACT
Intercalation of Bentonit clay with quaternary ammonium salt, N-cetyl, N,N,N –trimethyl ammonium bromide in the presence of palmitic acid was investigated in this research. The aim was to improve the capacity of Bentonit clay as adsorbent for lead ion (Pb2+). The salt used has a capacity of 8 mmol/10kg clay, which equal to its capacity as cation exchanged. After intercalating process, palmitic acid was added and then clay was ready to be used as adsorbent for lead ion (Pb2+).
Characterisation of physical chemistry properties of the intercalated Bentonit clay was performed using X-ray diffractometer for basal spacing distance between interlayer Bentonit clay, infra red spectrometer for Brownstead acid site, and atomic adsorption spectroscopy to determine the capacity of adsorption by analyzing isotherm adsorption and equilibrium temperature data.
It was found that the intercalation of Bentonit clay with quaternary ammonium salt, N-cetyl, N,N,N – trimethyl ammonium bromide increased the distance between interlayer Bentonit clay (basal spacing from 15.9236 Ao to 21.0554 Ao. The infra red spectra data revealed the appearance of Brownstead acid site at ν 1419.5 cm-1. The result also found that the capacity of Bentonit clay as adsorbent for lead ion (Pb2+) improved from 1.9565 mg/g before intercalation to 4.0263 mg/g (after intercalation process).
Keywords : intercalation, clay, ammonium quaternary salt, adsorption
PENDAHULUAN
Cadangan tanah lempung cukup berlimpah hampir di seluruh wilayah Indonesia namun pemanfaatannya masih perlu dikembangkan secara berkelanjutan.
Berdasarkan kandungan mineralnya tanah lempung dibedakan menjadi bentonit (smektit), kaolinit, haloisit, klorit dan ilit (Wiley,1977). Bentonit adalah istilah yang digunakan dalam dunia perdagangan untuk tanah lempung yang mengandung lebih dari 80% montmorillonit.
Mineral montmorillonit merupakan mineral lempung yang penyebarannya paling luas dan bersifat unik karena memiliki kemampuan mengembang (swelling), kapasitas tukar kation yang tinggi, dan dapat diinterkalasi. Karena sifatnya yang unik tersebut montmorillonit (yang terdapat dalam bentonit) dapat dimodifikasi untuk memperoleh produk senyawa alumino silikat yang memiliki sifat-sifat kimia fisik yang lebih baik dari sebelumnya. Sifat-sifat kimia fisik tersebut meliputi kristalinitas, basal spcing d001, keasaman permukaan dan stabilitas termal yang merupakan syarat mutlak sebagai katalis, pengemban katalis, dan adsorben.
Beberapa senyawa lempung termodifikasi telah dibuat untuk mengadsorpsi logam logam berat melalui proses pertukaran kation. Modifikasi lempung dengan senyawa-senyawa organik menghasilkan kompleks yang dapat digunakan sebagai adsorben, salah satunya sebagai adsorben ion Pb2+.
Surfaktan kationik seperti garam amonium kuarterner merupakan senyawa organik yang dapat digunakan dalam modifikasi lempung yang akan membentuk kompleks lempung-surfaktan yang dapat digunakan sebagai adsorben logam berat dalam larutan encer. Senyawa kationik ini akan menggantikan kation-kation permukaan lempung dan mengubah permukaan lempung menjadi sangat hidrofobik. Modifikasi permukaan lempung montmorillonit lebih lanjut digunakan untuk menjangkar ligan-ligan seperti asam palmitat melalui interaksi hidrofibik. Asam palmitat atau ligan tersebut akan membentuk senyawa kompleks dengan ion Pb2+ yang teradsorpsi.
MATERI DAN METODE
Bahan
Bahan-bahan kimia yang digunakan dalam penelitian ini adalah timbal(II)Nitrat, garam amonium kuarterner jenis N cetyl N,N,N trimetil amonium Bromida, asam palmitat, akuades, lempung bentonit yang diperoleh dari PT. Tunas Inti Makmur Semarang.
Peralatan
Alat-alat yang digunakan dalam penelitian ini adalah peratan gelas, penggerus porselin, ayakan 105µm, oven, pengaduk magnetik, pemanas, kertas saring, timbangan analitik. Peralatan instrumen yang digunakan meliputi XRD-6000, spektrofotometer infra merah, dan spektrofotometer serapan atom.
Cara Kerja
Proses Interkalasi
Sepuluh gram lempung dilarutkan ke dalam 1000ml akuades, diaduk selama 5 jam untuk membuat suspensi lempung bentonit. Kemudian ke dalamnya dimasukkan 2,9155 g garam amonium kuarterner jenis N cetyl N,N,N trimetil amonium Bromida dan diaduk selama 24 jam. Selanjutnya dimasukkan ke dalam suspensi tersebut 2,0480 g asam palmitat, diaduk selama 48 jam. Kemudian campuran disaring, dicuci dengan akuades dan dikeringkan dalam oven pada temperatur 60ºC. Setelah kering lempung termodifikasi tersebut digerus dan diayak, kemudian dianalisis dengan XRD dan keasaman permukaan dianalisis dengan spektrofotometer FTIR.
Penentuan Waktu Setimbang
Ke dalam 5 buah erlenmeyer 100 ml masing masing dimasukkan 0,2 g lempung bentonit yang tidak terinterkalsi. Kemudian ke dalam masing-masing erlenmeyer tersebut ditambahkan adsorbat 20 ml Pb(II) 80 ppm. Campuran diaduk dengan waktu yang berbeda-beda yaitu selama 10, 20, 40, 80, dan 120 menit. Selanjutnya disaring dan filtratnya diukur dengan spektrofotometer serapan atom. Prosedur yang sama juga dilakukan untuk lempung terinterkalasi. Absorbansi yang terbaca kemudian dimasukkan ke dalam persamaan regresi sehingga konsentrasi Pb(II) dalam filtrat bisa ditentukan. Untuk mengetahui waktu setimbang dibuat grafik antara banyaknya Pb(II)yang teradsorpsi pergram adsorben dan waktu yang diberikan. Waktu setimbang ditentukan dari grafik dimana waktu memberikan konsentrasi Pb(II) tertinggi yang teradsorpsi.
Penentuan Isoterm Adsorpsi
Ke dalam 5 buah erlenmeyer 100 ml masing masing dimasukkan 0,2 g lempung bentonit yang tidak terinterkalsi.Kemudian ke dalam masing-masing erlenmeyer tersebut ditambahkan adsorbat Pb(II) dengan konsentrasi yang berbeda-beda yaitu 40, 60, 80, 100, dan 120 ppm. Campuran diaduk selama waktu yang diperoleh dari penentuan waktu setimbang, selanjutnya disaring dan filtratnya diukur dengan spektrofotometer serapan atom. Prosedur yang sama juga dilakukan untuk lempung terinterkalasi. Konsentrasi Pb(II) maksimum yang diserap pada isoterm adsorpsi diperoleh dengan cara membuat kurva antara jumlah Pb(II) yang teradsorpsi oleh adsorben (mg/g)dan konsentrasi ion Pb(II)dalam larutan.
Penentuan Kapasitas Adsorpsi
Masing-masing ke dalam erlenmeyer 100 mL dimasukkan 0,2 g lempung tanpa terinterkalasi dan lempung terinterkalasi. Kemudian ditambahkan 20 ml larutan Pb (II) dengan konsentrasi yang didapat dari penentuan isoterm adsorpsi dan diaduk selama waktu setimbang adsorpsi. Selanjutnya disaring dan filtratnya diukur dengan spektrofotometer serapan atom.
Perhitungan Kapasitas Adsorpsi
Kapasitas adsorpsi ditentukan berdasarkan banyaknya zat terlarut yang teradsorpsi oleh setiap gram adsorben pada keadaan jenuh.Perhitungan kapasitas adsorpsi lempung bentonit dilakukan dengan rumusan :
C1 - C. 1
A = 1 2 × V ×
1000 B
Dimana A adalah jumlah Pb(II) yang teradsorpsi oleh lempung bentonit (mg/g), C1 adalah konsentrasi Pb(II) awal, C2 konsentrasi Pb(II) yang tersisa dalam filtrat (ppm), V adalah volume Pb(II) yang digunakan (mL) dan B adalah berat lempung yang digunakan (g).
HASIL DAN PEMBAHASAN
Karakterisasi basal spacing d001
Dilakukan dengan menggunakan metode XRD,hasil yang diperoleh dapat digunakan untuk menentukan besarnya pergeseran jarak antar lapis silikat lempung. Jika terjadi interkalasi maka akan terlihat pergeseran jarak antarlapis nya yang ditandai dengan perubahan basal spacing d001. Jika jarak antar lapisnya meningkat maka luas permukaannya juga akan meningkat.
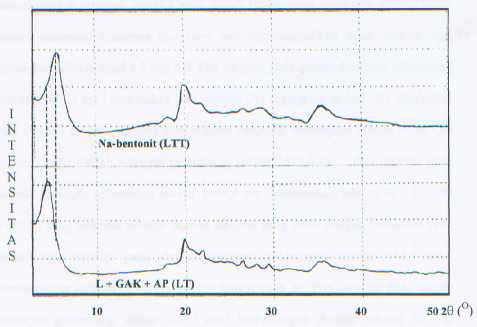
Gambar 1. Difraktogram lempung Na-Bentonit tanpa terinterkalasi(LTT) dan Lempung terinterkalasi garam amonium kuartener(LT)
Tabel 1. Peningkatan jarak antar lapis karena interkalasi
|
SAMPEL |
2θ(º) |
d(Å) |
|
Na-bentonit(LTT) |
5,5455 |
15,9236 |
|
L+GAK+AP (LT) |
4,1936 |
21,05341 |
Dari difraktogram dan peak list XRD dapat dinyatakan bahwa garam amonium kuartener dan asam palmitat telah terinterkalasi ke dalam antar lapis lempung yang ditandai dengan pergeseran sudut 2θ ke arah yang lebih kecil dan terjadi peningkatan jarak antar lapis sebesar 5,1298 Å
Analisis Spektra Infra Merah
Karakterisasi produk interkalasi dengan menggunakan spektrofotometer infra merah dilakukan untuk mengidentifikasi gugus fungsi yang terdapat dalam produk tersebut. Dari spektra yang dihasilkan dapat dilihat tejadinya pergeseran beberapa frekuensi vibrasi., Seperti yang terlihat pada tabel berikut.
Tabel 2. Serapan karakteristik lempung
bentonit
|
λ (cm-1) |
Gugus serap |
|
3433,1 |
Rentangan H2O dan –OH oktahedral |
|
1629,7 |
-OH tekuk |
|
1033,8 |
Rentangan Si-O-Si |
|
916,1 |
Rentangan OH yang terikat pada Al |
|
518,8 |
Rentangan Si-O |
|
Tabel 3. |
Pergeseran serapan yang terjadi pada lempung terinterkalasi |
|
λ (cm-1) |
Gugus serap |
|
3425,3 |
-OH regang |
|
1635,5 |
-OH tekuk |
|
1041,5 |
Si-O-Si regang |
|
914,2 |
Al-O regang |
|
524,6 |
Si-O regang |
Keasaman Permukaan
Hasil analisis keasaman permukaan secara kualitatif dengan spektrofotometer FTIR menunjukkan bahwa dengan interkalasi muncul situs asam Lewis pada bilangan gelombang 1542,9 cm-1 dengan pita serapan yang tajam.Munculnya situs asam Lewis karena terinterkalasinya asam palmitat pada ruang antar lapis lempung yang sebelumnya telah mengikat N+ dari garam amonium kuartener yang berfungsi sebagai akseptor elektron dan asam palmitat sebagai donor elektron yang nantinya membentuk senywa koordinasi.
Dari spektra FTIR juga terdeteksi situs asam Bronsted yang muncul pada bilangan gelombang1419,5 cm-1 yang disebabkan karena adanya kation H+yang terperangkap dalam lempung.
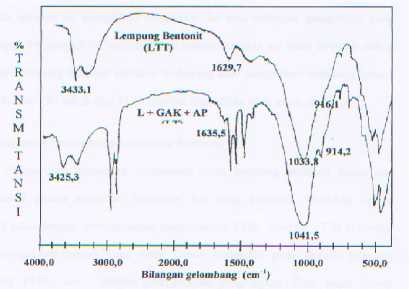
Gambar 2. Spektra FTIR dari LTT dan LT
Waktu Setimbang Adsorpsi
Dari grafik diperoleh lempung teinterkalasi mempunyai waktu setimbang yang lebih besar dibandingkan dengan lempung yang tidak terinterkalasi yaitu 40 menit untuk lempung terinterkalsi dan 20 menit untuk lempung tak terinterkalasi. Ini disebabkab karena lempung terinterkalasi mempunyai luas permukaan yang lebih besar sehingga memerlukan waktu kontak dengan adsorbat yang lebih lama.
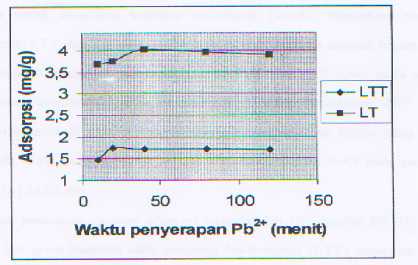
Gambar 3. Grafik Waktu Penyerapan vs Adsorpsi
Isoterm Adsorpsi
Penentuan pola isoterm adsorpsi dilakukan untuk mengetahui pengaruh konsentrasi ion logam Pb(II) yang diinteraksikan terhadap jumlah ion Pb (II) yang teradsorpsi baik oleh lempung tidak terinterkalasi(LTT) maupun lempung terinterkalasi (LT). Dari isoterm adsorpsi diperoleh konsentrasi yang memberikan peneyerapan maksimum masing-
masing untuk LTT dan LT adalah 80 ppm dan 100 ppm. Pola isoterm adsorpsi yang dihasilkan diklasifikasikan ke dalam tipe H yang merupakan bentuk khusus dari isoterm tipe Langmuir yang mengindikasikan adanya afinitas yang sangat tinggi antara adsorbat dengan adsorben.
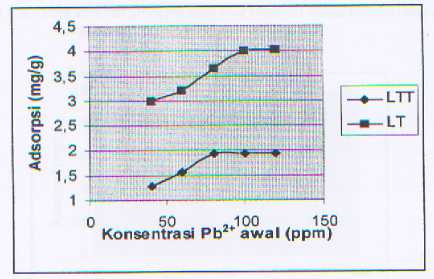
Gambar 4. Grafik Konsentrasi vs Adsorpsi
Kapasitas Adsorpsi
Penentuan kapasitas adsorpsi dilakukan untuk menegetahui kemampuan lempung bentonit terinterkalasi mengikat ion Pb(II). Didapatkan bahwa lempung terinterkalasi mempunyai kapasitas adsorpsi yang lebih besar dibandingkan lempung yang tidak terinterkalasi. Peningkatan kapasitas adsorpsi ini disebabkan karena lempung terinterkalasi telah membentuk senyawa kompleks dengan garam amonium kuartener yang menjadi interkalatnya yang kemudian menjangkar asam palmitat sebagai ligannya melalui interaksi hidrofob. Ligan-ligan tersebut kemudian akan mengikat ion Pb(II). Peningkatan kapasitas adsorpsi juga disebabkan karena meningkatnya jarak antar lapis lempung yang dengan sendirinya juga meningkatkan luas permukaan lempung.
Tabel 4. Nilai Kapasitas Adsorpsi LTT dan LT terhadap ion Pb(II)
|
Adsorben |
d001 (Å) |
Konsentrasi awal (mg/g) |
Kapasitas Adsorpsi (mg/g) |
Persentase Adsorpsi |
|
LTT |
15,9136 |
8,0000 |
1,9565 |
24,46 |
|
LT |
21,05341 |
10,0000 |
4,0263 |
40,26 |
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian yang diperoleh, dapat disimpulkan sebagai berikut : 1) Interkalasi garam amonium kuartener dan asam palmitat ke dalam antar lapis lempung meningkatkan jarak antar lapis lempung (basal spacing) sebesar 5,12981Å.
-
2) Interkalasi juga menyebabkan munculnya situs asam Lewis pada 1542,9 cm-1 dan asam Bronsted pada 1419,5 cm-1.
-
3) Interkalasi juga meningkatkan kapasitas adsorpsi dari 1,9764 mg/g menjadi 4,0263 mg/g.
Saran
Perlu dilakukan variasi konsentrasi garam amonium kuartener yang ditambahkan sehingga didapatkan peningkatan jarak antar lapis yang maksimal dan variasi jenis ligan yang ditambahkan sehingga didapatkan kapasitas adsorpsi yang lebih besar.
UCAPAN TERIMA KASIH
Terima kasih penulis ucapkan kepada saudari Ni Wayan Sekarini atas kerjasamanya dan semua pihak yang telah membantu dari pelaksanaan penelitian hingga penerbitan tulisan ini.
DAFTAR PUSTAKA
Brady, J. E., and Holum, J. R., 1992, Chemistry: The Study of Matter and Its Change, WilleyInc, Canada
Fietcher, A., 1992, Biosurfactan: Moving Toward Industrial Application, Tibtech, 10 : 208-217
Malakul, P., 1998, Metal Adsorption and Desorption Characteristic of Surfactan-Modified Clay Complexes, Ind.
Eng.Chem.Res., 37 : 4296-4301
Shaw, D. J. FRSC., 1996, Introduction to Colloid and Surface Chemistry,
Departement of Chemistry and Biochemistry, Liverpool Polytechnic, Butterworth Heinemann, Canada
Wiley, J., 1977, Clay Colloid Chemistry, For Clay Technologist , Geologist, and Soil Scientist, Second Edition, a Wiley – Interscience Publication, New York
32
Discussion and feedback