ISOLASI SENYAWA GOLONGAN TRITERPENOID DAN UJI TOKSISITAS EKSTRAK ETANOL BATANG PRANAJIWA (Euchresta horsfieldii (Lesch) Benn) TERHADAP LARVA UDANG (Artemia salina Leach)
on
ISSN 1907-9850
ISOLASI SENYAWA GOLONGAN TRITERPENOID DAN UJI TOKSISITAS EKSTRAK ETANOL BATANG PRANAJIWA (Euchresta horsfieldii (Lesch) Benn) TERHADAP LARVA UDANG (Artemia salina Leach)
I W. G. Gunawan*, Oka Ratnayani, dan I Putu Gede Suwindra Putra
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*E-mail : gunawanwayangede@yahoo.co.id
ABSTRAK
Isolasi dan identifikasi senyawa toksik berpotensi sebagai antikanker dari batang pranajiwa (Euchresta horsfieldii (Lesch) Benn) telah dilakukan pada penelitian ini. Sebanyak 800 g sampel batang pranajiwa diekstraksi dengan 5000 mL etanol 96% menghasilkan 40,19 g ekstrak pekat etanol, dan hasil uji toksisitasnya terhadap larva udang Artemia salina Leach menunjukan LC50 79,43 ppm. Partisi ekstrak etanol dengan n-heksana, kloroform, dan air menghasilkan 1,50 g ekstrak n-heksana (LC50 50,11 ppm), 1,20 g ekstrak kloroform (LC50 630,95 ppm), dan 30,06 g ekstrak air (LC50 158,48 ppm). Ekstrak n-heksana bersifat paling toksik selanjutnya dipisahkan, dimurnikan, dan diidentifikasi. Pemisahan ekstrak n-heksana secara kromatografi kolom dengan fase diam dan fase gerak n-heksana-kloroform (5:5) menghasilkan empat fraksi (F1-F4). Fraksi F1 dengan noda tunggal pada kromatografi lapis tipis bersifat paling toksik (LC50=79,43 ppm). Hasil identifikasi fraksi F1 dengan uji fitokimia, spektrofotometer UV-Vis, dan FTIR, diduga F1 positif mengandung senyawa golongan triterpenoid.
Kata kunci : Euchresta horsfieldii (Lesch) Benn, triterpenoid, toksisitas, Artemia salina Leach
ABSTRACT
Isolation and identification of toxic compounds potential for anticancer from pranajiwa stem (Euchresta horsfieldii (Lesch) Benn) has been carried out in this research. About 800 g sample of pranajiwa stem was extracted with 5000 mL of 96% ethanol resulted in 40.19 g viscous ethanol extract and the result of toxicity test against brine shrimp larvae showed the value of LC50 = 79.43 ppm. Partition of the ethanol extract with n-hexane, chloroform and water gained 1.50 g n-hexane extract (LC50 = 50.11 ppm), 1.20 g chloroform extract (LC50 = 630.95 ppm) and 30.06 g water extract (LC50 = 158.48 ppm). The n-hexane extract as the most toxic one was then separated, purified and identified. Separation of n-hexane extract by column chromatography with silica gel 60 as stationary phase and n-hexane-chloroform (5:5) as mobile phase yielded four fraction (F1, F2, F3, and F4). Fraction F1 with single spot on the thin layer chromatography showed the most toxic among others (LC50 = 79.43 ppm). Identification result of fraction F1 by using phytochemical test, UV-Vis spectrophotometer and infrared spectrophotometer suggested that it contained triterpenoids group compounds.
Keywords : Euchresta horsfieldii (Lesch) Benn, triterpenoide, toxicity, Artemia salina Leach
PENDAHULUAN
Kanker merupakan sel dalam tubuh yang tidak dapat dikendalikan pertumbuhan dan perkembangannya. Sampai saat ini usaha terapi kanker belum mencapai hasil yang maksimal. Hal ini disebabkan karena rendahnya selektivitas obat
antikanker serta pathogenesis dari penyakit kanker belum jelas (Meiyanto dan Sugianto,1997). Upaya yang dapat dilakukan untuk meningkatkan obat antikanker adalah menggali sumber obat nabati.
Tanaman pranajiwa (Euchresta horsfieldii (Lesch) Benn) dapat dikembangkan sebagai obat antikanker. Saat ini industri jamu telah mengolah
biji tanaman pranajiwa menjadi suatu bahan atau produk yang bernilai ekonomi. Akar dan batangnya mengandung senyawa metabolit sekunder yaitu isoflavon, pterocarpan, caumaronochromon dan flavonon. Bijinya mengandung alkaloid berupa cytosin (1,5 %), matrin dan matrin-N-oxid, yang dapat digunakan sebagai obat sakit TBC, penyakit dada dan muntah darah (Heyne, 1987).
Skrining awal yang antikanker terhadap senyawa aktif yang terkandung dalam batang pranajiwa dilakukan dengan uji toksisitas atau pengujian efek toksik terhadap larva udang (Artemia Salina Leach) dengan metode yang digunakan yaitu Brine Shrimp Lethality Test (BSLT). Uji toksisitas dengan metode BSLT merupakan uji pendahuluan yang dapat digunakan untuk memantau senyawa bioaktif dari bahan alami. Hal ini yang melatar belakangi dilakukan penelitian tehadap batang pranajiwa tehadap larva udang sebagai obat anti kanker. Tujuan dari penelitian ini adalah untuk mengetahui toksisitas isolate aktif batang pranajiwa terhadap larva udang (Artemia Salina Leach) serta untuk mengidentifikasi senyawa golongan triterpenoid pada isolat batang tanaman yang paling toksik terhadap larva udang (Artemia Salina Leach).
MATERI DAN METODE
Bahan
Penelitian ini menggunakan bahan batang Pranajiwa (Euchresta horsfeildii (Lesch) Benn) serta beberapa bahan kimianya yaitu etanol 96%, kloroform (CHCl3), n-heksan, silika gel GF254, silika gel 60, akuades, air laut, asam asetat anhidrida, dan H2SO4.
Peralatan
Alat yang digunakan dalam penelitian ini yaitu seperangkat alat gelas, pisau, penghancur atau blender, penguap putar vakum (rotary vacum evaporator), neraca digital, bak kaca (akuarium), batang pengaduk (stirring rod atau glas rod), tabung reaksi (Test Tube), pipet volume atau pipet gondok, pipet tetes, pipet mikro, kertas saring, aluminium foil, corong pemisah, seperangkat alat
kromatografi lapis tipis (KLT), alat kromatografi kolom, alat Spektrofotometer UV-Vis dan FTIR. Cara Kerja
Penyiapan Sampel
Sampel batang pranajiwa (Euchresta horsfeildii (Lesch) Benn) yang kering dibersihkan dan dipotong kecil-kecil. Sampel setelah dipotong selanjutnya dihaluskan dengan blender sampai diperoleh sampel halus.
Ekstraksi Metabolit Sukunder
Sampel halus batang pranajiwa ± 800 kg diekstraksi dengan cara maserasi menggunakan pelarut etanol 96% selama ± 24 jam. Proses
ekstraksi metabolit dilakukan secara berulang-ulang dengan tujuan semua kandungan metabolit pada batang pranajiwa terekstrasi sehingga mendapatkan filtrat yang baik. Filtrat yang dihasilkan pada proses ekstraksi metabolit kemudian diuapkan pada suhu 400C dengan
bantuan alat penguap putar vacum (rotary vacum evaporator) sehingga diperoleh ekstrak pekat etanol. Ekstrak pekat etanol ini kemudian dilarutkan dengan campuran etanol dan air dengan perbandingan 7:3, kemudian campuran ekstrak tersebut diuapkan menggunakan rotary vacum evaporator sampai habis dan diperoleh ekstrak air. Ekstrak air ini kemudian dipartisi dengan n-heksan dan klorofom sehingga diperoleh tiga ekstrak yaitu ekstrak n-heksan, ekstrak kloroform, dan ekstrak air. Ketiga ekstrak yang diperoleh diuapkan kemudian ditimbang dan di uji efek toksik atau toksisitasnya terhadap larva udang (Artemia salina Leach). Selanjutnya dengan bantuan kromatografi kolom ekstrak yang paling aktif dipisahkan dan dimurnikan.
Uji Toksisitas Terhadap Larva Udang (Artemia salina Leach)
Pada tahap uji efek toksik atau toksisitas ini dilakukan pengambil ekstrak n-heksana, ekstrak kloroform, dan ekstrak air masing-masing sebanyak 20 mg kemudian dilarutkan dengan 2 mL pelarutnya. Sehingga diperoleh tiga larutan stok yaitu larutan ekstrak n-heksana, kloroform, dan air. Sebanyak 500 µL, 50 µL, dan 5 µL larutan diambil dari masing-masing larutan stok, selanjutnya dimasukkan kedalam botol vial dan pelarutnya diuapkan selama 24-48 jam. Dilakukan 3 kali pengulangan pada setiap ekstrak. Sebanyak 50 µL tween88 dan sedikit air laut dimasukkan kedalam
masing-masing botol vial, kemudian dikocok sampai ekstrak larut dan bercampur. Campuran kemudian dimasukkan dalam labu ukur 5 mL dan ditambahkan masing-masing 10 ekor larva udang dan air laut sampai volume yang dihasilkan 5 mL sehingga diperoleh konsentrasi larutan 1000 ppm, 100 ppm, dan 10 ppm. Sementara untuk kontrol atau pembanding dibuat dengan memipet 50 µL tween88, sedikit air laut, 10 ekor larva udang, kemudian ditambahkan air laut hingga volumenya 5 mL. Masing-masing botol vial ditutup dengan aluminium foil dan dilubangi sedikit. Pencatatan terhadap jumlah larva udang yang mati dilakukan setelah 24 jam dan dilakukan analisis data dengan tujuan mendapatkan konsentrasi kematian (LC50) dengan metode grafik % mortalitas. Ekstrak yang mengandung toksik paling tinggi kemudian dipisahkan dan dimurnikan.
Pemisahan dan Uji Kemurnian Kromatografi Lapis Tipis (KLT)
Sampel secukupnya dilarutkan dengan pelarutnya kemudian ditotolkan tepat pada garis batas bawah plat KLT. Garis yang dibuat adalah masing-masing 1 cm untuk batas atas dan batas bawah, yaang sebelumnya disesuaikan agar batas bawah berada sedikit di atas permukan pengembang. Plat KLT yang mengandung sampel setelah dibiarkan beberapa saat, dimasukkan ke dalam bejana kromatografi yang berisi fase gerak yang telah dijenuhkan. Kertas saring diletakan untuk mempercepat penjenuhan (Sastrohamidjojo, 1991). Pengembangan dilakukan pada bejana tertutup dan dihentikan setelah fase gerak mencapai garis batas yang telah ditentukan. Plat KLT diambil dari bejana kromatografi dan dikeringkan di udara terbuka. Radiasi ultraviolet pada panjang gelombang (λ) 254 dan 366 nm digunakan sebagai penampak noda. Noda yang terbentuk diamati dan dihitung harga Rf nya (Sastrohamidjojo, 1991).
Kromatografi Kolom
Kromatografi kolom dilakukan untuk pemisahan dan pemurnian ekstrak pekat dengan menggunakan fase diam silika gel 60 dan fase geraknya menggunakan eluen terbaik hasil analisis kromatografi lapis tipis. Caranya adalah kapas dimasukkan ke bagian bawah kolom sebagai penahan fase diam. Silika gel 60 sebanyak 60 g
yang telah diaktifkan dalam oven pada suhu ±1000C sampai kering, kemudian didinginkan lalu ditambah fase gerak sehingga menjadi bubur. Bubur silika dimasukkan ke dalam kolom yang sudah berisi fase gerak dengan hati-hari agar tidak terbentuk gelembung-gelembung udara dalam kolom. Ekstrak pekat sebanyak kurang lebih 1,5 g dilarutkan dalam fase geraknya selanjutnya dimasukkan ke dalam kolom. Eluen kemudian dimasukkan ke dalam kolom sedikit demi sedikit sampai semua sampel masuk ke dalam fase diam. Aliran kolom diatur kecepatannya hingga 1 mL/menit. Eluat ditampung setiap 3 mL. Setelah eluat ditampung, proses elusi akan dihentikan jika sudah diperkirakan semua komponen keluar dari kolom (Sastrohamidjojo, 1991).
Setiap botol eluat dideteksi nodanya menggunakan kromatografi lapis tipis. Eluat yang memiliki pola pemisahan atau pola noda yang sama digabungkan, diuapkan, ditimbang sehingga diperoleh beberapa fraksi. Fraksi-fraksi yang diperoleh diuji toksisitasnya. Fraksi yang paling toksik diuji kemurniannya dengan kromatografi lapis tipis. Fraksi murni ditandai dengan terbentuknya satu noda tunggal dengan beberapa campuran eluen yang mempunyai kepolaran yang berbeda (Sastrohamidjojo, 1991).
Uji Fitokimia
Pengujian adanya senyawa golongan triterpenoid pada ekstrak kental, fraksi hasil kromatografi kolom maupun isolat, dilakukan dengan menambahkan pereaksi (Lieberman-Bruchard) sedikit ekstrak kental ditambahkan beberapa tetes asetat anhidrat dan beberapa tetes H2SO4 pekat, perubahan warna menjadi merah ungu menunjukkan positif triterpenoid.
Analisis Spektrofotometer UV-Vis
Pada spektrofotometer UV-Vis pelarut akuades digunakan sebagai blanko. Setelah pengkalibrasian dilakukan, isolat sebanyak 2 mL dimasukkan dimasukan kedalam kuvet. Dinding kuvet dibersihkan dengan tissue kemudian dipasangkan pada alat. Pada pengoperasian alat spektroskopi UV-Vis, dipilih panjang gelombang yang sesuai. Pengamatan dilakukan pada panjang gelombang maksimal yaitu pada 200-800 nm. Spektrum hasil identifikasi kemudian dilanjutkan
ke tahap berikutnya yaitu dibawa ke monitor sehingga dapat dibaca dan dapat di print.
Analisis Spektrofotometer Inframerah (IR)
Pada spektrofotometer inframerah, kalium bromide (KBr) dioven sampai kering. Selanjutnya alat spektrofotometer inframerah (FTIR) dinyalakan, jalankan program inframerah, dan scan background untuk menghilangkan gangguan latar. Kalium bromide (KBr) yang telah kering kemudian dimasukkan kedalam cawan secukupnya dan ditambahkan sampel. Sampel dan KBr digerus sampai halus dan tercampur rata kemudian ditekan-tekan sehingga diperoleh bentuk pelet. Pelet dimasukkan kedalam sampel holder start spektrofotometer inframerah, kemudian dibuat spektrum inframerah-nya dan dianalisa spektra yang diperoleh.
HASIL DAN PEMBAHASAN
Identifikasi dan Penyiapan Bahan
Nama latin dari tumbuhan pranajiwa ini adalah Euchresta horsfieldii (Lesch) Benn. Berdasarkan penelitian yang dilakukan oleh pihak Konservasi Tumbuhan Kebun Raya Eka Karya Bali menunjukkan bahwa dari 40 senyawa kimia yang terdapat pada tumbuhan pranajiwa, senyawa Kaur-16-ene terdapat pada batangnya adalah 36,13%. Dari proses pengumpulan, pengeringan, dan penggilingan batang pranajiwa, diperoleh serbuk sampel berwarna putih kecoklatan sebanyak ± 800 g.
Ekstraksi Batang Pranajiwa
Serbuk batang pranajiwa sebanyak ± 800 gram diekstraksi dengan 5000 mL etanol 96% dan menghasilkan sebanyak 40,19 gram ekstrak pekat etanol. Ekstrak pekat etanol yang diperoleh kemudian diuji toksisitasnya terhadap larva udang. Sehingga mendapatkan hasil LC50 = 79,43. Hasil uji toksisitas tersebut menunjukkan bahwa ekstrak pekat etanol batang pranajiwa bersifat toksik terhadap larva Artemia salina Leach. Estrak dianggap toksik bila mempunyai LC50 dibawah 1000 ppm (Meyer, 1982).
Fraksionasi (partisi)
Ekstrak pekat etanol yang telah dilarutkan dan dicampur dengan etanol dan air kemudian
diuapkan menggunakan penguap putar vakum sampai diperoleh ekstrak airnya. Ekstrak air yang dihasilkan kemudian dipartisi kembali secara berturut-turut dengan n-heksan (350 mL) dan klorofom (300 mL) sampai diperoleh tiga ekstrak yaitu ekstrak n-heksan dengan berat kental 1,50 gram dan berwarna hijau muda, ekstrak kloroform dengan berat kental 1,20 gram dan berwarna kuning, dan ekstrak air berat kental 30,06 g dan warnanya coklat pekat. Kemudian dilakukan pengujian efek toksik atau toksisitas dari ketiga ekstrak tersebut terhadap larva udang (Artemia salina Leach). Ekstrak pekat n-heksana dengan nilai LC50 50,11 ppm, ekstrak pekat air dengan nilai LC50 158,48 ppm dan ekstrak pekat kloroform dengan nilai LC50 630,95 ppm bersifat toksik terhadap larva Artemia salina Leach. Toksisitas ekstrak n-heksan lebih tinggi dari toksisitas ekstrak etanol, ekstrak kloroform, dan ekstrak air. Hal ini menunjukkan senyawa toksik yang terkandung pada ekstrak n-heksana, kloroform, dan air tersebut bersifat antagonis. Tahap kerja selanjutnya hanya dilakukan pada ekstrak n-heksana hasil fraksionasi. Ekstrak n-heksana bersifat paling toksik disebabkan kemungkinan senyawa-senyawa toksik bersifat nonpolar sehingga larut dalam pelarut n-heksana.
Pemisahan komponen ekstrak n-heksan dilakukan menggunakan alat kromatografi kolom dengan fase diam dan fase gerak (eluen) berupa campuran pelarut n-heksana : kloroform (5:5) dan jumlah noda yang diperoleh 5 (lima) dengan harga Rf : 0,062, 0,187, 0,25, 0,437, dan 0,5.
Pemisahan 1,5 g fraksi n-heksana menghasilkan 120 botol eluat yang ditampung setiap 3 mL. Eluat dengan pola pemisahan yang sama kemudian dikumpulkan dan digabungkan sehingga diperoleh empat fraksi (F1-F4). Keempat fraksi tersebut selanjutnya dilakukan pengujian toksisitas terhadap larva Artemia salina Leach. Uji toksisitas terhadap larva Artemia salina Leach menunjukkan hanya fraksi satu (F1) dan fraksi dua (F2) hasil kromatografi kolom bersifat toksik terhadap larva Artemia salina Leach dengan nilai LC50 79,43 ppm dan 398 ppm, sedangkan fraksi tiga (F3) dan empat (F4) bersifat tidak bersifat toksik terhadap larva Artemia salina Leach dengan nilai LC50 di atas 1000 ppm. Jika dibandingkan dengan fraksi dua (F2) fraksi satu (F1) memiliki
kemampuan untuk dipisahkan lebih lanjut karena fraksi satu (F1) memiliki keaktifan ysng lebih tinggi dan jika dilihat dari kromatogramnya pola pemisahan fraksi lebih sederhana. Fraksi satu (F1) memiliki toksisitas lebih rendah dari toksisitas ekstrak n-heksan, hal ini berarti gabungan senyawa dalam fraksi satu (F1) bersifat sinergi. Selanjutnya dilakukan proses uji kemurnian, identifikasi dengan uji fitokimia, spektrofotometer ultraviolet-sinar tampak (UV-Vis) dan spektrofotometer Inframerah (IR) terhadap fraksi satu(F1).
Uji Kemurnian
Fraksi satu (F1) diuji kemurniannya menggunakan kromatografi lapis tipis dengan berbagai macam eluen. Uji kemurnian F1 menggunakan eluen n-heksana-kloroform-etanol (3:6:1), eluen n-heksana-kloroform-etanol (5:4:1), dan eluen n-heksana-kloroform-etanol (6:3:1). Hasil uji kemurnian menunjukkan F1 terdiri dari satu noda. Hal ini membuktikan bahwa fraksi satu (F1) relatif murni secara KLT. Fraksi relatif murni ditandai dengan terbentuknya noda tunggal dengan beberapa eluen yang mempunyai kepolaran yang berbeda.
Identifikasi Isolat dengan Uji Fitokimia
Uji fitokimia dilakukan dengan menambahkan pereaksi fitokimia ke dalam isolat aktif. Hasil uji fitokimia terhadap isolat aktif dapat dilihat pada Tabel 1.
Tabel 1. Hasil uji triterpenoid pada keempat kelompok fraksi (F1-F4)
|
Fraksi |
Perubahan Warna |
Ket. |
|
F1 |
Hijau menjadi merah ungu |
+ |
|
F2 |
Kuning menjadi orange |
- |
|
F3 |
Hitam menjadi ungu kehitam |
+ |
|
F4 |
Coklat menjadi coklat kehitam |
+ |
Hasil uji terpenoid dengan pereaksi Lieberman-Burchard membuktikan bahwa fraksi F1, F3, dan F4 positif triterpenoid. Hasil toksisitas menunjukkan bahwa F1 lebih toksik dibandingkan dengan F3 dan F4, sehingga yang dilanjutkan untuk analisis lebih lanjut dan kualitatif intensitas perubahan warna yang dihasilkan pada penambahan pereaksi Lieberman-Burchard yaitu dari
hijau menjadi merah ungu dengan intensitas warna yang kuat.
Identifikasi Isolat dengan Spektrofotometer Inframerah (IR).
Hasil analisis isolat F1 dengan menggunakan Spektrofotometer Inframerah menggunakan pelet KBr dapat dilihat pada Gambar 1, sedangkan data bilangan gelombang, bentuk pita, intensitas dan gugus-gugus yang terkait dipaparkan pada Tabel 2.
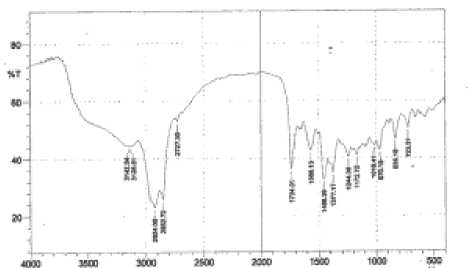
Gambar 1. Spektrum inframerah isolat F1
Pada data Tabel 2 Fraksi F1 memperlihatkan adanya pita serapan melebar di daerah bilangan gelombang 3142,04 cm-1 dengan intensitas yang sedang. Bilangan gelombang 2924,09cm-1 memiliki bentuk pita yang tajam dengan intensitas kuat. Pada bilangan gelombang 1568,13 cm-1 memiliki pita serapan yang tajam dan intensitasnya sedang dikarenakan kemungkinan gugus fungsi yang dimiliki C=C sedangkan munculnya pita serapan tajam dengan intensitas kuat pada bilangan gelombang 1734,0 cm-1 menunjukkan adanya gugus fungsi C=O (Lambert, 1976).
Identifikasi Isolat dengan Spektrofotometer UV-Vis
Hasil analisa isolat F1 menggunakan spektrofotometer UV-Vis memberikan 1 serapan landai yaitu pada panjang gelombang 217 nm. Spektrum spektrofotometer UV-Vis dari isolat F1 dipaparkan pada Gambar 2.

Tabel 2. Data Spektrum inframerah isolat F1
Gambar 2. Spektrum UV-vis dari isolat F1
|
Bilangan Gelombang (ʋ) (cm-1) |
Bentuk pita |
Intensitas |
Kemungkinan gugus fungsi | |
|
Spektra |
Pustaka | |||
|
3142,04 |
3450-3200 |
Lebar |
Sedang |
-OH terikat (stretching) |
|
2924,09 |
2850-3000 |
Tajam |
Kuat |
-CH alifatik (-CH3stretching) |
|
2852,72 |
2850-3000 |
Tajam |
Kuat |
-CH alifatik (-CH2stretching) |
|
1734,01 |
1650-1900 |
Tajam |
Kuat |
C=O |
|
1568,13 |
1566-1653 |
Tajam |
Sedang |
C=C |
|
1456,26 |
1300-1475 |
Tajam |
Kuat |
-CH alifatik (-CH2bending) |
|
1377,17 |
1300-1475 |
Tajam |
Sedang |
-CH alifatik (-CH3bending) |
|
1244,09 |
1300-1000 |
Tajam |
Sedang |
-C-O alkohol (bending) |
(Silverstain, 1981)
Analisis isolat dengan menggunakan alat spektrofotometer UV-Vis menghasilkan 1 puncak serapan. Terjadinya serapan pada panjang gelombang 217 nm disebabkan oleh adanya transisi elektron n→ π* dikarenakan adanya suatu kromo-for C=O. Hal ini dibuktikan dari inframerah yang menghasilkan isolat mempunyai gugus fungsi C=O pada daerah bilangan gelombang 1734,01 cm-1. Dengan demikian, fraksi satu (F1) diduga mengandung senyawa golongan triterpenoid (Mukti, 2011).
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang dilakukan, dapat disimpulkan bahwa hasil uji toksisitas dengan metode BSLT menunjukkan bahwa isolat batang pranajiwa mempunyai sifat toksik terhadap larva Artemia salina Leach dengan nilai LC50 sebesar 79,43 ppm. Hasil identifikasi dengan uji fitokimia, spektrofotometer IR dan spektrofoto-
meter UV-Vis menunjukkan isolat batang pranajiwa tersebut mengandung senyawa golongan triterpenoid.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui sturktur dan letak gugus-gugus fungsi –OH, -CH, C=O, C=C, -C-O dari senyawa triterpenoid tersebut dengan menggunakan spektrofotometer NMR 1H, NMR 13C, spektrofo-tometer massa dan difraksi sinar X dimensi serta penelitian lebih lanjut tentang uji bioaktivitas lanjutan senyawa-senyawa antikanker dengan menggunakan hewan coba dan metode lain.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada para penguji Dr. Ir. Sri Wahyuni, M.Kes., Dra. Wiwik Susanah Rita, M.Si., dan Drs. I Wayan Suarsa, M.Si. serta kepada pihak-pihak yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Dalimartha, S., 2006, Atlas Tumbuhan Obat
Indonesia jilid 4, Puspa Swara, Jakarta
Heyne, K., 1987, Tumbuhan Berguna Indonesia III, Yayasan Sarana Wana jaya, Jakarta
Meiyanto, E, dan Sugiyanto, 1997, Uji Toksisitas Beberapa Fraksi Etanol Daun Gynura Procumbens (Lour) Merr Terhadap Larva Udang (Artemia Salina Leach), Majalah Farmasi Indonesia, 8(1): 42-9
Meyer, B.N., Ferrigni, N.R., Putnam, J.E., Jacobsen, L.B., Nichols, D.E., and McLaughlin, J.L., 1982, Brine Shrimp: A Convenient General Bioassay for Active Lant Constituents, Plant Medica
Mukti K., 2011, Analisis Spektrofotometri UV-VIS Penentuan Konsentrasi Permanganat (KMnO4), Skripsi, Program Sarjana
Jurusan Fisika, FMIPA Universitas Sebelas Maret. Surakarta
Nasution, M.R., Utami, R., dan Gushelmawita, 2010, Penentuan Total Fenol dan Uji Aktivitas Antibakteri Dari Ekstrak Heksana, Diklorometana dan Metanol
Daun Keji Beling (Sericocalyx Crispus. L). Prosiding Seminar dan Rapat Tahunan BKS-PTN Wilayah Barat ke-23, Pekanbaru 10-11 Mei 2010.ISBN 978-791222-92-1 (Jilid 1), Pekanbaru
Sastrohamidjojo, H. 1992, Spektroskopi
Inframerah, Liberty, Yogyakarta
Silvertstein, R.M., Bassler, G.C., and Morrill, T.C., 1991, Spectrometric Identification of Organic Compounds, fifth edition, John Wiley and Sons, Singapore
Sukardiman, R. Abdul dan Fatma, P.N., 2004, Uji Praskrining Aktivitas Antikanker Ekstrak Eter dan Ekstrak Metanol Marchantia planiloba Steph Dengan Metode Uji Kematian Larva Udang dan Profil Densitometri Ekstrak Aktif. Majalah Farmasi Airlangga, 4 (3) : 97 –100
Tirta, I. G., Ardaka, I M., dan Darma, I Dw. Pt., 2010, Studi fenologi dan senyawa kimia pronojiwo (Euchresta horsfieldii (Lesch.) Benn.), Bul. Littro, 21 (1) : 28 - 36
218
Discussion and feedback