OPTIMASI ADSORPSI Cr(VI) PADA SILIKA GEL DARI ABU SEKAM PADI TERMODIFIKASI DIFENILKARBAZIDA (Si-DPZida)
on
JURNAL KIMIA 8 (2), JULI 2014: 198-204
OPTIMASI ADSORPSI Cr(VI) PADA SILIKA GEL DARI ABU SEKAM PADI TERMODIFIKASI DIFENILKARBAZIDA (Si-DPZida)
Henny Puspa Dewi Giri, I Wayan Sudiarta, dan Ida Ayu Raka Astiti Asih
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
*email : henny_giri@ymail.com
ABSTRAK
Telah dilakukan penelitian mengenai adsorpsi Cr(VI) pada adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) yang bertujuan untuk menentukan kondisi optimum adsorpsinya. Penelitian ini meliputi penentuan keasaman permukaan dengan metode titrasi asam-basa, penentuan luas permukaaan spesifik dengan metode metilen biru, penentuan kondisi optimum, dan penentuan isoterm adsorpsi.
Hasil penelitian menunjukkan bahwa adsorben Si-DPZida memiliki keasaman permukaan (Kal) sebesar 1,5996 mmol/g dan jumlah situs aktif sebesar 9,6328. 1020 atom/g, sementara nilai luas permukaan spesifik adsorben Si-DPZida sebesar 4,4538 m2/g. Adsorpsi Cr(VI) oleh adsorben Si-DPZida terjadi pada pH 5 dan waktu interaksi 15 menit. Adsorpsi yang terjadi cenderung mengikuti pola isoterm Freundlich.
Kata kunci : adsorpsi, silika gel, ligan difenilkarbazida, kromium (VI)
ABSTRACT
Adsorption of chromium (VI) on silica gel modified by diphenilcarbazide (Si-DPZida) have been studied. Parameters analyzed were surface acidity by acid-base titration method, specific surface area by absorption of methylene blue method, optimum conditions of adsorption (pH, contact time), and isotherm adsorption.
The results showed that Si-DPZida adsorbent has surface acidity (Kal) of 1,5996 mmol/g with the number of active sites of 9,6328 x 1020 atom/g with specific surface area of 4.4538 m2/g. The optimum adsorption process of chromium (VI) by both Si-DPZida occurred at pH 5 and 15 minutes of contact time. The isotherm adsorptions on both adsorbents tend to follow Freundlich adsorption pattern.
Keywords : adsorptions, silica gel, diphenilcarbazide, chromium (VI)
PENDAHULUAN
Perkembangan dalam bidang industri saat ini cukup pesat. Hal ini ditandai dengan semakin banyaknya industri yang memproduksi berbagai jenis kebutuhan manusia seperti industri kertas, tekstil, penyamakan kulit dan industri lainnya. Kromium (Cr) adalah salah satu logam berat yang berasal dari limbah industri tekstil, kertas, elektroplating dan lainnya yang dapat merusak lingkungan tanah, udara dan perairan (Sharma dan Weng, 2007). Kromium apabila masuk ke dalam tubuh manusia dan terakumulasi di dalam tubuh
dapat menyebabkan kanker paru–paru, kerusakan hati (liver), dan ginjal (Kaim and Schwederski, 1994). Cr(VI) mempunyai potensi karsinogenik, bersifat lebih toksik terhadap makhluk hidup termasuk manusia dibandingkan Cr(III) (Anderson, 1997).
Mengingat dampak negatif yang ditimbulkan oleh logam kromium khususnya Cr(VI) bagi makhluk hidup dan lingkungan, maka keberadaan logam tersebut sebagai pencemar di lingkungan perlu diminimalkan bahkan dihilangkan. Usaha-usaha pengendalian limbah ion logam belakangan ini semakin berkembang, yang
mengarah pada upaya-upaya pencarian metode-metode baru yang murah, efektif, dan efisien (Effendi, 2003). Beberapa metode kimia maupun biologis telah dicoba untuk menghilangkan logam berat yang terdapat di dalam limbah, diantaranya adsorpsi, pertukaran ion (ion exchange), dan pemisahan dengan membran. Metode adsorpsi lebih sering digunakan karena dalam metode ini pengerjaannya lebih sederhana, ekonomis, dan tidak memerlukan peralatan yang rumit (Endawati, 2008). Adsorpsi Cr(VI) pada limbah – limbah cair telah banyak dilaporkan menggunakan adsorben seperti, resin sintetik, karbon aktif, sorben dari bahan-bahan organik (biosorben) menggunakan bahan-bahan organik mati, serta sorben dari bahan anorganik seperti zeolit, lempung dan silika gel (Yu, et al., 2003).
Silika gel merupakan salah satu padatan anorganik yang mempunyai situs aktif gugus silanol (Si-OH) dan siloksan (Si-O-Si) (Oscik, 1982). Adanya gugus -OH pada situs aktif permukaan silika gel yang mempunyai kemampuan polarisabilitas rendah atau bersifat basa keras (hard), sehingga cenderung untuk berinteraksi dengan logam berat yang umumnya mempunyai kemampuan polarisabilitas yang tinggi atau asam lunak (soft) secara teoritis relatif tidak begitu kuat. Oleh karena itu, modifikasi pada permukaan silika gel perlu dilakukan (Atkins, 1999).
Modifikasi silika gel telah banyak dilakukan untuk meningkatkan kinerja dari proses penyerapan (adsorpsi) logam berat sesuai dengan keperluannya. Mandala (2012)telah berhasil mensintesis silika gel dari abu sekam padi yang tanpa termodifikasi dan yang termodifikasi difenilkarbazida serta melakukan uji adsorpsinya terhadap Cr(III) dan Cr(VI). Kemampuan adsorpsi silika gel tanpa modifikasi dan silika gel termodifikasi difenilkarbazida dalam menghilangkan Cr(III) secara berturut-turut sebesar 1,95% dan 25,78%, sedangkan dalam menghilangkan Cr(VI) secara berturut-turut adalah 13,92% dan 23,39%. Hasil penelitiannya ini juga menunjukkan peningkatan kemampuan adsorpsi untuk Cr(III) dan Cr(VI) pada silika gel termodifikasi difenilkarbazida bila dibandingkan dengan silika gel tanpa modifikasi. Kemampuan proses adsorpsi menurut Bernasconi (1995) dapat dipengaruhi oleh beberapa faktor, diantaranya
adalah pengaruh konsentrasi, pH, waktu kontak dan luas permukaan. Dengan demikian penelitian ini akan mempelajarikarakteristik adsorben, kondisi optimum dan isoterm adsorpsi logam Cr(VI) dengan silika gel termodifikasi difenilkarbazida.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain : silika gel termodifikasi difenilkarbazida (Si-DPZida), K2Cr2O7, H2C2O4, HCl, NaOH, phenolptalein (pp), metilen biru, HNO3, akuades, aluminium foil, dan kertas saring.
Peralatan
Alat-alat yang digunakan dalam penelitian ini antara lain : pipet ukur, pipet volume, labu ukur, gelas ukur, gelas beker, erlenmeyer, corong, buret, pengaduk magnetik, statif, klem, stirrer, pipet tetes, batang pengaduk, botol vial, pH-meter, timbangan analitik, desikator, alat pencatat waktu dan bola hisap. Peralatan instrumen yang digunakan adalah Atomic Absorption Spektrofotometer (AAS) (AA 7000 Shimadzu) dan Spektrofotometer UV-Vis (Jenway 6105 U.V׀Vis Spektrofotometer)..
Cara Kerja
Penentuan Keasaman Permukaan Adsorben
Sebanyak 0,1 g adsorben Si-DPZida yang sudah kering dimasukkan ke dalam 2 erlenmeyer 50 mL yang berbeda kemudian masing-masing ditambahkan 10,0 mL NaOH 0,1 M, selanjutnya erlenmeyer ditutup rapat dan diaduk selama 1 jam pada temperatur kamar. Perlakuan yang sama juga dilakukan pada larutan blanko yang hanya mengandung 10,0 mL larutan NaOH 0,1 M. Setelah 1 jam larutan disaring menggunakan kertas saring dan residunya dibilas dengan menggunakan aquades. Filtrat ditambahkan 2 tetes indikator pp lalu dititrasi dengan larutan HCl 0,1M yang sudah dibakukan (dalam Widihati, 2010)
Penentuan Luas Permukaan Adsorben dengan Metode Metilen Biru
Sebanyak 0,1 g adsorben Si-DPZida yang sudah keringdimasukkan ke dalam 7 erlenmeyer 50 mL yang berbeda kemudian masing-masing
ditambahkan 20,0 mL larutan metilen biru 50 ppm, lalu diaduk dengan pengaduk magnet dengan waktu kontak yang bervariasi, yaitu 5, 10, 15, 20, 30, 40, dan 50menit. Larutan hasil pengocokan disaring dan filtratnya dianalisis menggunakan spektrofotometer UV-Vis (dalam Widihati, 2010) Penentuan pH Optimum Adsorpsi Cr(VI)
Ke dalam 7 buah erlenmeyer 50 mL, dimasukkan masing-masing 0,1 g adsorben Si-DPZida yang sudah kering lalu ditambahkan 20,0 mL larutan Cr(VI) 200 ppm dengan pH larutan masing-masing 1, 2, 3, 4, 5, 6 dan 7. Penentapan pH dilakukan dengan penambahan NaOH dan HNO3 dengan penambahan buffer untuk mempertahankan pH. Campuran kemudian diaduk dengan pengaduk magnet selama 1 jam. Selanjutnya, campuran disaring dan filtratnya diambil untuk analisis Cr(VI) yang tersisa dengan menggunakan spektrofotometer serapan atom (Mahmoud, 2007).
Penentuan Waktu Optimum Adsorpsi Cr(VI)
Ke dalam 8 buah erlenmeyer 50 mL dimasukkan masing-masing 0,1 g Si-DPZida yang sudah kering dan ditambahkan masing-masing 20,0 mL larutan Cr(VI) dengan konsentrasi 200 ppm dan pH optimum yang diperoleh campuran diaduk dengan pengaduk magnet selama masing-masing 5, 10, 15, 20, 30, 40, 50, dan 60 menit. Selanjutnya, campuran disaring dan filtratnya diambil untuk dianalisis. Konsentrasi Cr(VI) dalam larutan ditentukan dengan mengukur absorbansi filtrat dengan menggunakan spektrofotometer serapan atom (Mahmoud, 2007). Penentuan Isoterm Adsorpsi
Ke dalam 13 buah erlenmeyer 50 mL dimasukkan masing-masing 0,1 g Si-PDZida yang sudah kering dan ditambahkan 20,0 mL larutan Cr(VI) dengan konsentrasi berturut-turut 300, 400, 500, 750, 1000, 1200, 1400, 1500, 1700, 2000, 2500, 3000, dan 5000ppm. Kemudian campuran
diinteraksikan selama waktu kontak dan pH optimumnya pada temperatur kamar. Selanjutnya, campuran disaring dan filtratnya diukur dengan spektrofotometer serapan atom.
Nilai absorbansi yang diperoleh dimasukkan ke dalam persamaan regresi linier Cr(VI) sehingga konsentrasi Cr(VI) yang tersisa dalam filtrat dapat diketahui. Data pola isoterm adsorpsi diterapkan ke dalam persamaan isoterm adsorpsi Langmuir dan Freundlich’s (Kriswiyanti dan Danarto, 2007).
HASIL DAN PEMBAHASAN
Sebelum menentukan kondisi optimum adsorpsi pada adsorben silika gel termodifikasi difenilkarbazida, terlebih dahulu ditentukan keasaman permukaan dan luas permukaan adsorben guna untuk mengetahui karakteristik dari adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida).
Keasaman Permukaan Adsorben
Penentuan keasaman permukaan adsorben silika gel termodifikasi ligan difenilkarbazida (Si-DPZida) dilakukan secara kuantitatif dengan metode titrimetri (titrasi asam – basa). Keasaman permukaan adsorben silika gel termodifikasi ligan ditentukan untuk mengetahui jumlah mmol situs asam yang terikat pada adsorben setiap gramnya. Adsorben silika gel termodifikasi ligan direaksikan dengan NaOH berlebih dan sisa OH- yang tidak bereaksi diketahui melalui titrasi dengan HCl. Hasil penelitian menunjukkan bahwa keasaman permukaan adsorben silika gel termodifikasi difenilkarbazida sebesar 1,5996 ± 0,0061 (mmol/gram) dan jumlah situs aktif sebesar 9,6328 . 1020 (atom/gram).
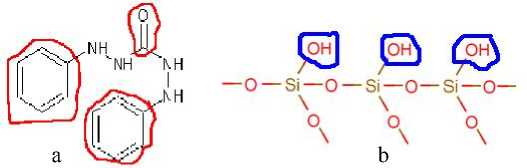
Gambar 1. a. Situs aktif pada ligan difenilkarbazid (Cotton dan Wilkinson, 1989) b. Situs aktif pada silika gel(Kaim dan Schwederski, 1994)
Bernasconi (1995) menyatakan bahwa keasaman permukaan adsorben silika gel termodifikasi ligan difenilkarbazida (Si-DPZida) disebabkan karena adanya situs aktif yaitu gugus silanol (-OH) pada silika gel dan cincin aromatik serta karbonil (C=O) pada ligan difenilkarbazida (Si-DPZida) seperti pada Gambar 1.
Luas Permukaan Adsorben dengan Metode Metilen Biru
Luas permukaan adsorben merupakan salah satu karakter fisik yang memiliki peranan penting dalam proses adsorpsi karena banyaknya jumlah zat tiap gramnya yang teradsorpsi selain tergantung pada situs aktif juga ditentukan oleh luas permukaan adsorben yang telah aktif. Pada penelitian ini, luas permukaan ditentukan dengan metode metilen biru, dimana daya penyerapan metilen biru sebanding dengan luas permukaan adsorben. Hasil perhitungan luas permukaan adsorben silika gel termodifikasi ligan difenilkarbazida (Si-DPZida) ditunjukkan pada Tabel 1.
Tabel 1. Luas Permukaan Adsorben Silika Gel
Termodifikasi Ligan difenilkarbazida
|
T (menit) |
Adsorben Si-DPZida | |
|
Wads(mg/g) |
S (m2/g) | |
|
5 |
1,1990 |
4,4479 |
|
10 |
1,0831 |
4,0179 |
|
15 |
1,2046 |
4,4686 |
|
20 |
1,2364 |
4,5866 |
|
30 |
1,2104 |
4,4902 |
|
40 |
1,2385 |
4,5944 |
|
50 |
1,2322 |
4,5710 |
|
Rata |
– rata |
4,4538 |
Berdasarkan Tabel 1, luas permukaan adsorben silika gel termodifikasi ligan difenilkarbazida (Si-DPZida) sebesar 4,4538m2/g. Hal ini dapat terjadi karena ukuran molekul dari ligan difenilkarbazida yang menempel pada pori – pori silika gel, ukuran molekul yang terikat pada adsorben berbanding terbalik dengan luas permukaan adsorben. Semakin kecil ukuran molekul maka luas permukaan pada adsorben semakin besar begitu pula sebaliknya (Subroto, 2007).
pH Optimum Adsorpsi Cr(VI)
Penentuan pH optimum pada adsorpsi Cr(VI) menggunakan adsorben silika gel termodifikasi ligan difenilkarbazida (Si-DPZida) dilakukan pada variasi pH 1, 2, 3, 4, 5, 6 dan 7. Penentuan pH optimum ini bertujuan untuk mengetahui pH larutan dimana Cr(VI) dapat teradsorpsi secara maksimal oleh adsorben silika gel termodifikasi ligan difenilkarbazida (Si-DPZida). Hasil penelitian menunjukkan bahwa hubungan antara pH larutan terhadap jumlahCr(VI) yang teradsorpsi dapat dilihat pada Gambar 2.
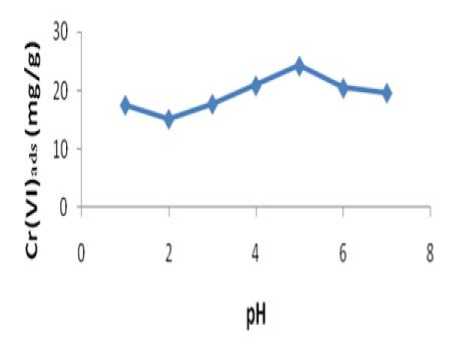
Gambar 2. Pengaruh pH dengan jumlah Cr(VI) yang terserap pada adsorben Si-DPZida
Berdasarkan Gambar 2 terlihat bahwa pH 5 merupakan pH optimum adsorpsi antara Cr(VI) dengan adsorben silika gel termodifikasi difenilkarbazida. Pada pH 1-4 jumlah Cr(VI) yang terserap adsorben lebih sedikit, demikian pula pada pH > 5 jumlah Cr(VI) yang terserap cenderung menurun. Hal ini dipengaruhi oleh perbedaan spesiasi Cr(VI) dalam larutan karena pengaruh pH (Cotton dan Wilkinson, 1989).
Spesiasi Cr(VI) tergantung pada keseimbangan dalam larutannya. Perubahan pH menyebabkan keseimbangan pada larutan juga berubah. Spesies utama akuatik Cr(VI) adalah HCrO4-, CrO42-, dan Cr2O72-. Pada pH 2-6 spesies yang utama adalah ion Cr2O72-. Pada pH 1 spesies yang dominan pada larutan adalah ion HCrO4-. Pada pH > 6 spesies CrO42-yang lebih dominan (Cotton dan Wilkinson, 1989). Berdasarkan spesiasi tersebut dapat dijelaskan bahwa setelah
tercapai pH optimum jumlah Cr(VI) yang terserap lebih rendah karena spesies Cr2O72-berubah menjadiCrO42-.
Waktu Kontak Optimum Adsorpsi Cr(VI)
Waktu kontak optimum pada proses adsorpsi Cr(VI) oleh adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) ditentukan pada kondisi pH 5 dengan variasi waktu kontak yaitu 5, 10, 15, 20, 30, 40, 50 dan 60 menit. Penentuan waktu kontak optimum ini bertujuan untuk menentukan waktu Cr(VI) teradsorpsi secara maksimal oleh adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida). Waktu kontak optimum adsorben Si-DPZida dapat diketahui dengan membuat grafik antara banyaknya Cr(VI) yang teradsorpsi (mg/g) terhadap waktu interaksi. Waktu kontak optimum adsorpsi tercapai ketika terjadi keseimbangan antara fasa permukaan (adsorbat yang diserap oleh adsorben) dengan fasa ruah (adsorbat yang tersisa dalam larutan) (Khan, 1980). Pada kondisi ini jumlah adsorbat yang teradsorpsi oleh adsorben relatif tetap terhadap waktu kontak. Hubungan antara waktu kontak dengan jumlahCr(VI) yang teradsorpsi dapat dilihat pada Gambar 3.
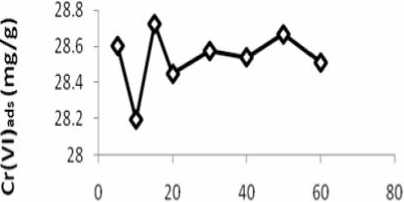
waktu (menit)
Gambar 3. Pengaruh waktu terhadap jumlah Cr(VI) yang terserap pada adsorben Si-DPZida
Gambar 4 menunjukkan terjadnya peningkatan jumlah Cr(VI) yang terserap seiring dengan variasi konsentrasi Cr(VI) dari 300-1700 ppm pada adsorben silika gel termodifikasi difnilkarbazida (Si-DPZida), kemudian setelah konsentrasi 1700 ppm mengalami penurunan
sampai konsentrasi 5000 ppm. Semakin besar konsentrasi ion Cr2O72-yang terlarut dalam larutan maka semakin banyak jumlah konsentrasi ion Cr2O72-yang teradsorpsi pada permukaan adsorben tetapi akan menurun apabila telah mencapai kesetimbangan. Hal ini disebabkan karena adanya interaksi antara permukaan adsorben dengan adsorbat semakin besar akibat kelimpahan ion Cr2O72-pada larutan, sehingga apabila belum mencapai setimbang konsentrasi ion Cr2O72-yang terlarut dalam larutan semakin banyak maka gaya tarik menarik antar ion Cr2O72-dengan permukaan adsorben juga semakin besar tetapi akan munurun setelah tercapainya kesetimbangan. Jumlah Cr(VI) yang terserap pada adsorben silika gel termodifikasi difenilkarazida (Si-DPZida) dengan waktu optimum 15 menit adalah sebesar 126,5089 mg/g.
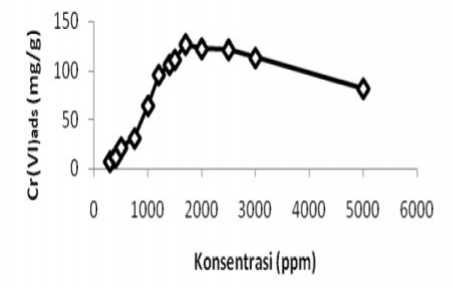
Gambar 4. Jumlah Cr(VI) yang terserap (mg/g) terhadap variasi konsentrasi Cr(VI) pada adsorben Si-DPZida (mg/L)
Persamaan Isoterm Adsorpsi
Jenis adsorpsi yang terjadi pada adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) terhadap ion Cr(VI) dapat diketahui dengan menguji persamaan regresi linier isotermis adsorpsi Langmuir dan persamaan isotermis Freundlich. Isotermis adsorpsi Langmuir memiliki asumsi bahwa adsorben mempunyai permukaan yang homogen. Setiap molekul adsorben hanya dapat mengadsorpsi satu molekul adsorbat (monolayer). Dan teori isotermis adsorpsi Langmuir ini juga berlaku untuk adsorpsi kimia yaitu membentuk lapisan monolayer (P´erez-
Mar´ın, 2007). Asumsi Isotermis adsorpsi Freundlich adalah adsorben mempunyai permukaan yang heterogen. Setiap molekul adsorben mempunyai potensi penyerapan yang berbeda-beda (multilayer). Teori isotermis adsorpsi Freundlich ini berlaku untuk adsorpsi fisika yaitu membentuk lapisan multilayer (Kriswiyanti dan Danarto, 2007).
Persamaan isoterm adsorpsi Langmuir dan Freundlich dapat diketahui dengan cara melihat nilai R2. Isoterm adsorpsi Cr(VI) pada adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) mengikuti persamaan yang mempunyai nilai R2mendekati 1(Kriswiyanti dan Danarto, 2007). Hasil perbandingan nilai R2dari persamaan isoterm adsorpsi Langmuir dan Freundlich dapat dilihat pada Tabel 2.
Tabel 2. Perbandingan nilai R2dari persamaan isoterm adsorpsi Langmuir dan Freundlich
Adsorben Langmuir Freundlich
Si-DPZida 0,371 0,5843
Tabel 2 menunjukkan bahwa nilai R2 dari Persamaan Isoterm Freundlich lebih besar dibandingkan nilai R2 dari Persamaan Isoterm Langmuir. Hal ini menunjukkan bahwa adsorpsi Cr(VI) pada adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) mengikuti persamaan Isoterm Freundlich. Hal ini disebabkan karena proses adsorpsi terjadi secara fisika.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian, maka dapat disimpulkan bahwaadsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) memiliki keasaman permukaan (Kal) sebesar 1,5996 mmol/g dan jumlah situs aktif sebesar 9,6328 . 1020 atom/g. Nilai luas permukaan spesifik adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) sebesar 4,4538 m2/g. Kondisi optimum adsorpsi logam Cr(VI) oleh adsorben silika gel termodifikasi dan difenilkarbazida (Si-DPZida) diperoleh pada pH 5 dan waktu interaksi 15 menit. Pola isoterm
adsorpsi logam Cr(VI) oleh adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) cenderung mengikuti pola isoterm Freundlich dibandingkan pola isoterm Langmuir.Nilai R2 pada persamaan isoterm adsorpsi Freundlich pada adsorben silika gel termodifikasi difenilkarbazida (Si-DPZida) sebesar 0,5843.
Saran
Penelitian lebih lanjut terhadap adsorben silika gel termodifikasi difenilkarbazon (SiDPZon) dan difenilkarbazida (Si-DPZida) dengan menggunakan logam lain.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Bapak dan Ibu penguji Drs. I Gusti Agung Gede Bawa, M.Si., James Sibarani, S.Si., M.Si., Ph.D., dan Ir. I G. A. Kunti Sri Panca Dewi, M.Si. atas saran dan masukannya.
DAFTAR PUSTAKA
Anderson, R.A., 1997, Chromium as an Essential Nutrient for Human, Reg. Toxico. Pharmacol., 26 : 534-541
Atkins, P. W., 1999, Kimia Fisika Jilid 2; a.b. Dr. Irma I. Kartohadiprojo, Erlangga, Jakarta, h. 302-313
Bernasconi, G., H. Gerster, H. Hauser, H. Stauble, dan E. Schneiter, 1995, Teknologi Kimia Bagian 2, a.b. Lienda Handojo, Pradnya Paramita, Jakarta
Cotton dan Wilkinson, 1989, Kimia Anorganik Dasar, a.b. Suharto, Sahati, UI-Press, Jakarta
Effendi, H., 2003, Telaah Kualitas Air : BagiPengelolaan Sumber Daya dan LingkunganPerairan IPB, Kanisius, Bogor
Endawati., 2008, Kapasitas Adsorpsi Kitosan dan Nanomagnetik Kitosan terhadap Ion Ni(II), Prosiding, Seminar Nasional Sains dan Teknologi Universitas Lampung, Lampung
Kaim. W. and Schwederski, B., 1994, Bioinorganic Chemistry : Inorganic
Elements in The Chemistry of Life, Jhon Wiley, New York
Khan, S.U., 1980, Pesticides in The Soil Environment, Elseveir Scientific
Publishing Company, New York
Kriswiyanti, Enny A., dan Danarto, Y.C., 2007, Model Kesetimbangan Adsorpsi Cr Dengan Rumput Laut, Jurusan Teknik Kimia Fakultas Teknik UNS,Ekuilibrium, 6 (2) : 47-52
Lestari, Sri., 2010, Pengaruh Berat dan Waktu Kontak Untuk Adsorpsi Pb(II) Oleh Adsorben dari Kulit Batang Jambu Biji (Psidium guajava L), Jurnal Kimia Mulawarman, VIII (1) :
Mandala, G. A., 2012, Sintesis Silika Gel dari Abu Sekam Padi Termodifikasi Difenilkarbazida dan Uji Adsorpsinya terhadap Ion Logam Cr(III) dan Cr(VI), Skripsi, Jurusan Kimia FMIPA, Universitas Udayana, Bali
Mahmoud, M. and Al-Saadi, M.S.M., 2007, Silica Physical Adsorbed-diphenilkarbazone as a Selective Solid Phase Extractor and Pre-concentratir for Chromium (III) and Iron(III), J Saudi chem., Soc., 11 (2) : 331340
Oscik, J. dan Cooper, L., 1982, Adsorptions, Ellis Horwoo Limited John Wiley and Sons, New York
P´erez-Mar´ın, V., Meseguer Zapata , J.F., Ortu˜no, M. Aguilar, J. S´aez, dan M. Llor´ens, 2007, Removal of Cadmium from Aqueous Solutions by Adsorption Onto Orange Waste, Journal of Hazardous Materials B1, 39 (2007) : 122–131
Sharma, Y.C. dan Weng, C.H., 2007, Removal of Chromium(VI) from Aqueous Solution by Activated Carbons: Kinetic and Equilibrium Studies, Journal of Hazardous Materials, 142 : 449–454
Subroto, T., 2007, Produksi Biomaterial, PT. Pribumi Mekar, Bandung
Widihati, I. G. A., Ratnayanai, O.., dan Angelina, Y., 2010, Karakterisasi Keasaman dan Luas Permukaan Tempurung kelapa Hijau (Cocos nucifera) dan pemanfaatannya sebagai Biosorben Ion Cd2+, Jurnal Kimia, 4 (1) : 7-14
Yu, L.J., Sukhla, S.S., Dorris, K.L., Sukhla, A.J.L., 2003, Adsorption of Chromium From Aqueous Solution by Maple Swadust, J. Hazard Mater, 100, 53-63
204
Discussion and feedback