PENGGUNAAN KITOSAN DARI LIMBAH KULIT UDANG SEBAGAI INHIBITOR KEASAMAN TUAK
on
ISSN 1907-9850
PENGGUNAAN KITOSAN DARI LIMBAH KULIT UDANG SEBAGAI INHIBITOR KEASAMAN TUAK
Fikriatun Nurhikmawati, Manuntun Manurung, dan A. A. I. A. Mayun Laksmiwati
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
*email : fikrienh@gmail.com
ABSTRAK
Telah dilakukan penelitian untuk mengetahui kemampuan kitosan dari limbah kulit udang sebagai inhibitor keasaman tuak. Isolasi kitin dilakukan melalui tiga tahapan yaitu deproteinasi, demineralisasi, dan depigmentasi. Sedangkan proses deasetilasi untuk mengubah kitin menjadi kitosan dengan larutan NaOH 50% (b/v) rasio 1:10 pemanasan hingga 90oC selama 120 menit, didapatkan kitin sebanyak 15,33 g dan rendemen kitin sebesar 15,33%, kemudian kitosan yang diperoleh sebanyak 9,94 g dan hasil rendemen kitosan sebesar 9,94% dengan derajat deasetilasi sebesar 69,87%. Konsentrasi optimum kitosan untuk menghambat perubahan pH tuak diperoleh pada konsentrasi 2% (b/v) sehingga memberikan masa simpan tuak lebih lama dengan nilai persentase keasaman tuak (pH) terendah.
Kata kunci : kulit udang, kitin, kitosan, derajat deasetilasi, tuak, pH
ABSTRACT
The research has been conducted to determine the ability of chitosan from shrimp shell as an inhibitor of tuak acidity. Isolation of chitin is done through three stages, namely deproteination, demineralization, and depigmentation. The deacetylation process of chitin into chitosan was accomplished with 50% (w/v) NaOH with a ratio of 1:10 at 90oC for 120 minutes. 15.33 g chitin was gained (15.33%), and 9.94 g chitosan or 9.94% were obtained with a degree of deacetylation of 69.87%. The optimum concentration of kitosan to inhibit tuak pH changes was 2% (w/v) thus providing a longer shelf life with lowest acidity (pH).
Keywords : shrimp shell, kitin, kitosan, degree of deacetylation, tuak, pH
PENDAHULUAN
Bahan pengawet adalah senyawa yang mampu menghambat dan menghentikan proses fermentasi, pengasaman atau bentuk kerusakan lainnya. Atau dapat juga sebagai bahan yang dapat memberikan perlindungan bahan pangan dari pembusukan. Menurut peraturan Meneteri Kesehatan Republik Indonesia Nomor 722/Menkes/Per/IX/1988 tentang bahan tambahan pangan yang mencegah atau menghambat fermentasi, pengasaman atau penguraian lain terhadap pangan yang disebabkan oleh mikroorganisme (Peleza, et.al., 1988).
Kulit udang merupakan salah satu sumber yang potensial untuk digunakan dalam pembuatan kitin dan kitosan, yaitu suatu biopolimer yang secara komersil berpotensi di bidang industri. Kulit udang mengandung protein 25-40%, kalsium karbonat 40-50%, dan kitin 20-36,61%, tetapi besarnya kandungan komponen tersebut tergantung jenis udang dan tempat hidupnya. Secara kimiawi kitin merupakan polimer β-(1,4)-2-asetamida-2-dioksi-D-glukosa yang tidak dapat dicerna oleh mamalia. Kitin tidak larut dalam air sehingga penggunaannya terbatas. Namun dengan menghidrolisis kitin dengan menggunakan basa kuat (proses deasetilasi) menjadi kitosan β-(1,4)-2-
amino-2-dioksi-D-glukosa akan mempunyai sifat kimia yang lebih baik (Srijiantodan Imam, 2005).
Kitosan merupakan produk alamiah yang merupakan turunan dari polisakarida kitin. Kitosan mempunyai nama kimia poli D-glukosamin( β (14) 2-amino-2-deoksi-D-glukosa), bentuk kitosan padatan amorf bewarna putih dengan struktur kristal tetap dari bentuk awal kitin murni. Bila kitosan disimpan lama dalam keadaan terbuka (terjadi kontak dengan udara) maka akan terjadi dekomposisi, warnanya menjadi kekuningan dan viskositas larutan menjadi berkurang (Krissetiana, 2004).
Kitosan dapat dimanfaatkan di berbagai bidang biokimia, obat-obatan atau farmakologi, pangan dan gizi, pertanian, mikrobiologi, penanganan air limbah, industri-industri kertas, tekstil membran atau film, kosmetik danlain sebagainya (Suhardi, 1992). Dalam cangkang udang, kitin terdapat sebagai mukopoli sakarida yang berikatan dengan garam-garam anorganik, terutama kalsium karbonat (CaCO3), protein dan lipida termasuk pigmen-pigmen. Oleh karena itu untuk memperoleh kitin dari cangkang udang melibatkan proses-proses pemisahan protein (deproteinasi) dan pemisahan mineral (demineralisasi). Sedangkan untuk mendapatkan kitosan dilanjutkan dengan proses deasetilasi (Krissetiana, 2004).
Reaksi pembentukan kitosan dari kitin merupakan reaksi hidrolisa suatu amida oleh suatu basa. Kitinbertindak sebagai amida dan NaOH sebagai basanya. Mula-mula terjadi reaksi adisi, dimana gugus OH- masuk ke dalam gugus NHCOCH3 kemudian terjadi eliminasi gugus CH3COO- sehingga dihasilkan suatu amida yaitu kitosan.
Reaksi Pembentukan Kitosan dari Kitin :
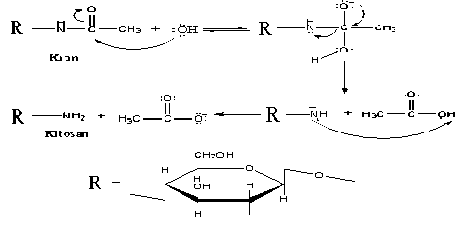
Kitosan sangat berpotensi untuk dijadikan sebagai bahan antimikroba, karena mengandung enzim lysosimdan gugus aminopolysacharida yang dapat menghambat pertumbuhan mikroba dan efisiensi daya hambat kitosanterhadap bakteri tergantung dari konsentrasi pelarutan kitosan. Kemampuan dalam menekan pertumbuhan bakteri disebabkan kitosan memiliki polikation bermuatan positif yang mampu menghambat pertumbuhan bakteri dan kapang (Tanbury, et al, 1984).
Kerusakan bahan pangan dapat diidentifikasi dengan beberapa cara, yang pertama adalah dengan Ujiorganoleptik yaitu dengan melihat tanda-tanda kerusakan seperti perubahan tekstur atau kekenyalan, keketanlan, warna bau, pembentukkan lendir, dan lain-lain. Uji fisik untuk melihat perubahan-perubahan fisik yang terjadikarena kerusakan oleh mikroba maupun oleh reaksi kimia, misalnya perubahan pH, kekentalan, tekstur, dan lain-lain (Sugiyono, 2002).
Pada penelitian ini kami mencoba mengaplikasikan kitosan sebagai bahan penghambat keasaman tuak. Tuak merupakan minuman tradisional, dimana cara pembuatannya dengan cara menyadap tandan bunga enau atau aren yang baru mekar (Ikegami,1997). Nira segar mempunyai rasa manis, berbau harum, tidak berwarna, dengan pH antara 5,5-6,5. Rasa manis pada nira disebabkan adanya gula (sukrosa, glukosa, fruktosa, dan maltosa). Selain gula, nira mengandung bahan lain seperti protein, lemak, air, pati dan abu serta asam-asam organik (sitrat, malat, suksinat, laktat, fumarat) yang berperan dalam pembentukan cita rasa gula merah yang spesifik (Judoamidjojo, 1985). Komposisi nira secara umum terdiri dari : air (80 - 90%), sukrosa (12,30-17,40%), gula reduksi (0,5-1%) dan bahan lainnya (1,5-7%).
Dengan komposisi tersebut, nira merupakan media yang baik untuk pertumbuhan mikroorganisme seperti bakteri, jamur dan ragi. Kehadiran mikroorganisme dapat mengakibatkan kerusakan nira yang ditandai dengan terbentuknya lendir menjadi keruh, suram, berwarna hijau, berbuih putih dan rasa asam (Gautara dan Soesarsono, 1981). Untuk mencegah terjadinya kerusakan nira, dilakukan berbagai cara melalui penambahan bahan pengawet nabati karena nira yang telah rusak kurang baik jika digunakan untuk membuat produk turunannya.
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah kulit udang, asam klorida pekat (HCl 37%), natrium hidroksida (NaOH), natrium hipoklorit (NaOCl), H2SO4, KI-I2, tuak aren, akuades, phenolftalein (pp), asam oksalat.
Peralatan
Ayakan (ukuran 0,25 mm), oven, neraca analitik, corong, dan kertas saring, termometer, gelas beker, erlenmeyer, pipet volume, labu ukur, seperangkat alat titrasi, spektrofotometer infra merah Prestige-21 Shimadzu.
Cara Kerja
Preparasi sampel
Kulit udang sebanyak ± 1 kg dicuci agar kotoran yang melekat hilang, lalu dikeringkan di bawah sinar matahari ± 2 hari. Setelah kering, kulit udang digiling dan diayak menggunakan ayakan 0,25 mm sehingga diperoleh serbuk kulit udang dengan ukuran partikel lebih kecil dari 0,25 mm. Hasil ayakan digunakan sebagai sampel.
Pembuatan serbuk kitin
Deproteinasi
Serbuk kulit udang dicampur dengan larutan NaOH 4% dengan rasio 1:10 (gr /mL). Dipanaskan pada suhu 700C selama 2 jam sambil dilakukan pengadukan, selanjutnya disaring dan dibilas dengan akuades sampai pH netral. Padatan yang terbentuk didinginkan dan dikeringkan pada suhu 800C di dalam oven selama ± 6 jam setelah itu ditimbang hingga berat konstan. Filtrat dan padatan diuji dengan pereaksi biuret untuk mengetahui protein yang terkandung. Bila pada filtrat muncul warna biru sedangkan padatan tidak muncul, maka proses deproteinasi dinyatakan berhasil.
Demineralisasi
Serbuk bebas protein dicampur dengan larutan HCl 1,5 M dengan rasio 1:15 (g/mL). Campuran diaduk selama 1 jam tanpa pemanasan kemudian disaring dan dibilas dengan akuades sampai pH netral. Identifikasi sisa ion Cl-dapat diuji dengan larutan AgNO3 bila tidak terbentuk endapan putih maka ion Cl- sudah hilang (Weska et al., 2006). Padatan dikeringkan di dalam oven
pada suhu 700C selama ± 6 jam setelah itu ditimbang hingga berat konstan.
Depigmentasi
Serbuk bebas mineral dicampurkan dengan larutan NaOCl 4% dengan rasio 1:10 (g/mL). Campuran diaduk selama 1 jam tanpa mengalami pemanasan setelah itu disaring dan dibilas dengan akuades hingga pH netral. Padatan dikeringkan pada suhu 70oC selama ± 6 jam setelah itu ditimbang hingga berat konstan sehingga diperoleh sampel berupa serbuk udang (Hang K. No et al, 1989). Serbuk yang diperoleh dari hasil depigmentasi berupa padatan kering yaitu serbuk kitin halus.
Karekterisasi kitin
Kitin yang diperoleh kemudian dikarakterisasi dengan reaksi warna Van Wesslink, dengan cara mereaksikan serbuk kering hasil depigmentasi dengan garam iodine (KI-I2) 1%, bila positif mengandung kitin akan memberikan warna coklat, kemudian ditambahkan H2SO4 1 M akan berubah warnanya menjadi violet. Karekterisasi kitin kemudian berlanjut dengan menggunakan spektrofotometer inframerah.
Deasetilasi kitin menjadi kitosan
Serbuk kitin kering dicampurkan dengan larutan NaOH 50% dengan rasio 1:10 (g/mL). Campuran dipanaskan pada suhu 90oC selama 2 jam kemudian disaring dan dibilas dengan akuades. Padatan dituangkan di atas cawan porselen dan dikeringkan di dalam oven pada suhu 800C selama ± 6 jam setelah itu ditimbang hingga berat konstan.
Karakterisasi kitosan
Kitosan kemudian dikarakterisasi dengan spektrofotometer inframerah, kemudian untuk penentuan derajat deasetilasinya dapat ditentukan dengan mensubsitusikan nilai absorbansi pita amida dan hidroksil pada persamaan berikut : (Tamveer et.al, 2002).
DD = 100 – [{(A1654,6/A3341,2) x 100} / 1,33]
Keterangan:
DD : derajat deasetilasi
A1654,6 : absorbansi pita amida
A3341,2 : absorbansi pita hidroksil
1,33 : nilai perbandingan A1654,6/A3341,2 yang
sempurna terdeasetilasi
Uji kemampuan kitosan sebagai daya hambat keasamn tuak dengan variabel waktu dan konsentrasi kitosan
Pengaruh konsentrasi kitosan terhadap tingkat keasaman tuak
Kedalam 5 erlenmeyer dituangkan masing-masing larutan tuak sebanyak 100 mL, kemudian pada masing-masing erlenmeyer ditambahkan kitosan sebanyak 0,25; 0,5; 1; 1,5 dan 2 g. Sehingga konsentrasi kitosan dari masing-masing penambahan berat kitosan menjadi 0,25; 0,5; 1; 1,5; dan 2,0% (b/v) terhadap larutan tuak. Campuran tersebut didiamkan selama 2 hari yang kemudian dilakukan perlakuan dengan titrasi asam basa. Hal yang sama juga dilakukan pada larutan tuak tanpa kitosan (blanko).
Pengaruh waktu terhadap tingkat keasaman tuak
Campuran pada konsentrasi yang berbeda-beda tersebut masing-masing sebanyak 100 mL dalam Erlenmeyer disimpan selama 7 hari. Setiap harinya dilakukan pengukuran kadar asam dengan cara titrasi asam basa. Masing-masing campuran tuak diambil 10 mL, dimasukkan kedalam erlenmeyer kemudian dititrasi dengan NaOH 0,2 N sampai terjadi perubahan warna dari takberwarna menjadi merah muda dengan indikator pp dan pada masing-masing sampel juga di ukur nilai keasamannya dengan pH meter.
HASIL DAN PEMBAHASAN
Isolasi kitin
Deproteinasi
Hasil yang diperoleh dalam proses ini adalah serbuk kulit udang bebas protein sebanyak 68,0540 g atau rendemen sebesar 68,05%. Keberhasilan proses deproteinasi dipastikan dengan pendeteksi Biuret terhadap filtrat dan residu (kitin). Hasil menunjukkan warna biru keunguan terhadap filtrat yang positif mengandung protein sedangkan residu tidak mengalami perubahan warna berarti reaksi negatif yang artinya residu telah bebas protein.
Demineralisasi
Ekstrak kulit udang sebanyak 68,05 g yang telah dideproteinasi direaksikan dengan asam klorida (HCl) 1,5 M sebanyak 1020 mL pada suhu kamar sambil dilakukan pengadukan (Weska et.al,
2006). Hasil yang diperoleh pada perlakuan ini adalah ekstrak kulit udang yang telah kehilangan mineral seperti kalsium fosfat [Ca3(PO4)2] dan kalsium karbonat (CaCO3). Reaksi penghilangan mineral diperkirakan sebagai berikut:
Ca3(PO4)2(s) + 6HCl(aq) → 3CaCl2(aq) + 2H3PO4(aq)
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
Residu yang diperoleh dari hasil ini adalah kitin berwarna cokelat muda sebanyak 30,4330 g dan rendemen sebesar 44,71% (dibandingkan terhadap hasil ekstrak bebas protein). Proses demineralisasi diyakini berhasil ketika penetesan larutan AgNO3 pada setiap pembilasan residu kitin tidak terbentuk lagi endapan putih. Berikut ini adalah reaksi pembentukan endapan putih tersebut:
AgNO3(aq) + HCl(aq) → AgCl(S) ↓ (putih) + HNO3(aq)
Residu kitin yang diperoleh dikeringkan dalam oven pada suhu 700C hingga beratnya konstan. Hasil yang didapat berupa serbuk berwarna coklat.
Depigmentasi
Sebanyak 30,4330 g serbuk kitin direaksikan dengan larutan natrium hipoklorit (NaOCl) 4 % (b/v) sebanyak 304 mL pada suhu kamar sambil dilakukan pengadukan (Weska, et al, 2006). Pada tahap ini kitin mengalami perubahan warna menjadi putih bersih. Hal ini dapat terjadi karena NaOCl merupakan oksidator kuat yang mampu mengoksidasi warna pigmen dari kulit udang. Berat kitin yang diperoleh pada tahap ini adalah sebesar 15,3330 g dengan persentase hasil sebesar 50,38% rendemen kitin.
Karakterisasi kitin
Secara kualitatif hasil deteksi kitin dengan pereaksi Van Wesslink yang terdiri dari KI-I2 1% dan H2SO4 1 M. Hasil yang bisa diamati dari pereaksi ini adalah timbulnya warna merah kecoklatan saat direaksikan dengan KI-I2 kemudian saat ditambahkan dengan H2SO4 terjadi reaksi perubahan warna menjadi violet. Reaksi tersebut menandakan bahwa hasil isolasi adalah benar kitin. Karakterisasi kitin lebih lanjut menggunakan spektrofotometer inframerah (IR) yang menghasilkan serapan gugus fungsi spesifik
|
kitin. Hasil analisa spektra FTIR ditampilkan pada dipanaskan pada suhu 900C selama 2 jam sambil Tabel 1. dilakukan pengadukan . Hasil yang diperoleh pada perlakuan ini adalah serbuk kitosan yang berwarna Tabel 1. Perbandingan Data Serapan Kitin Hasil putih dengan berat 9,9458 g, rendemen 64,70% isolasi dengan Serapan Literatur dan derajat deasetilasi sebesar 69,87%. Hasil Gugus fungsi Bilangan gelombang analisa spektra FTIR ditampilkan pada Tabel 2. (cm-1) Literatur Hasil isolasi Tabel 2. Perbandingan Data Hasil Deasetilasi O-H 3000-3600 3481 dengan Serapan Literatur C=O 1650-1760 1658 Gugus fungsi Bilangan gelombang N-H 1550-1640 1558 (cm-1) C-O-C 1080-1300 1074 Literatur Hasil isolasi C-H stretching 2800-2960 2862 O-H 3000-3600 3479 C-H bending 1350-1470 1425 N-H 1550-1640 1560,4 (sumber : Muzarelli RAA, 1985) C-O-C 1080-1300 1076 C-H stretching 2800-2960 2879,7 Deasetilasi dan karakterisasi kitosan C-H bending 1350-1470 1431 Sebanyak 15,3330 g kitin direaksikan dengan NaOH 50% sebanyak 150 mL dan Tabel 3. Nilai rata-rata konsentrasi dan waktu terhadap keasaman tuak pada nilai volume NaOH 0,2 N (mL) | |||||||
|
Waktu (hari ) |
Konsentrasi (b/v) rata-rata (mL) | ||||||
|
blanko I |
blanko II |
0.25% |
0.5% |
1% |
1.5% |
2% | |
|
1 |
11.7 |
9.35 |
11.3 |
10.1 |
9.05 |
8.75 |
7.45 |
|
2 |
21.75 |
19.6 |
20.8 |
19.1 |
17.7 |
15.1 |
11.8 |
|
3 |
33.35 |
31.1 |
31.35 |
30.2 |
27.45 |
24.15 |
21.45 |
|
4 |
45.1 |
43.8 |
44.05 |
42.5 |
39.85 |
36.2 |
32.9 |
|
5 |
58.8 |
56.55 |
57.15 |
54.8 |
50.4 |
48.1 |
44.1 |
|
6 |
69.1 |
67.8 |
67.4 |
67.9 |
64.6 |
61.9 |
59.05 |
|
7 |
82.6 |
79.8 |
80.1 |
79.4 |
75.1 |
71.2 |
68.85 |
Tabel 4. Perubahan pH rata-rata tuak dari hari ke-0 s/d hari ke-7
|
Konsentrasi (b/v) |
% pH hari ke- | ||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 | |
|
blanko I |
16.4 |
23.43 |
36.71 |
46.09 |
55.46 |
64.51 |
67 |
|
blanko II |
14.84 |
21.87 |
30.46 |
40.31 |
48.43 |
59.37 |
64.06 |
|
0.25% |
15.62 |
25 |
32.81 |
39.84 |
46.09 |
57.03 |
62.5 |
|
0.50% |
13.28 |
21.09 |
27.34 |
37.5 |
46.87 |
53.12 |
58.59 |
|
1% |
10.93 |
19.53 |
25 |
35.15 |
42.96 |
49.21 |
54.68 |
|
1.50% |
7.03 |
13.38 |
22.65 |
28.12 |
36.71 |
43.75 |
49.21 |
|
2% |
3.12 |
7.03 |
14.84 |
21.87 |
25.78 |
38.28 |
42.96 |
Penentuan Daya Hambat Kitosan terhadap Keasaman Tuak dengan variabel waktu dan konsentrasi
Berdasarkan dari hasil percobaan dengan menggunakan variabel waktu dan konsentrasi dari masing-masing larutan tuak sebanyak 100 mL kemudian ditambahkan kitosan secara berturut-turut 0,25; 0,5; 1; 1,5 dan 2 gr, sehingga konsentrasi kitosan dari masing-masing penambahan berat kitosan menjadi 0,25%; 0,5%; 1,0%; 1,5% dan 2,0% (b/v). Hal yang sama juga dilakukan pada larutan tuak tanpa kitosan (blanko I dan blanko II), dimana blanko I dalam keadaan terbuka dan blanko II dalam keadaan tertutup. Analisa dilakukan setelah disimpan selama 2 hari, kemudian dilakukan titrasi dengan larutan NaOH 0.2 N yang kemudian nilai rata-rata dari hasil tersebut ditampilkan pada Tabel 3 dan Tabel 4.
Pada data tersebut untuk setiap konsentrasi kitosan, selama masa penyimpanan tujuh hari, NaOH yang diperlukan untuk netralisasi bertambah. Artinya bahwa tingkat keasaman tuak bertambah setiap hari. Perubahan tingkat keasaman memiliki pola yang sama untuk setiap konsentrasi kitosan. Volume terendah diperoleh untuk kitosan 2% (b/v), hal ini berarti bahwa kitosan mampu menghambat laju keasaman tuak dan yang terbesar pada konsentrasi 2% (b/v).
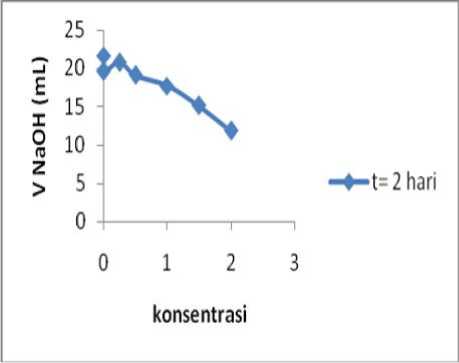
Gambar 1. Hubungan konsentrasi kitosan dengan volume NaOH 0,2 N pada 2 hari penyimpanan
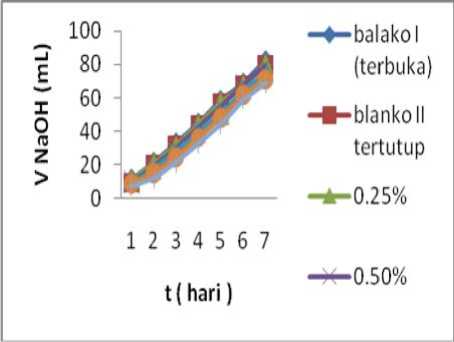
Gambar 2. Hubungan waktu dengan volume
NaOH
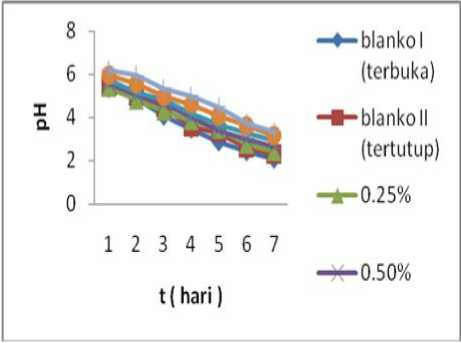
Gambar 3. Hubungan pH terhadap waktu
penyimpan
Berdasarkan tabel di atas nilai pH pada masing-masing konsentrasi kitosan dan blanko mengalami penurunan setiap hari selama tujuh hari pengamatan. Hal tersebut mungkin di akibatkan adanya aktivitas bakteri sehingga proses fermentasi tetap berlangsung, namun semakin besar nilai konsentrasi kitosan semakin baik dalam menghambat proses fermentasi. Menurut Pelezar dan Chan, (1988) kitosan mempunyai sifat sebagai anti bakteri, artinya kitosan mampu menghambat aktivitas bakteri yang tumbuh didalamnya. Adanya aktivitas bakteri pada tuak terbukti pada perubahan sifat kimia pada nira, hal ini dapat dilihat pada reaksi dibawah ini :
C12H22O11 + H2O (glukosa)
♦ C6H12O6 + C6H2O6 (fruktosa)
C6H12O6
Saccharomyces ellipsoideu ---------------► 2C2H5OH + CO2
(etanol)
C2H5OH + O2
acetobacter aceti ---------►
CH3COOH + H2O
(asam asetat)
Reaksi-reaksi tersebut dapat menyebabkan kadar sukrosa menurun dan kadar asam meningkat, sehingga pH cenderung menurun. Penambahan kitosan dalam konsentrasi 2% (b/v) mampu menghambat keasaman tuak dengan nilai persentase lebih kecil.
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian dan pembahasan dapat disimpulkan sebagai berikut :
-
1. Pembuatan kitosan dari 100g limbah serbuk kulit udang didapatkan kitin sebanyak 15,33 g dan rendemen kitin sebesar15,33%. kemudian kitosan yang diperoleh sebanyak 9,94 g dan hasil rendemen kitosan sebesar9,94% dengan derajat deasetilasi sebesar 69,87%.
-
2. Konsentrasi kitosan yang mampu memberikan nilai perubahan keasaman tuak (pH) yang terkecil yaitu 2% (b/v), sehingga memiliki masa simpan lebih lama.
Saran
Berdasarkan hasil penelitian, maka dapat disarankan untuk dilakukan penelitian lanjut mengenai:
-
1. Perlu dikaji kembali untuk pembuatan kitosan dari limbah kulit udang agar didapatkan derajat deasetilasi yang lebih tinggi dengan suhu dinaikkan, waktu deasetilasi dan konsentrasi NaOH lebih tinggi.
-
2. Perlu dianalisis lebih lanjut konsentrasi kitosan yang lebih tinggi dari 2% agar di dapat konsentrasi yang lebih optimum.
UCAPAN TERIMA KASIH
Melalui kesempatan ini penulis menyampaikan banyak-banyak terima kasih
kepada Bapak Dr. Drs. Manuntun Manurung, M.S. dan Ibu A.A.I.A. Mayun Laksmiwati, S.Si,. M.Si. atas segala saran dan masukannya, serta pihak-pihak lain yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Gautara dan Soesarsono Wijardi, 1981, Dasar Pengolahan Gula I, Jurusan Teknologi Industri FATEMETA IPB, Bogor
Hang, K. No., S.P. Meyer, and K.S. Lee, 1989, Isolation and Characterization of Chitin from Crawfish Shell Waste, J. Agricultural and Food Chemistry, 37 : 493 – 575
Ikegami, S., 1997, Tuak dalam Masyarakat Batak Toba: Laporan Singkat tentang Aspek Sosial-Budaya Penggunaan Nira, Annual Report of the University of Shizuoka, Hamamatsu College, Part. 5, No.11-3
Krissetiana, H., 2004, Kitin dan Kitosan dari Limbah Udang, Suara Merdeka,
http://www.suaramerdeka.com/harian/040 5/31/ragam4.htm. 22 Juli 2011
Muzzarelly, 1985, Studies on The Suitable of Chitinocistic Microorganism for Shrimp Waste Fermentation, Dissertation,
University of Washington, New York
Pelezar MJ dan Chan ECS, 1988, Dasar-Dasar Mikrobiologi, UI, Jakarta
Srijanto dan Imam, 2005, Optimasi deasetilasi kitin pada udang, Jurnal Kimia, 2 (5) : 1904-9730
Sugiyono, 2002, Ilmu Pengetahuan Bahan Pangan, PAU Pangan dan Gizi IPB, Bogor
Suhardi, 1992, Khitin dan Khitosan, Buku Monograf, Pusat Antar Universitas Pangan dan Gizi UGM, Yogyakarta
Tanbury, Peter F., and Allan Whitaker, 1984, Principles of Fermentation Technology, Pergamon Press, New York
Weska, R. F. and Moura, J. M., 2006, Optimation of Deasetylation in the Production of Chiltosan from Shrimp Waste, Journal Foad Enginering, 80 (3) : 749-753
197
Discussion and feedback