IDENTIFIKASI SENYAWA AKTIF ANTIMAKAN BIJI SIRSAK (Annona muricata L.) TERHADAP ULAT KUBIS (Plutella xylostella)
on
ISSN 1907-9850
IDENTIFIKASI SENYAWA AKTIF ANTIMAKAN BIJI SIRSAK (Annona muricata L.) TERHADAP ULAT KUBIS (Plutella xylostella)
Lusiana Tabuni*, Sri Wahjuni, dan Oka Ratnayani
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
*email : lssyanatbn@rocketmail.com
ABSTRAK
Identifikasi senyawa aktif antimakan biji sirsak (Annona muricata Linn) sebagai pestisida alami terhadap Plutella xylostella telah dilakukan. 1800 g serbuk biji sirsak dimaserasi menggunakan metanol dan n-heksana menghasilkan 46,42 g ekstrak metanol dan 94,19 g ekstrak n-heksana. Ekstrak kental metanol dilarutkan dalam campuran metanol : air (7:3), diuapkan hingga metanol hilang, kemudian dipartisi dengan kloroform. Ektrak kental n-heksana, kloroform, air di uji aktivitas antimakannya. Ekstrak n-heksana menunjukkan aktivitas antimakan yang paling tinggi. Pemisahan 2 gram ektrak kental n-heksana dengan kromatografi kolom menggunakan silika gel 60 dan fase gerak n-heksana : aseton (4:1 ) menghasilkan 5 fraksi. Uji aktifitas antimakan terhadap semua fraksi menunjukkan fraksi C memiliki aktivitas antimakan yang paling tinggi. Identifikasi isolat antimakan fraksi C menggunakan Kromatografi Gas-Spektroskopi Massa (KG-SM) berdasarkan Database\NISTO2.L dan Database\wiley7n.1 diduga mengandung senyawa aktif asam etil heksadekanoat dan asam 11-oktadekanoat.
Kata kunci : Annona Muricata Linn, Antimakan, Kromatografi Gas-Spektroskopi Massa, Plutella xylostella
ABSTRACT
Identification of antifeedant active compounds from Soursop seeds (Annona muricata Linn) as natural pesticides against Plutella xylostella has been carried out. 1800 g Soursop seed powder maceration was applied using methanol and n-hexane resulted in 46.42 g extract of methanol and 94.19 g extract of n-hexane. Viscous extract of methanol was diluted with the mixture of methanol:water (7:3), then evaporated until the entire methanol was removed, and after that it was partitioned with chloroform. The antifeedant activity of viscous extract of n-hexane, chloroform and water was tested which showed that the extract of n-hexane had highest activity compared to the others. Separation of 2 g viscous n-hexane extract with Coloumn Chromatography using Gel Silica 60 and n-hexane:aceton (4:1) as the mobile phase resulted in 5 fractions. The fractions were tested against Plutella xyllostella. The results showed that fraction C had the highest antifeedant activity. The isolate of fraction C was then identified using Gas Chromatography-Mass Spectrometry (GC-MS) based on the data base (Database\NISTO2.L and Database\wiley7n.1) suggested the active compounds were ethyl hexadecanoate ester and 11-octadecanoic acid.
Keywords : Annona Muricata Linn, Antifeedant, Gas Chromatography-Mass Spectrometry, Plutella Xylostella
PENDAHULUAN
Plutella xylostella merupakan salah satu ulat tanaman famili Cruciferae atau Brassicaceae yang dapat merusak tanaman kubis. Apabila tidak ada tindakan pengendalian, kerusakan kubis oleh hama tersebut dapat meningkat dan hasil panen dapat menurun baik jumlah maupun kualitasnya
(Herlinda, S. 2004). Berbagai usaha dan cara telah dilakukan untuk melindungi tanaman dari gangguan hama contohnya secara kimia dengan menggunakan pestisida sintetik (Tukimin, 2006).
Pestisida sintetik memberikan peranan penting di bidang pertanian sebagai salah satu upaya para petani dalam melakukan pengendalian hama serta penyakit pada tanaman (Djojosumanto,
2008). Namun, penggunaan pestisida sintetik yang tidak selektif serta sesuai dengan dosisnya mampu memberikan dampak negatif terhadap kelestarian ekosistem pertanian. Pemakaian pestisida sintetik dalam jangka waktu yang lama sebagai pengendali hama dapat menyebabkan resistensi hama terhadap pestisida tersebut, terbunuhnya berbagai predator pada ekosistem pertanian, pencemaran lingkungan dan akhirnya kesehatan manusia akan terganggu. Untuk itu diupayakan suatu pengendalian hama dan penyakit secara terpadu yang salah satu komponennya adalah pestisida alami (Oka, 1993).
Pestisida alami adalah pestisida yang bahan aktifnya berasal dari bagian tumbuhan seperti akar, daun, batang atau buah. Bahan-bahan ini diolah menjadi berbagai bentuk, antara lain bahan mentah berbentuk tepung, ekstrak (Anonim 1, 2011). Pestisida alami memiliki beberapa keunggulan yang dapat dikembangkan karena bersifat selektif dan ramah lingkungan. Pengembangan pestisida nabati pada saat ini diarahkan pada pencarian senyawa-senyawa baru yang tidak hanya efektif dalam mengendalikan hama serangga tetapi juga mempunyai aktivitas selektif terhadap satu atau sejumlah serangga pengganggu (Meinwald et al., 1978).
Pestisida alami dapat dibagi ke dalam dua kelompok yaitu kelompok pengendali pertumbuhan Larva (larva growth regulator) yang mengubah pertumbuhan, perkembangan, dan reproduksi ulat serta kelompok yang mengubah perilaku ulat yang meliputi feromon, penolak (repellent), penarik (attractant), antimakan (antifeedant), stimulant dan, penolak peletakan telur (oviposisi). Feromon dan antimakan dianggap memiliki prospek komersial yang lebih baik (Ruslan et al., 1989).
Senyawa antimakan telah menarik banyak perhatian di kalangan industri pertanian untuk digunakan sebagai alternatif dalam melindungi tanaman pangan karena senyawa ini tidak membunuh, mengusir, atau menjerat tetapi hanya menghambat aktivitas makannya (Tjokronegoro, 1987). Senyawa antimakan didefinisikan sebagai suatu zat apabila diujikan pada serangga akan menghentikan aktivitas makan secara sementara maupun permanen tergantung potensi dari zat tersebut (Miles et al., 1985). Keberadaan dan potensi senyawa antimakan telah dikenal di Amerika Serikat sekitar tahun 1930-an.
Senyawa antimakan banyak ditemukan pada berbagai jenis tumbuhan seperti dari famili Meliaceae, Solanaceae, Piperaceae, Legumineceae, Burseraceae, Astaceae, annonaceae dan sebagainya. Salah satu tumbuhan yang berkembang dengan baik di Indonesia dan berpotensi sebagai pestisida alami adalah Sirsak. Biji sirsak (Annona muricata L.) diketahui mempunyai sifat racun (toksik) yang cukup kuat. Menurut Mulyawati et al., (2010) senyawa aktif dari biji sirsak akan menyerang jaringan syaraf-syaraf dalam tubuh serangga mengakibatkan serangga tidak mampu bergerak dan memakan tanaman karena kehilangan nafsu makan, sehingga tubuh serangga uji mengering dan akhirnya mati karena kehilangan energi. Biji sirsak juga sudah banyak digunakan untuk pembasmi hama (Feras,Q., 1999).
Dengan demikian maka pada penelitian ini akan dilakukan pemanfaatan biji sirsak sebagai pestisida alami antimakan untuk mengendalikan ulat Plutella xylostella yang dapat merusak tanaman kubis.
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah biji sirsak (Annona miricata L.) yang diperoleh di daerah Badung. Bahan kimia yang digunakan dalam penelitian ini yaitu akuades, kertas saring, metanol teknis dan p.a, n-heksana teknis dan p.a, kloroform, KBr, silika GF254, plat KLT GF254, silika gel60, asam asetat anhidrat, KOH 10%, NaOH 10%, H2SO4 pekat, HCl pekat, gelatin, pereaksi Meyer, Wagner, Liebermann-Burchard, Wilstatter, Bate Smith-Metalcalfe, Borntrager.
Peralatan
Alat-alat yang digunakan dalam penelitian ini yaitu: pisau, blender, neraca analitik, corong, gelas ukur, pipet mikro, pipet tetes, batang pengaduk, botol reagen, tabung reaksi, cawan petri, kuas, kain kasa, penguap putar vakum, desikator, seperangkat alat kromatografi kolom, lampu UV 254 nm dan GC-MS.
Cara Kerja
Preparasi Sampel
Biji sirsak (Annona muricata L.) dipisahkan dari daging buahnya, hanya bijinya yang diambil, kemudian dicuci bersih dan dipotong kecil-kecil dan dikeringkan di udara terbuka (tanpa terkena sinar matahari secara langsung). Biji sirsak kering dihancurkan dengan menggunakan blender hingga diperoleh serbuk halus kering dan disimpan di dalam wadah atau toples yang tertutup rapat. Serbuk halus ini selanjutnya digunakan sebagai bahan untuk diekstraksi.
Ekstraksi Senyawa Aktif AntiMakan dari Biji Sirsak
Sebanyak 1800 g serbuk kering biji sirsak diekstrak dengan cara maserasi dengan menggunakan pelarut n-heksana sampai semua serbuk terendam. Setiap 24 jam ekstrak tersebut disaring dan diganti dengan pelarut yang sama. Proses ekstraksi ini dilakukan sebanyak 3 kali sampai metabolit yang terdapat di dalam ekstrak telah habis. Setelah itu ekstrak n-heksana yang diperoleh disimpan untuk penelitian selanjutnya, sedangkan ampas dikeringkan agar terbebas dari pelarut n-heksana kemudian diekstraksi (maserasi) kembali dengan pelarut metanol. Ektraksi ini dilakukan beberapa kali sampai metabolit habis terekstrak. Ekstrak metanol yang diperoleh kemudian diuapkan pelarutnya dengan menggunakan penguap putar vakum (rotary evaporator) hingga diperoleh ekstrak kental metanol. Ekstrak kental metanol yang diperoleh disimpan untuk penelitian selanjutnya.
Ekstrak kental metanol dilarutkan dalam campuran pelarut metanol-air (7:3) dan diuapkan pelarutnya sehingga tidak mengandung pelarut metanol. Selanjutnya ekstrak dipartisi dengan kloroform menggunakan corong pisah, campuran dikocok dan didiamkan sampai memisah. Lapisan kloroform berada dibagian bawah dan lapisan air berada di bagian atas. Lapisan kloroform dan lapisan air dipisahkan kemudian ditampung, sehingga diperoleh ekstrak kloroform dan air. Ketiga ekstrak (kloroform, n-heksana dan air) kemudian diuapkan dengan menggunakan penguap putar vakum (rotary evaporator) diperoleh hasil ekstrak kental kloroform, ekstrak kental n-heksana dan ekstrak kental air.
Ekstrak kental n-heksana dipisahkan dan dimurnikan dengan metode kromatografi kolom dengan mengunakan eluen n-heksana : aseton (4:1). Fraksi hasil pemisahan dengan kromatografi kolom kemudian diuji antimakannya terhadap plutella xylostella.
Analisis dengan Kromatografi Gas-Spektroskopi Massa (KG-SM)
Fraksi yang peling aktif selanjutnya dianalisis dengan KG-SM untuk mengetahui komponen golongan senyawa kimia penyusun dari isolat.
HASIL DAN PEMBAHASAN
Ekstraksi Senyawa Aktif AntiMakan dari Biji Sirsak
Maserasi 1,8 Kg serbuk kering biji sirsak (Annnona muricata L.) menggunakan 10 L n-heksana dan 10 L metanol dilakukan sebanyak 3 kali sampai metabolit yang terdapat di dalam ekstrak telah habis. Sehingga, didapat ekstrak kental metanol yang berwarna coklat kehitaman 46,9249 g dan 94,1967 g ekstrak n-heksana yang berwarna kuning kecoklatan. Ekstrak kental metanol dilarutkan dalam campuran pelarut metanol : air (7:3), kemudian dipartisi dengan klorofom sehingga diperoleh ektrak air dan klorofom.
Pemisahan ekstrak n-heksana dengan kromatografi kolom mengunakan fase gerak campuran n-heksana-aseton (4:1). Hasil pemisahan n-heksana dengan kromatografi kolom menghasilkan 30 botol eluet, dan eluet yang memiliki pola pemisahan yang sama digabungkan dan diperoleh lima kelompok fraksi, kemudian diuji antimakannya terhadap plutella xylostella. Hasil uji antimakan dari fraksi gabungan dapat dilihat pada Tabel 1 yang menunjukkan bahwa fraksi FC dibandingkan dengan fraksi-fraksi yang lain. Oleh karena itu fraksi FC selanjutnya diuji kemurniannya dengan berbagai fase gerak. Hasil uji kemurnian menunjukkan fraksi FC ini relatif murni dengan memberikan satu noda pada berbagai fese gerak yang digunakan seperti kloroform : n-heksana (1:1), kloroform: metanol (1:1), metanol : n-heksan (1:2), kloroform : n-heksana (1:2), kloroform : n-heksana (3:4).
Tabel 1. Hasil uji aktivitas antimakan dari hasil fraksi penggabungan
|
NO |
Fraksi |
C (ppm) |
Persen aktivitas | ||
|
Per 1 |
Per 2 |
Rata-rata | |||
|
1 |
A (1-5) |
100 |
25 |
30 |
25 |
|
200 |
60 |
40 |
50 | ||
|
400 |
40 |
44 |
42 | ||
|
800 |
60 |
15 |
37,5 | ||
|
1600 |
70 |
55 |
62,5 | ||
|
2 |
B (6-7) |
100 |
45 |
25 |
35 |
|
200 |
50 |
20 |
35 | ||
|
400 |
10 |
59 |
34,5 | ||
|
800 |
66 |
55 |
60,5 | ||
|
1600 |
30 |
60 |
45 | ||
|
3 |
C (8-11) |
100 |
100 |
94 |
97 |
|
200 |
96 |
46 |
71 | ||
|
400 |
84 |
53 |
68,5 | ||
|
800 |
83 |
70 |
76,5 | ||
|
1600 |
89 |
63 |
76 | ||
|
4 |
D (12-16) |
100 |
20 |
60 |
13,5 |
|
200 |
90 |
40 |
65 | ||
|
400 |
100 |
33 |
66,5 | ||
|
800 |
0 |
50 |
25 | ||
|
1600 |
8,3 |
60 |
34,5 | ||
|
5 |
E(17-30) |
100 |
20 |
40 |
60 |
|
200 |
35 |
60 |
47,5 | ||
|
400 |
29 |
39 |
34 | ||
|
800 |
90 |
22 |
56 | ||
|
1600 |
70 |
53 |
61,5 | ||
Identifikasi Fraksi FC
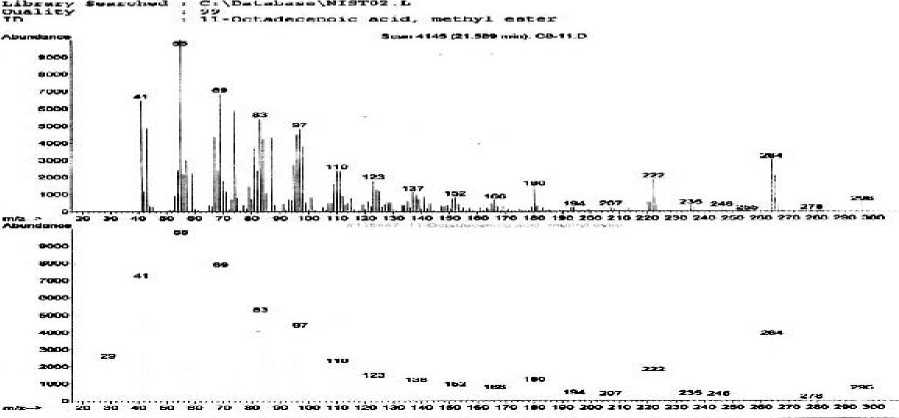
Hasil analisis isolat aktif fraksi C pada Gambar 1 menunjukan bahwa diduga adanya senyawa-senyawa golongan asam lemak berdasarkan database\NISTO2.L dan database\wiley7n.1 hanya 2 puncak dominan yang dapat teridentifikasi dengan baik dimana spektrum massa sampel sesuai dengan data base, waktu retensi (tR) dan kelimpahan (%) yaitu puncak 1, tr 20,55 menit (5,31%) dan puncak 2, tr 21,59 menit (10,21%).
Spektrum massa pada puncak 1 dengan waktu retensi 20,55 menit, pada Gambar 2 yang memiliki ion molekul (M+) pada m/z 284 dan puncak-puncak penggalan pada m/z 269, m/z 255, m/z 241, m/z 227, m/z 213, m/z 199, m/z 185, m/z 171, m/z 157, m/z 143, m/z 129, m/z 115, dan m/z 101 merupakan pola fragmentasi karena adanya pemecahan pada tiap ikatan c-c dan dikenal sebagai pola fragmentasi deret ion CnH2n-1O2+. Pola fragmentasi ini merupakan pola fragmentasi karakteristik untuk senyawa-senyawa golongan ester rantai panjang (Silverstein, et al., 1991), Berdasarkan pendekatan database\NISTO2.L dan database\wiley7n.1 maka kemungkinan puncak 1 adalah senyawa asam hexadekanoat etil ester dengan rumus molekul yang paling mungkin adalah C18H36O2 dengan berat molekul 284.
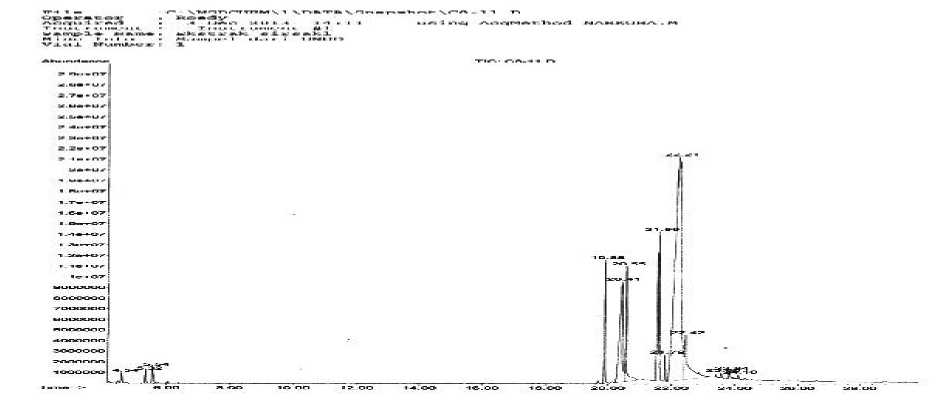
Gambar 1. Kromatogram kromatografi gas isolat aktif fraksi C
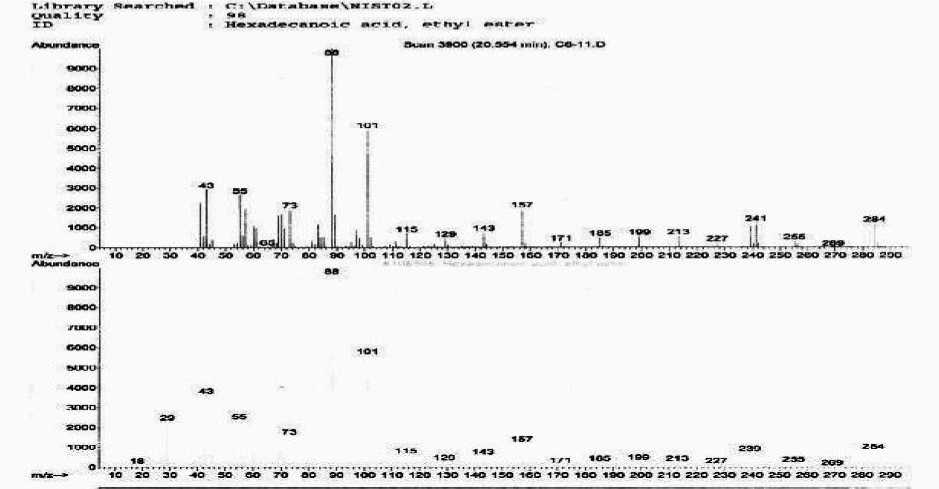
Gambar 2. (a). Spektrum massa senyawa puncak 1
(b). Spektrum massa data base senyawa asam etil heksadekanoat.
Pola pemenggalan dari spektrum massa asam etil heksadekanoat pada Tabel 2 menunjukkan adanya pemenggalan gugus propil (m+ -C3H7) pada m/z 241. Adanya pelepasan gugus metilen (M+ - 14) pada m/z 227 sampai 115 secara berurutan merupakan ciri khas dari hidrokarbon jenuh dapat dilihat pada Tabel 2.
|
Tabel 2. |
Pola pemenggalan senyawa puncak 1 |
spektrum massa |
|
m/z |
Pemenggalan |
Penggalan |
|
284(M+) |
- |
- |
|
269 |
M+-CH3 |
C17H33O2+ |
|
255 |
M+ - C2H5 |
C16H31O2+ |
|
241 |
M+ - C3H7 |
C15H29O2+ |
|
227 |
M+ - C4H9 |
C14H27O2+ |
|
213 |
M+ - C5H11 |
C13H25O2+ |
|
199 |
M+ - C6H13 |
C12H23O2+ |
|
185 |
M+ - C7H15 |
C11H21O2+ |
|
171 |
M+ - C8H17 |
C10H19O2+ |
|
157 |
M+ - C9H19 |
C9H17O2+ |
|
143 |
M+ - C10H21 |
C8H15O2+ |
|
129 |
M+ - C11H23 |
C7H13O2+ |
|
115 |
M+ - C12H27 |
C6H11O2+ |
|
73 |
M+ - C15H31 |
C3H5O2+ |
Berdasarkan pola pemenggalan dari senyawa yang di tunjukkan oleh database\NISTO2.L dan database\wiley7n.1 maka kemungkinan senyawa puncak 3 adalah senyawa asam etil heksadekanoat dengan rumus molekul C18H36O2 dan memiliki rumus struktur berikut ini.

O
Gambar 3. Struktur molekul asam etil
heksadekanoat
Fragmentasi yang terjadi pada senyawa asam etil heksadekanoat, sesuai dengan pola pemenggalan yang dapat diperkirakan seperti pada Gambar 4.
Berdasarkan pola pemenggalan pada Gambar 4, maka diduga senyawa pada puncak 1 identik sama dengan senyawa asam etil heksadekanoat.
Spektrum Puncak 2 dengan waktu retensi 21,59 menit, menghasilkan spektrum massa puncak-puncak penggalan pada m/z 152, 166, dan 180.
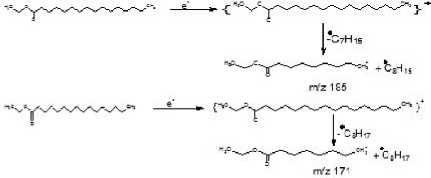
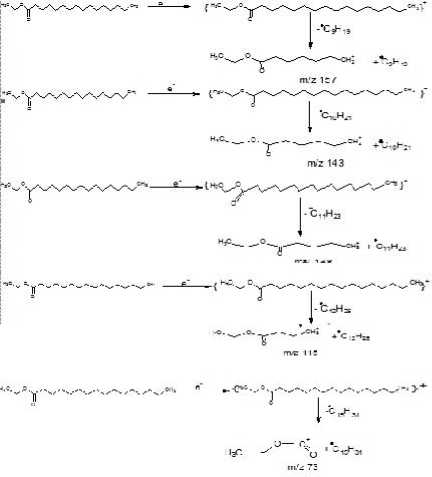
Gambar 4. Pola fragmentasi senyawa asam etil heksadekanoat
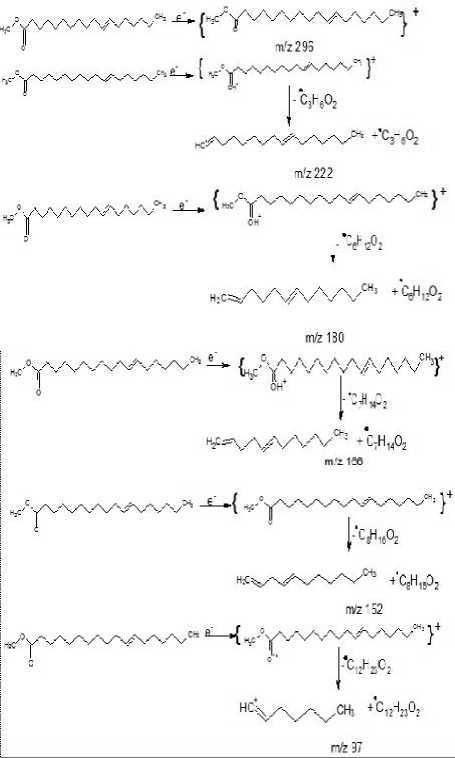
Pola fragmentasi ini karena adanya pemecahan pada tiap ikatan c-c dan dikenal sebagai pola fragmentasi deret ion CnH2n-1O2+. Pola fragmentasi ini merupakan pola fragmentasi karakteristik untuk senyawa-senyawa golongan ester rantai panjang (silverstein, et, al., 1991). seperti Gambar 5 yang menunjukkan adanya ion molekul (M+) pada m/z 296 dan berat molekul senyawa puncak 4 adalah sebesar 296. Berat molekul yang genap, dapat menunjukkan bahwa komponen senyawa tidak mengandung atom N atau mengandung jumlah atom N yang genap. Rumus molekul yang paling mungkin adalah C19H36O2.
Pola pemenggalan dari senyawa puncak 4 dengan spektrum massa senyawa asam metil 11-oktadekadinenoat dapat dilihat pada Tabel 3
Tabel 3. Pola pemenggalan spektrum massa senyawa puncak 2
|
m/z |
Pemenggalan |
Penggalan |
|
296 (M+) |
- |
- |
|
222 |
M+ - C3H6O2 |
C16H30O2+ |
|
180 |
M+ - C6H12O2 |
C13H24O2+ |
|
166 |
M+ - C7H14O2 |
C12H22O2+ |
|
152 |
M+ - C8H16O2 |
C11H20O2+ |
|
97 |
M+ - C12H23O2 |
C7H13O2+ |
Gambar 5. (a). Spektrum massa senyawa puncak 2
(b). Spektrum massa data base senyawa asam metil 11-oktadekadinenoat
Berdasarkan senyawa yang database\NISTO2.L
pola pemenggalan dari di tunjukan oleh dan database\wiley7n.1
dengan rumus molekul C19H3602 dan rumus
struktur seperti Gambar 6 .

O
Gambar 6. Struktur molekul asam metil 11-oktadekadinenoat
Fragmentasi yang terjadi pada senyawa senyawa asam metil 11-oktadekadinenoat, sesuai dengan pola pemenggalan yang dapat diperkirakan pada Gambar 7.
Gambar 7. Pola fragmentasi senyawa asam metil
11-oktadekadinenoat
Berdasarkan pola pemenggalan diatas, maka diduga senyawa pada puncak 2 identik sama dengan senyawa asam metil 11-oktadekadinenoat.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dan pembahasan dapat disimpilkan sebagai berikut : 1. Hasil penelitian ini menunjukkan bahwa ekstrak kental air, kloroform dan n-heksana dari biji sirsak (Annona muricata Linn) bersifat aktif antimakan terhadap ulat Plutela Xylostella, dimana ekstrak n-heksana memiliki aktivitas anti-makan sebesar 76,77% pada konsentrasi 0,1% yang relatif lebih tinggi dibandingkan dengan ekstrak kloroform (55,31%) dan air (5,88%).
-
2. Senyawa aktif dari isolat ekstrak n-heksana biji sirsak memiliki aktifitas antimakan 97 % yang diduga merupakan campuran asam lemak, dimana senyawa aktif yang teridentifikasi dengan baik menggunakan KG-SM berdasarkan database\NISTO2.L dan database\wiley7n.1 adalah asam etil heksadekanoat dan asam metil 11-oktadekadinenoat.
Saran
-
1. Perlu dilakukan penelitian dengan menggunakan bioindikator lain selain larva Plutella xylostella dalam uji hayati antimakan.
-
2. Perlu dilakukan penelitian lebih lanjut untuk mengidentifikasi isolat aktif dengan menggunakan alat instrument lain seperti LC-MS atau LC-NMR sehingga dapat ditetapkan suatu struktur usulan dari isolat aktif tersebut.ve
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dari pelaksanaan penelitian hingga penerbitan penulisan karya ilmiah ini.
DAFTAR PUSTAKA
Djojosumanto, 2008, Teknik Aplikasi Pestisida Pertanian, Kanisius, Yogyakarta
Feras,Q., et al., 1999, Annonaceous acetogenins: Recent Progress, J. Nat.Prod., 62 (3) : 504-540
Herlinda, S., 2004, Ekologi Ulat Daun Kubis, Plutella xylostella L. (Lepidoptera: Plutellidae) pada Tanaman Kubis (Brassica oleracea L.), Prosiding Seminar dan Lokakarya Nasional dalam
Menyambut Hari Pendidikan Nasional, Kerjasama DRD Sumsel dengan
Balitbangda Sumsel dan Universitas Sriwijaya, Palembang, 28-29 April 2004, h. 97-107
Meinwald, J.G.D., Prestwich, K. Nakanishi, and I. Kubo, 1978, Chemical Ecology: Studies from East Africa, Science, 199 (4325) : 1167-1173
Miles, D. H., B.L Hankinson, and S.A Randle, 1985, Insect Antifeedant from The Peruvian Plant Alchornea triplinerva,
dalam Paul Hedin (Editor): Bioregulator for Pest Control, Washington DC: American Chemical Society
Ruslan, K., S. Soetarno, dan S. Sastrodihardjo, 1989, Insektisida dari Produk Alami, PAU Bidang Ilmu Hayati, Institut Teknologi Bandung
Oka, I. N., 1993, Penggunaan, Permasalahan serta Prospek Pestisida Nabati dalam Pengendalian Hama Terpadu, Prosiding Seminar Hasil Penelitian Dalam Rangka Pemanfaatan Pestisida Nabati, Bogor 1-2 Desember1993
Tjokronegoro, R.K., 1987, Penelusuran Senyawa Kandungan Tumbuhan Indonesia Bioaktif Terhadap Serangga, Desertasi, Universitas Padjadjaran, Bandung
Tukimin, S.W., 2006, Peluang Pestisida Nabati Untuk Pengendalian Hama dan Penyakit, Prosiding Lokakarya Nasional Pertanian Organik, Universitas Brawijay, Malang
212
Discussion and feedback