BAKTERI PELARUT FOSFAT MEMICU KETAHANAN TANAMAN KEDELAI (Glycine max) TERHADAP PENYAKIT SOYBEAN MOSAIC VIRUS
on
J. Agric. Sci. and Biotechnol.
ISSN: 2302-0113
Vol. 7, No. 1, Juli 2018
BAKTERI PELARUT FOSFAT MEMICU KETAHANAN TANAMAN
KEDELAI (Glycine max) TERHADAP PENYAKIT SOYBEAN MOSAIC VIRUS
Ni Nyoman Alit Purwaningsih1, I Dewa Nyoman Nyana1*),
I Gede Rai Maya Temaja1, Gede Suastika2
1Program Studi Bioteknologi Pertanian, Universitas Udayana 2Departemen Proteksi Tanaman, Fakultas Pertanian Institut Pertanian Bogor *)Corresponding author at: Jl. PB. Sudirman Denpasar, Bali, Indonesia E-mail: dewanyana@yahoo.com
Abstract
Soybean (Glycine max) is an important commodity in Indonesia. The high utilization of soybean has not been accompanied by the sufficiency of amount of its production, even decreased from year to year. One of the factors that cause the decreased of soybean productivity is soybean mosaic disease caused by viral pathogens. Soybean mosaic virus is one of the most important types of virus in soybean could cause a decreased in yield until 25-90%.
This study aimed to test rhizobacteria isolated from the rhizosphere of Leguminosae plants that able to providing resistance to SMV disease on soybean plant. Six isolates rhizobacteria that could be isolated from Leguminosae plants had used as a treatment in the test. The result of field test showed three isolates namely R13, R12, and R9 able to increase soybean plant resistance, so each isolates made influence to crop yield. The results of identification based on the analysis of 16S rRNA gene, isolate R13 which gave the best response to soybean plant resistance and had percentage similarity between 94-98% with species Empedobacter brevis (Flavobacterium breve).
Keywords: soybean, leguminosae, phosphate solubilizing bacteria, Soybean mosaic virus
Konsumsi kedelai yang dibutuhkan di Indonesia tercatat sebesar 2,8 juta ton/tahun (FAO, 2014), namun belum dapat terpenuhi seluruhnya dari produksi kedelai dalam negeri. Pemerintah melakukan impor kedelai tahun 2015 mencapai 2,26 juta ton senilai 1,03 miliar dollar AS (BPS, 2015). Rendahnya produktivitas kedelai di Indonesia salah satunya disebabkan oleh adanya serangan patogen dari golongan virus. SMV termasuk salah satu virus penting di Indonesia yang memberikan kerugian mencapai 25-90% tergantung dari umur tanaman saat terjadinya infeksi (Prayogo, 2012).
Alternatif pengendalian yang ramah lingkungan dan mudah diaplikasikan dapat dilakukan yaitu dengan memanfaatkan mikroorganisme sebagai agen
biokontrol, misalnya rizobakteri. Pemanfaatan rhizobakteria juga secara nyata mampu memacu pertumbuhan bibit padi (Maulina, 2015) dan meningkatkan hasil tanaman padi (Suprapta, 2014). Rizobakteri pelarut fosfat dikatakan dapat meningkatkan ketahanan sistemik tanaman dengan memacu sel akar untuk menghasilkan senyawa yang mampu menghambat pertumbuhan patogen (Hanuddin dkk., 2008). Oleh karena itu, penelitian ini bertujuan untuk mengetahui kemampuan beberapa isolat bakteri pelarut fosfat tersebut dalam meningkatkan ketahanan tanaman kedelai terhadap virus.
Penelitian dilaksanakan dari bulan Oktober 2016 sampai Maret 2017. Pengambilan sampel isolat bakteri pelarut fosfat dilakukan di sentra penanaman leguminosae di Bali. Isolasi rizobakteri dan identifikasi virus dilakukan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian, Universitas Udayana. Identifikasi bakteri dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Uji kemampuan bakteri pelarut fosfat terhadap ketahanan virus kedelai dilakukan dengan penanaman menggunakan pot yang dilaksanakan dalam rumah kaca kedap serangga milik UPTD Balai Proteksi Tanaman Pangan Hortikultura Provinsi Bali.
-
2.2 Isolasi Bakteri Pelarut Fosfat dari Rizosfer Tanaman Legum
Sampel diambil dari rhizosfer beberapa jenis tanaman leguminosae. Tanah pada daerah perakaran diambil sebanyak 50–100 g. Isolasi rizobakteri dari rizosfer menggunakan metode Quintao (2013). Mikroba pelarut fosfat yang telah diremajakan selanjutnya dilakukan uji kemampuan melarutkan fosfat dalam cawan petri berisi media Pikovskaya padat steril.
-
2.3 Uji Kemampuan Bakteri Pelarut Fosfat dalam Memicu Respon Ketahanan
Tanaman Kedelai Terhadap Virus
Penelitian ini menguji enam isolat yang diambil dari berbagai akar tanaman leguminose di beberapa daerah. Isolat tersebut meliputi R20 (kara benguk), R10 (lamtoro), R13 dan R12 (undis), R9 (centrosema), dan R3 (turi kecil). Beberapa isolat tersebut merupakan isolat koleksi dari Laboratorium Penyakit Tumbuhan. Penelitian ini menggunakan Rancangan Acak Kelompok (RAK) dengan delapan perlakuan, diantaranya enam perlakuan menggunakan berbagai isolat rizobakteri dan dua tanpa perlakuan rizobakteri (kontrol). Setiap perlakuan diulang sebanyak empat kali sehingga terdapat 32 unit penelitian. Benih kedelai yang akan digunakan untuk perlakuan PGPR direndam dalam suspensi PGPR selama kurang lebih 5 menit. Benih kedelai yang telah diberi perlakuan dan tanpa perlakuan dengan PGPR, selanjutnya ditanam pada polibag yang telah diisi dengan media tanah dan humus steril dengan perbandingan 2:1.
Inokulasi SMV dilakukan pada umur tanaman yang telah memiliki daun sempurna. Dua minggu setelah inokulasi dilakukan pengamatan gejala SMV secara visual berdasarkan persentase tanaman yang terserang dengan menghitung kejadian penyakit. Kejadian penyakit dihitung berdasarkan rumus (Cooke, 1998): a
KP = x 100 % ……………………………………. (1)
b
KP = Kejadian penyakit (%)
a = Jumlah tanaman yang menunjukkan gejala penyakit pada satu perlakuan
b = Jumlah tanaman pada perlakuan yang sama
Nilai kejadian penyakit yang didapat kemudian dikelompokkan dalam ketegori ketahanan tanaman terhadap virus menurut Akin (2006) disajikan pada Tabel 1.
Tabel 1. Kategori respon ketahanan tanaman kedelai terhadap SMV
|
Kategori |
Kejadian Penyakit (%) |
|
Tahan Agak tahan Agak rentan Rentan Sangat rentan |
0 – 15 16 – 25 26 – 35 36 – 55 56 – 100 |
-
2.4 Konfirmasi gejala infeksi virus berdasarkan uji ELISA (Enzyme Linked Immunosorbent Assay)
Tanaman kedelai yang telah diinokulasi dengan virus, dideteksi dengan Direct ELISA sesuai petunjuk dari Agdia, USA. Kontrol negatif digunakan dari ekstrak tanaman sehat sedangkan kontrol positif merupakan ekstrak tanaman yang terinfeksi oleh virus yang sesuai.
-
2.5 Pengukuran aktivitas peroksidase
Pengukuran aktivitas peroksidase dilakukan 10 hari setelah inokulasi virus pada tanaman kedelai. Cara yang digunakan adalah prosedur Cohen Cit yang dikemukakan oleh Simons & Ross (1970) dan telah dimodifikasi. Kadar Protein total dihitung dengan reagen Bradford menggunakan bovine serum albumin (BSA; Sigma Aldrich USA).
-
2.6 Identifikasi spesies rizobakteri pelarut fosfat terbaik
Satu isolat rizobakteri yang menunjukkan kemampuan paling baik dalam memicu ketahanan terhadap penyakit SMV diidentifikasi untuk menentukan spesies. Ekstraksi total DNA dilakukan dengan GeneJET Genomic DNA Purification Kit Thermo. Gen 16S rRNA diamplifikasi dengan PCR menggunakan pasangan primer 16S 63F (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan
1387R (5’-GGG CGG WGT GTA CAA GGC-3’) (Marchesi et al., 1998). Amplifikasi DNA menghasilkan fragmen DNA berukuran ±1.300 pb. Selanjutnya dilakukan sekuensing 16 RNA dan analisis sekuen DNA. Data yang berasal dari GenBank kemudian dilakukan analisis kesamaan menggunakan program BioEdit v.7.0.5. Analisis filogenetika menggunakan program MEGA v.6.06 berdasarkan algoritma Neighbor Joining dengan bootstrap 1000 kali.
-
2.7 Analisis Data
Data dianalisis dengan analisis sidik ragam atau ANOVA. Apabila pada analisis keragaman nilai F hitung ≤ F tabel atau peluang (p) F > 0,05; maka H0 : Ti = 0 diterima yang berarti terdapat perbedaan pengaruh tidak nyata antar perlakuan yang dicoba; dan sebaliknya. Apabila terdapat perbedaan nyata, dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) pada taraf 5%.
Hasil uji efektivitas isolat-isolat terhadap respon tanaman kedelai menujukkan perbedaan yang sangat nyata antara tanaman kedelai yang diberi perlakuan isolat rizobakteri dengan tanaman yang tidak diberi perlakuan. Isolat R13 (isolat dari perakaran tanaman undis daerah Buleleng) memberikan respon terbaik terhadap berbagai variabel pertumbuhan dan tingkat ketahanan tanaman kedelai.
Tabel 2. Rata-rata nilai pengaruh isolat rhizobakteria terhadap kandungan klorofil,
bintil akar, jumlah biji, berat biji, dan hasil
|
Perlakuan |
Klorofil (SPAD UNIT) |
Bintil akar (butir) |
Jumlah Biji (butir/tan) |
Berat 100 biji (g) |
Hasil (ton/ha) |
|
R0(1) |
40.9 ab |
52.5 ab |
43.3 b |
11.4 b |
3.79 b |
|
R0(2) |
39.0 b |
43.8 b |
44.3 ab |
10.1 c |
3.37 c |
|
R20 |
42.0 a |
60.0 a |
56.3 ab |
11.3 b |
3.84 b |
|
R10 |
41.6 ab |
57.5 ab |
49.5 ab |
11.1 b |
3.85 b |
|
R13 |
42.0 a |
66.3 a |
58.0 ab |
12.2 a |
4.17 a |
|
R12 |
42.8 a |
65.0 a |
60.0 a |
12.6 a |
4.08 a |
|
R9 |
41.6 ab |
65.0 a |
43.3 b |
12.2 a |
4.07 a |
|
R3 |
41.5 ab |
52.5 ab |
47.5 ab |
11.3 b |
3.81 b |
Keterangan: Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama
menunjukkan perbedaan tidak nyata pada Uji Duncant taraf 5%.
Perlakuan isolat rizobakteri menunjukkan ketahanan lebih baik daripada kontrol R0(2). Kejadian penyakit pada R0(2) yang menimbulkan gejala setelah inokulasi terjadi sekitar 50% sehingga tingkat ketahanan pada R0(2) tergolong rentan terserang virus. Perlakuan R13 dan R12 tidak menujukkan adanya gejala
SMV sehingga tingkat ketahanan tergolong tahan. Perlakuan bakteri pelarut fosfat terbukti mampu meningkatkan ketahanan, walaupun berdasarkan uji ELISA positif terinfeksi SMV.
Tabel 3. Rerata kejadian penyakit dan kategori ketahanan terhadap SMV sebagai
pengaruh isolat bakteri pelarut fosfat
|
Perlakuan |
Jumlah tanaman terinfeksi/tanaman yang diinokulasi |
Kejadian penyakit (%) |
Tingkat ketahanan |
Masa Inkubasi (HSI) |
|
R0(1) |
(0/0) |
0 |
- |
- |
|
R0(2) |
(6/12) |
50 |
rentan |
8 – 13 |
|
R20 |
(4/12) |
33 |
agak rentan |
10 – 13 |
|
R10 |
(1/12) |
8 |
tahan |
13 |
|
R13 |
(0/12) |
0 |
tahan |
- |
|
R12 |
(0/12) |
0 |
tahan |
- |
|
R9 |
(2/12) |
17 |
agak tahan |
12 |
|
R3 |
(6/12) |
50 |
rentan |
9 – 13 |
Keterangan: Klasifikasi tingkat ketahanan berdasarkan nilai persentase kejadian
penyakit menurut Akin (2006) (Tabel 1)
Berdasarkan analisis aktivitas peroksidase (Tabel 4) menunjukkan bahwa tanaman yang diberikan perlakuan isolat rizobakteri (R13 dan R3) menghasilkan aktivitas enzim peroksidase lebih tinggi dibandingkan dengan kontrol R0(1) dan R0(2).
Tabel 4. Aktivitas enzim peroksidase
|
Perlakuan |
Peroksidase (unit/mg) |
|
R0(1) |
0,0011 |
|
R0(2) |
0,0541 |
|
R13 |
0,1440 |
|
R3 |
0,0936 |
-
3.2 Identifikasi bakteri pelarut fosfat secara molekuler
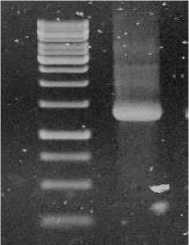
Identifikasi rizobakteri dilakukan terhadap satu isolat yang menunjukkan kemampuan paling baik dalam memicu ketahanan terhadap SMV yaitu R13 (isolat rizobakteri dari perakaran Undis daerah Buleleng). Deteksi menggunakan PCR terhadap R13 memberikan hasil pita DNA yang sangat jelas dan dengan produk PCR sesuai dengan primer yang digunakan yaitu 16S 63F dan 1387R.
M R13
1500 pb
1000 pb
1300 pb
Gambar 1. Amplifikasi PCR gen 16S rRNA. M = marker 1000 pb (Promega)
Pengujian tingkat homologi antar isolat menujukkan bahwa isolat rizobakteri perakaran undis daerah Buleleng mempunyai kesamaan sebesar 98% dengan Empedobacter brevis strain ZJUY 1401 yang berasal dari Cina. Isolat R13 (perakaran Undis daerah Buleleng) juga memiliki homologi yang tinggi (95%) dengan tiga isolat Empedobacter brevis yang berasal dari Jepang dan USA.
Tabel 5. Homologi isolat rizobakteri perakaran undis daerah Buleleng dengan
sekuen homolognya yang ada di Genbank berdasarkan gen 16S rRNA
|
No. Isolat |
1 |
2 |
Homologi | ||
|
3 |
4 |
5 6 12 | |||
|
Rizobakteri Undis (Buleleng) |
ID | ||||
|
Empedobacter brevis JCM 1276 (Jepang) |
95% |
ID | |||
|
Empedobacter brevis LMG 4011 (USA) |
95% |
100% |
ID | ||
|
Empedobacter brevis ZJUY 1401 (Cina) |
98% |
96% |
96% |
ID | |
|
Empedobacter brevis NBRC 14943 (Jepang) |
95% |
100% |
100% |
96% |
ID |
|
Flavobacterium breve (Jepang) |
94% |
90% |
90% |
94% |
90% ID |
|
Escherichia coli (USA) |
68% |
70% |
70% |
68% |
70% 65% ID |
Isolat rizobakteri perakaran undis daerah Buleleng (R13) dengan isolat Empedobacter brevis strain JCM 1276 asal Jepang, Empedobacter brevis strain LMG 4011 asal USA, Empedobacter brevis strain ZJUY 1401 asal Cina, dan Empedobacter brevis strain NBRC 14943 asal Jepang memiliki nilai jarak genetik yang paling rendah yaitu 0,002. Nilai tersebut menujukkan bahwa tingkat kedekatan antara isolat rizobakteri perakaran undis daerah Buleleng (R13) dengan keempat isolat tersebut sangat tinggi.
Berdasarkan pohon filogeni pada Gambar 2. terlihat bahwa rizobakteri perakaran undis daerah Buleleng (R13) berada satu kelompok dengan sekuen spesies Empedobacter brevis dan Flavobacterium breve. Keberadaan isolat rizobakteri perakaran undis daerah Buleleng (R13) dalam kelompok/klade yang sama dengan Empedobacter brevis (Flavobacterium breve) dan Empedobacter falsenii menunjukkan bahwa isolat tersebut memiliki kedekatan karena berasal dari famili Flavobacteriaceae dan genus Empedobacter.
— R13 (Rizobakteri undis Buleleng)
— Empedobacterbrevis (Jepang) ao⅛— Empedobacter brevis (USA)
— Empedobacter brevis (Cina)
9S
— Empedobacterbrevis (Jepang)
— Flavobacterium breve (Jepang)
C
ιoo
— Empedobacterfalsenii 1 (Cina)
l---Empedobacterfalsenii 2 (Cina)
04
— Empedobacterfalsenii 3 (Cina) i—Flavobacteriumoryzae (Taiwan) '— Flavobacterium aciduliphilum (Korea) — Escherichia ∞li (USA)
0.0 100.0
Gambar 2. Homologi Isolat R13 dengan sekuen homolognya yang ada di GenBank
-
3.3 . Pembahasan umum
Hasil uji efektivitas isolat-isolat terhadap respon pertumbuhan tanaman kedelai pada tanah steril menujukkan bahwa terlihat perbedaan yang sangat nyata antara tanaman kedelai yang diberi perlakuan isolat rizobakteri dengan tanaman yang tidak diberi perlakuan seperti yang ditunjukkan Gambar 3.

Gambar 3. Karakteristik tanaman kedelai. R0(1), tanpa BPF dan tanpa inokulasi SMV; R0(2) tanpa BPF dengan inokulasi SMV; R13, isolat perakaran undis (Buleleng); R12, isolat perakaran undis (Badung); R9, isolat perakaran centrosema (Tabanan)
Berdasarkan Gambar 3, terlihat bahwa isolat R13 (isolat dari perakaran tanaman undis daerah Buleleng) memberikan respon terbaik terhadap berbagai variabel pertumbuhan dan tingkat ketahanan tanaman kedelai. Hal tersebut kemungkinan karena isolat R13 mampu beradaptasi dan bersimbiosis dengan lingkungan perakaran kedelai sehingga dapat menyediakan kebutuhan tanaman melalui kemampuannya sebagai PGPR yaitu sebagai biofertilizer, biostimulan, dan bioprotektan.
Isolat bakteri pelarut fosfat juga memberikan reaksi positif pada jumlah bintil akar pada perakaran kedelai. Hal tersebut karena pemberian rizobakteri memicu terbentuknya asam organik yang merupakan nutrisi bagi perakaran
tanaman sehingga terjadi co-inokulasi yang menyebabkan terbentuknya bintil akar. Menurut Khalimi, dkk (2010), selain menambat fosfat, tanaman kedelai yang diberi perlakuan isolat rizobakteri juga menghasilkan anthiamin, riboflavin, nicotin indol acetic acid dan giberelin yang dapat mempercepat perkecambahan bila diaplikasikan pada benih dan merangsang regenerasi bulu akar sehingga penyerapan unsur hara melalui akar menjadi optimal.
Hasil penelitian ini menujukkan bahwa tanaman yang diberi perlakuan isolat rizobakteri memiliki kandungan klorofil yang lebih tinggi dibandingkan dengan tanaman kontrol. Menurut Khalimi, dkk. (2010), meningkatnya kandungan klorofil disebabkan karena aktivitas ACC-deaminase yang memperlambat proses pembusukan klorofil atau diduga juga karena meningkatnya fotosintesis per luas daun dibandingkan dengan tanaman yang terinfeksi oleh virus. Tanaman yang terinfeksi virus mengalami penurunan jumlah klorofil per luas daun, penurunan efesiensi klorofil, dan penurunan pertumbuhan daun.
Selain meningkatkan pertumbuhan tanaman, beberapa rizobakteri yang digunakan dalam penelitian ini terbukti mampu menginduksi ketahanan tanaman, sehingga tanaman mampu menekan kejadian penyakit. Adanya variasi tingkat ketahanan antara kontrol dan perlakuan yang diberikan isolat rizobakteri diduga terbentuk respon ketahanan tanaman terhadap infeksi SMV melalui mekanisme tidak langsung yaitu melalui peningkatan pertumbuhan dan induksi ketahanan tanaman.
Berdasarkan analisis aktivitas peroksidase (Tabel 4) menunjukkan bahwa tanaman yang diberikan perlakuan isolat rizobakteri R13 dan R3 menghasilkan aktivitas enzim peroksidase lebih tinggi dibandingkan dengan kontrol R0(1) (tanpa inokulasi virus). Penelitian Sudana, dkk. (2016) juga membuktikan rizobakteri perakaran undis (Cajanus cajan) memiliki aktivitas peroksidase yang tinggi. Hasil penelitian ini sesuai dengan penelitian Gupta et al. (1990) yang menyatakan bahwa tanaman yang agak tahan terhadap penyakit cenderung memperlihatkan aktivitas peroksidase yang lebih tinggi dibandingkan dengan tanaman rentan. Hal tersebut mempengaruhi ekspresi pada perlakuan R13 yang menunjukkan gejala silent infection yang disebabkan karena SMV.
Peroksidase berhubungan dengan serangkaian Induced Systemic Resistance (ISR) yang diatur oleh jasmonat dan ethylene dan diaktifkan oleh mikroorganisme saprofit termasuk rizobakteri (Van Loon, dkk. 1998). Pengaruh yang terjadi pada akar tanaman yang mengalami ISR adalah (1) penguatan epidermis dan korteks dinding sel serta terbentuknya penghalang di sekeliling tempat infeksi yang berupa kalis, lignin, dan senyawa fenol, (2) peningkatan jumlah beberapa enzim seperti kitinase, peroksidase, polyphenol oxidase dan phenylalanine ammonia lyase, (3) meningkatkan pembentukan fitoaleksin, dan (4) meningkatkan ekspresi gen yang berkaitan dengan kondisi stress.
Peran rizobakteri mampu meningkatkan pertumbuhan dan ketahanan tanaman kedelai sehingga berpengaruh terhadap hasil tanaman. Gambar 4
menujukkan hasil kedelai per hektar tertinggi diperoleh oleh pengaruh perlakuan isolat R13 dengan hasil kedelai 4,17 ton. Hasil penelitian ini sejalan dengan hasil penelitian yang dikemukakan oleh Husen dkk. (2009) yang melaporkan bahwa tanaman kedelai yang diberi perlakuan PGPR secara signifikan meningkatkan jumlah polong dan meningkatkan hasil tanaman. Selain itu, rendahnya hasil kedelai pada R0(2) disebabkan karena pengaruh infeksi SMV pada awal pertumbuhan yang akan menyebabkan hasil asimilat rendah, sehingga tingkat kehampaan biji semakin tinggi (Andayanie, 2012).
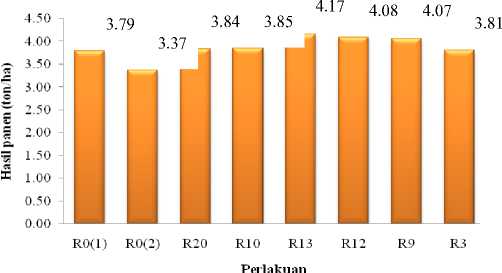
Gambar 4. Grafik rata-rata hasil panen tanaman kedelai berbagai perlakuan
Penelitian ini menujukkan bahwa rizobakteri mampu meningkatkan pertumbuhan dan ketahanan tanaman kedelai sehingga berpengaruh terhadap hasil tanaman. Hal ini sesuai dengan pernyataan Widodo (2006) yang menyatakan bahwa mekanisme rizobakteri dalam meningkatkan pertumbuhan dan ketahanan tanaman dapat terjadi melalui tiga cara, yaitu menekan perkembangan hama/penyakit (bioprotektan) yang secara tidak langsung mampu memacu produksi metabolit antibiotik dan siderofor yang dapat menurunkan pertumbuhan fitopatogen; memproduksi fitohormon (biostimulan) misalnya IAA (Indole Acetic Acid), sitokinin, giberelin, dan penghambat produksi etilen, dapat menambah luas perlukaan akar-akar halus; serta meningkatkan ketersediaan nutrisi bagi tanaman (biofertilizer).
Hasil analisis filogenetika dengan 1000 kali ulangan Bootstrap dan pendekatan Maximum parsimony menujukkan bahwa rizobakteri perakaran undis daerah Buleleng (R13) memiliki kedekatan dengan spesies Empedobacter brevis atau Flavobacterium breve. Hal tersebut karena berdasarkan pohon filogeni pada Gambar 2 terlihat bahwa rizobakteri perakaran undis daerah Buleleng (R13) berada satu kelompok (klade) dengan sekuen-sekuen spesies Empedobacter brevis dan Flavobacterium breve.
Flavobacterium breve dan Empedobacter brevis merupakan bakteri yang sama. Hal tersebut telah diteliti oleh Panaiyadiyan dan Chellaia (2011) yang menyatakan bahwa Empedobacter brevis sebelumnya dikenal sebagai Flavobacterium breve yang ditemukan di lingkungan tanah, air, maupun tanaman.
Flavobacterium breve merupakan bakteri pelarut fosfat yang pernah dilaporkan oleh Suliasih dan Rahmat (2007) selain Klebsiella aerogenis dan Chromobacterium lividum. Menurut Goenadi dan Saraswati (1993),
Flavobacterium dapat melarutkan fosfat yang terikat dalam mineral tanah menjadi senyawa yang mudah diserap oleh tanaman dan membantu proses dekomposisi bahan organik tanah. Bakteri ini hidup di tanah dan air. Hal serupa dinyatakan oleh Sashidhar dan Podile (2009) bahwa Flavobacterium merupakan bakteri yang mampu melarutkan fosfat tidak tersedia menjadi fosfat tersedia bagi tanaman.
Flavobacterium breve merupakan bakteri pelarut fosfat yang pernah dilaporkan oleh Suliasih dan Rahmat (2007) selain Klebsiella aerogenis dan Chromobacterium lividum. Menurut Goenadi dan Saraswati (1993),
Flavobacterium dapat melarutkan fosfat yang terikat dalam mineral tanah menjadi senyawa yang mudah diserap oleh tanaman dan membantu proses dekomposisi bahan organik tanah. Bakteri ini hidup di tanah dan air. Hal serupa dinyatakan oleh Sashidhar dan Podile (2009) bahwa Flavobacterium merupakan bakteri yang mampu melarutkan fosfat tidak tersedia menjadi fosfat tersedia bagi tanaman.
Berdasarkan hasil penelitian, maka dapat disimpulkan bahwa:
-
1. Tiga isolat yaitu R13 (rizobakteri perakaran undis daerah Buleleng), R12 (rizobakteri perakaran undis daerah Badung), R9 (rizobakteri perakaran centrosema daerah Tabanan) mampu meningkatkan ketahanan tanaman kedelai sehingga berpengaruh terhadap hasil tanaman.
-
2. Isolat R13 (rizobakteri perakaran undis daerah Buleleng) yang terbaik memberikan respon positif terhadap ketahanan tanaman kedelai mempunyai similaritas tinggi (98%), jarak genetik yang kecil (0,002) dan berada dalam subkelompok yang sama dengan Empedobacter brevis (Flavobacterium breve) yang merupakan golongan dari bakteri pelarut fosfat.
-
4.2 Saran
Adapun saran yang dapat diajukan adalah sebagai berikut:
-
1. Perlu dilakukan pengembangan beragam formula rizobakteri dan pengujian lapangan untuk mengetahui efektifitas formula yang efektif dalam mengendalikan Soybean mosaic virus (SMV) pada tanaman kedelai.
-
2. Perlu dilakukan isolasi dan identifikasi terhadap senyawa aktif yang dihasilkan oleh rizobakteri yang berperan dalam menekan Soybean mosaic virus (SMV) pada tanaman kedelai.
Daftar Pustaka
Akin, H. M. 2006. Virologi Tumbuhan. Kanisius. Yogyakarta.
Andayanie, W. R. 2012. Diagnosis penyakit mosaik (Soybean Mosaic Virus) terbawa benih kedelai. Jurnal Hama Penyakit Tumbuhan Tropika 12(2):185‒191.
Badan Pusat Statistik [BPS]. 2015. Data Statistik Indonesia. Badan Pusat Statistik.
Jakarta. www.bps.go.id (diakses tanggal 2 Oktober 2015)
Cooke B. M. 1998. Disease Assessment and Yield Loss. Ed ke-2. London UK: Kluwer.
FAO. 2014. Data Tahunan FAO 2014. www. fao.org/statistic. (diakses tanggal 2 Oktober 2015).
Goenadi, D. H. dan Saraswati, R., 1993, Kemampuan Melarutkan Fosfat dari Beberapa Isolat Bakteri Pelarut Fosfat, Menara Perkebunan, 61(3): 160166.
Gupta, S. K., P.P. Gupta, T.P. Yadava, and C.D. Kaushik. 1990. Metabolic Changes in Mustard Due to Alternaria Leaf Blight. Indian Phytopathol. 43(1): 64-69.
Hanudin, E. S., S. Mihardja dan I. Sanusie. 2008. Mikroba Antagonis Agen Pengendali Penyakit Tanaman. Balai Penelitian Tanaman Hias, Cianjur.
Husen, E. 2009. Effect of IAA-Producing Bacteria on The Growth of Hot Pepper. Journal Mikrobiology Indonesia 8 (1): 22-26.
Khalimi, K., G. R. M. Temaja, G. N. Raka, G. Suastika. 2010. Pengembangan Teknik Formulasi PGPR dan Uji Konsistensinya dalam Meningkatkan Pertumbuhan dan Ketahanan Tanaman Kedelai Terhadap Soybean stunt virus. Laporan Penelitian Hibah Kompetitif Penelitian. Unud.
Marchesi, J. R. T. S., A. J. Weightman, T. A. Martin, J. C. Fry, S. J. Hiom, and W. G. Wade. 1998. Design and Evaluation of Useful Bacterium-Specific PCR Primers That Amplify Genes Coding for Bacterial 16S rRNA. Applied Environmental Microbiology 64: 795-799.
Maulina, I, Khamdan Khalimi, G.N. Alit Susanta Wirya, D.N. Suprapta. 2015. Potensi Rizobakteria yang Diisolasi dari Rizosfir Tanaman Graminae Non-Padi untuk Memacu Pertumbuhan Bibit Padi. Journal of Agriculture Biotechnology and Bioscience, 4(1).1-8.
Panaiyadayan, P. and S. R. Chellaia. 2011. Biodiversity of Microorganisms Isolated from Rhizosphere Soils of Pachamalai Hills, Tamilnadu, India. Research Journal of Forestry, 5: 27-35
Quintao, V. 2013. Pemanfaatan Rizobakteri yang Diisolasi dari Rizosfer Tanaman Padi sebagai Agen Hayati untuk Mengendalikan Penyakit Blas pada Tanaman Padi. Tesis. Program Magister P.S. Bioteknologi Pertanian, Universitas Udayana
Sashidhar, B. and Podile, A.R. 2009. Transgenic Expression of Glucose Dehydrogenase in Azotobacter vinelandii Enhances Mineral Phosphate Solubilization and Growth of Sorghum Seedlings. Microbial Biotechnol 2, 521–529.
Simons, T. J. and Ross A. F. 1970. Enhanced Peroxidase Activity Associated with Induction of Resistance to Tobaccto Mosaic Virus in Hypersensitive Tobacco. Phytopathological Notes 60: 383-384.
Sudana, M., I. G. N. Alit Susanta Wirya, and Gusti Ngurah Raka. 2016. Utilization of Phosphate Solubilizing Rhizobacterium Derived from Leguminosae Plants to Stimulating Plant Growth and Induce Systemic
Resistance of Soybean (Glycine max l. Merrill) to Mosaic Deseases. Int.J.Curr.Microbiol.App.Sci. 5(9): 600-610.
Suliasih dan Rahmat. 2007. Aktivitas Fosfatase dan Pelarutan Kalsium Fosfat oleh Beberapa Bakteri Pelarut Fosfat. Biodiversitas 8 (1): 23-26.
Suprapta, D.N, Ni Made Intan Maulina, Khamdan Khalimi. 2014. Effectiveness of Enterobacter cloacae to Promote the Growth and Increase the Yield of Rice . Journal of Biology, Agriculture, and Healthcare. 4(1). 44-50.
Van Loon. L. C, Bakker P. A, Pieterse C. M. J. 1998. Induction and Expression of PGPR-Mediated Induced Resistance Against Pathogens. Biological Control of Fungal and Bacterial Plant Pathogens 21: 103-110.
Widodo. 2006. Peran Mikroba Bermanfaat dalam Pengelolaan Terpadu Hama dan Penyakit Tanaman. Nganjuk: Apresiasi Penanggulangan OPT Tanaman Sayuran.
https://ojs.unud.ac.id/index.php/JASB
34
Discussion and feedback