PEMANFAATAN RHIZOBAKTERI PELARUT FOSFAT DARI TANAMAN LEGUM UNTUK PENINGKATAN PERTUMBUHAN DAN HASIL TANAMAN KEDELAI
on
J. Agric. Sci. and Biotechnol.
ISSN: 2302-0113
Vol. 7, No. 1, Juli 2018
PEMANFAATAN RHIZOBAKTERI PELARUT FOSFAT DARI TANAMAN LEGUM UNTUK PENINGKATAN PERTUMBUHAN DAN HASIL TANAMAN KEDELAI
Ni Komang Budiyani1, G. N. Alit Susanta Wirya1*),
I Made Sudana1, I Gusti Ngurah Raka 2
1Program Studi Bioteknologi Pertanian, Universitas Udayana 2Departemen Proteksi Tanaman, Fakultas Pertanian Institut Pertanian Bogor *)Corresponding author at: Jl. PB. Sudirman Denpasar, Bali, Indonesia
E-mail: alitsusanta@yahoo.com
Abstract
Soybean is one of the strategic commodities in Indonesia. Soybean became the third most important crop after rice and maize. Leguminose plants are known to have microbial diversity in soils through their root exudates and can have a positive impact on plant growth. The use of rhizobacteria, known as Plant Growth Promoting Rhizobacteria (PGPR), is a bacteria that lives in the root area (rhizospher) and plays an important role in the growth of plants with the ability to form colonies around the roots quickly and can maintain environmental sustainability, one of bacteria rootsis phosphate solubilizing bacteria. This research is conducted to determine the influence of phosphate solubilizing bacteria on the growth and yield of soybean crops. This study used a factorial pattern (RAK) with 3 repetition and 9 treatments. Treatments of Rhizo 09 isolates from undis Rhizosfer here showed the best results.The analysis of sequencing and pyhlogeni shows that Rhizo 09 has close proximity with Flavobakterium johnsoniae from China and having a high similarity (98%) and a small genetic distance (0.003).
Keywords :soybean, PGPR, phosphate solubilizing bacteria
Kedelai merupakan salah satu komoditas pangan utama setelah padi dan jagung yang kaya akan kandungan protein, sehingga komoditas ini memiliki kegunaan yang beragam terutama sebagai bahan baku industri makanan dan sekaligus sebagai bahan baku pakan ternak (Zakaria 2010).Ada beberapa faktor penyebab yang mempengaruhi penurunan produksi kedelai antara lain; penggunaan dosis pupuk kimia yang berlebihan, budidaya yang kurang tepat, dan pengaruh pertumbuhan hasil kedelai. Salah satu alternatif pengganti pupuk kimia adalah dengan menggunakan pupuk hayati. Menurut Maryanti (2006), Isolat bakteri pelarut fosfat memiliki potensi untuk dapat dimanfaatkan sebagai mikroorganisme yang menguntungkan bagi
tanaman. Pemanfaatan isolat bakteri biasanya dilakukan pada biji atau tanah bersama dengan pemakaian pupuk yang mengandung fosfat. Rhizobakteria dapat melarutkan fosfat dengan menghasilkan asam organik pengkelat. Pemanfaatan rhizobakteria juga secara nyata mampu memacu pertumbuhan bibit padi (Maulina, 2015) dan meningkatkan hasil tanaman padi (Suprapta, 2014).
Berdasakan latar belakang tersebut maka perlu dilakukan uji dari beberapa jenis bakteri yang diisolasi dari beberapa rhizosfer tanaman yang mampu berperan sebagai bakteri pelarut fosfat meningkatkan hasil tanaman kedelai.
Penelitian ini dilaksanakan dari bulan November 2016 sampai dengan April 2017, yang bertempat di Laboratorium Ilmu Penyakit Tumbuhan, Fakultas Pertanian Universitas Udayana dan Laboratorium Virology Tumbuhan Fakultas Pertanian Institut Pertanian Bogor. Sedangkan penelitian di lapangan dengan penanaman menggunakan pot, pada lahan terbuka di gedung parkir kampus Universitas Udayana.
-
2.2 Isolasi rhizobakteri dari rhizosfer tanaman leguminose
Isolasi rhizobakteri dari rhizosfer menggunakan metode Quinatao (2013), dimana sebanyak 10 g sampel akar dan tanah dimaserasi pada mortal kemudian diencerkan dalam 100 ml Phosphate Buffered Saline (PBS). Selanjutnya, dibuat seri pengenceran dengan PBS sampai pengenceran 10-4. Media yang digunakan untuk mengisolasi rhizobakteri adalah media Nutrient Agar (NA), 0,5% pepton, 1,5% agar, dan air suling. Koloni rhizobakteri yang tumbuh lalu dimurnikan dengan menggoreskan rhizobakteri pada media NA baru menggunakan loop kawat untuk mendapatkan koloni tunggal. Koloni tunggal lalu dipindahkan ke dalam media NA miring untuk digunakan pada pengujian selanjutnya.
-
2.3 Isolasi bakteri pelarut fosfat
Isolasi bakteri pelarut fosfat dilakukan menggunakan metode pengenceran (Platting Method). Diambil sebanyak 10 gram tanah dan dilakukan pengenceran (serial dilution method) hingga faktor pengenceran 10-5. Penanaman sempel dilakukan secara pour plate pada media selektif pikovskaya pada faktor pengenceran 10-4 dan 10-5. Koloni yang membentuk zona bening dimurnikan dengan cara steak for singel colony pada media pikovskaya (Pelczar dan Chan, 2006).
-
2.4 Uji kemampuan rizobakteri dalam melarutkan fosfat
Mikroba pelarut fosfat yang telah diremajakan selanjutnya dilakukan uji kemampuan melarutkan fosfat dalam cawan petri berisi media Pikovskaya padat
steril. Bahan yang digunakan dalam pembuatan media uji ini sama dengan bahan media Pikosvkaya pada tahap isolasi, namun Ca3(PO4)2 g/l pada media isolasi diganti dengan AlPO4, dan batuan fosfat (rock phosphate) dengan dosis 5 g/l media. Media uji dimasukkan dalam cawan petri dan dibiarkan mengeras. Selanjutnya biakan murni ditumbuhkan pada media uji. Tiap biakan murni diulang sebanyak tiga kali untuk mendapatkan rataan hasil yang valid. Inkubasi dilaksanakan selama tujuh hari. Mikroba pelarut fosfat yang membentuk holozone paling cepat dengan diameter paling besar secara kualitatif di sekitar koloni menujukkan besar kecilnya potensi mikroba pelarut fosfat dalam melarutkan unsur P dari bentuk yang tidak terlarut. Selanjutnya potensi mikroba dihitung menggunakan nilai indeks pelarutan yaitu nisbah antara diameter zona jernih terhadap diameter koloni (Premono, 1998).
-
2.5 Identifikasi spesies rizobakteri pelarut fosfat
Satu isolat rizobakteri yang menunjukkan kemampuan paling baik dalam meningkatkan hasil produksi tanaman kedelai, diidentifikasi untuk menentukan spesies. Ekstraksi total DNA dilakukan dengan GeneJET Genomic DNA Purification Kit Thermo. Gen 16S rRNA diamplifikasi dengan PCR menggunakan pasangan primer 16S 63F (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan 1387R (5’-GGG CGG WGT GTA CAA GGC-3’). Amplifikasi DNA menghasilkan fragmen DNA berukuran ±1.300 pb. Selanjutnya dilakukan sekuensing 16 RNA dan analisis sekuen DNA. Data yang berasal dari GenBank kemudian dilakukan analisis kesamaan menggunakan programBioEdit v.7.0.5. Analisis filogenetika menggunakan program MEGA v.6.06 berdasarkan algoritma Neighbor Joining dengan bootstrap 1000 kali.
-
2.6 Analisis Data
Data analisis secara statistik dengan anova (Analysis of Varians). Apabila pada analisis keragaman nilai F hitung < F tabel atau perluang (p) F > 0,05; maka H0 : Ti = 0 diterima yang berarti bahwa terdapat perbedaan pengaruh tidak nyata antar perlakuan yang dicoba, dan sebaliknya apabila F hitung > F tabel atau peluang (p) F < 0,05% maka H0 : Ti = 0 ditolak yang berarti bahwa terdapat perbedaan pengaruh yang nyata antara perlakuan yang dicoba. Apabila terdapat pebedaan yang nyata dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) pada taraf 5 %.
Uji hasil isolat-isolat rhizobakteri yang diberikan terhadap pertumbuhan tanaman kedelai memiliki pengaruh yang signifikan diantara pemberian perlakuan rhizobakteri dengan tanaman tanpa perlakuan rhizobakteri. Isolat 09 (berasal dari
perakaran tanaman undis di Kedisan Gianyar) yang memiliki hasil terbaik pada pertumbuhan tanaman kedelai.
Tabel 1.Tinggi tanaman, jumlah cabang. jumlah daun, dan kandungan klorofil pada
|
pertumbuhan tanaman kedelai yang diberikan perlakuan isolat Rhizobakteria | |
|
No |
Isolat Tinggi Jumlah Jumlah daun Kandungan tanaman(cm) cabang (helai) Klorofil (buah) (SPAD Unit) |
|
1 2 3 4 5 6 7 8 9 |
Rhizo 01 51.8 ab 2.3 ab 9.4 c 34.4 ab Rhizo 05 56.3 a 2.6 ab 12.6 a 39.0 a Rhizo 06 56.2 a 2.2 ab 14.1 a 39.1 a Rhizo 07 56.7 a 2.3 ab 9.5 c 34.9 ab Rhizo 09 59.0 a 3.6 a 14.7 a 39.8 a Rhizo 12 52.2 ab 2.3 ab 10.3 c 34.0 ab Rhizo 17 50.5 ab 2.6 ab 10.0 bc 34.6 ab Rhizo 19 50.1 ab 2.0 b 11.8 c 34.6 ab Kontrol 45.6 b 2.0 b 7.7 c 33.2 b |
Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan berbeda tidak nyata pada uji Duncant taraf 5%.
-
3.2 Identifikasi spesies rhizobakteri pelarut fosfat secara molokuler
Amplifikasi produk PCR sekuens 16 rRNA dari Rhizobakteri isolat Rhizo 09 yang menunjukkan kemiripan dari hasil uji biokimia kemudian diidentifikasi menggunakan primer 16S63F (5’-CAG GCC TAA CAC ATG CAA GTC-3' dan 1387R (5'-GGG CGG WGT GTA CAA GGC-3') menghasilkan fragmen DNA dengan ukuran ± 1.300 pb dan berhasil teramplifikasi (Gambar 1). Fragmen DNA yang dihasilkan selanjutnya dipurifikasi dan disekuensing untuk mengidentifikasi bakteri berdasarkan kemiripan dengan spesies bakteri yang telah teridentifikasi di program Genbank.
M Rhizo 09
1.500
1.000
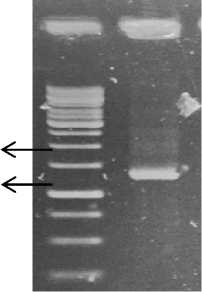
1.300
Gambar 1. Amplipikasi PCR dari gen 16S rRNA menggunakan primer 63F dan 1387 R pada gel agarose. M = Marker 1000 pb (Promega), Rhizo 09 = DNA Rhizobakteri isolat 09
Pengujian tingkat homologi antar isolat menunjukkan bahwa isolat Rhizobakteri perakaran undis kedisan mempunya kesamaan sebesar 97% dengan Flavobakterium johnsoniae yang berasal dari Cina.
Tabel 2. Homologi gen 16s rRNA bakteri dari perakaran undis daerah Kedisan
dengan hasil sekuen yang ada di Genbank
|
No. Isolat |
1 |
2 |
3 |
Homologi | ||||||
|
4 |
5 |
6 |
7 |
8 |
9 |
10 | ||||
|
Rhizo 09 | ||||||||||
|
FJ1CN |
97% | |||||||||
|
FJ2CN |
98% |
99% | ||||||||
|
FJ3CN |
97% |
100% |
100% | |||||||
|
FJ4JP |
91% |
94% |
93% |
93% | ||||||
|
FJ5US |
91% |
94% |
93% |
94% |
99% | |||||
|
FJ6US |
93% |
95% |
95% |
95% |
98% |
97% | ||||
|
FAJR |
88% |
91% |
90% |
90% |
96% |
96% |
94% | |||
|
FSJR |
88% |
91% |
90% |
91% |
96% |
96% |
94% |
98% | ||
|
ESC |
67% |
68% |
68% |
68% |
68% |
68% |
70% |
69% |
69% | |
Keterangan : Rhizo 09 (Isolat Kedisan), FJ1CN (Flavobakterium johnsoniae Cina), FJ2CN
(Flavobakterium johnsoniae Cina), FJ3CN (Flavobakterium johnsoniae Cina), FJ4JP(Flavobakterium johnsoniae Jepang), FJ5US (Flavobakterium johnsoniae US), FJ6US (Flavobakterium johnsoniae US), FAJR (Flavobakterium Aquidurense JERMAN), FSJR (Flavobakterium saccharophilum JERMAN), ESC (Escherichia Coli).
Hasil analisis sikuen nukleotida dengan Clustal W juga menunjukkan bahwa isolat Rhizo 09 memiliki homologi yang tinggi dengan isolat-isolat Flavobakterium johnsoniaeyang berasal dari Cina, Jepang, dan USA. Tingkat homologinya adalah berkisar 91%-98%. Tingkat kesamaan Rhizobakteri undis Kedisan dengan isolat perakaran Negara lain dapat dilihat pada Tabel 2.
Tabel 3. Jarak genetik gen 16s rRNA bakteri yang diisolasi dari perakaran undis
daerah Kedisan dengan yang ada di Genbank
|
No. Isolat |
Jarak Genetik | ||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 10 | |
|
Rhizo 09 | |||||||||
|
FJ1CN |
0.003 | ||||||||
|
FJ2CN |
0.003 |
0.000 | |||||||
|
FJ3CN |
0.003 |
0.000 |
0.000 | ||||||
|
FJ4JP |
0.012 |
0.009 |
0.009 |
0.009 | |||||
|
FJ5US |
0.010 |
0.007 |
0.007 |
0.007 |
0.008 | ||||
|
FJ6US |
0.013 |
0.010 |
0.010 |
0.010 |
0.002 |
0.008 | |||
|
FAJR |
0.044 |
0.041 |
0.041 |
0.041 |
0.045 |
0.045 |
0.046 | ||
|
FSJR |
0.035 |
0.032 |
0.032 |
0.032 |
0.038 |
0.038 |
0.038 |
0.019 | |
|
ESC |
0.271 |
0.269 |
0.269 |
0.269 |
0.269 |
0.271 |
0.270 |
0.268 |
0.266 |
Keterangan : Rhizo 09 (Isolat Kedisan), FJ1CN (Flavobakterium johnsoniae Cina), FJ2CN
(Flavobakterium johnsoniae Cina), FJ3JP(Flavobakterium johnsoniae Cina), FJ4JP(Flavobakterium johnsoniae Jepang), FJ5US (Flavobakterium johnsoniae US), FJ6US (Flavobakterium johnsoniae US), FAJR (Flavobakterium Aquidurense JERMAN), FSJR (Flavobakterium saccharophilum JERMAN), ESC (Escherichia Coli).
Jarak genetik merupakan perselisihan genetik antara spesies atau antara populasi dalam satu spesies tertentu. Jarak genetik diukur dengan berbagai parameter.Jarak genetik yang kecil menunjukkan hubungan genetik yang dekat dan sebaliknya, jarak genetik yang besar menunjukkan hubungan genetik yang jauh.Isolat Rhizobakteri dari perakaran undis daerah Kedisan (Rhizo 09) dengan tiga isolat Flavobacterium Johnsoniae dari Cina dan memiliki nilai jarak genetik terendah yaitu 0,003. Nilai tersebut menunjukkan bahwa nilai kedekatan antara isolat Rhizobakteri perakaran undis daerah Kedisan dengan tiga isolat tersebut sangat tinggi, dapat dilihat di tabel 3.
Hasil analisis pohon filogeni menggunakan metode maximum parsimony (MP) dengan 1.000 kali ulangan bootstrap menunjukkan bahwa pohon filogeni
terbagi atas tiga kelompok besar, kemudian terbagi lagi menjadi kelompok spesifik. Pohon tersebut menunjukkan kelompok pertama terdiri atas 3 strain isolat flavobakterium johnsoniae, flavobakterium aquidurense, flavobakerium saccharophilum, bahwa Rhizobakteri isolat Rhizo 09 memiliki kedekatan dengan Flavobakterium johnsoniae yang berasal dari Cina berasal dari perakaran tanaman tomat dengan menunjukkan satu klade dan memiliki nilai 95,7 % Bootstrap Support (BS) dapat dilihat pada gambar 2. Dharmayanti (2011) menyatakan bahwa untuk cabang-cabang dalam topologi filogenetika dapat diprediksi menjadi signifikan jika set data resampled seharusnya berulang kali (sebagai contoh > 70%) dalam memprediksi cabang-cabang yang sama.
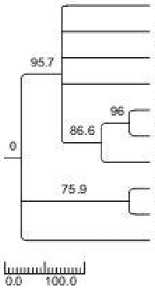
Rhizo 09
Flavobacteridm Johnsoniae (CINA) Flavobacteriumjohnsoniae (CINA) FlavobacteriumJohnsoniae (CINA) Flavobacterium Johnsoniae (JEPANG) Flavobacteriumjohnsoniae (USA) FlavobacteriumJohnsoniae (USA) Flavobacterium aquidurense (JERMAN) Flavobacterium Saccharophllum (JERMAN) Escherichia coli (USA)
Gambar 2. Hubungan kekerabatan 10 isolat bakteri hasil analisis kelompok berdasarkan gen 16S rRNA dengan metode Maximum Parsimony. Angka pada cabang merupakan persentase tingkat kepercayaan pengelompokan
-
3.3 Pembahasan umum
Pertumbuhan adalah proses dalam kehidupan tanaman yang mengakibatkan perubahan ukuran tanaman semakin besar dan juga menentukan hasil tanaman. Perubahan ukuran tubuh tanaman secara keseluruhan merupakan hasil dari pertumbuhan ukuran organ tanaman akibat dari pertambahan jaringan sel yang dihasilkan oleh pertambahan ukuran sel. Jumlah dan ukuran daun dipengaruhi oleh genotip dan lingkungan, dalam hal ini hasil penelitian mengenai pertumbuhan tanaman kedelai terlihat pada Gambar 3. Hasil pertumbuhan tanaman kedelai pada perlakuan kontrol dibandingkan dengan tanaman kedelai yang diberi perlakuan Rhizobakteri 05, Rhizo 06 dan Rhizo 09 menunjukkan perbedaan. Interaksi antara genotip dengan lingkungan memberikan penampakan pada tanaman (Gardner et al., 1991; Humphries dan Wheeler, 1963; Sitompul dan Guritno,1995). Dalam hal ini jumlah daun memiliki peranan untuk dapat meningkatkan hasil kedelai karena fotosintesis terjadi di dalam daun. Daun sebagai organ fotosintat utama karena
fungsinya sebagai penerima cahaya dan alat fotosintesis, maka daun secara tidak langsung memiliki peranan yang besar terhadap hasil kedelai (Sitompul dan Guritno, 1995).

Gambar 3. Pertumbuhan tanaman kedelai yang diberi berbagai isolat rhizobakteria pada 72 hari setelah tanam.
Keterangan : Kontrol (tanpa perlakuan), Rhizo 05 (isolat dari perakaran kelor), Rhizo 06 (isolat dari perakaran Undis), Rhizo 09 (isolat dari perakaran Undis Kedisan).
Pertumbuhan tanaman kedelai yang terbaik adalah yang diberikan isolat Rhizo 09, isolat tersebut mampu meningkatkan tinggi tanaman, jumlah cabang, jumlah daun, kandungan klorofil. Peningkatan tersebut disebabkan karena isolat Rhizo 09 yang mampu mampu beradaptasi dengan lingkungan perakaran kedelai dan bersimbiosis dengan akar kedelai secara baik sehingga dapat membantu menyediakan kebutuhan perkembangan tanaman. Rhizobakteria yang mampu berkoloni disekitar akar tanaman dan mampu memacu pertumbuhan tanaman disebut dengan Plant Growth Promoting Rhizobacteria (PGPR). Hasil penelitian ini sejalan dengan hasil penelitian Kloepper dan Scroth (1982) yang menemukan bahwa bakteri tanah yang mendiami daerah perakaran tanaman dan diinokulasikan ke dalam benih ternyata mampu meningkatkan partumbuhan tanaman. Keberadaan mikroorganisme ini akan sangat baik dan menguntungkan bagi tanaman. Hasil Rhizobakteri yang mampu meningkatkan hasil kedelai perhektar adalah pada isolat Rhizo 06 dan Rhizo 09 karena mampu meningkatkan berat biji per tanaman, berat polong per tanaman, jumlah biji per polong, dan jumlah biji per tanaman. Semakin tinggi biji yang
dihasilkan maka semakin tinggi hasil kedelai yang dihasilkan, karena pengamatan tersebut yang digunakan sebagai penilaian hasil kedelai.
Berdasarkan hasil penelitian maka dapat disimpulkan sebagai berikut :
-
1. Rhizobakteri pelarut fosfat Rhizo 09 yang diisolasi dari perkarakan tanaman undis di Desa Kedisan merupakan Plant Growth Promoting Rhizobacteria(PGPR) mampu memacu pertumbuhan tanaman dan
meningkatkan hasil tanaman kedelai.
-
2. Rhizo 09 secara molekuler diidentifikasi sebagai Flavobacterium johnsoniae.
-
4.2 Saran
-
1. Perlu dilakukan pengembangan beragam formula rizobakteri pelarut fosfat isolat Rhizo 09 dan pegujian lapangan untuk mengetahui efektivitas formula yang efektif dalam meningkatkan pertumbuhan dan hasil tanaman kedelai.
-
2. Perlu dilakukan isolasi identifikasi terhadap senyawa aktif yang dihasilkan oleh Rhizobakteri Flavobakterium johnsoniae dan isolat Rhizo 09 yang berperan dalam pertumbuhan dan hasil tanaman kedelai.
Daftar Pustaka
Dharmayanti, N.L.P.I. 2011. Filogenetika Molekuler: Metode Taksonomi Organisme Berdasarkan Sejarah Evolusi. Wartazoa.
Gardner, P. dan Mitchell. 1991. Fisiologi Tanaman Budidaya. UI Press. Jakarta.
Kloepper, J.W., & Schroth, M.N. 1982. Plant growth-promoting rhizobacteria onradish. 879-882. Dlm. Proc. 4th into Conf. Plant Pathogenic Bact. GibertClarey,Tours, Franco
Maryanti, D. 2006. Isolasi dan Uji Kemampuan Bakteri Pelarut Fosfat Dari Rhizosfir Tanaman Pangan dan Semak.[Skripsi]. Padang. Fakultas Pertanian Universitas Andalas.
Maulina, I, Khamdan Khalimi, G.N. Alit Susanta Wirya, D.N. Suprapta. 2015. Potensi Rizobakteria yang Diisolasi dari Rizosfir Tanaman Graminae Non-Padi untuk Memacu Pertumbuhan Bibit Padi. Journal of Agriculture Biotechnology and Bioscience, 4(1).1-8.
Pelczar, M.J. dan Chan. E. C. S. 2006.Dasar-dasar MikrobiologiJilid 2, UI Press. Jakarta.
Premono, E. 1994. Jasad renik pelarut fosfat “pengaruhnya terhadap P-tanah dan efisiensi pemupukan P-tanaman tebu. Disertasi. Program Pasca Sarjana. IPB. Bogor.
Sitompul, S.M. dan B.Guritno. 1995. Analisa pertumbuhan tanaman. UGM Press.Jogyakarta.
Suprapta, D.N, Ni Made Intan Maulina, Khamdan Khalimi. 2014. Effectiveness of Enterobacter cloacae to Promote the Growth and Increase the Yield of Rice . Journal of Biology, Agriculture, and Healthcare. 4(1). 44-50.
Zakaria AK. 2010. Kebijakan Pengembangan Budidaya Kedelai Menuju Swasembada Melalui Partisipasi Petani. Analisis Kebijakan Pertanian
https://ojs.unud.ac.id/index.php/JASB
22
Discussion and feedback