PEMANFAATAN BAKTERI PELARUT FOSFAT PENGINDUKSI HORMON IAA (Indol Acetic Acid) UNTUK PENINGKATAN PERTUMBUHAN KEDELAI ( Glycine max)
on
J. Agric. Sci. and Biotechnol.
ISSN: 2302-0113
Vol. 7, No. 1, Juli 2018
PEMANFAATAN BAKTERI PELARUT FOSFAT PENGINDUKSI HORMON IAA (Indol Acetic Acid) UNTUK PENINGKATAN PERTUMBUHAN KEDELAI (Glycine max)
Desak Putu Sudarmini1, I Made Sudana1*), I Putu Sudiarta1, Gede Suastika2
1Program Studi Bioteknologi Pertanian, Universitas Udayana 2Departemen Proteksi Tanaman, Fakultas Pertanian Institut Pertanian Bogor *)Corresponding author at: Jl. PB. Sudirman Denpasar, Bali, Indonesia E-mail: imadesudana74@yahoo.com
Abstract
Soybean is one of the agricultural commodities that are needed to fulfil food nutrients of Indonesian people. The low production of this commodity in Indonesia has not yet been able to meet the high demand for soybean that reaches 2.8 million tons per year, so that the Indonesian government still import soybeans at the amount of 2.26 million tons annually. The low production of soybeans in Indonesia is due to several factors, one of which is the expensive price of chemical fertilizers The use of rhizobacteria as bio-controlling agents can increase the availability of nutrients as well as crop production. Phosphate solubilizing bacteria are rhizobacteria that have the capacity to solubilize bound phosphate as well as trigger the growth hormone IAA that is the main hormone that controls various physiological processes in plants. The current study aimed to investigate whether isolates derived from rhizospheres of Leguminosae plants can induce IAA hormone and foster the vegetative growth of soybeans.
The research results showed that five out of nine isolates of the phosphate solubilizing bacteria are able to induce IAA hormone and foster the vegetative growth of soybeans. Isolate treatment that showed the best impact toward soybean growth was identified molecularly through PCR. The result of RHC6 isolate identification shows a DNA ladder size of 1300bp which is suitable with the primer used. Based on the phylogenetic analysis conducted, nucleotide sequence of RHC6 isolate from Bali has a high similarity (97%) to and a low genetic distance (0.018) from Brevundimonas diminuta isolate from the US.
Keywords: phosphate solubilizing bacteria, IAA hormone, soybean.
Tanaman kedelai (Glycine max ) merupakan salah satu komoditi pertanian yang diperlukan untuk mencukupi kebutuhan gizi pangan masyarakat Indonesia. Kebutuhan kedelai di Indonesia setiap tahun selalu meningkat seiring dengan pertambahan penduduk dan perbaikan pendapatan per kapita, namun produksi kedelai di Indonesia masih tergolong rendah dan belum dapat memenuhi kebutuhan konsumen. Rendahnya produksi kedelai di Indonesia dipengaruhi oleh
beberapa faktor, salah satunya adalah mahalnya harga pupuk kimia sehingga petani sulit untuk membeli pupuk kimia dan menyebabkan petani tidak dapat memupuk tanaman kedelai secara maksimal, Penggunaan pupuk kimia secara terus menerus dengan dosis yang berlebihan akan berdampak buruk terhadap lingkungan dan keberadaan mikroorganisme yang bermanfaat bagi pertumbuhan tanaman. Oleh karena itu perlu dilakukan usaha-usaha untuk peningkatan budidaya kedelai tanpa merusak lingkungan namun mampu meningkatkan produksi kedelai, salah satu upaya yang dapat dilakukan untuk meningkatkan produksi kedelai yaitu dengan aplikasi teknologi alternatif yang murah dan ramah lingkungan dengan memanfaatkan mikroorganisme sebagai agen biokontrol. Mikroorganisme yang sudah banyak dilaporkan mampu sebagai agen biokontrol adalah rhizobakteria atau dikenal sebagai plant growth promoting rhizobacteria (PGPR).
Bakteri pelarut fosfat merupakan salah satu rhizobakteri yang mempunyai peranan penting dalam meningkatkan ketersediaan P di dalam tanah bagi tanaman dan mempunyai kemampuan dalam menghasilkan zat pengatur tumbuh seperti IAA (Indole Acetic Acid) (Rao, 1994). Zat pengatur tumbuh merupakan senyawa yang dalam jumlah sedikit dapat berpengaruh besar terhadap pertumbuhan dan produksi tanaman. Zat pengatur tumbuh mampu diproduksi oleh mikroorganisme tertentu dan dapat dihasilkan oleh tanaman yang dapat mempengaruhi proses fisiologis. Penelitian ini bertujuan untuk mengetahui apakah isolat Bakteri pelarut fosfat yang diisolasi dari rhizosfer tanaman Leguminosae mampu menginduksi hormon IAA dan meningkatkan pertumbuhan vegetatif kedelai.
Penelitian ini dilaksanakan dari bulan Oktober 2016 sampai dengan Juni 2017. Isolat rhizobakteri yang digunakan adalah isolat yang di isolasi dari perakaran tanaman leguminosae yang tumbuh disekitar Kabupaten Badung, Buleleng, Gianyar dan Tabanan. Identifikasi secara molekuler terhadap BPF yang menujukan pertumbuhan terbaik dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
-
2.2 Isolasi Bakteri Pelarut Fosfat dari Rizosfer Tanaman Legum
Sampel diambil dari rhizosfer beberapa jenis tanaman leguminosae. Tanah pada daerah perakaran diambil sebanyak 50–100 g. Isolasi rizobakteri dari rizosfer menggunakan metode Quintao (2013). Mikroba pelarut fosfat yang telah diremajakan selanjutnya dilakukan uji kemampuan melarutkan fosfat dalam cawan petri berisi media Pikovskaya padat steril.
-
2.3 Uji Kemampuan Bakteri Pelarut Fosfat
Uji kemampuan pelarutan fosfat dilakukan dengan menggunakan media
Pikovskaya
Agar (0,25 g ekstrak yeast; 5 g dekstrosa; 2,5 g Ca3(PO4)2; 0,25 g (NH4)2SO4; 0,1 g KCl;
0,05 g MgSO4.7H2O; 0,005 g MnSO4.2H2O; 0,005 g FeSO4.7H2O; 10 g agar; 1000 mL air destilata). Bakteri pelarut fosfat yang telah diremajakan diinokulasi pada media Pikovskaya, secara aseptis sebanyak 1 ose kemudian diinkubasi pada suhu 28°C selama 3 hari dan diamati terbentuknya zona bening. Kemampuan pelarutan dihitung melalui rasio antara diameter zona bening dengan diameter koloni bakteri (Berraqueiro et al., 1976). Kemampuan pelarutan posfat dapat diklasifikasikan sebagai berikut: aktivitas pelarutan rendah (low solubilization) (E < 2), aktivitas pelarutan sedang (average solubilization) (2 < E <3) dan aktivitas pelarutan tinggi (high solubilization) (E > 3). Zona bening yang terdapat di sekeliling koloni diamati dan diukur indeks pelarutan fosfatnya berdasarkan rumus Silva
Filho (2002), :
Diameter zona bening – diameter koloni Diameter koloni
-
2.4 Uji kemampuan Isolat Rizobakteri Dalam Menghasilkan IAA
Penelitian ini menguji sembilan isolat yang diambil dari berbagai akar tanaman leguminose di beberapa daerah. Isolat tersebut meliputi RHC1 (undis 4), RHC2 (undis 1), RHC3 (undis 3), RHC4 (undis2), RHC5 (bangkoang), RHC6 (kelor), RHC7 (kara benguk), RHC8 (lamtoro), dan RHC8 (karo). Beberapa isolat tersebut merupakan isolat koleksi dari Laboratorium Penyakit Tumbuhan. Kemapuan masing-masing isolat rizobakteri dalam menghasilkan IAA dianalis dengan menggunakan metode Wahyudi at al., (2011) dan Rahman et al., (2010). Isolat rizobakteri ditumbuhkan selama 48 jam dengan medium NB. Untuk memacu sintesis IAA, ke dalam media NB ditambahkan asam amino L- trptopan 1 mM. Kultur rizobakteri disentrifugasi dengan kecepatan 1610 x g selama 30 menit, kemudian supernatant dipisahkan dari endapan bakteri, disaring dengan kertas saring Millipore (0,45 mm), dan kandungan IAA dianalisis. Kandungan IAA dalam filtrate kultur bakteri dideteksi dengan menggunakan pereaksi Salkowski. Pereaksi Salkowski (1 ml0,5 M FeCl13 dan 49 ml
35 % HClO4). Sebanyak 100 µl filtrate kultur rizobakteri dimasukan ke dalam sumuran Microplate ELISA ( ThermoFisher Scientific) selanjutnya Microplate ELISA diinkubasi dalam ruang gelap pada suhu kamar selama 30 menit. Penentuan Konsentrasi IAA dalam filtrate kultur rizobakteri dilakukan berdasarkan metode Kromatografi Gas – Spektroskopi Mass (KG2-SM) yaitu berdasarkan perbandingan kadar senyawa IAA dalam standar pada total luas area tertentu
sehingga diperoleh konsentrasi relatif senyawa IAA yang ada dalam sampel.
Senyawa IAA standar yang digunakan sebesar 0,05 mg/ml ( 50 µg/ml).
-
2.5 Identifikasi spesies rizobakteri pelarut fosfat terbaik
Satu isolat rizobakteri yang menunjukkan kemampuan paling baik dalam memicu ketahanan terhadap penyakit SMV diidentifikasi untuk menentukan spesies. Ekstraksi total DNA dilakukan dengan GeneJET Genomic DNA Purification Kit Thermo. Gen 16S rRNA diamplifikasi dengan PCR menggunakan pasangan primer 16S 63F (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan 1387R (5’-GGG CGG WGT GTA CAA GGC-3’) (Marchesi et al., 1998). Amplifikasi DNA menghasilkan fragmen DNA berukuran ±1.300 pb. Selanjutnya dilakukan sekuensing 16 RNA dan analisis sekuen DNA. Data yang berasal dari GenBank kemudian dilakukan analisis kesamaan menggunakan program BioEdit v.7.0.5. Analisis filogenetika menggunakan program MEGA v.6.06 berdasarkan algoritma Neighbor Joining dengan bootstrap 1000 kali.
-
2.6 Analisis Data
Data dianalisis dengan analisis sidik ragam atau ANOVA. Apabila pada analisis keragaman nilai F hitung ≤ F tabel atau peluang (p) F > 0,05; maka H0 : Ti = 0 diterima yang berarti terdapat perbedaan pengaruh tidak nyata antar perlakuan yang dicoba; dan sebaliknya. Apabila terdapat perbedaan nyata, dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) pada taraf 5%.
Hasil uji efektivitas isolat-isolat terhadap petumbuhan tanaman kedelai menujukkan perbedaan yang sangat nyata antara tanaman yang diberi perlakuan isolat rizobakteri dengan tanaman yang tidak diberi perlakuan. Isolat RHC6 (isolat dari perakaran tanaman kelor daerah Gianyar) memberikan respon terbaik terhadap berbagai variabel pertumbuhan tanaman kedelai
Tabel 1. Rata-rata Nilai Pengaruh Isolat Rhizobakteri terhadap Tinggi Tanaman, Jumlah Daun, Cabang dan Kandungan Klorofil pada Kedelai Umur Lima MingguTinggi
|
Jumlah |
Tanaman (cm) |
Daun (Helai) |
Jumlah |
Klorofil ( SPAD) | |||||
|
1 |
Kontrol |
46,78 |
bc |
11,00 |
b |
2,33 |
b |
31,4 |
ab |
|
2 |
RHC1 |
48,33 |
b |
11,00 |
b |
2,00 |
b |
33,2 |
ab |
|
3 |
RHC2 |
51,84 |
a |
12,25 |
a |
2,67 |
ab |
40, 1 |
a |
|
4 |
RHC3 |
46,6 |
bc |
11,08 |
b |
2,33 |
b |
32,6 |
ab |
|
5 |
RHC4 |
50,86 |
b |
11,83 |
a |
3,00 |
a |
42, 5 |
a |
|
6 |
RHC5 |
50,63 |
b |
11,25 |
b |
2,00 |
ab |
35,9 |
ab |
|
7 |
RHC6 |
53,82 |
a |
12,67 |
a |
3,00 |
a |
45, 8 |
a |
|
8 |
RHC7 |
51,56 |
a |
12,08 |
a |
2,67 |
b |
37,8 |
b |
|
9 |
RHC8 |
47,22 |
b |
11,00 |
b |
2,00 |
ab |
33,8 |
b |
|
10 |
RHC9 |
46,91 |
bc |
11,00 |
b |
2,00 |
ab |
32,5 |
ab |
Keterangan : Angka - angka yang diikuti oleh huruf yang sama pada kolom yang sama menunjukan perbedaan tidak nyata pada Uji Duncant taraf 5%
Bakteri pelarut fosfat berpengaruh sangat nyata terhadap pertumbuhan vegetatif tanaman kedelai yang meliputi tinggi, jumlah daun, kandungan klorofil dan jumlah cabang. Isolat RHC6 mununjukan persentase pertumbuhan tertinggi jika dibandingkan dengan perlakuan isolat lainnya, kemudian diikuti dengan isolat RHC2 dan RHC7. Hal ini menunjukan bahwa isolat rhizobakteri yang diinokulasikan pada tanaman kedelai memberikan pengaruh terhadap pertumbuhan kedelai sehingga mampu meningkatan pertumbuhan kedelai jika dibandingkan dengan tanaman kontrol yang tanpa diberikan perlakuan isolat rhizobakteri.
Bakteri pelarut fosfat merupakan bakteri yang memiliki kemampuan sebagai biofertilizer dengan cara melarutkan fosfat yang masih terjerat didalam tanah seperti unsur Fe, Al, Ca dan Mg, sehingga unsur-unsur tersebut dapat dilarutkan oleh bakteri selanjutnya menjadi unsur yang tersedia bagi tanaman. Tanaman yang diinokulasikan dengan bakteri pelarut fosfat telah diteliti oleh Toro et al., (1996), hasil penelitian tersebut menunjukkan bahwa simbiosis antara tanaman dengan bakteri pelarut fosfat tersebut dapat meningkatkan pertumbuhan dan serapan nutrisi tanaman.

Kontrol RHC2 RHC6 RHC7
Gambar 1. Perbandingan tanaman Kontrol dengan tiga tanaman yang diberikan perlakuan isolat RHC2, RHC6 dan RHC7 pada umur lima minggu yang menunjukan pertumbuhan terbaik diantara perlakuan isolat lainnya.
Bakteri pelarut fosfat juga memiliki kemampuan mestimulus hormon-hormon pertumbuhan tanaman seperti IAA yang merupakan hormon utama yang mengatur aktivitas fisiologi pada tanaman. Perlakuan rhizobakteri meningkatkan konsentrasi IAA dalam akar tanaman kedelai, Rhizobakteri yang sudah berkolonisasi di akar mengubah asam amino tryptopan yang terkandung dalam eksudat akar kedelai menjadi senyawa IAA Peningkatan konsentrasi IAA dalam akar akan meningkatkan pertumbuhan dan perkembangan akar sehingga penyerapan unsur hara menjadi lebih maksimal untuk pertumbuhan tanaman kedelai. IAA juga berperan dalam pembelahan dan pemanjangan sel, salah satunya pada sel-sel batang dan tunas pada pertumbuhan vegetatif, sehingga mampu meningkatkan panjang batang pada suatu tanaman (Talanca, 2010) . Peningkatan jumlah akar akan meningkatkan koinokulasi Rhizobium sehingga meningkatkan penyerapan unsur hara terutama unsur utama nitrogen meningkatkan, protein, asam amino, amida, asam nukleat, nukleotida, dan krolofil. Unsur nitrogen akan meningkatkan warna hijau dan dapat mendorong pertumbuhan batang dan daun ( Olaniyi et al., 2008).
-
3.2 Kemampuan Rhizobakteri Pelarut Fosfat Dalam Memacu Hormon
Tumbuh IAA Pada
Pertumbuhan Vegetatif Tanaman Kedelai
Hasil pengujian terhadap kemampuan beberapa isolat bakteri pelarut fosfat dalam memacu hormon IAA pada pertumbuhan vegetatif tanaman kedelai menunjukan bahwa terdapat beberapa isolat mampu menghasilkan hormon IAA. Isolat RHC2, RHC4, RHC5, RHC6, RHC7 menunjukan hasil yang positif dapat menghasilkan hormon IAA , sedangkan isolat RHC1, RHC3, RHC8, dan RHC9 menunjukan hasil yang negatif. Isolat yang mengalami perubahan
warna bening menjadi warna merah muda menunjukan bahwa isolat tersebut mampu mengghasilkan hormon auksin. Sedangkan pada isolat yang tidak mengalami perubahan warna menunjukan isolat tersebut tidak menghasilkan hormon IAA. Isolat yang mampu menghasilkan IAA secara kualitatif akan berwarna merah muda karena adanya interaksi antara IAA dengan Fe membentuk senyawa kompleks [Fe2(OH)2(IA)4], Interaksi tersebut terjadi pada suasana asam (Kovacs 2009). Berdasarkan penelitian-penelitian yang telah dilakukan, respon tanaman terhadap IAA yang dihasilkan mikroba berbeda-beda tergantung spesies tanaman dan konsentrasi IAA yang dilepaskan ( Patten dan Glick, 2002).
-
3.3 . Identifikasi Spesies Rhizobakteri Pelarut Fosfat Secara Molekuler
Isolat rhizobakteri yang diindentifikasi adalah isolat yang menunjukan persentase pertumbuhan tertinggi pada fase vegetatif tanaman kedelai yaitu isolat RHC6. Deteksi dengan menggunakan PCR terhadap isolat RHC6 memberikan hasil pita DNA yang sangat jelas dan produk PCR sesuai dengan primer 16S 63F dan 1387 R.
M RHC6
1500bp
1000bp—►
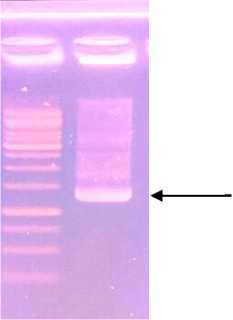
1300bp
Gambar 2. Hasil amplifikasi PCR dari gen 16S rRNA menggunakan primer 16S pada gel agarose.
(M = marker 1000 bp (Promega), RHC6 = hasil PCR rhizobakteri isolat RHC6).
Deteksi menggunakan PCR terhadap sampel isolat RHC6 yang menunjukan persentase tertinggi pada pertumbuhan vegetatif tanaman kedelai menunjukan hasil pita DNA berukuran 1300 bp sesuai dengan primer yang digunakan. Pengujian tingkat homologi antar isolat menunjukkan bahwa isolat RHC6 Bali (Gianyar) mempunyai kesamaan sebesar 97% dengan isolat Brevundimonas diminuta berasal dari USA ( BVR4). Isolat RHC6 Bali jika dibandingkan dengan isolat P. diminuta asal USA memiliki tingkat homologi yang lebih rendah dibandingkan dengan Isolat B. diminutadan B. naejangsanensis yaitu 86%.
Isolat RHC6 Bali dengan isolat B. diminuta yang bersasal dari USA memiliki nilai jarak genetik yang paling rendah yaitu 0,018. Nilai tersebut menunjukkan bahwa tingkat kedekatan antara Isolat RHC6 Bali dengan B. diminuta yang bersasal dari USA sangat tinggi. Tingginya kedekatan antara isolat RHC6 Bali dengan isolat B. diminuta menunjukkan bahwa kedua isolat tersebut memiliki kesamaan gen yang tinggi.
Tabel 2. Homologi isolat RHC6 dengan sekuen homolognya yang ada di Genbank
NO HOMOLO
ISOLAT GI
RHC6 ID
|
BVR4 |
97% |
ID | ||||||||
|
BVR3 |
96% |
97% |
ID | |||||||
|
BVR2 |
96% |
99% |
97% |
ID | ||||||
|
BVR1 |
96% |
99% |
98% |
98% |
ID | |||||
|
BVR |
96% |
99% |
97% |
99% |
99% |
ID | ||||
|
PSD |
86% |
87% |
89% |
86% |
87% |
86% |
ID | |||
|
BVRN1 |
94% |
97% |
97% |
97% |
96% |
97% |
87% |
ID | ||
|
BVRN2 |
93% |
96% |
96% |
96% |
95% |
96% |
88% |
99% |
ID | |
|
ECH |
77% |
77% |
79% |
77% |
77% |
77% |
71% |
78% |
77% |
ID |
Keterangan: RHC6, Isolat Bakteri Pelarut Fosfat Gianyar; BVR4, isolat
Brevundimonas diminuta USA; BVR3, isolat B. diminuta USA; BVR2, isolat B. diminuta France; BRV1, isolat B. diminuta USA; BRV, isolat B. diminuta USA; PDS, Pseudomonas diminuta USA; BVRN1, isolat B. naejangsanensis USA; BVRN2, isolat B. naejangsanensis China; ECH, isolat Escherichia coli sebagai outgroup.
Isolat RHC6 Bali jika dibandingkan dengan isolat B. diminuta dari USA (BRV, BRV1 dan BRV3) dan France (BRV2) memiliki nilai jarak genetik dengan kisaran nilai diantara 0,021-0,023. Jarak genetik yang dimiliki antara Isolat RHC6 Bali dengan isolat P. diminuta yang berasal dari USA yaitu 0,020. Nilai jarak genetik yang besar juga dihasilkan Isolat RHC6 Bali dibandingkan dengan isolat B. naejangsanensis (BVRN1 dan BVRN2) yaitu 0.031.
Tabel 3. Jarak genetik Isolat RHC6 dengan sekuen homolognya yang ada di Genbank
NO
Jarak Genetik
|
ISOLAT |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
RHC6 | |||||||||
|
BVR4 |
0.018 | ||||||||
|
BVR3 |
0.020 |
0.002 | |||||||
|
BVR2 |
0.021 |
0.003 |
0.006 | ||||||
|
BVR1 |
0.023 |
0.005 |
0.006 |
0.008 | |||||
|
BVR |
0.021 |
0.003 |
0.002 |
0.007 |
0.005 | ||||
|
PSD |
0.020 |
0.002 |
0.001 |
0.005 |
0.007 |
0.002 | |||
|
BVRN1 |
0.031 |
0.013 |
0.014 |
0.016 |
0.016 |
0.013 |
0.013 | ||
|
BVRN2 |
0.031 |
0.013 |
0.014 |
0.016 |
0.016 |
0.013 |
0.013 |
0.000 | |
|
ECH |
0.202 |
0.191 |
0.192 |
0.191 |
0.193 |
0.193 |
0.191 |
0.193 |
0.193 |
Keterangan: RHC6, Isolat Bakteri Pelarut Fosfat Gianyar; BVR4, isolat Brevundimonas diminuta USA; BVR3, isolat B. diminuta USA; BVR2, isolat B. diminuta France; BRV1, isolat B. diminuta USA; BRV, isolat B. diminuta USA; PDS, Pseudomonas diminuta USA; BVRN1, isolat B. naejangsanensis USA; BVRN2, isolat B. naejangsanensis China; ECH, isolat Escherichia coli sebagai outgroup.
Hasil analisis filogenetika pada Gambar 2. menunjukan bahwa pohon filogeni tersebut terbagi menjadi tiga kelompok besar. Percabangan kelompok untuk rhizobakteri perakaran kelor daerah Gianyar (RHC6) masuk ke dalam satu kelompok dengan dukungan nilai bootstrap 93% bersama B. diminuta strain 2P05AC asal USA, B. diminuta strain 3P09MD asal USA, B. diminuta strain 3P09MA asal USA, B. diminuta strain 2P04AC asal USA, B.
diminuta strain 3F5N asal France dan P. diminuta asal USA .
r—RHC6 GIANYAR BALI
— Brevundimonas diminuta USA 1
— Brevundimonas diminuta USA 2
93
--Brevundimonas diminuta USA 3 — Brevundimonas diminuta USA 4 — Brevundimonas diminuta France o — — Pseudomonas diminuta USA
loo l- Brevundimonas naejangsanensis USA '—Brevundimonas naejangsanensis CHINA ------AF511430 1 Escherichia coli
Gambar 2. Hubungan kekerabatan 10 isolat hasil analisis kelompok berdasarkan pola pita DNA dengan metode Maximum Parsimony. Skala menunjukkan panjang cabang. Angka pada cabang merupakan persentase tingkat kepercayaan pengelompokan
Hasil analisis filogenetika dengan 1000 kali ulangan Bootstrap dan pendekatan Maximum parsimony menunjukkan bahwa isolat rhizobakteri perakaran kelor daerah Gianyar (RHC6) memiliki kedekatan dengan spesies B. diminuta dan
P. diminuta. Hal tersebut karena berdasarkan pohon fohon filogeni terlihat bahwa RHC6 berada dalam satu kelompok (klade) dengan sekuen-sukuen spesies B. diminuta dan P. diminuta. Kelompok besar kedua adalah dari spesies Brevundimonas naejangsanensis dengan holomologi 93-94%. Keberadaan isolat RHC6 dalam kelompok/klade yang sama dengan B. diminuta (P. diminuta) dan B. naejangsanensis menunjukan bahwa isolat tersebut memiliki kedekatan karena berasal genus Brevundimonas.
Brevundimonas diminuta dan Psedoumonas diminuta merupakan bakteri yang sama (Seger, 1994). B. diminuta sebelumnya dikenal sebagai B. diminuta (P. diminuta) yang merupakan bakteri Gram negatif yang hidup aerob di tanah dan air. B. diminuta (P. diminuta) merupakan salah satu bakteri pelarut posfat yang mempunyai kemampuan melarutkan fosfat yang terikat di dalam tanah. Berdasarkan hasil penelitian Asyiah dkk., 2015 menyatakan bahwa P. diminuta mampu meningkatkan pertumbuhan tanaman kopi arabika pada parameter tinggi tanaman, diameter batang, serta berat kering tajuk dan mengendalikan nematoda parasit Pratylenchus coffeae. Berdasarkan penelitian Namrata Singh at al., 2015 menyatakan bahwa B. diminuta mampu menghasilkan IAA dalam memacu pertumbuhan pada tanaman padi. Bakteri pelarut fosfat seperti
Pseudomonas dapat hidup bebas dalam bintil akar, rhizosfir, permukaan akar tanaman dan dalam tanah (Venkateswarlu dan Rao, 1983). Menurut Widawati dan Muharam (2012), aktivitas bakteri beberapa mampu menyediakan unsur P bagi tanaman serta dapat memproduksi hormon tumbuh seperti IAA (Indol Asam Asetat). Mekanisme Pseudomonas sp. Dalam memacu pertumbuhan tanaman banyak yang dilaporkan sebagai penghasil fitohormon dalam jumlah besar khususnya IAA untuk merangsang pertumbuhan (Watanabe, dkk., 1987). Glick dan Pasternak (1994) melaporkan bahwa Pseudomonas sp. adalah mikroba penghasil fitohormon khususnya IAA dalam jumlah besar dan mampu meningkatkan pertumbuhan tanaman dengan mengatur keseimbangan hormonal di dalam tanaman yang diinfeksi. Pseudomonas sp. mampu berkompetisi nutrisi berupa ion Fe yang terjadi pada kondisi ion Fe dalam jumlah yang terbatas. Bakteri ini mampu membentuk senyawa pengikat/penghelat ion tersebut sehingga menjadi tidak tersedia bagi mikroorganisme lain termasuk patogen.
Berdasarkan hasil penelitian dapat disimpulkan bahwa:
-
1. Lima dari sembilan isolat bakteri pelarut fosfat mampu memicu hormon tumbuh IAA yaitu isolat RHC2 (rhizobakteri perakaran undis daerah Gianyar), RHC4 (rhizobakteri perakaran undis daerah Buleleng), RHC5 (rhizobakteri perakaran bengkuang daerah Badung), RHC6 (rhizobakteri perakaran Kelor daerah Gianyar) dan RHC7 ( rhizobakteri perakaran kara benguk daerah Badung).
-
2. Hormon yang diekskresikan oleh isolat-isolat bakteri pelarut fosfat mampu meningkatkan pertumbuhan vegetatif tanaman kedelai.
-
3. Hasil identifikasi Isolat RHC6 (rhizobakteri perakaran kelor daerah Gianyar) yang menunjukan persentase pertumbuhan tertinggi pada fase vegetatif
kedelai mempunyai similiritas tinggi (97 %), jarak genetik yang kecil ( 0,018) dan berada dalam satu subkelompok yang sama dengan isolat Brevundimonas diminuta (Psedoumonas diminuta).
-
4.2 Saran
Perlu dilakukan penelitian lanjutan mengenai jenis hormon-hormon lainnya yang diinduksi oleh isolat rhizobakteri serta konsentrasi masing-masing hormon yang dihasilkan dalam mendukung pertumbuhan tanaman kedelai.
Daftar Pustaka
Aisyah, L.N. Soekarno W, Irfan F, Rita H. 2015. Populasi Pratylencus coffeae ( z). dan Pertumbuhan Bibit Kopi Arabika Akibat Inokulasi Pseudomonas diminuta L. dan Bacillus subtilis (C.)
Berraqueiro F. R, Baya A. M, Cormenzana A. R. 1976. Estabelecimiento de índices para el estudio de la solubilizacion de fosfatos por bacterias del suelo. ARS Pharmacéutica. 17: 399-406.
Kovacs K. 2009. Applications of Mosssbauer Spectroscopy in Plant Physiology [Ph.D.
Dissertation]. ELTE Chemistry Doctoral School, ELTE Institute of Chemistry, Budapest.
Marchesi, J. R. T. S., A. J. Weightman, T. A. Martin, J. C. Fry, S. J. Hiom, and W. G. Wade.
-
1998. Design and Evaluation of Useful Bacterium-Specific PCR Primers That Amplify
Genes Coding for Bacterial 16S rRNA. Applied Environmental Microbiology 64: 795-799.
Olaniyi,J.O.,Adelayose, K.A., Jegede, C.O. 2008. Influence of nitrogen fertilizer on the growth, yield and quality of grain Amaranth varieties. World Journal of agricultural Sciences 4 (4): 506 -513.
Pattern,C.L.,Glick,B.R. 2002. Role of Pseudomonas putida indole acetic acidin development of the the plant root system. Appl Environ Microbio
Quintao,V.2013. “Pemanfaatan Rhizobakteri yang Diisolasi Dari Rhizosfer Tanaman Padi Sebagai Agen Hayati untuk Mengendalikan Penyakit Blas pada Tanaman Padi” (tesis). Program Magister P.S. Bioteknologi Pertanian, Universitas Udayana.
Rahman, A., Sitepu,I.R., Yan T.S., Hashidoko, Y.2010. Salkowski’s reagen test as a primary screening index for functionalities of Rhizobacteria
isolated from wild dipterocarp saplings growing naturally on medium strongly acidic tropical peat soil. Biosci. Biotechnol.Biochem.74(11): 1-7.
Rao S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Edisi 2. UI Press, Jakarta Sergers, P.Vancanney, M. Pot. B., Torck, U. Hoste, B. 1994.
Classsification of Pseudomonas vesicularis Busing, Doll and Frytag 1953 in Brevundimonas gen, nov. as Brevundimonas diminuta comb. Nov., and Brevundimonas vesicularis comb.
Nov., Respectively.
Talanca, A.H., dan A.M. Adnan. 2005. Mikoriza dan Manfaatnya pada Tanaman Prosiding
Perhimpunan Entomologi dan Fitologi Indonesia p: 311-315.
Toro,M.,Azcon,R.,and J. M. Barea, 1997. Improvement of Arbuscular Mycorrhiza
development by inoculation of soil with Phosphate-Solubilizing Rhizobacteria to Improve Rock Phosphate Bioavailability (P32) and Nutrient Cycling. Appl Environ Microbiol 63:4408-4412.
Venkateswarlu,K and A.V. Rao. 1983. Response of Pearl millet to Inoculation with Different
Straints of Azospirillum brasilense, Plant Soil, 74:379- 387.
Wahyudi, A.T., Astuti, R.P., Widyawati, A., Meryandini, A., Nawaningsih, A.A 2011.
Characterization of Bacillus sp. Strain isolatd from rhizosphere of soybean plants for their use as potensial plant growth for promoting rhizobakteria. Journal of Microbiology and antimicrobials 3(2): 34-4
Watanabe I., Yoneyama T., Padre B., Ladha J.K. 1987. Different in Natural Abudance of N Varieties in Several Rice (Oriza Sativa L.) Varieties : Application for Evaluating N-Fixation. Soil Sci
Widawati, S dan Muharam, A. 2012. Uji Laboratorium Azospirillum sp. Yang Diisolasi dari
Beberapa Ekosistem. Journal Hortikultura 22 (3), 258-267.
https://ojs.unud.ac.id/index.php/JASB
12
Discussion and feedback