STRATEGI PENGENDALIAN PAPAYA RINGSPOT VIRUS (PRSV) PENYEBAB PENYAKIT BERCAK BERCINCIN PADA PEPAYA
on
J. Agric. Sci. and Biotechnol.
ISSN: 23020-113
Vol. 5, No. 1, Juli 2016
STRATEGI PENGENDALIAN PAPAYA RINGSPOT VIRUS (PRSV) PENYEBAB PENYAKIT BERCAK BERCINCIN PADA PEPAYA
I Gede Rai Maya Temaja1), I Putu Sudiarta, Ni Nengah Darmiati, Ni Made Puspawati
Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Udayana.
Jl. PB. Sudirman Denpasar. Telp./Fax: 0362-255346.
1E-mail: tderai@yahoo.com
Abstract
ELISA test results of symptomatic leaves from Tabanan, Bali showed that papaya ringspot virus (PRSV) as causing agents of ring spot disease on papaya in Bali. The objective of the study were to determine the control strategies of ringspot disease on papaya in the field. Control strategies of ringspot disease tested in this study were the use of metallic gray plastic mulch and plant barrier. Research result showed that plant barrier can provide a buffer zone to protect papaya that are planted within the confines of the buffer.
Key words: ringspot disease, papaya ringspot virus (PRSV), vector, host range
-
1. Pendahuluan
Pepaya (Carica papaya L.) merupakan buah meja bermutu dan bergizi yang tinggi. Buah pepaya telah lama dimanfaatkan sebagai bahan makanan. Buah matangnya sangat digemari sebagai buah meja dan sering dihidangkan sebagai buah pencuci mulut karena cita rasanya yang enak, relatif tingginya kandungan nutrisi dan vitamin, serta fungsinya dalam melancarkan pencernaan.
Tanaman pepaya banyak dibudidayakan, baik di daeah tropis maupun subtropis. Pepaya berasal dari Amerika Tengah. Tanaman buah menahun ini tumbuh pada tanah lembab yang subur dan tidak tergenang air, dapat ditemukan di dataran rendah sampai ketinggian 1000 m dpl. Negara-negara di daerah tropis yang banyak memanam pepaya adalah Brazil, Nigeria, Filipina, Meksiko, India dan Indonesia. Produksi pepaya di Bali tahun 2010, 2011, dan 2012 masing-masing 10.068 ton, 9.233 ton dan 7.864 ton (Statistik Dearah Propinsi Bali, 2013). Angka itu sangat jauh dari kebutuhan pepaya di Bali yaitu 50 ton per hari (Bisnis Bali, 2013), dan kebutuhan ini dipenuhi oleh perdagangan atar pulau.
Dalam pembudidayaannya, tanaman pepaya banyak menghadapi kendala terutama serangan patogen. Salah satu diantaranya adalah papaya ringspot virus
(PRSV). PRSV adalah penyakit pepaya yang ganas dan sering sebagai faktor pembatas produksi pepaya di dunia. Di Kauai (Hawaii) penyakit ini ditemukan tahun 1985 (Nishina et al., 1989). Walaupun penyakit yang disebabkan oleh virus ini baru ditemukan di Queeenslan tenggara (Australia) pada tahun 1991 (Thomas and Dodman, 1993), pada tahun 2005 penyakit ini sudah menjadi salah satu dari lima penyakit utama pada tanaman pepaya, dan tetap menjadi ancaman besar bagi industri pepaya komersial (Rod et al., 2005).
Gejala utama penyakit ini adalah tanaman terinfeksi menunjukkan gejala menguning dan stunting,motle pada helaian daun, shoe-string pada daun muda, water-soaked streak pada tangkai daun dan gejala bercak bercincin gelap kecil pada permukaan buah. PRSV-P ditularkan oleh 21 spesies kutudaun dari 11 genus, dua diantaranya yaitu Myzus persicae dan Aphis gossypii merupakan vektor utamanya (Purcifull et al. 1984). Sedangkan PRSV-W dapat ditularkan oleh 24 spesies kutudaun dari 15 genus, dengan Myzus persicae, Acyrthosiphum solani, Aphis craccivoradan Macrosiphum euphorbiae sebagai vektor alaminya.
Penelitian penulis pada tahun 2014, menemukan PRSV sudah menginfeksi pepaya di Desa Bangli, Kecamatan Baturiti, Kabupaten Tabanan; dan menimbulkan gejala bercak bercincin (Temaja et al., 2015). Dari kejadian ini, hal penting yang perlu mendapat perhatian dan tindak lajut adalah PRSV telah masuk ke Bali dan baru terdeteksi di daerah Tabanan. Adalah menjadi tanggung jawab moral bagi ilmuwan yang berkecimpung di bidang Fitopatologi, khususnya Virologi Tumbuhan untuk melaporkan secara ilmiah kejadian penyakit baru pada komoditas penting seperti pepaya, dan mencari solusi pengendaliannya.
Penyebaran penyakit pada areal pertanaman terutama karena perantaraan serangga vektor. Penelitian ini bertujuan untuk mancari strategi pengendalian penyakit ini di lapangan dengan mengendalikan serangga vektor yang masuk ke dalam pertanaman pepaya. Strategi pengendalian penyakit yang dikaji adalah pemanfaatan mulsa plastik abu-abu metalik dan tanaman penghalang.
-
2. Metode Penelitian
Strategi pengendalian yang diuji pada percobaan ini adalah strategi untuk mengendalikan penyebaran virus melalui serangga vektor, yaitu apliksi mulsa plastik hitam perak dan tanaman penghalang.
-
2.1 Penyiapan Lahan Bermulsa
Lahan yang digunakan percobaan adalah lahan tegalan dengan ketesediaan air yang mencukupi di kecamatan Baturiti. Daerah ini dipilih agar tekanan infeksi virus dari luar pertanaman cukup tinggi. Daerah tersebut menyediakan berbagai macam jenis tanaman yang dapat digunakan inang alternatif bagi virus sehingga berfungsi sebagai sumber inokulum bagi tanaman percobaan. Daerah tersebut menyediakan populasi berbagai jenis kutudaun (aphis) pada tingkat yang cukup tinggi sebagai agen pembawa (vektor) bagi virus ke dalam pertanaman percobaan. Lahan diolah dan dibuat guludan.Tanah guludan dicampur merata dengan pupuk kandang (atau pupuk organik lainnya) pada dosis 5 ton per hektar sebagai pupuk dasar. Pupuk NPK juga ditambahkan sebagai pupuk dasar. Setelah dirapikan, tanah guludan ditutup dengan mulsa plastik yang berwarna hitam perak. Lubang berdiameter 10 cm dibuat pada mulsa plastik dengan jarak 200 cm (kearah memanjang) sebagai tempat menanam bibit pepaya. Demikian juga sebagai perlakuan kontrol, lahan diolah sama seperti di atas namun tidak menggunakan mulsa plastik. Tata letak petak percobaan diatur sedemikian rupa sehingga memenuhi kaidah rancangan percobaan acak kelompok.
-
2.2 Penyiapan Tanaman Penghalang.
Dua minggu sebelum dilakukan penanaman benih pepaya, di sekeliling masing-masing petak perlakuan ditanami sebaris tanaman jagung dengan jarak tanam rapat (20 cm) sehingga baris tanaman jagung sudah siap sebagai penghalang bila tanaman pepaya sudah tumbuh. Pengamatan dilakukan setiap hari dengan mencatat perkembangan gejala yang terjadi pada semua individu tanaman pada setiap petak percobaan. Konfirmasi infeksi virus pada tanaman bergejala dilakukan dengan ELISA.
-
3. Hasil dan Pembahasan
-
3.1 Populasi Kutudaun
-
Pengamatan terhadap populasi kutudaun A. gossypii dan M. sanborni pada pertanaman papaya pada percobaan pengendalian PRSV dilakukan sejak dua minggu setelah tanam. Dari hasil pengamatan diketahui bahwa semakin bertambahnya umur tanaman, keberadaan kutudaun semakin meningkat dan mencapai puncaknya pada pengamatan 6 minggu setelah tanam (mst). Selanjutnya, keberadaan kutudaun akan menurun kembali dan terendah populasinya pada pengamatan 15 mst (Gambar 1 dan 2).
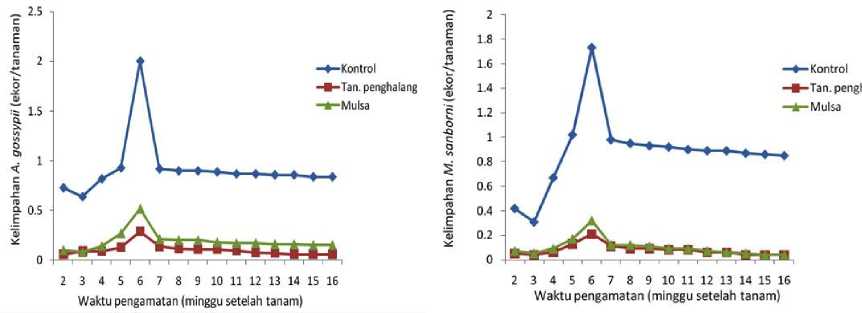
Gambar 1. Grafik rata-rata kelimpahan A. gossypii
Gambar 2. Grafik rata-rata kelimpahan M. sanborni
Pada pengamatan 6 mst, analisis sidik ragam menunjukkan bahwa perlakuan pengendalian yang diuji berpengaruh nyata terhadap populasi kutudaun. Perlakuan kontrol menyebabkan populasi kutudaun tertinggi dan berbeda nyata dengan perlakuan tanaman penghalang yang juga menunjukkan berbeda nyata dengan perlakuan mulsa (Tabel 1). Rata-rata kelimpahan A. gossypii pada kontrol yaitu sebesar 2 ekor, pada tanaman penghalang 0,29 ekor dan pada perlakuan mulsa 0,52 ekor. Sedangkan rata-rata kelimpahan M. sanborni pada kontrol yaitu sebesar 1,73 ekor, pada tanaman penghalang 0,21 ekor dan pada perlakuan mulsa 0,32 ekor.
Rendahnya populasi kutudaun pada perlakuan mulsa plastik hitam perak, karena warna perak pada permukaan atas mulsa memiliki kemampuan memantulkan sekitar 33% cahaya near ultra violet (Fahrurrozi dan Stewart, 1994), gelombang cahaya yang disukai oleh kebanyakan serangga, sehingga serangga akan mengikuti arah pantulan dan
meninggalkan pertanaman (Kring, 1974). Perlakuan tanaman rumput raja sebagai barier (perlakuan tanaman penghalang) juga cukup efektif menurunkan populasi kutudaun baik itu A. gossypii maupun M. sanborni. Perlakuan ini mengakibatkan populasi kutudaun terendah, walaupun secara statistik tidak berbeda nyata dengan perlakuan mulsa plastik hitam perak. Tanaman penghalang yang kanopinya lebih tingi dari tanaman pepaya menarik perhatian serangga untuk hinggap dan melakukan probing pada tanaman penghalang tersebut.
Tabel 1. Rata-rata kelimpahan A. gossypii dan M. sanborni pada pengamatan 6 mst
|
Perlakuan |
Rata-rata populasi | |
|
A. gossypii |
M. sanborni | |
|
Kontrol |
2,00 a |
1,73 a |
|
Tananaman penghalang |
0,29 b |
0,21 b |
|
Mulsa |
0,52 b |
0,32 b |
Keterangan : Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan perbedaan tidak nyata pada uji jarak berganda Duncant taraf 5 %.
Rata-rata kelimpahan kutudaun A. gossypii dan M. sanborni pada tanaman papaya mengalami peningkatan pada pengamatan 6 mst. Pada pengamatan 6 mst tanaman pepaya mengalami puncak masa vegetatif. Pada fase tersebut jaringan tanaman masih muda banyak mengandung cairan yang berisi nutrisi yang berguna untuk kebutuhan hidup serangga. Ini sesuai dengan pernyataan Ditlin (2008) yang menyatakan bahwa perkembangan kutu daun dapat tumbuh secara optimal pada saat tanaman bertunas atau pada fase vegetatif. Pada fase tersebut jaringan tanaman masih muda banyak mengandung cairan yang berisi nutrisi yang berguna untuk kebutuhan hidup serangga. Vanada (2013) menyatakan bahwa kutu daun memakan tanaman dengan cara menghisap cairan tanaman, sehingga serangga ini lebih menyukai tanaman yang masih lunak atau yang masih muda.
Pada pengamatan 15 mst populasi kutudaun baik itu A. gossypii maupun M. sanborni menurun karena pada pengamatan ini tanaman mengalami masa pertumbuhan generatif sehingga nutrisi pada tanaman sudah mulai berkurang sebab jaringan-jaringan tanaman telah mengalami pendewasaan. Sesuai dengan pendapat Untung (1993) menyatakan bahwa kelimpahan serangga akan berkurang ketika sumber makanan, tempat berlindung dan faktor lingkungan lainnya tidak mencukupi.
-
3.2 Persentase Infeksi PRSV
Keberadaan populasi vektor kutudaun A. gossypii sangat berkaitan dengan munculnya penyakit virus. Semakin banyak populasi vektor pada pertanaman, maka prevalensi virus sangat cepat sehingga mempercepat perkembangan epidemik penyakit (Boss, 1994). Hasil penelitian menunjukkan bahwa tanaman pepaya pada perlakuan kontrol memiliki persentase bergejala virus yang lebih tinggi daripada tanaman pepaya pada perlakuan tanaman penghalang dan mulsa palstik hitam perak. Pada pengamatan 12 mst, tanaman pepaya bergejala pada perlakuan kontrol, tanaman penghalang dan mulsa plastik hitam perak masing-masing 45,2%, 10,7% dan 20,8% (Tabel 2).
Tabel 2. Persentase tanaman bergejala
|
Perlakuan |
Tanaman bergejala (%) | |||||
|
2 mst* |
4 mst |
6 mst |
8 mst |
10 mst |
12 mst | |
|
Kontrol |
17,8 |
24,6 |
30,6 |
37,1 |
42,9 |
45,2 |
|
Tananaman penghalang |
0 |
3,3 |
5,3 |
7,8 |
9,6 |
10,7 |
|
Mulsa |
0 |
10 |
12,1 |
15,3 |
18,8 |
20,8 |
*
mst = minggu setelah tanam
Persentase tanaman yang menunjukkan gejala virus pada perlakuan kontrol sudah mulai terlihat pada umur 2 mst, sedangkan pada perlakuan lainnya tanaman bergejala virus baru tampak pada umur 4 mst. Tanaman pada perlakuan kontrol lebih banyak terinfeksi pada umur tanaman muda (2 mst). Virus lebih cepat menimbulkan gejala pada tanaman yang muda dibandingkan dengan tanaman tua, sehingga tanaman muda yang terinfeksi virus menimbulkan gejala yang lebih berat dan mengakibatkan pertumbuhan tanaman menjadi terganggu (Sastrahidayat, 1987). Saleh dan Baliadi (1992) mengungkapkan bahwa gejala tanaman yang terinfeksi akan lebih cepat tampak apabila infeksi terjadi pada saat tanaman masih muda, yang disebabkan oleh aliran energy atau metabolism lebih cepat dibandingkan dengan tanaman tua.
Persentase tanaman bergejala virus terendah terjadi pada perlakuan tanaman penghalang. Hal ini sebagai akibat dari rendahnya populasi vektor yang menghinggapi tanaman pepaya, disamping itu vektor kutudaun yang berhasil masuk ke pertanaman pepaya adalah vektor yang tidak mengandung virus (non-viruliferous vector), karena sebelumnya sudah hinggap dan melakukan probing pada tanaman penghalang (rumput raja) yang mengakibatkan virus yang dibawa oleh kutudaun dari tanaman terinfeksi dilepaskan pada tanaman penghalang tersebut.
Verifikasi terhadap tanaman bergejala virus dilakukan pada umur 12 mst, dengan uji ELISA. Hasil uji ELISA menunjukkan bahwa semua tanaman yang bergejala penyakit bercak bercincin terbukit positif terinfeksi virus PRSV.
Teknik pengendalian dengan tanaman penghalang yang ditanam di sekeliling pertanaman pepaya memberikan pengaruh yang lebih baik daripada mulsa plastik hitam perak, walaupun secara statistik tidak berbeda nyata. Persentase gejala dan infeksi PRSV yang rendah pada perlakuan ini sebagai akibat karakter vektor kutudaun A. gossypii yang penularannya secara non persisten dan tidak memiliki kemampuan terbang jarak jauh sehingga cenderung menghinggapi tanaman yang terdekat (tanaman penghalang) dan melakukan probing. Pada saat probing itulah virus yang ada pada styletnya dilepaskan pada jaringan tanaman penghalang pada saat vektor mencucukkan styletnya. Selanjutnya walaupun vektor ini terbang ke tanaman pepaya, tetapi vektor tersebut sudah non-viruliferous (tidak membawa virus). Teknik pengendalian ini juga dilaporkan oleh Gonsalves et al. (2004) cukup efektif mengendalikan penyakit bercak bercincin pada pepaya nontransgenik di Hawaii, dengan menanam tanaman transgenik di sekeliling areal nontransgenik sebagai barier. Vektor viruliferous akan hinggap dan menginfeksi tanaman pepaya border yang tahan terhadap virus PRSV, sehingga tanaman pepaya di dalam areal pertanaman tidak terinfeksi PRSV karena vektornya yang masuk ke dalam areal tersebut adalah vektor non-viruliferous.
Pengendalian PRSV isolat Bali penyakit bercak bercincin dapat dilakukan dengan menanam tanaman penghalang di sekitar pertanaman pepaya sebagai barier. Di samping itu harus memperhatikan tanaman inang alternatif dari PRSV. Tanaman-tanaman mentimun, semangka, melon dan labu berpotensi sebagai sumber inokulum PRSV isolat Bali di lapangan, yang meripakan inang-inang alternatif virus tersebut.
Penanaman tanaman penghalang di sekitar pertanaman pepaya efektif mengendalikan penyakit bercak bercincin pada pepaya.
Penulis mengucapkan terima kasih kepada Universitas Udayana atas dukungan dana penelitiannya, melalui dana PNBP.
Daftar Pustaka
Blackman RL, Eastop VF. 2000. Aphids on the World’s Crop. An identification and Information Guide 2ndeds.New York :John Wiley and Sons.
BPS. 2010. http://www.bps.go.id.Tanggal akses 1 September 2012.
Bos, L. 1994. Pengantar Virologi Tumbuhan. Penerjemah Triharso. Gajah Mada University Press.
Cottier W. 1953. Aphids of New Zealand. Wellington : Department of Scientific and Industrial Research Bulletin.
Dijkstra J, de Jager CP. 1998. Pratical Plant Virology. Protocol and Exercises. New York: Springer-Verlag Berlin Heidelberg.
Ditlin. 2008. Kutu Daun (Myzus persicae). http://ditlin.hortikultura.go. Diakses tanggal 5 Juli 2013. Edwardson J.R. and Christie R.G. 1986. Viruses infecting forage legumes. Florida Agriculture Experiment Station Monograph Series 4.
Fahrurrozi dan Stewart K.A., 1994. Effect of mulch optical properties on weed growth and development. Hort. Science 29 (6): 545.
Gonsalves, D. And Ishii M. 1980. Purification and serology of papaya ringspot virus. Phytopathology 70: 1028-1032.
Gonsalves D., Gonsalves C., Ferreira S., Pitz K., Fitch M., Manshardt R., Slightom J. 2004 Transgenic Virus Resistant Papaya: From Hope to Reality for Controlling Papaya Ringspot Virus in Hawaii. APSnet Feature. July 2004.
Kring J.B. 1974. New ways to repel aphids. Frontier of Plant Science 17:6-7.
Nishina M.S., W. T. Nishijima, F. Z. Curator, C. L. Chia, R. F.L. Mau, D. O. Evans. 1989. Papaya Ringspot Virus (Pry): A Serious Disease of Papaya. Hawaii Cooperative Extension Service, Hawaii Institute of Tropical Agriculture and Human Resources University of Hawaii at Manoa.
Noordam D. 1973.Identification of plant viruses, Methods &experiments.Wageningen : Centre for Agricultural Publh and Doc.
Rod D., Persley D., O’Brien C.and Bateson M. 2005. Papaya Ringspot Virus in Australia and the Development of Virus Resistant Plants. Proc. IInd IS on Biotech. of Trop & Subtrop. Species. Chang and Drew (Eds). Acta Hort 692, ISHS 2005. Pp. 101-106.
Temaja, IGRM., I P. Sudiarta, NN. Darmiati. 2015. Papaya Ringspot Virus (PRSV) Causing Ringspot Disease on Papaya in Bali. Journal of Biology, Agriculture and Healthcare: 5(18):50-55.
Thomas, J.E. and Dodman, R.L. 1993. The first record of papaya ringspot virustype P from Australia.Australasian Plant Path. 22:1-7.
Untung, K. 1993. Pengantar Pengelolaan Hama Terpadu. Yogyakarta: Gajah Mada University Press.
Vanada, A. 2013.Posisi Hama penting pada Setiap Fase Pertumbuhan Kedelai (Glycine max L. Mer.) di Kebun Percobaan Pegok (Skripsi). Denpasar : Fakultas Pertanian Universitas Udayana.
http://ojs.unud.ac.id/index.php/JASB
18
Discussion and feedback