DAYA HAMBAT EKSTRAK DAUN CABE JAWA (Piper retrofractum Vahl.) TERHADAP PERTUMBUHAN Staphylococcus aureus
on
Jurnal ITEPA Vol. 6 No. 2, Tahun 2017
DAYA HAMBAT EKSTRAK DAUN CABE JAWA (Piper retrofractum Vahl.) TERHADAP PERTUMBUHAN Staphylococcus aureus
Inhibition of Javanese Pepper Leaf Extract (Piper retrofractum Vahl.) To The Growth Of Staphylococcus aureus
I Putu Gede Krisnawan 1, Putu Ari Sandhi W 2, Agus Selamet Duniaji 2
1 Mahasiswa Jurusan Ilmu dan Teknogi Pangan, Fakultas Teknologi Pertanian, Universitas Udayana 2 Dosen Jurusan Ilmu dan Teknogi Pangan, Fakultas Teknologi Pertanian Universitas Udayana Email: iptgdkrisnawan@gmail.com
ABSTRACT
The research aimed to test the inhibition of javaneese pepper leaf extract (Piper retrofractum Vahl.) using distilled solvent to the growth of Staphylococcus aureus and to determine the best concentration of the javaneese pepper leaf extract can inhibit the growth of S.aureus. This research uses a Completely Randomized Design (RAL) using 5 treatments javaneese pepper leaf extract concentration of 20%, 35%, 50%, 65%, and 80% with 3 repetitions. Inhibition testing method using the discs to determine the diameter of the growth inhibition of S.aureus. The results of this research showed that all treatments give an inhibition effect 1.40; 2.38; 2.88; 3.76 and 4.4 mm respectivily. The best consentration treatment uses produced 4.49 mm diameter inhibition of 80% extract.On findings candidate phytochemical screening test showed that the leaf extract of javaneese pepper has active compounds such as saponins and flavonoids, as well as the findings Testing The levels of flavonoids have the highest levels of flavonoids are at treatment concentrations of 80% is equal to 222. 567 ppm.
Keywords: Javaneese pepper leaf extract, Staphylococcus aureus, Inhibition
PENDAHULUAN
Di Bali tanaman cabe jawa atau tabia bun (sebutan di daerah Bali) mudah ditemukan di dinding-dinding rumah dan tanaman ini sudah mulai dibudidayakan di seluruh desa adat di Bali (Sardiana, 2010). Tanaman cabe jawa adalah salah satu bahan obat tradisional yang dapat menyembuhkan radang mulut dan sakit gigi (Winarto, 2003). Daun cabe jawa merupakan bagian dari tanaman cabe jawa yang umumnya digunakan sebagai sayuran namun sebenarnya dapat dimanfaatkan sebagai antibakteri. Penelitian Jamal et al (2013) menyebutkan minyak atsiri hasil dari destilasi daun cabe jawa dapat menghambat beberapa jenis bakteri, salah satunya adalah pertumbuhan S.aureus (NBRC 14276) dengan daya hambat sebesar 8,00 mm pada konsentrasi 50%. Senyawa aktif yang berupa minyak atsiri pada daun cabe jawa sangat
berperan penting pada proses penghambatan pertumbuhan dari S.aureus. Selain minyak atsiri, di dalam daun cabe jawa juga terdapat beberapa senyawa lainnya seperti flavonoid dan saponin (Sari, 2012). Flavonoid dan saponin merupakan senyawa aktif yang pada daun cabe jawa dan untuk mendapatkan senyawa tersebut perlu dilakukannya proses ekstraksi dengan prasyarat pelarut yang digunakan harus sesuai. Sari et al (2013) menyebutkan penggunaan pelarut aquades memiliki keunggulan dibandingkan menggunakan pelarut etanol terhadap hasil ekstraksi yaitu hasil rendemen lebih dan kandungan bahan yang dicari lebih baik.
Ekstraksi dilakukan dengan menggunakan metode maserasi dimana proses pengekstrakan ( penarikan senyawa-senyawa aktif yang terdapat pada bahan) dilakukan
dengan cara merendamkan bahan ke dalam pelarut (Anon, 1986 dalam Sari 2012). Pemilihan pelarut dalam penelitian sangat mempengaruhi hasil dari ekstrak daun cabe jawa yang dibuktikan pada pelaksanaan pra penelitian. Hasil pra penelitian menunjukkan ekstrak daun cabe jawa dengan pelarut etanol memiliki daya hambat yang kecil yaitu sebesar 2,26 mm apabila dibandingkan dengan pelarut aquades yang memiliki daya hambat sebesar 4,57 mm pada konsentrasi 80%. Berdasarkan hal tersebut penelitian ini dilanjutkan menggunakan pelarut aquades untuk mengekstrak daun cabe jawa yang nantinya digunakan sebagai daya hambat pertumbuhan S.aureus.
S.aureus merupakan bakteri patogen yang umumnya hidup dipermukaan kulit dan bakteri ini memiliki sifat yang tahan tehadap perlakuan fisik atau enzim, tetapi lebih sensitif dengan antibakteri (Fardiaz, 1989). S.aureus merupakan bakteri patogen yang sering mengkontaminasi beberapa jenis bahan pangan seperti susu (Octaviantris, 2007) serta karkas ayam yang kurang baik saat penanganan pasca panen (Chotiah, 2009). Berdasarkan hal tersebut penelitian ini ingin menguji daya hambat ekstrak daun cabe jawa terhadap pertumbuhan S.aureus dan ingin mengetahui konsentrasi terbaik dari ekstrak daun cabe jawa dalam menghambat pertumbuhan S.aureus. Konsentrasi terbaik nantinya diharapkan dapat diaplikasikan sebagai senyawa aktif dalam pembuatan hand sanitizer.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Pengolahan Pangan, Laboratorium Analisis Pangan dan Laboratorium Mikrobiologi Pangan Jurusan Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Kampus Sudirman serta Di UPT Laboratorium Biosains dan Laboratorium Bioteknologi Fakultas Pertenakan, Universitas Udayana. Pelaksanaan penelitian ini dilakukan pada bulan September-Desember 2016.
Bahan dan Alat
Bahan utama berupa daun cabe jawa tua ( daun yang sudah berwarna hijau tua dan daun cabe jawa diambil pada petikkan daun ke 4 sampai petikkan daun ke 9) yang berasal dari Desa Dangin Puri Kaja, Denpasar Utara, Kota Denpasar, Provinsi Bali. Bahan kimia yang digunakan adalah aquades, aluminium foil, etanol 95% kertas saring, kertas whatman no 1, isolat bakteri Staphylococcus aureus yang diperoleh dari Laboratorium Mikrobiologi Pangan Jurusan Ilmu dan Teknologi Pangan FTP, Nutrien Broth (NB), Nutrien Agar (NA), AlCl310% (Merck), NaOH 10% (Merck), Standar Kuarsetin, dan alkohol 95%.
Alat-alat yang digunakan dalam penelitan ini adalah timbangan analitik ( Shimadzu), mikropipet (IKA), incubator (Memmert), rotary vacuum evaporator (IKA), spektrofotometer Uv-Vis, autoclav (Hirayama), mikroskop , jangka sorong, Laminar Flow (Kojair).
Pelaksanaan Penelitian
Penelitian ini dilakukan terhadap ektrak daun cabe jawa sebagai daya hambat pertumbuhan S.aureus. Adapun tahapan – tahapan pelaksanaan penelitian ini diawali dengan persiapan ekstrak daun cabe jawa, pengujian kualitatif, pembuatan konsentrasi dan pengujian kuantitatif ekstrak daun cabe jawa, persiapan S.aureus, dan pengujian daya hambat ekstrak daun cabe jawa terhadap pertumbuhan S.aureus.
Daun cabe jawa dicuci bersih, kemudian diangin-anginkan selama 60 menit, setelah itu daun cabe jawa dipotong kecil-kecil. Proses pembuatan ekstrak daun cabe jawa mengguankan metode meserasi dengan perbandingan daun cabe jawa dengan pelarut yaitu 1:10. Maserasi dilakukan selama 1x24 jam. Ekstrak disaring menggunakan kertas whatman no 1. Hasil dari semua saringan maserasi dijadikan satu kemudian diuapkan pelarutnya secara vakum menggunakan rotary evaporator sampai berbentuk ekstrak kental (Pandey dan Avinash 2010 yang dimodifikasi )
-
2. Pengujian kualitatif, pembuatan konsentrasi dan pengujian kuantitatif ekstrak daun cabe jawa
Pengujian kualitatif yang dilakukan pada ekstrak daun cabe jawa adalah uji kualitatif saponin dan flavonoid. Pengujian saponin dilakuan dengan cara diambil ekstrak daun cabe jawa sebanyak 0,1g ditambah 5 ml aquades panas lalu dikocok, sedangkan pengujian kualitatif flavonoid dilakukan
dengan cara diambil 0,1 g ekstrak daun cabe jawa kemudian ditambah 5 ml aquades lalu ditetesi NaOH 10 % (Rahayu et al., 2015).
Ekstrak daun cabe jawa, dibuat menjadi beberapa seri konsentrasi dengan menggunakan pelarut aquades. Setiap seri konsentrasi dibuat dengan menambahkan pelarut aquades ke dalam ekstrak kental daun cabe jawa, sampai volumenya 5 ml. Adapun perlakuan konsetrasi yang dibuat adalah 20%, 35%, 50%, 65% dan 80%.
Pengujian ini dilakukan dengan cara pengambilan sampel setiap konsentrasi sebanyak 0,1 ml, lalu ditambahkan 0,4 ml etanol 50% serta ditambahkan AlCl3 10% sebanyak 0,5 ml kemudian divorteks dan diinkubasi selama 24 menit. Ukur absorbansi pada 415 nm dan pengukuran absorbansi dilakukan 3 kali kemudian hasilnya dirata-ratakan (Chang dan Chern 2002 yang dimodifikasi).
Diinokulasi 1 ose biakan S.aureus dari media NA ke dalam 7 ml medium NB steril. Setelah itu inokulum diinkubasidalam inkubator selama 18- 24 jam pada suhu 370C . Pertumbuhan S.aureus dapat dilihat dengan adanya kekeruhan pada media NB (Akbar, 2008).
Pengujian ini meliputi pewarnaan gram dan pengamatan bentuk bakteri. Tahap awalnya adalah isolat bakteri yang telah disegarkan diratakan pada kaca objek yang
sudah dibersihkan dan diviksasi diatas api bunsen. Preparat ditetesi dengan kristal violet, air, lugol, dan saftranin. Preparat yang sudah dibilas dengan air dikeringkan dengan kertas saring kemudian campurkan 1 ose biakan dengan larutan nigrosin dan gelas preparat direkatkan. Preparat yang dibuat diamati pada mikroskop (Suriawiria, 1990)
Bakteri yang sudah disegarkan diambil menggunakan jarum ose, lalu ditanamkan pada media Nutrien Agar miring dengan cara menggores, setelah itu diinkubasi dalam inkubator pada suhu 37°C selama 18-24 jam. Untuk pembuatan stok kultur bakteri S.aureus (Silaban, 2009 dalam Fatisa, 2013).
-
4. Pengujian daya hambat ekstrak daun cabe jawa terhadap pertumbuhan Staphylococcus aureus
Bakteri yang telah disegarkan dimabil sebanyak 100 µL dan disebar ke dalam cawan petri yang sudah berisi media NA (Surjowardojo et al., 2015). Kemudian kertas cakram whatman no 1 yang sudah steril kemudian ditetesi dengan ekstrak daun cabe jawa sesuai perlakuan masing-masing sebanyak 20 µl, didiamkan sebentar hingga ekstrak daun cabe jawa meresap kedalam kertas cakram lalu ditempelkan pada media NA dan diinkubasi selama 24 jam pada suhu 37ᵒC. Hasil pengujian daya hambat berupa penghitungan zona bening yang dihasilkan oleh ekstrak daun cabe jawa terhadap pertumbuhan S.aureus (Ariyanti et al., 2012).
Analisis Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 5 perlakuan konsentrasi ekstrak daun cabe jawa (Piper retrofractum Vahl.) yaitu: 20%, 35%, 50%, 65% dan 80%. Percobaan diulang sebanyak tiga kali ulangan, sehingga diperoleh 15 unit percobaan. Data hasil penelitian berupa variabel diameter penghambatan (Inayati, 2007), Pengujian kualitatif saponin dan flavonoid (Rahayu et al., 2015) dan Pengujian Kadar Flavonoid (Azizah et al., 2014) disajikan dalam bentuk tabel dan gambar, kemudian dianalisis mengunakan ANOVA. Apabila terdapat pengaruh pada variabel yang diamati, maka dilanjutkan pada uji Duncan (Irianto, 2004).
HASIL DAN PEMBAHASAN
Hasil uji konfirmasi S.aureus dilihat dari pewarnaan gram dan pengamatan morfologi. Hasil pewarnaan gram bakteri terhadap S.aureus menunjukkan terjadinya pembentukan warna ungu yang menandakan S.aureus tersebut adalah bakteri gram positif. Berdasarkan hasil pengamatan pewarnaan gram dapat dilihat pada Gambar 1.
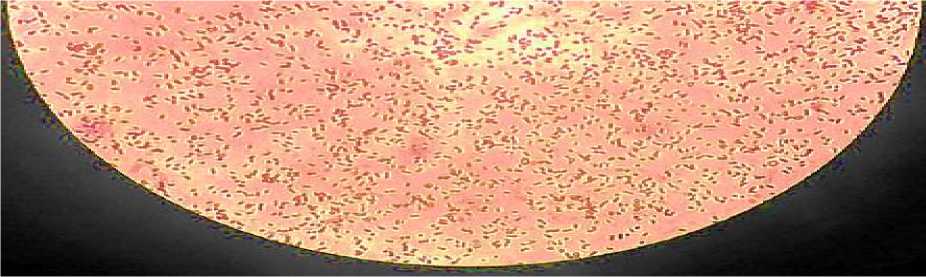
Gambar 1. Pewarnaan Gram Pada Staphylococcus aureus
Menurut Lay (1994) yang menyebutkan bahwa S.aureus merupakan bakteri gram positif yang ditandai dengan adanya warna ungu pada proses pewarnaan gram karena bakteri gram positif akan mempertahankan zat warna kristal violet dan akan tampak berwarna ungu tua di bawah mikroskop. Kemampuan bakteri gram positif yang bisa mempertahankan warna dikarenakan 90% dari dindingnya terdiri dari lapisan peptidoglikan maka dari itu saat proses
pencucian dengan alkohol setelah penambahan kristal violet dan lugol, lapisan peptidoglikan tidak tercuci semuanya dan tetap berwarna ungu (Fardiaz, 1989).
Hasil pengamatan morfologi atau bentuk terhadap sampel dengan menggunakan mikroskop yang dilakukan selama penelitian menunjukkan S.aureus, memiliki bentuk bulat dan berkoloni. Bentuk morfologi S.aureus dapat dilihat pada Gambar 2.

Gambar 2. Morfologi Staphylococcus aureus dengan Mikroskop Pada Pembesaran 1000x. Keterangan :
—► : bentuk bulat atau coccus pada bakteri Staphylococcus aureus
Jawetz et al.(1996) menyatakan S.aureus merupakan bakteri Gram positif yang berbentuk bulat dan berdiameter 0,7-1,2 µm, tersusun dalam kelompok-kelompok yang tidak teratur seperti buah anggur, berisfat
fakultatif anaerob, tidak membentuk spora, dan tidak bergerak. Bahkan bakteri ini tumbuh pada suhu optimum 37 ºC, tetapi membentuk pigmen paling baik pada suhu kamar (20-25 ºC).
-
2. Daya Hambat ekstrak Daun Cabe Jawa Terhadap Pertumbuhan Staphylococcus aureus
Hasil dari pengujian daya hambat ekstrak daun cabe jawa terhadap pertumbuhan S.aureus dapat dilihat pada Tabel 1. Hasil analisis sidik ragam menunjukkan bahwa perlakuan ekstrak daun cabe jawa dengan pelarut aquades berpengaruh sangat nyata (P<0,01) terhadap diameter penghambatan
-
S.aureus. Tabel 1. menunjukkan diameter penghambatan S.aureus berkisar antara 1,40 mm sampai 4,49 mm. Diameter penghambatan S.aureus terbesar diperoleh pada perlakuan ekstrak daun cabe jawa dengan konsentrasi 80% yaitu sebesar 4,49 mm, sedangkan diameter penghambatan S.aureus terkecil diperoleh pada perlakuan ekstrak daun cabe jawa yang 20% yaitu sebesar 1,40 mm.
Tabel 1. Diameter penghambatan ekstrak daun cabe jawa dengan pelarut aquades terhadap pertumbuhan Staphylococcus aureus
|
No |
Perlakuan (Konsentrasi) |
Rata-Rata Diameter Penghambatan (mm) |
Kategori Daya Hambat |
|
1 |
20% |
1,40 a |
Lemah |
|
2 |
35% |
2,38 b |
Lemah |
|
3 |
50% |
2,88 c |
Lemah |
|
4 |
65% |
3,76 d |
Lemah |
|
5 |
80% |
4,49 e |
Sedang |
Keterangan: Nilai rata-rata yang diikuti oleh huruf yang berbeda nyata pada kolom sama
menunjukkan perbedaan yang sangat nyata (P<0,01).
Perlakuan konsetrasi 20% sampai dengan konstrasi 65% termasuk dalam kategori daya hambat yang lemah sedangkan perlakuan konsentrasi 80% termasuk dalam kategori daya hambat yang sedang yang dapat dilihat pada Tabel 1. Pan et al., (2009) menyebutkan kategori daya hambat pada diameter penghambatan dikelompokkan menjadi tiga kategori yaitu pertama termasuk kategori lemah dengan diameter penghambatan adalah 0 mm – 3mm, kedua termasuk kategori sedang dengan diameter penghambatan adalah 3 mm – 6 mm dan ketiga termasuk kategori kuat dengan diameter penghambatan adalah > 6 mm. Tabel 1. menunjukkan terjadinya peningkatan diameter penghambatan terhadap S.aureus yang berbanding lurus dengan
perlakuan konsentrasi yaitu semakin tinggi konsentrasi ekstrak cabe jawa maka semikin tinggi juga daya hambat ekstrak daun cabe jawa terhadap pertumbuhan S.aureus. Kemampuan daya hambat ekstrak daun cabe jawa terhadap pertumbuhan S.aureus pada Tabel 1 diatas tidak terlepas dari peran senyawa aktif yang terdapat pada ekstrak daun cabe jawa serta peran pelarut yang digunakan untuk mengekstrak daun cabe jawa. Sari (2012) menyebutkan bahwa ekstrak daun cabe jawa memiliki kandungan senyawa aktif seperti flavonoid dan saponin sebagai antimikroba. Senyawa flavanoid merupakan senyawa polar yang umumnya mudah larut dalam pelarut polar (Kurniawan dan Aryana, 2015), sedangkan senyawa saponin merupakan
senyawa yang bersifat polar yang dapat larut dalam air (Evans, 2002 dalam Prasetyo dan Yosephine, 2012).
Pelarut yang digunakan untuk mengektrak sangat berperan penting bagi proses pengekstrakan atau penarikan senyawa aktif yang terdapat pada daun cabe jawa, karena pelarut aquades merupakan pelarut yang memiliki sifat polar dan sangat mempengaruhi
senyawa-senyawa yang terekstrak dalam bahan (Affandi, 2006).
Skrining fitokimia diujikan juga dalam penelitan ini sebagai landasan bagi perlakuan kadar setiap konsentrasi terhadap kekuatan daya hambat ekstrak daun cabe jawa dimana menunjukkan bahwa dalam ekstrak daun cabe jawa positif mengandung senyawa flavonoid dan saponin yang dapat dilihat pada Tabel 2.
Tabel 2.Skrining Fitokimia Ekstrak Daun Cabe Jawa
|
Skrining Fitokimia Ekstrak Daun Cabe Jawa |
Pereaksi |
Hasil Pengujian |
Kesimpulan |
|
Flavonoid |
NaOH 10% |
Terjadi perubahan warna kuning kecolatan |
Positif |
|
Saponin |
Aquades Panas |
Terbentuk Busa |
Positif |
Hasil skrining fitokimia pada Tabel 2 menunjukkan bahwa ekstrak daun cabe jawa memiliki senyawa flavonoid karena pada saat penambahan pereaksi berupa NaOH 10% terjadinya perubahan warna pada ekstrak daun cabe jawa menjadi kuning kecoklatan. Achmad (1986) menyebutkan terjadi perubahan warna kuning pada ekstrak setelah menambahkan peraksi NaOH 10%. Hal ini disebabkan adanya senyawa krisin yang merupakan turunan dari senyawa-senyawa flavon pada penambahan NaOH mengalami penguraian oleh basa menjadi molekul seperti asetofenon yang berwarna kuning karena adanya pemutusan ikatan pada struktur isoprena.
Ekstrak daun cabe jawa juga memiliki senyawa saponin setelah ditambahkan aquades panas dengan terbentuknya busa. Jaya (2010) menjelaskan bahwa penyebab terbentuknya
busa pada saponin disebabkan karena senyawa saponin memiliki sifat fisika yaitu mudah larut dalam air dan akan menimbulkan busa ketika dikocok.
Penelitian ini terbatas hanya menguji kadar flavonoid, karena senyawa flavonoid merupakan senyawa aktif yang umumnya digunakan sebagai antibakteri, selain itu kadar flavonoid sering digunakan untuk mengetahui besar atau kecilnya pengaruh dari diameter hambat yang dihasilkan sebagai daya hambat dari pertumbuhan bakteri. Hal serupa didapatkan oleh Parubak, (2013) yang menyebutkan kadar flavonoid diperoleh pada ekstrak daun Akway (Drimys beccariana Gibbs) sebesar 0,3680% dan memiliki diameter hambat sebesar (6,9 mm) sampai (7,3 mm). Sehingga ekstrak daun Akway (Drimys beccariana Gibbs) dapat dikembangkan 7
sebagai bahan antibakteri, antiseptik, antijamur dan sebagainya. Hasil pengujian kadar
flavonoid dapat dilihat pada tabel 3.
Tabel 3.Kadar Flavonoid
|
Perlakuan (Konsentrasi) |
Hasil rata-rata Kadar Flavonoid (ppm) |
|
20% |
37,031 a |
|
35% |
80,488 b |
|
50% |
110,206 c |
|
65% |
147,345 d |
|
80% |
222,567 e |
Keterangan: Nilai rata-rata yang diikuti oleh huruf yang berbeda nyata pada kolom sama menunjukkan perbedaan yang sangat nyata (P<0,01)
Hasil analisis ragam menunjukkan bahwa perlakuan konsentrasi pada ekstrak daun cabe jawa dengan kadar flavonid berpengaruh sangat nyata (P<0,01). Pada Tabel 3 dibawah menunjukkan kadar flavonoid pada ekstrak daun cabe jawa berkisar antara 37,031 ppm -222,567 ppm. Kadar flavonoid tertinggi pada ekstrak daun cabe jawa pada perlakuan konsentrasi 80% yaitu 222,567 ppm. Kadar flavonoid terendah pada ekstrak daun cabe jawa pada perlakuan konsentrasi 20% yaitu 37,031 ppm. Semakin banyak ekstrak yang digunakan saat pembuatan konsentrasi maka semakin besar pula kadar flavonoid. Hal ini menunjukkan terjadinya peningkatan kadar flavonoid berbanding lurus dengan perlakuan konsentrasi ekstrak daun cabe jawa ( Azizah et al., 2014).
KESIMPULAN DAN SARAN Kesimpulan
Kesimpulan dalam penelitian ini adalah
-
1. Ekstrak daun cabe jawa dengan pelarut aquades mampu menghambat pertumbuhan S.aureus dengan diameter
penghambatan tertinggi sebesar 4,49 mm pada konsentrasi 80%.
-
2. Hasil uji profil fitokimia menunjukkan bahwa ekstrak daun cabe jawa dengan pelarut aquades positif mengandung senyawa flavonoid dan saponin
-
3. Kadar flavonoid yang tertinggi terdapat pada konsentrasi 80% yaitu sebesar 222,567ppm.
Saran
-
1. Perlu dilakukan penelitian lebih lanjut mengenai pemilihan jenis pelarut yang tepat untuk mengekstraksi daun cabe jawa, sehingga dapat memaksimalkan daya hambat dari ekstrak daun cabe jawa terhadap pertumbuhan S.aureus
-
2. Perlu dilakukan pengujian lebih lanjut mengenai uji kuantitatif senyawa saponin yang terdapat dalam ekstrak daun cabe jawa dengan pelarut aquades.
DAFTAR PUSTAKA
Achmad, S.A., 1986. Kimia Organik Bahan Alam. Karunika Jakarta, Universitas Terbuka, Jakarta.
Affandi, Y. 2006. Pengujian Daya Penghambatan Ekstrak Air dan Etanol Keladi Tikus (Typhonium Flagelliforme) Terhadap Enzim Tirosin Kinase Secara In Vitro. Skripsi Institut Pertanian Bogor, Bogor.
Akbar, T.M. 2008. Pengaruh Cahaya Terhadap Senyawa Antibakteri Dari Chaetoceros gracilis. Skripsi Program Studi Teknologi Hasil Perikanan Fakultas Perikanan Dan Ilmu Kelautan Institut Pertanian Bogor, Bogor.
Ariyanti, N.K., I.B.G. Darmayasa, dan S.K. Sudirga. 2012. Daya Hambat Ekstrak Kulit Daun Lidah Buaya (Aloe barbadensis Miller) Terhadap Pertumbuhan Bakteri Staphylococcus aureus ATCC 25923 Dan Escherichia coli ATCC 25922. Jurnal Biologi XVI (1) : 1 – 4.
Azizah. D.N., E.Kumolowati, dan F.Faramayuda. 2014. Penetapan Kadar Flavonoid Metode Alcl3 Pada Ekstrak Metanol Kulit Buah Kakao (Theobroma cacao L.). Kartika Jurnal Ilmiah Farmasi, 2 (2), 45-49.
Chang, C.Y.M, dan W.H.Chern J. 2002. Estimation of Total
FlavonoidContent in Propolis by Two Complementary Colorimetric Methods, Journal of Food and Drug Analysis, Vol.10, No.3, 2002. Pages 178-182.
Chotiah, S. 2009. Cemaran Staphylococcus aureus Pada Daging Ayam dan Olahannya. Seminar Nasional Teknologi Peternakan dan Veteriner. Balai Besar Penelitian Veteriner, Bogor.
Fardiaz,S. 1989. Mikrobiologi Pangan. IPB Press, Bogor
Fatisa, Y. 2013. Daya Antibakteri Estrak Kulit Dan Biji Buah Pulasan (Nephelium mutabile) Terhadap Staphylococcus aureus dan Escherichia coli Secara In Vitro. Jurnal Peternakan Vol 10 No 1.
Inayati, H. 2007. Potensi Antibakteri Ekstrak Daun Kedondong Bangkok (Spondias dulcis Forst.).Skripsi
Program Study Biokimia IPB, Bogor.
Irianto, H.A. 2004. Statistik Edisi I. Kencana Prenanda Media Grup, Jakarta.
Jamal, Y., Pipit.I., Ahmad.F., dan Andria. A.2013. Chemical Constituen and Antibacterial Effect of Essensial Oil of Javaneese Pepper Leaves (Piper retrofractum Vahl.).
Indonesian Institute of Sciences, Research Center For Biology LIPI, Bogor.
Jawetz, E., J.L. Melnick, dan E.A. Adelberg. 1996. Edisi 20. Mikrobiologi Kedokteran. Penerbit Salemba
Medika, Jakarta.
Jaya, A.M. 2010. Isolasi dan Uji Efektivitas Antibakteri Senyawa Saponin dari Akar Putri Malu (Mimosa pudica). Skripsi Jurusan Kimia Fakultas Sains dan Teknologi Universitas Islam Negeri (UIN) Maulana Malik Ibrahim, Malang.
Kurniawan, B Dan W. F. Aryana. 2015. Binahong (Cassia Alata L) As Inhibitor Of Escherichia coli Growth. Artikel Review. Universitas Lampung, Lampung.
Lay, B.W. 1994. Analisis Mikroba di Laboratorium. Rajawali, Jakarta.
Octaviantris, F.A. 2007. Deteksi Bakteri Staphylococcus aureus Pada Susu Bubuk Skim (Skim Milk Powder) Impor. Skripsi Fakultas Kedokteran Hewan Institut Pertanian Bogor, Bogor.
Pan, X., F. Chen, T. Wu, H. Tang, dan Z. Zhao. 2009. The acid, Bile Tolerance and Antimicrobial
property of Lactobacillus
acidophilus NIT. J. Food Control 20 : 598-602.
Pandey, R & Avinash M. (2010). Antibacterial Activities of Crude Extract of Aloe barbadensis to Clinically Isolated Bacterial Pathogen.Appl Biochem Biotechnol. 160:1356–1361.
Parubak, A.S. 2013. Senyawa Flavonoid Yang Bersifat Antibakteri Dari Akway (Drimys becariana.Gibbs). Chem. Prog. Vol. 6, No.1.
Prasetyo, Susiana dan F.Yosephine. 2012. Model Perpindahan Massa Pada Ekstraksi Saponin Biji Teh Dengan Pelarut Isopropil Alkhohol 50%
dengan Pengontakan Secara Dispersi Menggunakan Analisis Dimensi. Jurnal Reaktor, Vol. 14 No. 2. Hal. 87-94
Rahayu, S., N.Kurniasih, Dan V.Amalia. 2015. Ekstraksi Dan Identifikasi Senyawa Flavonoid Dari Limbah Kulit Bawang Merah Sebagai Antioksidan Alami Al Kimiya, Vol. 2, No. 1.
Sardiana, I.K. 2010. Gumi Banten: Unit Pembibitan Tanaman Ritual (Upakara) Lembaga Pengabdian Kepada Masyarakat Universitas Udayana. MajalahAplikasi Ipteks Ngayah 1 (1), hal 13-21.
Sari, E.R. 2012. Uji Aktivitas Antifungi Ekstrak Etanol Daun Cabe Jawa (Piper retrofractum Vahl.) Terhadap Pertumbuhan Candida Albicans.Tugas Akhir Fakultas Matematika Dan Ilmu Pengetahuan
Alam Universitas Sebelas Maret, Surakarta.
Sari, F.K., Nurhayati, dan Djumarti. 2013. Ekstraksi Pati Resisten Dari Tiga Varietas Kentang Lokal yang Berpotensi Sebagai Kandidat Prebiotik Berkala Ilmiah Pertanian. Volume 1, Nomor 2, hlm 38-42
Surjowardojo, P., T.E.Susilorini, dan G.R.B.Sirait. 2015. Daya Hambat Dekok Kulit Apel Manalagi (Malus sylvestrs Mill.) Terhadap
Pertumbuhan Staphylococcus aureus dan Pseudomonas sp. Penyebab Mastitis Pada Sapi Perah. J. Ternak Tropika Vol. 16, No.2: 40-48.
Suriawiria, U. 1990. Pengantar Mikrobiologi Umum. Angkasa, Bandung.
Winarto,W.P. 2003. Cabe Jawa: Si Pedas Berkhasiat Obat. Agromedia
Pustaka, Jakarta.
10
Discussion and feedback