Kadar antioksidan superoksida dismutase (SOD) hati tikus pada aktivitas fisik berat
on
ARTIKEL PENELITIAN
E-JURNAL MEDIKA UDAYANA, VOL. 7 NO. 4, APRIL, 2018 : 143 - 147
ISSN: 2303-1395
DIRECTORY OF OPEN ACCESS JOURNALS
Kadar antioksidan superoksida dismutase (SOD) hati tikus pada aktivitas fisik berat
I Putu Prananta Andi Yunarsa1, I Putu Gede Adiatmika2
ABSTRAK
Aktivitas fisik berat yang dilakukan akan meningkatkan produksi radikal bebas atau reactive oxygen species ( ROS) di dalam tubuh sehingga dapat menurunkan enzim antioksidan intrasel hati, diantaranya superoksida dismutase (SOD). Penelitian ini bertujuan untuk mengetahui kadar antioksidan superoksida dismutase hati pada aktivitas fisik berat. Penelitian ini merupakan penelitian eksperimen laboratorium dengan rancangan randomized post-test only control group design. Penelitian ini menggunakan 20 ekor tikus jantan albino strain wistar dengan bobot badan rata-rata 200 g. Hewan percobaan dibagi menjadi dua kelompok, yaitu tanpa perlakuan atau perlakuan kontrol (K1) dan perlakuan dengan aktivitas fisik berat (K2). Perlakuan aktivitas fisik berat yang diberikan berupa renang selama satu jam/hari. Penelitian dilakukan selama tiga minggu. Pada akhir perlakuan, semua tikus dikorbankan nyawanya dengan cara euthanasia menggunakan ketamine-HCl 1 mL/200 g bb. Hati tikus diambil dan dibagi dua, yaitu untuk analisis kadar SOD dan untuk pewarnaan imunohistokimia. Data yang diperoleh dianalisis dengan uji t tidak berpasangan (independent t test). Hasil penelitian menunjukkan bahwa perlakuan aktivitas fisik berat mempunyai pengaruh negatif. Kadar SOD pada jaringan hati tikus sebesar 34,84% lebih rendah dibandingkan dengan perlakuan kontrol (K1) sebesar 68,39% (p<0,01). Secara imunohistokimia, pada jaringan hati tikus kontrol normal (K1), secara kualitatif tampak SOD bereaksi positif pada inti sel dan sitoplasma dengan intensitas warna coklat yang kuat dibandingkan jaringan hati tikus dengan perlakuan aktivitas fisik berat (K2). Dapat disimpulkan bahwa aktivitas fisik berat dapat menurunkan kadar enzim SOD di dalam hati.
Kata Kunci: aktivitas fisik berat, SOD, radikal bebas, stres oksidatif
ABSTRACT
Heavy physical activity will be increased the production of free radicals or reactive oxygen species (ROS) in the body, so it can decreased intracellular antioxidant enzymes liver, including superoxide dismutase (SOD). This study aims to determine antioxidant superoxide dismutase activity in liver on heavy physical activity. This research was a laboratory experiment with randomized post-test only control group design. This study was used of 20 male rats albino Wistar strain with an average body weight of 200 g. Rats were divided into two groups, without treatment or control treatment (K1) and treatment with heavy physical activity (K2). Heavy physical activity treatment are given swimming for one hour/ day. This research was carried out for 3 weeks. At the end of the treatment, all rats ware sacrificed by euthanasia using ketamine-HCl 1 mL/200 g bw. Rat liver were taken and divided into two, namely for SOD level analysis and for immunohistochemical staining. Data were analyzed by independent t test. The results showed that treatment of heavy physical activity have a negative impact. Level of SOD in rat liver tissue by 34.84% lower compared to the control treatment (K1) of 68.39% (p<0.01). By immunohistochemistry, on liver tissue of normal control rats (K1), qualitatively appear SOD react positively on nucleus and the cytoplasm with a strong brown color intensity compared to liver tissue rat with heavy physical activity treatment (K2). It can be concluded that heavy physical activity can reduce level of SOD enzyme in the liver.
Keywords: heavy physical activity, SOD, free radical, oxidative stress.
1Program Studi Pendidikan Dokter, Fakultas Kedokteran Universitas Udayana
2Bagian Fisiologi
Fakultas Kedokteran Universitas
Udayana
Email : pranantaandi94@gmail. com
Diterima : 16 Maret 2018
Disetujui : 30 Maret 2018
Diterbitkan : 9 April 2018
PENDAHULUAN
Perkembangan jaman dan teknologi yang semakin lama semakin pesat sangat membantu manusia dalam melakukan aktivitas seperti olahraga, transportasi, dan komunikasi. Semakin maju perkembangan teknologi maka pencemaran lingkungan, radiasi ultraviolet, dan paparan polutan semakin meningkat. Sehingga dalam kehidupan sehari-hari baik manusia, atau hewan tidak luput dari kondisi stres oksidatif dengan tingkat keparahan dan penyebab yang berbeda.
Stres oksidatif adalah suatu kondisi, dimana produksi radikal bebas melebihi dari
jumlah antioksidan dalam tubuh.1 Kondisi yang tidak seimbang ini sangat potensial menyebabkan kerusakan sel pada semua organ tubuh. Menurut Blokhina dkk.2 dan Esti3 terdapat dua faktor yang menyebabkan terjadinya stres oksidatif yaitu faktor endogen dan faktor eksogen. Faktor endogen diantaranya aktivitas fisik berat, stres psikologi, inflamasi, kanker dan kematian sel. Sedangkan faktor eksogen diantaranya konsumsi makanan (protein, karbohidrat, lemak, alkohol, kopi), polutan udara (asap rokok, asap kendaraan), obat-obatan, radiasi dan absorban kulit (insektisida, DDT).
Manusia dan hewan membutuhkan oksigen
untuk mendapatkan energi dan air. Secara normal diperkirakan, dua sampai lima persen oksigen yang dikonsumsi selama respirasi tidak direduksi secara sempurna menjadi air dan energi dalam proses rantai transport elektron di mitokondria. Hal ini menyebabkan terbentuknya radikal bebas yang lebih dikenal sebagai reactive oxygen species (ROS). Reactive Oxygen Species (ROS) yang awal terbentuk adalah anion superoksida. Menurut Kevin dkk.4 Reactive Oxygen Species adalah metabolit molekul oksigen yang mempunyai reaktivitas tinggi bila dibandingkan dengan oksigen.
Tubuh secara normal memiliki mekanisme pertahanan alami berupa enzim antioksidan intrasel dalam usaha untuk mengatasi ROS. Adapun enzim antioksidan intrasel tersebut yaitu superoxide dismustase (SOD), glutation peroksidase (GPx) dan Catalase (Cat). Ketiga enzim tersebut tersebar di dalam jaringan tubuh dan organ seperti hati,ginjal, jantung, limpa dan lain lain dengan jumlah yang berbeda.5
Kondisi aktivitas fisik berat dikaitkan dengan terjadi peningkatan ROS karena di dalam tubuh terjadi peningkatan aktivitas metabolisme di berbagai organ tubuh termasuk di hati. Selama aktivitas fisik berat konsumsi oksigen oleh seluruh tubuh meningkat 10-20 kali lipat dibanding dalam keadaan istirahat dan aliran oksigen ke dalam berbagai organ juga meningkat, bahkan pada otot aktif dapat meningkat sampai 100-200 kali lipat.6 Sehingga ROS yang terbentuk meningkat secara drastis dan kadar enzim antioksidan juga mengalami perubahan dalam rangka untuk menanggulangi dan menetralkan kelebihan ROS yang terbentuk.
Jika keadaan ini berlangsung terus-menerus maka tubuh berada dalam keadaan stres oksidatif, sehingga berimplikasi pada berbagai kondisi patologis seperti kerusakan sel pada organ seperti hati, ginjal, jantung, limpa, dan lain sebagainya. Kerusakan ini dapat berakhir pada kematian sel, gangguan fungsi organ, dan mempercepat penyakit degeneratif seperti kanker, gangguan sistem imun, dan proses penuaan dini.4
Efek dari radikal bebas atau ROS jika tidak segera ditangani dengan baik akan menjadi masalah serius dalam bidang kesehataan yang berdampak pada pembiayaan kesehatan dan kualitas sumber daya manusia. Oleh karena itu pada penelitian ini akan diamati pengaruh aktivitas fisik berat terhadap kadar SOD pada organ hati, sehingga dapat mencegah terjadinya kerusakan akibat ROS. Tujuan penelitian ini adalah untuk mengetahui pengaruh peningkatan aktivitas fisik berat terhadap kadar enzim antioksidan intrasel pada hati tikus.
METODE PENELITIAN
Penelitian ini adalah eksperimen laboratorium dengan rancangan randomized posttest only control group design. Hewan percobaan dibagi menjadi dua kelompok, yaitu tanpa perlakuan atau perlakuan kontrol (K1) dan perlakuan dengan aktivitas fisik berat (K2).
Sampel dalam penelitian ini adalah 20 ekor tikus jantan albino strain wistar dengan rerata bobot badan 200g. Tikus diberi pakan tikus berupa konsentrat. Bahan pewarnaan imunohistokimia adalah ketamine-HCl, BSA (bovine serum albumin), PBS (Phospate Buffered Saline), xantin oksidase, ethanol, xilol, antibodi primer anti-SOD, DAB ( diamino benzidine ), antibodi sekunder, avidin biotin HRP. Peralatan yang digunakan adalah kandang tikus, alat bedah tikus, tabung reaksi, pipet mikro, neraca, botol vial, pot plastik, tabung eppendorf, aluminium foil, ember, mikroskop yang dilengkapi dengan kamera, peralatan bedah, dan seperangkat peralatan gelas.
Perlakuan aktivitas fisik berat yang diberikan berupa renang selama satu jam/hari. Penelitian dilakukan selama tiga minggu. Pada akhir perlakuan, semua tikus dikorbankan nyawanya dengan cara euthanasia menggunakan ketamine-HCl 1 mL/200 g bb.
Analisis kadar SOD dilakukan dengan cara sebanyak 0,06mL supernatan hati direaksikan dengan campuran yang terdiri atas 2,70mL buffer natrium karbonat 50mM yang mengandung 0,01mM EDTA (pH 10), 0,06 mM xantin 10 Mm, 0,03 mM BSA 0,5% dan 0,03 mM NBT 2,5 mM. Kemudian dilakukan penambahan xantin oksidase (0,04 unit). Setelah 30 menit, nilai absorbansi diukur pada panjang gelombang 560 nm. Kadar SOD dihitung sesuai rumus berikut ini: aktivitas SOD (%)= [1-A/B] x100%, dimana A=Absorbansi larutan sampel dan B= Absorbansi larutan kontrol.
Pewarnaan imunohistokimia terhadap SOD menggunakan metode tidak langsung dua tahap dengan menggunakan Avidin Biotin Kompleks. Jaringan diinkubasi dengan H2O2 dalam methanol selama 15 menit. Selanjutnya jaringan diinkubasi dalam BSA 1% selama 45 menit. Jaringan kemudian diinkubasi dengan antibodi primer monoklonal anti-rat SOD pada suhu kamar selama dua jam. Selanjutnya jaringan digenangi dengan antibodi sekunder selama satu jam. Setelah dicuci tiga kali dengan PBS, jaringan diinkubasi dengan avidin biotin HRP selama 30 menit. Hasil reaksi antigen-antibodi divisualisasikan dengan DAB pada suhu kamar selama 10 menit, kemudian dikounterstain dengan hematoksilin. Pengamatan dilakukan dibawah mikroskop cahaya pembesaran 400 kali.
Hasil positif SOD ditunjukkan dengan warna coklat.
Data yang diperoleh dianalisis dengan Uji t tidak berpasangan (independent t test). Sedangkan gambaran imunohistokimia SOD hati dianalisis secara deskriptif.
HASIL
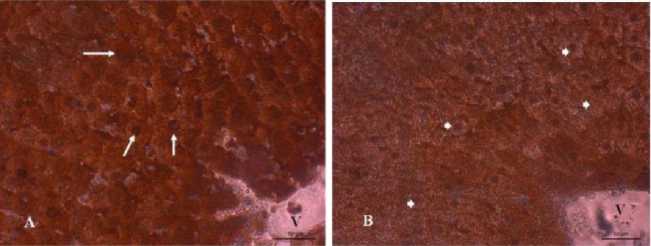
Hasil pewarnaan imunohistokimia SOD pada jaringan hati tikus perlakuan memperlihatkan bahwa SOD tersebar pada inti dan sitoplasma sel hati. Pada jaringan hati tikus kontrol normal (K1), secara kualitatif tampak SOD bereaksi positif pada inti sel dan sitoplasma dengan intensitas warna coklat yang kuat dibandingkan jaringan hati tikus dengan perlakuan aktivitas fisik berat (K2) (Gambar 1).
Hasil analisis statistik kadar SOD pada masing-masing perlakuan menunjukkan bahwa berdasarkan uji normalitas menggunakan One-Sample Kolmogorov-Smirnov Test menunjukkan data kadar SOD jaringan tikus tanpa perlakuan diperoleh nilai 0,999 (p>0,05) yang berarti bahwa data berdistribusi normal, dan data kadar SOD jaringan hati tikus perlakuan aktivitas fisik berat menunjukkan nilai 0,094 (p>0,05) yang berarti distribusi data normal. Hasil uji normalitas disajikan pada Tabel 1.
Tabel 1. Hasil Uji Normalitas Kadar SOD pada Jaringan Hati Antar Perlakuan Kontrol dengan Aktivitas Fisik Berat
|
Perlakuan |
n |
p |
|
Kontrol Normal (K1) |
10 |
0,999 |
|
Aktivitas Fisik Berat (K2) |
10 |
0,994 |
Hasil analisis statistik kadar SOD pada masing-masing perlakuan menunjukkan bahwa berdasarkan uji homogenitas menggunakan Levene’s test menunjukkan ragam antara perlakuan kontrol normal dengan perlakuan aktivitas fisik berat bersifat homogen dengan nilai p sebesar 0,66 (p>0,05). Hasil uji homogenitas disajikan pada Tabel 2.
Tabel 2. Hasil Uji Homogenitas Varian Antar Perlakuan Kontrol dengan Aktivitas Fisik Berat
n
10
Kadar SOD
10
p
Variasi di asumsikan sama
0,666
Variasi tidak di asumsikan sama
Hasil uji t rerata terhadap kadar SOD pada hati tikus percoban disajikan pada Tabel 3 dan Gambar 2, sedangkan hasil pewarnaan imunohistokimia SOD pada jaringan hati tikus diperlihatkan pada Gambar 1. Hasil analisis pada Tabel 3 menunjukkan bahwa dua perlakuan pada tikus percobaan berbeda dengan nilai p sebesar 0,000 (p<0,01).
Data pada Tabel 3 menunjukkan bahwa perlakuan aktivitas fisik berat mempunyai pengaruh negatif. Kadar SOD pada jaringan hati tikus sebesar 34,84% lebih rendah dibandingkan dengan perlakuan normal (K1) sebesar 68,39%. Kadar SOD pada masing-masing kelompok perlakuan disajikan pada Gambar 2.
Tabel 3. Hasil analisis independent t test kadar SOD pada hati tikus perlakuan
|
Kelompok |
n |
Rerata Kadar |
p |
|
Perlakuan |
SOD (%) |
Kontrol Normal 10 68,39 + 6,09a
(K1)
0,000
Aktivitas Fisik 10 34,84 + 6,64b
Berat (K2)
Gambar 1. Foto Mikrograf Jaringan Hati Tikus Pewarnaan Imunohistokimia SOD. A. Jaringan hati tikus kontrol normal; B. Jaringan hati tikus dengan latihan fisik berat. Tanda panah ( —► ) menunjukkan SOD positif warna coklat dengan intensitas kuat pada inti sel dan sitoplasma. Tanda kepala panah (►) menunjukkan SOD pada inti sel dan sitoplasma sudah berkurang dengan intensitas warna yang rendah. V:vena vorta. Skala bar ( ): 50 mm
PEMBAHASAN
Paparan radikal bebas dari berbagai sumber menyebabkan tubuh organisme mengembangkan serangkaian mekanisme pertahanan yang dikenal sebagai pertahanan antioksidan. Tubuh memiliki tiga enzim antioksidan intraseluler, yaitu enzim

superoxide dismutase (SOD), glutation peroksidase, dan catalase. Salah satu enzim intraseluler, yaitu enzim SOD keberadaannya dapat ditemukan hampir disemua jaringan atau organ tubuh, yaitu di hati, ginjal, otak, pankreas, dan otot.5 Enzim SOD berperan penting dalam mengkatalisis reaksi dismutasi pemecahan anion superoksida (O2·-) menjadi molekul oksigen (O2) dan molekul hidrogen peroksida (H2O2).1
Hasil analisis kadar enzim SOD pada hati tikus kelompok K2 menunjukkan bahwa kelompok K2 memiliki kadar sebesar 34,84%, lebih rendah dibandingkan dengan kelompok K1 sebesar 68,39%. Hal tersebut disebabkan oleh perlakuan berenang selama tiga minggu pada tikus percobaan. Pemberian perlakuan berenang selama tiga minggu termasuk perlakuan aktivitas fisik berat yang dapat menyebabkan kondisi stres oksidatif.
Menurut Scott dkk.7 bahwa salah satu pemicu timbulnya radikal bebas adalah aktivitas fisik. Pada saat aktivitas fisik yang tinggi terjadi konsumsi oksigen yang meningkat di dalam sel dengan cepat dan disertai dengan metabolisme yang meningkat di dalam sel guna penyediaan energi untuk otak dan pergerakan ekstremitas bagian-bagian tubuh pada saat berenang. Oksigen yang dikonsumsi oleh tubuh, sekitar 95% digunakan untuk proses fosforilasi oksidatif di mitokondria dan sekitar dua sampai lima oksigen mengalami reduksi parsial selama proses tranport elektron di mitokondria, yang selanjutnya akan berikatan dengan elektron tunggal yang mengalami kebocoran selama proses fosforilasi oksidatif sehingga terbentuk radikal
anion superoksida (O2·-).8
Manusia dan hewan memerlukan oksigen untuk efisiensi produksi energi di dalam mitokondria.1 Dalam proses transport elektron di mitokondria oksigen tereduksi menjadi air, namun oksigen dapat tereduksi parsial membentuk senyawa radikal bebas anion superoksida (O2·-). Menurut Valko dkk.9 bahwa hasil pengukuran terhadap partikel mitokondria diperoleh bahwa 1-3% elektron (e-) selama proses respirasi sel pada rantai transport elektron mengalami kebocoran dan menghasilkan radikal anion superoksida (O2·-).
Semua sel organisme hidup yang menggunakan oksigen akan mereduksi sebagian oksigen membentuk oksigen singlet (1O2), anion superoksida (O2•), radikal hidroksil (OH•), dan hidrogen peroksida (H2O2). Secara signifikan saat melakukan aktivitas fisik konsumsi oksigen seluruh tubuh meningkat 10-20 kali dan oksigen yang berfluktuasi ke serat otot skeletal meningkat sebanyak 100-200 kali.7
Suarsana5 dan Newsholme dkk.10 mengatakan bahwa dalam proses metabolisme energi normal, dalam hal ini dicontohkan metabolisme glukosa, selama proses fosforilasi oksidatif di mitokondria menghasilkan radikal anion superoksida. Bahkan Newsholme dkk.10 menyatakan bahwa radikal anion superoksida (O2·-) juga dihasilkan di membran bagian dalam sel pada saat oksidasi nikotimanide adenin difosfat hidrogen (NADPH) menjadi NADP+ dengan bantuan molekul oksigen dan NADPH oksidase.10 Peningkatan aktivitas metabolisme dan konsumsi oksigen terjadi apabila tubuh membutuhkan energi yang tinggi. Hal tersebut terjadi selama aktivitas fisik berat dan energi yang diperlukan cukup tinggi, sehingga semakin banyak energi yang dibutuhkan maka semakin banyak radikal bebas yang diproduksi.
Kerusakan yang diakibatkan oleh ROS tidak berhenti hanya pada terjadinya kelelahan pada otot. Blokhina dan Fagerstedt menyatakan bahwa konsekuensi dari stres oksidatif tergantung pada jaringan, sifat membran, kandungan antioksidan endogen dan kemampuan untuk menginduksi respon sistem antioksidan.11 Namun secara keseluruhan dapat ditarik kesimpulan bahwa ketika produksi ROS berlebihan, seperti yang terjadi selama latihan aerobik yang berkepanjangan, dan pertahanan antioksidan kewalahan untuk menetralkan ROS maka terjadi kerusakan sel dan jaringan.12
SIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa kadar enzim SOD pada tikus
perlakuan aktivitas fisik berat lebih rendah 34,84% dibanding dengan perlakuan kontrol 68,39%.
SARAN
Untuk melalukan aktivitas fisik berat (olah raga) sebaiknya tidak dilakukan secara terus menerus dalam jangka waktu lama tetapi perlu penjadwalan secara teratur.
Untuk mengurangi efek aktivitas fisik berat terhadap pengurangan aktivitas SOD pada hati yang berdampak pada kerusakan sel hati atau penuaan pada sel secara umum, sebaiknya perlu asupan antioksidan eksogen (misal, vitamin A, C, E yang berfungsi sebagai antioksidan).
DAFTAR PUSTAKA
-
1. Halliwell B. 2006. Reactive spesies and Antioxidants: Redox biology is a fudamental theme of aerobik life. Plant Phisiology. 2006;141:312-322.
-
2. Blokhina O., Fagerstedt K.V.2010. Oxidative metabolism, ROS and NO under oxygen deprivation. Plant Physiol. Biochem. 2006; 48: 359-73.
-
3. Esti S, 2012. Introduksi Reaksi Sel Terhadap Jejas. Dalam Buku Ajar Patologi I (Umum). Jakarta: Sagung Seto.
-
4. Kevin C, Kregel, Hannah J, Zhang. 2006. An integrated view of oxidative stres in aging: Basic mechanisms, functional effects, and pathological considerations. Am J Physiol Regul Integr Comp Physiol. 2006; 292: R18-R36.
-
5. Suarsana I.N, 2009. Aktivitas Hipoglikemik dan Antioksidatif Ekstrak Metanol Tempe Pada Tikus Diabetes. Disertasi. Sekolah Pascasarjana Institut Pertanian Bogor. Bogor.2009;172 Halaman.
-
6. Cardin R, Piciocchi M, Bortolami M, Kotsafti A, Barzon L, Lavezzo E, Sinigaglia A, Rodriguez-Castro KI, Rugge M, Farinati F. 2014. Oxidative damage in the progression of chronic liver disease to hepatocellular carcinoma: an intricate pathway. PubMed. National Center for Biotechnology Information, U.S. National Library of Medicine.
-
7. Scott K, Powers, Li Li Ji, Andreas N. Kavazis, and Malcolm J. Jackson. 2011. Reactive Oxygen Species: Impact On Skeletal Muscle. Published in final edited : Compr Physiol. NIH Public Access. 2011; 1(2): 941–969
-
8. Castrogiovanni P, Rosa Imbesi.2012. Review in Histology and Cell Biology : Oxidative Stress and Skeletal Muscle in Exercise. IJAE,. Department of Bio-Medical Science, University Catania, Italy. Vol 117. 2012;N.2 :107-116
-
9. Valko M, Leibfritz D, Moncol J, Cronin MTD, Mazur M, Tesler J. 2007. Review: Free radicals and Antioxidants in Normal Physiological Functions and Human Disease. Inter J Biochem & Cell Biol.2007; 39:44-84
-
10. Newsholme P,Haber EP, Hirabara SM, Rebelato ELO, Procopio J, Morgan D, Oliveira-Emilio HC, Carpinelli AR, Curi R. 2007. Diabetes Associated Cell Stres and Dysfunction: Role of Mitochondrial and non-Mitochondrial ROS Production and Activity. J Physiol 2007;583. 9–24.
-
11. Blokhina O., Fagerstedt K.V.2010. Oxidative metabolism, ROS and NO under oxygen deprivation. Plant Physiol. Biochem. 2010;48: 359-73.
-
12. Justin D.C, Arkan A, Bart P. H., Daniel I.O., Lauren G.M., Gregory R.S., Mark A.T.,2013. Elevated Mitochondrial Oxidative Stress Impairs Metabolic Adaptations to Exercise in Skeletal Muscle. PLOS ONE Volume 8, Issue 12. 1 December 2013.
http://ojs.unud.ac.id/index.php/eum
147
Discussion and feedback