POTENTIAL OF FLAVONOIDS IN MORINGA OLEIFERA LEAF EXTRACT AS AN ALTERNATIVE THERAPY OF REUMATOID ARTHRITIS BASED ON ANTI-INFLAMMATORY APPROACH
on
ARTIKEL TINJAUAN PUSTAKA

Essence of Scientific Medical Journal (2022), Volume 20, Number 2:97-106
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI FLAVONOID PADA EKSTRAK DAUN MORINGA OLEIFERA SEBAGAI ALTERNATIF TERAPI ARTRITIS REUMATOID BERBASIS PENDEKATAN ANTIINFLAMASI
Komang Wahyu Widyasanti Sutama1, Gregorius William Thongiratama1, Putu Dian Amelya Putri Widarani1, Ida Ayu Dewi Wiryanthini2
ABSTRAK
Pendahuluan: Artritis Reumatoid (AR) adalah penyakit autoimun sistemik kronik yang mengakibatkan terjadinya peradangan pada persendian dan kasusnya ditemukan paling banyak pada lansia. Akan tetapi, sampai saaat ini terapi farmakologi pengobatan AR dinilai masih kurang efisien, memerlukan biaya yang besar, serta menimbulkan banyak efek samping. Oleh karena itu, diperlukan alternatif pengobatan baru. Salah satu tanaman yang berpotensi sebagai terapi AR adalah Moringa oleifera karena memiliki efek antiinflamasi.
Pembahasan: Moringa oleifera efektif digunakan sebagai pengobatan AR karena kandungan fitokimia yang melimpah yaitu flavonoid sebagai antiinflamasi. Ekstrak daun Moringa oleifera dengan maserasi etanol mengandung flavonoid (12,16%), sebagian besar dalam bentuk quercetin (6,3%). Peran flavonoid sebagai agen anti-inflamasi pada AR adalah mengurangi aktivitas neutrofil dalam produksi sitokin proinflamasi melalui penghambatan sinyal Nuclear Factor kappa-light-chain-enhancer of activated B Cells (NF-κB), inhibisi aktivitas Matrix Metalloproteinase (MMP), dan penghambatan pada situs aktif peroksidase siklooksigenase-1 (COX-1), siklooksigenase-2 (COX-2), dan 5-lipoksigenase (5-LOX). Quercetin ampuh untuk menyembuhkan artritis reumatoid dengan memberikan efek antiinflamasi dan analgesik. Ekstrak daun Moringa oleifera yang paling efektif didapatkan melalui metode pengeringan d isertai proses maserasi dalam etanol 96% dan dikemas dalam kapsul oral. Ekstrak Moringa oleifera menyebabkan efek samping yang lebih sedikit dibandingkan dengan perawatan AR yang tersedia saat ini. Ekstrak Moringa oleifera yang dikombinasikan dengan obat lain sebagai adjuvan, seperti metotreksat dan indometasin, dapat meningkatkan efek kuratif anti-inflamasi pada RA tanpa efek samping yang signifikan.
Simpulan: Ekstrak daun Moringa oleifera memiliki potensi dalam pengobatan artritis reumatoid.
Kata kunci: Antiinflamasi, Artritis Reumatoid, Flavonoid, Moringa oleifera
ABSTRACT
Introduction: Rheumatoid arthritis (RA) is a chronic systemic autoimmune disease that causes joints
inflammation and the most cases are found in the elderly. However, until now pharmacological therapy for RA treatment is still considered inefficient, expensive, and causes many side effects. Therefore, a new alternative treatment is needed. One of the plants that can be used as alternative is Moringa oleifera due to its antiinflammatory properties.
Discussion: Moringa oleifera leaf extract with ethanol maceration contains flavonoids (12.16%), mostly in the form of quercetin (6.3%). The role of flavonoids as anti-inflammatory agents in RA is to reduce neutrophil activity in the production of proinflammatory cytokines through inhibition of Nuclear Factor kappa-light-chain-enhancer from Activated B Cells (NF-κB) signaling, inhibition of Matrix Metalloproteinase (MMP) activity, and inhibition of the peroxidase active sites at cyclooxygenase-1 (COX-1), cyclooxygenase-2 (COX-2), and 5-lipoxygenase (5-LOX). Quercetin is effective in treating rheumatoid arthritis by providing anti-inflammatory and analgesic effects. The most effective method to obtained Moringa oleifera leaf extract is by drying method with maceration process in 96% ethanol and packaged in oral capsules. Moringa oleifera extract also has fewer side effects compared to currently available RA treatments. Moringa oleifera extract combined with other drugs as adjuvants, such as methotrexate and indomethacin, can increase the anti-inflammatory curative effect in RA without significant side effects.
Conclusion: Moringa oleifera leaf extract has potential in the treatment of rheumatoid arthritis.
Keywords: Anti-inflammatory, Flavonoids, Moringa oleifera, Rheumatoid Arthritis
PENDAHULUAN
1Program Studi Sarjana Kedokteran, Fakultas Kedokteran, Universitas Udayana, Bali 2 Departemen Biokimia, Fakultas Kedokteran, Universitas Udayana, Bali
Lanjut Usia (Lansia) merupakan tahap akhir dari siklus perkembangan manusia. Karakteristik lansia yaitu memiliki keluhan dan kebutuhan yang beragam mulai dari kondisi kesehatan, maladaptif, hingga masalah berkaitan dengan situasi lingkungan tempat tinggal.[1] Seiring dengan pertambahan usia akan banyak terjadi perubahan pada tubuh.[2] Setiap tahunnya, jumlah lansia terus mengalami peningkatan. Berdasarkan data dari World Health Organization (WHO), jumlah lansia di seluruh dunia pada tahun 2025 diperkirakan mencapai 1,2 miliar jiwa. Sementara itu, jumlah lansia di Indonesia
diprediksi meningkat 41,4% dari total penduduk Indonesia pada tahun 2025.[3] Penambahan populasi lansia secara global turut meningkatkan prevalensi perubahan fisiologis yang dapat berakhir pada masalah kesehatan. Berdasarkan data Kemenkes RI (2013), gangguan sendi merupakan problematika yang paling sering muncul pada lansia dan menempati urutan kedua (14,5%) setelah penyakit kardiovaskuler.[4]
Salah satu masalah kesehatan pada lansia yang sering menyerang sistem muskuloskeletal, yaitu golongan reumatoid. Artritis Reumatoid (AR), yang merupakan penyakit autoimun sistemik kronik ditandai dengan terjadinya peradangan pada
persendian.[5] Lansia yang mengalami AR akan mengeluh nyeri pada punggung, kelemahan otot, nyeri sendi, hingga penurunan mobilitas.[6] Kejadian AR berdampak pada kegiatan sehari-hari, pekerjaan, bahkan apabila tidak ditangani dengan baik dapat menimbulkan kematian.[7–9]
Berdasarkan data dari WHO, prevalensi kejadian AR secara global pada tahun 2016 mencapai 335 juta penduduk.[10] Angka ini terus mengalami peningkatan dan pada tahun 2025 diprediksi akan meningkat sebesar 25%.[2] Penelitian lain dari Arthritis Foundation pada tahun 2015 menyatakan kalau sebanyak lebih dari 50 juta penduduk Amerika Serikat dengan usia 18 tahun keatas didiagnosis mengalami AR dan 1,5 juta dari data tersebut adalah usia dewasa.[6] Pada tahun 2012 angka penderita AR di Indonesia sebanyak 39,47% dari jumlah penduduk Indonesia dan meningkat pada tahun 2013 menjadi 45,59%.[10] Faktor risiko kejadian AR dikategorikan menjadi faktor yang dapat dikendalikan dan tidak dapat dikendalikan. Faktor yang tidak dapat dikendalikan meliputi umur, ras, serta keturunan sementara faktor yang dapat dikendalikan, yaitu aktivitas fisik, pola makan, dan kebiasaan merokok. Pemahaman terhadap AR berhubungan dengan komorbiditas serta mortalitas dini sehingga tindakan pengobatan AR harus dilakukan sedini mungkin. Terapi pengobatan AR yang umumnya digunakan adalah golongan Nonsteroidal Anti-inflammatory drugs (NSAIDs), Disease-modifying Antirheumatic Drugs (DMARDs), Janus Kinase (JAK) inhibitors, dan sebagainya.[11]
Intervensi pengobatan alopati yang ada saat ini masih kurang efisien, memerlukan biaya yang cukup besar, dan menyebabkan banyak efek samping.[6] NSAIDs adalah salah satu obat yang paling sering diresepkan dalam AR. Kebanyakan NSAIDs bersifat tidak spesifik dan menginhibisisi cyclooxygenase-1 (COX-1) sekaligus cyclooxygenase-2 (COX-2). Inhibitor COX-1 mengakibatkan efek samping seperti pendarahan gastrointestinal dan ulserasi, sementara inhibitor COX-2 efek sampingnya adalah hipertensi, gagal jantung kongestif, dan infark miokardial.[12–14] DMARDs juga memiliki myelosupresi, fibrosis hati, sirosis, infiltrat paru, dan perdarahan gastrointestinal.[15] Oleh karena itu, diperlukan alternatif pengobatan baru sebagai salah satu opsi terapi AR. Obat-obatan yang berasal dari bahan alam adalah pilihan yang tepat untuk pengembangan obat yang efektif dan aman pada terapi AR. Hal ini didasarkan atas kemudahan, ketersediaan, dan efisiensi biaya dibandingkan dengan obat-obatan alopati.[16] Moringa oleifera (MO) merupakan salah satu tanaman dalam famili Moringaceae dengan kandungan berbagai gugus senyawa fitokimia unik yang menghasilkan spektrum efek biologis yang sudah diakui dalam bidang pengobatan. Tanaman ini secara tradisional digunakan untuk mengobati demam, diare, radang sendi, dan lainnya.[17] Kandungan pada Moringa oleifera salah satunya akan menunjukkan efek antiinflamasi.[16] Kandungan tersebut akan menghambat Nuclear Factor kappa-light-chain-enhancer of activated B cells (NF-κB) yang selanjutnya berdampak pada penurunan sitokin proinflamasi Interleukin-1 (IL-1), Interleukin-6 (IL-6), serta Tumor Necrosis Factor-α (TNF-α) sehingga inflamasi jaringan mereda.[18] Konstituen bioaktif yang paling banyak digunakan adalah daun dengan
kandungan senyawa flavonoid bersifat antiinflamasi.[18,19]
Berdasarkan uraian di atas, kandungan flavonoid dalam ekstrak daun Moringa oleifera berpotensi dimanfaatkan sebagai antiinflamasi pada terapi AR. Oleh karena itu, diperlukan adanya pembahasan lebih lanjut mengenai modalitas ini.
PEMBAHASAN
Patofisiologi Artritis Reumatoid
Artritis Reumatoid (AR) merupakan penyakit autoimun yang menyerang persendian. Hal ini ditandai dengan peradangan progresif simetris pada area sendi yang dapat mengakibatkan erosi tulang, kecacatan tulang rawan, hingga kecacatan.[20] Secara klinis, gejala stadium awal dan lanjut AR berbeda. Gejala AR tahap awal tampak seperti gejala penyakit umum, seperti kekakuan otot, demam, serta sendi bengkak.[21] Sementara itu, gejala stadium lanjut AR menunjukkan gambaran klinis yang kompleks dengan terjadinya manifestasi sistemik, seperti efusi pleura dan aterosklerosis.[22,23]
Faktor genetik dan lingkungan terbukti berperan dalam perkembangan lebih lanjut AR.[24] Presdiposisi genetik pasien yang menghasilkan generasi sel T dan sel B autoreaktif, serta faktor pemicu seperti infeksi virus, bakteri, cedera jaringan akan memicu aktivasi Antigen-presenting Cells (APCs). Hal ini akan diikuti dengan aktifnya limfosit autoreaktif yang dihasilkan sebelumnya dan mengakibatkan kerusakan jaringan. Faktor risiko lain yang termasuk pemicu AR, yaitu merokok, obesitas, serta paparan sinar UV.[25] Kerusakan jaringan pada AR berupa peradangan kapsul sendi yang terdiri dari membran sinovial dan cairan sinovial. Inflamasi pada persendian dimulai dan dipertahankan oleh beberapa faktor, di antaranya interaksi kompleks antara subtipe sel dendritik yang berbeda, sel T, makrofag, sel B, neutrofil, fibroblas, dan osteoklas. Kerusakan pada sendi dimulai dari proliferasi makrofag dan fibroblas sinovial. Selanjutnya, terjadi proses infiltrasi daerah perivaskular oleh sel limfosit serta terjadi proliferasi jaringan endotel yang akan mengakibatkan terjadinya neovaskularisasi. Pembuluh darah di daerah inflamasi akan mengalami oklusi oleh sel-sel radang. Akibatnya, jaringan sinovial akan tumbuh secara ireguler dan terbentuklah pannus. Pannus akan menginvasi jaringan lalu mengakibatkan kerusakan. Selanjutnya sel-sel imun berperan dalam respon imunologi seluler maupun humoral. Respon imunologi seluler, meliputi sel T dan sel B berupa T Helper-1 (Th 1), T Helper-17 (Th17), Natural Killer T (NKT), T Helper-2 (Th2), Cytotoxic T Lymphocytes-Target Cell (CTL-Tc). Sementara itu, respon imunologi humoral diperankan oleh sitokin dan sel B, berupa Imunoglobulin A (IgA), Imunoglobulin D (IgD), Imunoglobulin M (IgM), Imunoglobulin E (IgE), dan Imunoglobulin G (IgG).[26]
Inflamasi dapat terjadi salah satunya disebabkan oleh adanya akumulasi neutrofil. Neutrofil pada penderita AR merupakan tipe yang telah teroksidasi oleh Reactive Oxygen Species (ROS). Kompleks imunitas pada sendi dengan AR yang mengandung Anti-citrullinated protein antibody (ACPA) dan Rheumatoid Factor (RF) dapat memicu degranulasi neutrofil melalui FcγR. Elastase dan cathepsin G dari neutrofil akan memroses IL-33 menjadi bentuk bioaktif yang dapat memicu
terjadinya inflamasi. Selain itu, adanya Mieloperoksidase (MPO) dari neutrofil dapat meningkatkan permeabilitas endotel yang mendukung terjadinya inflamasi. Selanjutnya MPO dapat mengikat lebih banyak neutrofil untuk meningkatkan efek yang diberikan sehingga akan memperburuk terjadinya inflamasi.[27] Ekspresi MPO dan Neutrophil Elastase (NE) yang berlebihan dapat diasosiasikan dengan terbentuknya pannus.[28] Fungsi kompleks dari neutrofil kemudian dapat dimanfaatkan untuk mengukur tingkat keparahan peradangan pada AR, ditandai dengan adanya peningkatan Neutrophile Lymphocyte Ratio (NLR), yang mana peningkatan NLR dapat disebabkan oleh adanya peningkatan jumlah neutrofil ataupun penurunan jumlah limfosit.[29]
Kandungan Fitokimia Daun Moringa oleifera
Kandungan kimia yang esensial dari Moringa oleifera meliputi berbagai jenis vitamin, alkaloid, tanin, steroid, asam fenolat, glukosinolat, flavonoid, dan terpenoid. Beberapa kandungan vitamin yang terdapat pada Moringa oleifera adalah retinol, beta karoten, asam askorbat, tokoferol, thiamin, riboflavin, dan niasin.[30]
Beberapa vitamin yang terkandung pada Moringa oleifera dapat mempengaruhi kondisi patologis artritis. Retinol memiliki peran penting dalam metabolisme Retinol binding protein 4 (RBP4) jaringan adiposa yang berkaitan dengan AR.[31,32] Beta karoten bermanfaat untuk blokade NOD-, LRR-and pyrin domain-containing protein 3 (NLRP3) inflamasom pada inflamasi.[33] Asam askorbat dapat memberikan efek analgesik pada nyeri akibat
inflamasi.[34] Tiamin dapat mengurangi gejala inflamasi melalui penurunan jumlah serum TNF-α and IL-1ß.[35] Riboflavin bermanfaat dalam mengurangi efek inflamasi dengan mencegah adanya infiltrasi dan akumulasi dari aktivasi granulosit.[36] Niasin dalam jumlah besar dapat diubah menjadi niasinamide, dapat dimanfaatkan sebagai pengobatan AR.[37,38]
Alkaloid dalam bentuk steroid yang terdapat pada Moringa oleifera dapat menurunkan gejala AR dengan mengurangi kerusakan sendi.[39] Alkaloid pada Moringa oleifera umumnya berada dalam bentuk N, α-L-rhamnopyranosyl vincosamide, asam N-benzylcarbamic, deoxy-niazimicin, 1, 3-dibenzyl urea, dan aurantiamide asetat.[40] Glukosinolat dalam jumlah besar terdapat dalam bentuk Glucomoringin (GMG). Moringa oleifera mengandung asam fenolat terbanyak dalam bentuk asam galat. Adanya
kandungan quercetin-3-O-glukosida, kaempferol-3-O-glukosida, dan asam klorgenat menunjukkan
manfaat antiinflamasi dan menghambat oksidasi kemotaktik leukosit.[41]
Flavonoid memiliki peran antiinflamasi lewat inhibisi regulasi enzim dan dan faktor transkripsi pad a inflamasi. Flavonoid mampu memodulasi protein kinase dengan inhibisi NF-κB melalui modulasi IκB. Selain itu, flavonoid dapat meregulasi faktor transkripsi pada sitokin CD4+ T helper 2 (Th2), seperti GATA Binding Protein 3 (GATA-3) dan signal transducer and activator transcription 6 (STAT-6).
Flavonoid dapat berikatan dengan reseptor sitokin IL-17RA dan IgE pada area inflamasi yang
menurunkan aktivasi dan respon proliferatif sistem imun pada inflamasi kronis.[42]
Tabel 1. Manfaat Senyawa Esensial Moringa oleifera
|
Golongan Senyawa |
Nama Senyawa |
Manfaat |
Sumber |
|
Terpenoid |
Retinol |
Mengatasi keriput dan mencerahkan kulit |
[43] |
|
Sebagai antiinflamasi |
[31,32] | ||
|
Mengatasi acrokeratosis |
[44] | ||
|
Beta karoten |
Memelihara kesehatan mata |
[45] | |
|
Sebagai antiinflamasi |
[33] | ||
|
Sebagai antioksidan |
[46] | ||
|
Alkaloid |
Thiamin |
Sebagai kofaktor enzim |
[47] |
|
Sebagai antioksidan |
[48] | ||
|
Sebagai antiinflamasi |
[36] | ||
|
Steroid |
Mengurangi risiko kanker |
[49] | |
|
Sebagai antiinflamasi |
[50] | ||
|
Mengatasi degradasi sendi pada RA |
[39] | ||
|
Asam fenolat |
Asam galat |
Sebagai antioksidan |
[51,52] |
|
Mengurangi risiko kanker |
[51,52] | ||
|
Sebagai antioksidan |
[51,52] | ||
|
Asam klorgenat |
Sebagai antiinflamasi |
[53] | |
|
Mengurangi risiko kanker |
[54,55] | ||
|
Menurunkan tekanan darah |
[56] | ||
|
Fenolik |
Riboflavin |
Sebagai antioksidan |
[57] |
|
(flavonoid) |
Mengatasi gangguan sistem saraf |
[58] | |
|
Sebagai antiinflamasi |
[36] | ||
|
Quercetin |
Memberikan efek analgesik |
[59] | |
|
(flavonoid) |
Sebagai antiinflamasi |
[60,61] | |
|
Sebagai antioksidan |
[61,62] | ||
|
Kaempferol |
Mengurangi risiko kanker |
[63,64] | |
|
(flavonoid) |
Sebagai antiinflamasi |
[64,65] | |
|
Mengobati gangguan sistem saraf pusat |
[66] | ||
|
Tannin |
Sebagai antibakteri |
[67] | |
|
Sebagai antiinflamasi |
[67] | ||
|
Sebagai antioksidan |
[67] |
|
Tokoferol |
Tokoferol |
Sebagai antioksidan |
[68] |
|
Sebagai antiinflamasi Memelihara sistem sirkulasi yang baik |
[69,70] [71] | ||
|
Asam |
Asam Askorbat |
Sebagai antioksidan |
[72] |
|
Askorbat |
Meningkatkan sistem imunitas Memberikan efek analgesik |
[73,74] [34] |
Penempatan Sampel pada Media Etil Asetat
Potensi Moringa oleifera Sebagai Antiinflamasi
Uji coba in vivo pada tikus menunjukkan adanya efek antiinflamasi yang ditunjukkan subjek mulai hari ke-5. Secara lebih lanjut, mekanisme antiinflamasi dapat terjadi melalui inhibisi infiltrasi monosit dan proliferasi fibroblas. Inhibisi ini berkaitan dengan aktivasi oleh flavonoid yang berdampak pada penurunan produksi sitokin sehing ga infiltrasi TNF-α menurun dan mencegah adhesi neutrofil serta limfosit yang menyebabkan inflamasi.[75]
Quercetin merupakan salah satu kandungan flavonoid berpotensi sebagai terapi pengobatan artritis. Quercetin dapat mengurangi aktivitas enzim Adenosine deaminase (ADA) yang menyebabkan kekakuan sendi dan rasa nyeri pada kondisi AR. Kemudian, quercetin dapat dikombinasikan dengan methoxetrate untuk meningkatkan efektivitas pengobatan AR.[59] Selain itu, quercetin dapat menghambat autofagositosis pada neutrophil yang terstimulasi Pam3CSK4 (PAM), yang ditunjukkan dengan inhibisi pembentukan Neutrophil Extracellular Traps (NET).[28]
Penelitian lainnya pada tikus yang terinduksi artritis menunjukkan adanya aktivitas quercetin dalam menurunkan ekspresi NF-κB p65 dan jumlah NO di jaringan sendi.[60] Selebihnya, terjadi penghambatan perilisan sel pemicu inflamasi pada jaringan sinovial bersamaan dengan berkurangnya hiperalgesia.[76] Adhesi neutrofil merupakan salah satu tahap pada ekstravasasi neutrofil. Pada ekstravasasi neutrofil, P-selectin dan E-selectin akan berikatan dengan ligan yang terglikosilasi, salah satunya adalah P-selectin glycoprotein ligand 1 (PSGL1) yang menyebabkan terjadinya penangkapan neutrofil. Neutrofil kemudian akan merangkak menuju area luka melalui interaksi reseptor Intercellular Cell Adhesion Molecule-1 (ICAM1) dan E- selectin pada endotel dengan Lymphocyte function-associated antigen 1 (LFA1), P-selectin glycoprotein ligand-1 (PSGL1), E-selectin ligand-1 (ESL1), dan Cluster of differentiation 44 (CD44) pada neutrofil. Adapun peran flavonoid yang menghambat terjadinya adhesi neutrofil yang melibatkan reseptor ICAM1 pada endotel.[77] Penelitian yang telah ada dengan melibatkan sampel dengan kontrol berupa injeksi Complete Freund's Adjuvant (CFA) ekstrak Moringa oleifera dengan indomethacin sebagai adjuvannya menunjukkan adanya penurunan gejala artritis dan inflamasi pada tikus cobaan.[78]
Efek antiinflamasi secara spesifik dapat diperoleh dalam bentuk aqueous extract dan methanol extract dari Moringa oleifera. Kandungan isothiocyanates dan polyphenols pada ekstrak Moringa oleifera menurunkan ekspresi gen dan produksi marker inflamasi, berupa iNOS and IL-1b.[79]
Mekanisme Konstruksi dan Administrasi Kapsul Moringa oleifera
Pengeringan dan Penggilingan
Maserasi Etanol 96%
Pencucian
Bubuk Ekstrak M. oleifera
Titrasi dan Penambahan NaOCI 4%
Pencampuran 4 dengan Isopropil Alkohol
Penyaringan dan
,enyarιngan αaπ ^
Pengendapan '
Ekstraksi dengan NazCO3
Kapsul Ekstrak M. oleifera
Pemotongan dan Pencucian
■ Perendaman
-dalam HCI 1%dan
- Netralisasi
| Pengeringan
Bubuk Natrium I ^j I
Alginat 1____________I
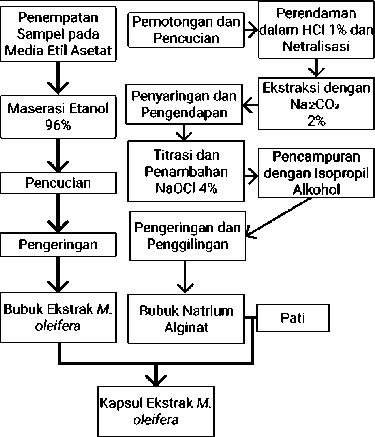
Gambar 1. Mekanisme Konstruksi dan Administrasi Kapsul Moringa oleifera
Metode pengeringan sampel pada media etil asetat merupakan cara paling efektif dalam memperoleh kandungan flavonoid.[80–82] Persentase flavonoid yang dapat diperoleh dari tumbuhan in i dapat dikatikan dengan metode ekstraksinya. Ekstrak Moringa oleifera dengan media maserasi etanol memiliki 12,16% flavonoid dan tidak kurang dari 6,3% dari 100 gram ekstrak tanaman Moringa oleifera merupakan quercetin flavonoid .[81,83]
Ekstrak kering Moringa oleifera diperoleh melalui proses pencucian dan pengeringan di bawah paparan sinar matahari ataupun dengan kabinet pengering dengan suhu 45o C selama 4 jam. Moringa oleifera kering kemudian dihancurkan menjadi bentuk bubuk untuk kemudian dimaserasi pada 96% etanol dengan rasio 1:10 selama 24 jam. Filtrat kemudian dikeringkan pada suhu 50o C dengan rotator evapory.[82] Ekstrak Moringa oleifera kemudian dienkapsulasi dengan bahan pati arginat dari rumput laut coklat (Sargassum sp.) yang memungkinkan sediaan ekstrak memiliki bioavailabilitas lebih baik dan mengurangi degradasi oleh CYP450.[84–86]
Pembuatan kapsul diawali dengan pemotongan dan pencucian Sargassum sp. dengan akuades. Sargassum sp. kemudian direndam selama 1 jam pada Hidrogen Klorida (HCl) 1% lalu dinetralkan dengan akuades. Setelah itu, dilakukan ekstraksi selama 2 jam dengan Na2CO3 2% dan diendapkan dengan HCL10%. Filtrat dilarutkan dalam isopropyl alcohol, diaduk, dan didiamkan selama 30 menit. Larutan kemudian dikeringkan dan digiling menjadi campuran bubuk.
Campuran bubuk ditambahkan akuades dengan perbandingan 1:15 (b/v) hingga membentuk larutan koloidal. Campuran selanjutnya diaduk selama kurang lebih 5 menit. Campuran dipanaskan dalam water bath tertutup aluminium foil selama 6090 menit pada suhu 70-80o C. Campuran ditambahkan pati dengan perbandingan campuran
dan pati sebesar 2:3. Pencetakan kapsul dilakukan dengan pemanasan dipping bath dengan penangas air dan pengolesan dengan pelumas makanan. Komposit homogen sebelumnya dituangkan pada dipping bath dan dibiarkan untuk mendapatkan viskositas yang tepat. Dipping gen kemudian dicelupkan beberapa kali pada dipping bath berisi komposit. Kapsul kemudian dikeringkan dan diisikan dengan bubuk ekstrak Moringa oleifera kering.[87]
Rute administrasi oral dalam bentuk kapsul memungkinkan sediaan berada dalam bentuk padat, yang mendukung kandungan flavonoid untuk dapat diperoleh dalam jumlah tertinggi, distribusi obat yang mudah, dan administrasi obat yang mudah.[88] Selain itu, aplikasi oral memungkinkan efek samping yang lebih ringan dan dapat diperhitungkan.[89]
Rekomendasi administrasi adalah sebelum makan untuk memaksimalkan absorpsi kapsul ekstrak Moringa oleifera pada usus halus dan menghindari penurunan bioavailabilitas dalam saluran pencernaan akibat peningkatan pH lambung akibat efek postprandial.[90–92] Dosis yang diberikan kepada pasien dapat disesuaikan dengan tingkat keparahan AR dan diperlukan konsultasi lanjutan dengan dokter yang berwenang.
Farmakokinetik Ekstrak Daun Moringa oleifera
Farmakokinetik meliputi absorpsi, distribusi, metabolisme, dan ekskresi. Absorpsi memengaruhi kecepatan dan konsentrasi obat saat tiba di lokasi yang diinginkan. Obat-obatan oral harus melewati saluran digestif sebelum tiba di sistem sirkulasi (first-pass metabolism) sehingga obat oral akan memiliki bioavailabilitas yang lebih rendah.[93]
Struktur kimia flavonoid sebagai komponen terbanyak dalam daun Moringa oleifera memengaruhi bioavailabilitasnya. Secara umum, terdapat dua jenis flavonoid yaitu aglikon dan glikosida. Sebagian besar senyawa flavonoid dalam daun Moringa oleifera berbentuk glikosida. Flavonoid dalam bentuk glikosida seperti quercetin umumnya akan melepas gugus glikosidanya terlebih dahulu sehingga berubah menjadi aglikon di usus halus. Setelah itu, misel akan membawa aglikon ke lapisan mukus usus halus untuk diabsorpsi. Akan tetapi, karena aglikon dari flavonoid glikosida bersifat hidrofilik, aglikon harus mengalami proses hidrolisis dengan bantuan enzim Lactase-phlorizin hydrolase (LPH).[94]
Penggunaan flavonoid, khususnya golongan quercetin, sebagai terapi AR, memiliki risiko toksisitas yang relatif rendah, ditandai dengan adanya jendela terapeutik yang tinggi. Pemanfaatan quercetin yang melebihi 1000 mg per hari berisiko rendah untuk menimbulkan efek samping yang signifikan pada serum elektrolit, fungsi ginjal, dan darah. Peran fisiologis quercetin dalam tubuh dapat dikaitkan dengan penyerapannya yang terakumulasi seiring dengan intensitas intervensi yang dilakukan. Secara lebih spesifik, banyaknya quercetin yang dapat dimetabolisme pada hati dan ginjal berdasarkan penelitian pada tikus adalah sebesar 314 mg dan 157 mg quercetin/kg berat badan per hari.[95]
Banyak studi telah membuktikan bahwa Moringa oleifera aman dikonsumsi secara oral pada anak-anak, orang dewasa, dan lansia.[78,96,97] Penggunaan ekstrak daun Moringa oleifera tidak direkomendasikan pada kehamilan karena bisa menggagalkan implantasi pada trimester pertama
kehamilan.[98] Interaksi antara daun Moringa oleifera dengan obat tertentu juga perlu diperhatikan. Moringa oleifera berpotensi untuk mengobati hipertiroidisme sehingga bertentangan dengan obat-obatan hipotiroidisme, seperti levothyroxine.[99,100] Moringa oleifera juga dapat menginhibisi enzim sitokrom P450.[101,102] Penggunaan Moringa oleifera bersamaan dengan obat-obatan yang dimetabolisme oleh enzim tersebut, seperti lovastatin, ketoconazole, triazolam, akan menjadi lebih lama dimetabolisme.
Farmakodinamik Ekstrak Daun Moringa oleifera pada Artritis Reumatoid
Flavonoid mampu menghambat situs aktif peroksidase enzim COX-1, COX-2, dan 5-LOX sehingga mampu mengurangi produksi prostaglandin dan leukotrien. Kurangnya produksi prostaglandin akan mengurangi edema dan nyeri pada area inflamasi pasien AR. Penghambatan COX merupakan mekanisme utama dari NSAIDs. Namun, karena mekanisme flavonoid sebagai antiinflamatori tidak bergantung secara langsung terhadap inhibisi enzim COX, tetapi memengaruhi jalur lain yang berhubungan dengan regulasi COX, flavonoid tidak menimbulkan efek samping seperti NSAIDs.[12]
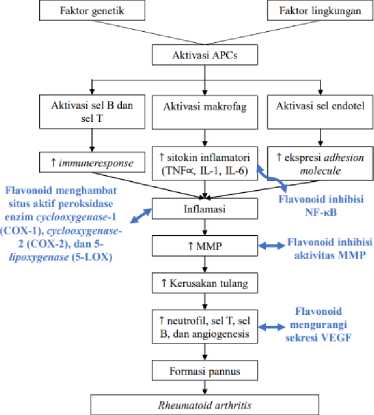
Gambar 2. Farmakodinamik Ekstrak Daun Moringa oleifera pada Patogenesis Artritis Reumatoid
Salah satu flavonoid yang umumnya terdapat pada daun Moringa oleifera adalah quercetin.[94] Quercetin berperan penting sebagai antiinflamatori dalam mengatasi AR. Quercetin mampu menghambat jalur NF-κB yang selanjutnya akan berdampak pada penurunan sitokin proinflamasi IL-1, IL-6, dan TNF-α sehingga inflamasi jaringan mereda.[12,28,103] Quercetin juga mampu mensupresi sel Th17 dan menginhibisi produksi IL-17 yang berperan dalam proses destruktif tulang pada AR.[104] Studi lain juga menunjukkan bahwa flavonoid mampu meningkatkan ekspresi molekul antiinflamatori seperti IL-1 receptor agonist (IL-1ra).[12] Jadi, flavonoid mampu menginhibisi produksi sitokin proinflamatori atau meningkatkan ekspresi sitokin antiinflamatori.
Quercetin juga mampu mengurangi sekresi Vascular Endothelial Growth Factor (VEGF) pada sel endotel sehingga akan mengurangi angiogenesis. Angiogenesis pada AR disebabkan oleh terbentuknya kapiler baru dan pertumbuhan ireguler
pada jaringan sinovial yang disebut pannus. Pannus dapat menyebabkan kerusakan sendi. Quercetin memiliki kemampuan inhibisi Matrix
Metalloproteinase (MMP) sehingga degradasi Matrix Ekstra Selular (MES) kartilago dan peningkatan osteoklas tidak akan terjadi pada pasien RA.[103]
Keunggulan Ekstrak Daun Moringa oleifera Dibandingkan Obat Alopati pada Terapi Artritis Reumatoid
Terapi pengobatan AR yang umumnya digunakan adalah golongan NSAIDs, DMARDs, JAK inhibitor, dan sebagainya.[11] Intervensi pengobatan alopati yang ada saat ini dinilai kurang efisien, memerlukan biaya yang cukup besar, dan menimbulkan banyak efek samping. Methotrexate (MTX) merupakan obat lini pertama RA, tetapi 3040% pasien tidak merespon terhadap obat ini. Sementara itu, banyak efek samping dari MTX termasuk hepatotoksisitas, aborsi, dan gangguan gastrointestinal.[105] Oleh karena itu, pendekatan baru diperlukan dalam terapi pengobatan AR yang efektif. Banyak sekali komponen senyawa natural yang memiliki antiinflamatori dan imunomodulator sehingga berpotensi untuk mengobati AR dengan efek samping yang lebih minimal. Salah satunya adalah ekstrak daun Moringa oleifera dengan komponen utama flavonoid sebagai antiinflamatori.
Daun Moringa oleifera dipilih karena availabilitasnya yang tinggi. Moringa oleifera tersedia di Indonesia dari Sumatra, Jawa, Kalimantan, Sulawesi, dan Papua.[106,107] Moringa oleifera juga memiliki efek samping yang lebih minimal dan bisa dimanajemen. Mekanisme flavonoid sebagai antiinflamatori tidak bergantung secara langsung terhadap inhibisi enzim COX, tetapi memengaruhi jalur lain yaitu inhibisi situs aktif peroksidase sehingga flavonoid tidak menimbulkan efek samping seperti NSAIDs.[12]
Mahdi H.J., dkk dalam studinya membuktikan bahwa ekstrak etanol daun Moringa oleifera oral dengan dosis 250 mg/kg BB terbukti lebih efektif dibandingkan indomethacin (NSAID) dalam indeks inhibisi edema kaki tikus dan indeks artritis.[78] Fatima N., dkk dalam studinya menunjukkan bahwa intervensi ekstrak aqueous daun Moringa oleifera 500 mg/kg BB menunjukkan peningkatan signifikan pada tikus diinduksi artritis sebanding dengan efek diclofenac (NSAIDs).[96] Clinical trial yang dilakukan Javadi, F., dkk membuktikan pemberian suplemen quercetin pada wanita dengan AR mampu mengurangi rasa sakit, kaku pada sendi, dan mengurangi faktor inflamatori seperti TNF-O. Sebuah studi lain oleh Haleafragara, N., dkk menyebutkan bahwa indeks ketebalan kaki tikus artritis terinduksi mengalami penurunan yang signifikan pada terapi kombinasi quercetin-methotrexate dibandingkan dengan monoterapi. Selain itu, penurunan signifikan juga ditemukan dalam skor artritis dan sitokin inflamatori. Hal ini dikarekanan terapi quercetin oral memberikan imunitas pada tikus artritis yang diobati dengan MTX.[105]
SIMPULAN
Artritis Reumatoid (AR) merupakan penyakit autoimun sistemik kronik yang mengakibatkan peradangan pada persendian. Pemanfaatan ekstrak daun Moringa oleifera dengan availabilitas yang tinggi di
Indonesia dapat menjadi alternatif pengobatan AR saat ini yang masih kurang terjangkau dan efektif, serta menimbulkan banyak efek samping. Daun Moringa oleifera mengandung senyawa flavonoid dengan jenis terbanyaknya berupa quercetin yang potensial untuk dimanfaatkan sebagai tata laksana AR. Kebermanfaatan quercetin terjadi dengan mengurangi kekakuan sendi, nyeri, dan inflamasi jaringan sinovial yang melibatkan adhesi neutrofil. Metode pengeringan sampel pada media etil asetat merupakan yang paling efektif dalam memperoleh kandungan flavonoid daun Moringa oleifera. Beragam penelitian yang telah diinduksi membuktikan efektivitas Moringa oleifera tanpa menunjukkan efek samping yang signifikan. Ekstrak Moringa oleifera ke depannya dapat dikembangkan menjadi terapi fitofarmaka atau adjuvan untuk meningkatkan keefektifan pengobatan .
SARAN
Kajian Pustaka ini memerlukan penelitian lebih lanjut oleh bidang farmasi untuk menentukan dosis dan kombinasi yang tepat dengan terapi lainnya untuk mengurangi efek samping pengobatan yang digunakan.
UCAPAN TERIMA KASIH
Terima kasih penulis sampaikan kepada semua pihak dan instansi yang telah terlibat dalam pembuatan dan penyelesaian tinjauan pustaka ini.
DAFTAR PUSTAKA
-
1. PUTRI RM, LUTFI A, ALINI A. PENGARUH TERAPI BACK MASSAGE TERHADAP PENURUNAN NYERI RHEUMATOID
ARTHRITIS PADA LANSIA. J Ners 2020;4(2):40–6.
-
2. Studi P, Keperawatan S, Pahlawan U, Tambusai T. EFEKTIFITAS KOMPRES SEREI HANGAT TERHADAP PENURUNAN SKALA NYERI ARTHRITIS RHEUMATOID PADA LANSIA DI DESA NAUMBAI WILAYAH KERJA PUSKESMAS KAMPAR. J Ners 2020;4(1):29– 34.
-
3. Pujastuti NKDM, Mertha IM, Dewi IDAR. Perbedaan Kompres Hangat Jahe Dan Back Massage Terhadap Penurunan Skala Nyeri Ekstrimitas Bawah Pada Lansia Dengan Rheumatoid Athritis. Fak Kedokt Univ Udayana 2018;6:67–72.
-
4. Widayati D, Hayati F. PENINGKATAN KENYAMANAN LANSIA DENGAN NYERI RHEUMATOID ARTHRITIS MELALUI MODEL Comfort Food For The Soul. J Ilmu Keperawatan 2017;5(1):6–15.
-
5. Murata S, Doi T, Sawa R, Saito T, Nakamura R, Isa T, et al. Association between joint stiffness and health-related quality of life in community-dwelling older adults. Arch Gerontol Geriatr 2017;73:234–9.
-
6. Dewi RS. Keperawatan Gerontik. Deepublish;
2014.
-
7. MacKey RH, Kuller LH, Deane KD, Walitt BT,
Chang YF, Holers VM, et al. Rheumatoid Arthritis, Anti-Cyclic Citrullinated Peptide Positivity, and Cardiovascular Disease Risk in the Women’s Health Initiative. Arthritis
Rheumatol (Hoboken, NJ) 2015;67(9):2311– 22.
-
8. England BR, Sayles H, Michaud K, Caplan L, Davis LA, Cannon GW, et al. Cause-Specific Mortality in Male US Veterans With Rheumatoid Arthritis. Arthritis Care Res (Hoboken) 2016;68(1):36–45.
-
9. Verstappen SMM. Rheumatoid arthritis and work: The impact of rheumatoid arthritis on absenteeism and presenteeism. Best Pract Res Clin Rheumatol 2015;29(3):495–511.
-
10. Bawarodi F, Rottie J, Malara R, Studi P, Keperawatan I, Kedokteran F. FAKTOR-FAKTOR YANG BERHUBUNGAN DENGAN KEKAMBUHAN PENYAKIT REMATIK DI WILAYAH PUSKESMAS BEO KABUPATEN TALAUD. J KEPERAWATAN 2017;5(1).
-
11. Chauhan K, Jandu JS, Goyal A, Al-Dhahir MA. Rheumatoid Arthritis. Rosen Barkin’s 5-Minute Emerg Med Consult Fifth Ed 2021;
-
12. Verri WA, Vicentini FTMC, Baracat MM, Georgetti SR, Cardoso RDR, Cunha TM, et al. Flavonoids as Anti-Inflammatory and Analgesic Drugs: Mechanisms of Action and Perspectives in the Development of Pharmaceutical Forms. Stud Nat Prod Chem 2012;36:297–330.
-
13. Wongrakpanich S, Wongrakpanich A, Melhado K, Rangaswami J. A comprehensive review of non-steroidal anti-inflammatory drug use in the elderly. Aging Dis 2018;9(1):143–50.
-
14. Ghlichloo I, Gerriets V. Nonsteroidal Antiinflammatory Drugs (NSAIDs). Treat Chronic Pain Cond A Compr Handb 2021;77–9.
-
15. Brand L, Wolmarans DW, Brand SJ. A quick and painless reminder: The pharmacotherapy of rheumatoid arthritis in primary practice. South African Fam Pract 2018;60(2):38–42.
-
16. Ray SJ, Wolf TJ, Mowa CN. Moringa oleifera and inflammation: A mini-review of its effects and mechanisms. Acta Hortic 2017;1158:317– 30.
-
17. Padayachee B, Baijnath H. An overview of the medicinal importance of Moringaceae. J Med Plants Res 2012;6(48):5831–9.
-
18. Narande JM, Wulur A, Yudistira A. UJI EFEK ANTIINFLAMASI EKSTRAK ETANOL DAUN SUJI (Dracaena angustifolia Roxb)
TERHADAP EDEMA KAKI TIKUS PUTIH JANTAN GALUR WISTAR. PHARMACON 2013;2(3).
-
19. Liang L, Wang C, Li S, Chu X, Sun K. Nutritional compositions of Indian Moringa oleifera seed and antioxidant activity of its polypeptides. Food Sci Nutr 2019;7(5):1754.
-
20. Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet (London, England) 2016;388(10055):2023–38.
-
21. Brzustewicz E, Henc I, Daca A, Szarecka M, Sochocka-Bykowska M, Witkowski J, et al. Autoantibodies, C-reactive protein, erythrocyte sedimentation rate and serum cytokine profiling in monitoring of early treatment. Cent J Immunol 2017;42(3):259–68.
-
22. Littlejohn EA, Monrad SU. Early Diagnosis and Treatment of Rheumatoid Arthritis. Prim Care 2018;45(2):237–55.
-
23. Aletaha D, Smolen JS. Diagnosis and Management of Rheumatoid Arthritis: A
Review. JAMA 2018;320(13):1360–72.
-
24. Deane KD, Demoruelle MK, Kelmenson LB,
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
Kuhn KA, Norris JM, Holers VM. Genetic and environmental risk factors for rheumatoid arthritis. Best Pract Res Clin Rheumatol 2017;31(1):3–18.
Tan EM, Smolen JS. Historical observations contributing insights on etiopathogenesis of rheumatoid arthritis and role of rheumatoid factor. J Exp Med 2016;213(10):1937–50.
Baratawidjaja KG, Rengganis I. Imunologi Dasar Edisi 10. Jakarta: Balai Penerbit
Fakultas Kedokteran Universitas Indonesia; 2012.
Zhang L, Yuan Y, Xu Q, Jiang Z, Chu CQ. Contribution of neutrophils in the pathogenesis of rheumatoid arthritis. J Biomed Res 2020;34(2):86–93.
Yuan K, Zhu Q, Lu Q, Jiang H, Zhu M, Li X, et al. Quercetin alleviates rheumatoid arthritis by inhibiting neutrophil inflammatory activities. J Nutr Biochem [Internet] 2020;84:108454. Available from:
https://doi.org/10.1016/j.jnutbio.2020.108454 Chandrashekara S, Mukhtar Ahmad M, Renuka P, Anupama KR, Renuka K. Characterization of neutrophil-to-lymphocyte ratio as a measure of inflammation in rheumatoid arthritis. Int J Rheum Dis 2017;20(10):1457–67.
Leone A, Spada A, Battezzati A, Schiraldi A, Aristil J, Bertoli S. Cultivation, genetic, ethnopharmacology, phytochemistry and pharmacology of Moringa oleifera leaves: An overview. Int J Mol Sci 2015;16(6):12791–835. Wei Y, Xia N, Zhang W, Huang J, Ren Z, Zhu L, et al. Serum retinol-binding protein 4 is associated with insulin resistance in patients with early and untreated rheumatoid arthritis. Jt Bone Spine [Internet] 2019;86(3):335–41. Available from:
http://dx.doi.org/10.1016/j.jbspin.2018.07.002 Zabetian-Targhi F, Mahmoudi MJ, Rezaei N, Mahmoudi M. Retinol Binding Protein 4 in Relation to Diet, Inflammation, Immunity, and Cardiovascular Diseases. Adv Nutr [Internet] 2015 [cited 2022 Mar 2];6(6):748–62. Available from:
https://academic.oup.com/advances/article/6/6/ 748/4555140
Clarke J. Β-Carotene Blocks the
Inflammasome. Nat Rev Rheumatol
2020;16(5):248.
Carr AC, McCall C. The role of vitamin C in the treatment of pain: New insights. J Transl Med 2017;15(1):1–14.
Zaringhalam J, Akbari A, Zali A, Manaheji H, Nazemian V, Shadnoush M, et al. Long-term treatment by vitamin B1 and reduction of serum proinflammatory cytokines, hyperalgesia, and paw edema in adjuvant-induced arthritis. Basic Clin Neurosci 2016;7(4):331–40.
Suwannasom N, Kao I, Pruß A, Georgieva R, Bäumler H. Riboflavin: The health benefits of a forgotten natural vitamin. Int J Mol Sci 2020;21(3).
Prousky JE. The use of niacinamide and solanaceae (nightshade) elimination in the treatment of osteoarthritis. J Orthomol Med 2015;30(1):13–21.
Sahin K, Kucuk O, Orhan C, Tuzcu M, Durmus AS, Ozercan IH, et al. Niacinamide and undenatured type II collagen modulates the
inflammatory response in rats with monoiodoacetate-induced osteoarthritis. Sci Rep [Internet] 2021;11(1):1–15. Available from: https://doi.org/10.1038/s41598-021-94142-3 53.
-
39. Doi K, Ito H, Tomizawa T, Murata K, Hashimoto M, Tanaka M, et al. Oral steroid decreases the progression of joint destruction of large joints in the lower extremities in rheumatoid arthritis.
Med (United States) 2019;98(47).54.
-
40. Xie J, Peng LJ, Yang MR, Jiang WW, Mao JY, Shi CY, et al. Alkaloid Extract of Moringa oleifera Lam. Exerts Antitumor Activity in
Human Non-Small-Cell Lung Cancervia
Modulation of the JAK2/STAT3 Signaling55.
Pathway. Evidence-based Complement Altern Med 2021;2021.
-
41. Rani NZA, Husain K, Kumolosasi E. Moringa genus: A review of phytochemistry and
pharmacology. Front Pharmacol
2018;9(FEB):1–26.
-
42. Maleki SJ, Crespo JF, Cabanillas B. Antiinflammatory effects of flavonoids. Food Chem 2019;299(July). 56.
-
43. Zasada M, Budzisz E. Retinoids: Active molecules influencing skin structure formation in cosmetic and dermatological treatments. Postep Dermatologii i Alergol 2019;36(4):392– 7.
Our Dermatology Online 2018;9(3):339–40.
Potential and Strategies to Enhance Its Bioavailability. Nutr Food Sci Int J [Internet] 2018;7(4):1–7. Availablefrom:
https://juniperpublishers.com/nfsij/pdf/NFSIJ.M S.ID.555716.pdf59.
-
46. Kasperczyk S, Dobrakowski M, Kasperczyk J, Ostałowska A, Zalejska-Fiolka J, Birkner E. Beta-carotene reduces oxidative stress, improves glutathione metabolism and modifies antioxidant defense systems in lead-exposed 60.
workers. Toxicol Appl Pharmacol
2014;280(1):36–41.
-
47. Polegato BF, Pereira AG, Azevedo PS, Costa NA, Zornoff LAM, Paiva SAR, et al. Role of Thiamin in Health and Disease. Nutr Clin Pract 2019;34(4):558–64. 61.
-
48. Manzetti S, Zhang J, Van Der Spoel D. Thiamin function, metabolism, uptake, and transport. Biochemistry 2014;53(5):821–35.
-
49. Salvador JAR, Carvalho JFS, Neves MAC, Silvestre SM, Leitão AJ, Silva MMC, et al. 62.
Anticancer steroids: Linking natural and semisynthetic compounds. Nat Prod Rep
2013;30(2):324–74. 63.
-
50. Rasheed A, Qasim M. a Review of Natural Steroids and Their Applications. Int J Pharm Sci Res [Internet] 2013;4(2):520–31. Available from: http://ijpsr.com/bft-article/antimicrobial-
activity-of-essential-oils-exploration-on-mechanism-of-bioactivity/
-
51. Junaidi E, Anwar YAS. Aktivitas Antibakteri dan Antioksidan Asam Galat dari Kulit Buah Lokal yang Diproduksi dengan Tanase. ALCHEMY J Penelit Kim 2018;14(1):131.
-
52. Kahkeshani N, Farzaei F, Fotouhi M, Alavi SS, Bahramsoltani R, Naseri R, et al. 64.
Pharmacological effects of gallic acid in health and disease: A mechanistic review. Iran J Basic Med Sci 2019;22(3):225–37.
Tajik N, Tajik M, Mack I, Enck P. The potential effects of chlorogenic acid, the main phenolic components in coffee, on health: a
comprehensive review of the literature. Eur J Nutr 2017;56(7):2215–44.
Huang S, Wang LL, Xue NN, Li C, Guo HH, Ren TK, et al. Chlorogenic acid effectively treats cancers through induction of cancer cell differentiation. Theranostics 2019;9(23):6745– 63.
Santana-Gálvez J, Villela Castrejón J, Serna-Saldívar SO, Jacobo-Velázquez DA.
Anticancer potential of dihydrocaffeic acid: a chlorogenic acid metabolite.
http://mc.manuscriptcentral.com/tcyt [Internet] 2020 [cited 2022 Mar 2];18(1):245–8. Available from:
https://www.tandfonline.com/doi/abs/10.1080/1 9476337.2020.1743762
Tajik N, Tajik M, Mack I, Enck P. The potential effects of chlorogenic acid, the main phenolic components in coffee, on health: a
comprehensive review of the literature. Eur J Nutr 2017 567 [Internet] 2017 [cited 2022 Mar 2];56(7):2215–44. Available from:
https://link.springer.com/article/10.1007/s00394 -017-1379-1
Ashoori M, Saedisomeolia A. Riboflavin (vitamin B2) and oxidative stress: A review. Br J Nutr 2014;111(11):1985–91.
Saedisomeolia A, Ashoori M. Riboflavin in Human Health: A Review of Current Evidences [Internet]. 1st ed. Elsevier Inc.; 2018. Available from: http://dx.doi.org/10.1016/bs.afnr.2017.11.002 El-Said KS, Atta A, Mobasher MA, Germoush MO, Mohamed TM, Salem MM. Quercetin mitigates rheumatoid arthritis by inhibiting adenosine deaminase in rats. Mol Med 2022;28(1).
Ansari MM, Neha, Khan HA. Quercetin alleviate oxidative stress and inflammation through upregulation of antioxidant machinery and down-regulation of COX2 and NF-κB expression in collagen induced rheumatoid arthritis. Int J Drug Dev Res 2014;6(1):215–30. Lesjak M, Beara I, Simin N, Pintać D, Majkić T, Bekvalac K, et al. Antioxidant and antiinflammatory activities of quercetin and its derivatives. J Funct Foods 2018;40(October 2017):68–75.
Xu D, Hu MJ, Wang YQ, Cui YL. Antioxidant activities of quercetin and its complexes for medicinal application. Molecules 2019;24(6).
Chen AY, Chen YC. A Review of The Dietary Flavonoid, Kaempferol on Human Health and Cancer Chemoprevention. Food Chem [Internet] 2013;138(4):2099–107. Available from:
http://dx.doi.org/10.1016/j.earlhumdev.2015.09. 003%5Cnhttp://dx.doi.org/10.1016/j.earlhumde v.2014.01.002%5Cnhttp://dx.doi.org/10.1016/S 0378-3782(12)70006-
3%5Cnhttp://www.sciencedirect.com/science/ar ticle/pii/S2341287914000763%5Cnhttp://dx.doi. org/10.1016/
Ren J, Lu Y, Qian Y, Chen B, Wu T, Ji G.
Recent progress regarding kaempferol for the treatment of various diseases (Review). Exp
-
65. Standing CT. Kaempferol as a Dietary AntiInflammatory Agent: :1-12.
Pharmacological Action of Kaempferol in Central Nervous System Diseases: A Review.
Front Pharmacol 2021;11(January).
2022;8(January):1–7.
-
68. Rizvi S, Raza ST, Ahmed F, Ahmad A, Abbas
health and some diseases. Sultan Qaboos Univ
Med J 2014;14(2):157–65.
-
69. Wallert M, Ziegler M, Wang X, Maluenda A, Xu X, Yap ML, et al. α-Tocopherol preserves cardiac function by reducing oxidative stress and inflammation in ischemia/reperfusion injury. Redox Biol [Internet]
2019;26(August):101292. Available from: 82.
https://doi.org/10.1016/j.redox.2019.101292
-
70. Salinthone S, Kerns AR, Tsang V, Carr DW. α-Tocopherol (vitamin E) stimulates cyclic AMP production in human peripheral mononuclear cells and alters immune function. Mol Immunol [Internet] 2013;53(3):173–8. Available from: 83.
http://dx.doi.org/10.1016/j.molimm.2012.08.005
-
71. Choudhury K, Clark J, Griffiths HR. An almond-enriched diet increases plasma α-tocopherol and improves vascular function but does not affect oxidative stress markers or lipid levels. 84.
Free Radic Res 2014;48(5):599–606.
-
72. Pozzer D, Invernizzi RW, Blaauw B, Cantoni O, Zito E. Ascorbic Acid Route to the Endoplasmic 85.
Reticulum: Function and Role in Disease. 2021.
-
73. Sorice A, Guerriero E, Capone F, Colonna G, Castello G, Costantini S. Ascorbic Acid: Its 86.
Role in Immune System and Chronic Inflammation Diseases. Mini-Reviews Med
Chem 2014;14(5):444–52.
-
74. Chambial S, Dwivedi S, Shukla KK, John PJ,
Sharma P. Vitamin C in disease prevention and87.
cure: An overview. Indian J Clin Biochem 2013;28(4):314–28.
moringa oleifera leaves in animal models. Int J
Basic Clin Pharmacol 2017;6(2):452.
-
76. Guazelli CFS, Staurengo-Ferrari L, Zarpelon
AC, Pinho-Ribeiro FA, Ruiz-Miyazawa KW,89.
Vicentini FTMC, et al. Quercetin attenuates zymosan-induced arthritis in mice. Biomed Pharmacother 2018;102:175–84.
inflammation. Nat Rev Immunol [Internet] 2013;13(3):159–75. Available from:
http://dx.doi.org/10.1038/nri3399
-
78. Mahdi HJ, Khan NAK, Asmawi MZ Bin, Mahmud R, A/L Murugaiyah V. In vivo anti-arthritic and anti-nociceptive effects of ethanol extract of Moringa oleifera leaves on complete 91.
Freund’s adjuvant (CFA)-induced arthritis in rats. Integr Med Res [Internet] 2018;7(1):85–
94. Available from:
https://doi.org/10.1016/j.imr.2017.11.002
Saini RK, Sivanesan I, Keum YS. Phytochemicals of Moringa oleifera: a review of their nutritional, therapeutic and industrial significance. 3 Biotech 2016;6(2):1–14.
Vongsak B, Sithisarn P, Mangmool S, Thongpraditchote S, Wongkrajang Y, Gritsanapan W. Maximizing total phenolics, total flavonoids contents and antioxidant activity of Moringa oleifera leaf extract by the appropriate extraction method. Ind Crops Prod [Internet] 2013;44(November 2017):566–71. Available from:
http://dx.doi.org/10.1016/j.indcrop.2012.09.021 Fatmawati A, Sucianingsih D, Kurniawati R, Abdurrahman M. Microscopic Identification and Determination of Total Flavonoid Content of Moringa Leaves Extract and Ethyl Acetate Fraction ( Moringa oleifera L .) Identifikasi Mikroskopis dan Penentuan Kandungan Flavonoid Total Ekstrak Daun Kelor dan Fraksi Etil Asetat. 2021;1(1).
Iwansyah AC, Manh TD, Andriana Y, Hessan MA Bin, Kormin F, Cuong DX, et al. Effects of various drying methods on selected physical and antioxidant properties of extracts from moringa oliefera leaf waste. Sustain 2020;12(20):1–12.
Sapra A, Mus S, Dwirandy D, Malluka R, Khairi N. Diffusion Study of Cream Formula of Lyophilized Ethanol Extract of Moringa oleifera L. Leaves. J Farm Galen (Galenika J Pharmacy) 2021;7(2):131–42.
Alqahtani MS, Kazi M, Alsenaidy MA, Ahmad MZ. Advances in Oral Drug Delivery. Front Pharmacol 2021;12(February).
Grgić J, Šelo G, Planinić M, Tišma M, Bucić-Kojić A. Role of the encapsulation in bioavailability of phenolic compounds. Antioxidants 2020;9(10):1–36.
Xie F, Ding X, Zhang QY. An update on the role of intestinal cytochrome P450 enzymes in drug disposition. Acta Pharm Sin B [Internet] 2016;6(5):374–83. Available from:
http://dx.doi.org/10.1016/j.apsb.2016.07.012 KARIMAH M. Pembuatan dan Karakterisasi Kapsul Pati-Alginat dari Ekstraksi Rumput Laut Coklat (Sargassum sp.) Sebagai Material Drug Delivery System. Adln - Perpust Univ Airlangga Pedoman 2016;
Homayun B, Lin X, Choi HJ. Challenges and recent progress in oral drug delivery systems for biopharmaceuticals. Pharmaceutics
2019;11(3).
Koyama A, Tanaka A, To H. Daily oral administration of low-dose methotrexate has greater antirheumatic effects in collagen-induced arthritis rats. J Pharm Pharmacol 2017;69(9):1145–54.
Abuhelwa AY, Foster DJR, Upton RN. A Quantitative Review and Meta-Models of the Variability and Factors Affecting Oral Drug Absorption—Part I: Gastrointestinal pH. AAPS J [Internet] 2016;18(5):1309–21. Available from: http://dx.doi.org/10.1208/s12248-016-
9952-8
Rolle T, Dallorto L, Rossatto S, Curto D, Nuzzi R. Assessing the Performance of Daily Intake of a Homotaurine, Carnosine, Forskolin,
Vitamin B2, Vitamin B6, and Magnesium Based Food Supplement for the Maintenance of Visual Function in Patients with Primary Open Angle Glaucoma. J Ophthalmol 2020;2020.
-
92. Abuhelwa AY, Williams DB, Upton RN, Foster DJR. Food, gastrointestinal pH, and models of oral drug absorption. Eur J Pharm Biopharm [Internet] 2017;112:234–48. Available from: http://dx.doi.org/10.1016/j.ejpb.2016.11.034
-
93. Chappell M, Payne S. Pharmacokinetics. Biosyst Biorobotics 2021;24:61–72.
-
94. Lin M, Zhang J, Chen X. Bioactive flavonoids in Moringa oleifera and their health-promoting properties. J Funct Foods 2018;47:469–79.
-
95. El-Saber Batiha G, Beshbishy AM, Ikram M, Mulla ZS, Abd El-Hack ME, Taha AE, et al. The pharmacological activity, biochemical
properties, and pharmacokinetics of the major natural polyphenolic flavonoid: Quercetin. Foods 2020;9(3).
-
96. Fatima N, Fatima SJ. Pharmacological screening for anti-arthritic activity of Moringa oleifera. Asian J Pharm Clin Res 2016;9(3):1– 6.
-
97. Saleem A, Saleem M, Akhtar MF. Antioxidant, anti-inflammatory and antiarthritic potential of Moringa oleifera Lam: An ethnomedicinal plant of Moringaceae family. South African J Bot 2020;128:246–56.
-
98. Ekhator CN, Osifo UC. Abortifacient Efficacy of Moringa oleifera Leave: An Experimental Study on Adult Female Wistar Rats. Asia Pasific Bus Rev 2015;3(6):269–72.
-
99. Sunhre L, Kar A, Panda S. Agnucastoside C, isolated from Moringa oleifera ameliorates thyrotoxicosis and liver abnormalities in female mice. Clin Phytoscience 2020 61 2020;6(1):1– 8.
-
100. Mondal C, Chandra AK.
Goitrogenic/antithyroidal potential of moringa leaves (Moringa oleifera) and spinach (Spinacia oleracea) of Indian origin on thyroid status in male albino rats. Brazilian J Pharm Sci 2019;55.
-
101. Showande SJ, Fakeye TO, Kajula M, Hokkanen J, Tolonen A. Potential inhibition of major human cytochrome P450 isoenzymes by selected tropical medicinal herbs—Implication for herb–drug interactions. Food Sci Nutr 2019;7(1):44–55.
-
102. Fantoukh OI, Albadry MA, Parveen A, Hawwal MF, Majrashi T, Ali Z, et al. Isolation, synthesis, and drug interaction potential of secondary metabolites derived from the leaves of miracle tree (Moringa oleifera) against CYP3A4 and CYP2D6 isozymes. Phytomedicine
2019;60:153010.
-
103. Ji JJ, Lin Y, Huang SS, Zhang HL, Diao YP, Li K. Quercetin: A Potential Natural Drug fo r Adjuvant Treatment of Rheumatoid Arthritis. African J Tradit Complement Altern Med 2013;10(3):418.
-
104. Kim HR, Kim BM, Won JY, Lee KA, Ko HM, Kang YS, et al. Quercetin, a Plant Polyphenol, Has Potential for the Prevention of Bone Destruction in Rheumatoid Arthritis. J Med Food 2019;22(2):152–61.
-
105. Haleagrahara N, Hodgson K, Miranda-Hernandez S, Hughes S, Kulur AB, Ketheesan N. Flavonoid quercetin-methotrexate
combination inhibits inflammatory mediators
and matrix metalloproteinase expression, providing protection to joints in collagen-
induced arthritis. Inflammopharmacology
2018;26(5):1219–32.
-
106. Timur T, Perlakuan D, Media P. Wahana
Forestra: Jurnal Kehutanan Vol . 14 No . 1
Januari 2019 Wahana Forestra: Jurnal
Kehutanan. 2019;14(1):1–9.
-
107. Ridwan, Hamim, Suharsono, Hidayati N, Gunawan I. Drumstick (Moringa oleifera) variation in biomass and total flavonoid content in Indonesia. Biodiversitas 2021;22(1):491–8.
-
108. Javadi F, Ahmadzadeh A, Eghtesadi S, Aryaeian N, Zabihiyeganeh M, Rahimi Foroushani A, et al. The Effect of Quercetin on Inflammatory Factors and Clinical Symptoms in Women with Rheumatoid Arthritis: A DoubleBlind, Randomized Controlled Trial. J Am Coll Nutr 2017;36(1):9–15.
106
Discussion and feedback