PENTHOXYFILLINE SEBAGAI TERAPI KOMPLEMENTER CHRONIC KIDNEY DISEASE
on
ARTIKEL TINJAUAN PUSTAKA
Essence of Scientific Medical Journal (2021), Volume 19, Number 1:22-26

P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
PENTOXYFILLINE SEBAGAI TERAPI ADJUVAN CHRONIC KIDNEY DISEASE
I Made Widianantara,1 Ni Nyoman Gita Kharisma Dewi,1 Ni Made Ari Purwaningrum,1
ABSTRAK
Chronic kidney disease (CKD) merupakan penyebab kematian paling umum ke-18 setiap tahunnya, yang sering dikaitkan dengan usia tua, diabetes, hipertensi, obesitas, serta penyakit kardiovaskular. Pengobatan CKD yang ada sekarang dirasa kurang efektif karena hanya sebatas memperlambat progresivitasnya. Pentoxyfilline (PTX) merupakan salah satu terapi adjuvan yang dapat mencegah dan menghambat progresivitas CKD. PTX dapat memberikan efek renoprotektif. PTX juga dapat mengatasi proteinuria pada penderita nefropati diabetik. Maka dari itu, PTX dapat digunakan sebagai terapi adjuvan pada penderita CKD.
Kata Kunci: chronic kidney disease, pentoxyfilline, proteinuria
ABSTRACT
Chronic kidney disease (CKD) was the 18th most common death cause annually, that often associated with elderly, diabetes, hypertension, obesity, and cardiovascular disease. CKD treatment that available now is less effective because it only postpone the progression of the disease. Pentoxyfilline (PTX) was one of treatment that can be used as adjuvant therapy in CKD. PTX can deliver renoprotective effect. Also, it can resolve proteinuria problem in patient with diabetic neuropathy. Therefore, PTX can be used as adjuvant therapy in patient with CKD.
Keywords: chronic kidney disease, pentoxyfilline, proteinuria
1Program Studi Sarjana Kedokteran dan Profesi Dokter, Fakultas Kedokteran, Universitas Udayana, Bali
PENDAHULUAN
Penyakit ginjal kronis masih menjadi permasalahan kesehatan global yang membutuhkan biaya tinggi dalam pengobatannya. Penyakit ginjal kronis atau chronic kidney disease (CKD) didefinisikan sebagai gangguan heterogen yang memengaruhi struktur dan fungsi ginjal.[1] CKD juga dapat diartikan sebagai penurunan fungsi ginjal atau peningkatan proteinuria yang dikonfirmasi pada 2 atau lebih pemeriksaan yang dilakukan sekurang-kurangnya antara 3 bulan.[2] CKD bersifat ireversibel yang dapat terjadi selama beberapa bulan hingga tahun.[3] Menurut data hasil Riskesdas tahun 2018, Indonesia memiliki prevalensi CKD sebesar 0,38% dengan kelompok umur terbanyak, yaitu lansia. Pasien CKD yang melakukan dialisis mengalami beberapa gejala fisik dan emosional, yaitu menunjukkan kejadian depresi yang tinggi dan merasakan penurunan quality of life (QOL). Gejala lain berupa rasa lelah yang berlebihan, nyeri, kaku otot, gangguan tidur, dan disfungsi seksual dijumpai pada sebagian pasien yang menjalani dialisis jangka panjang.[4]
Menurut penelitian Global Burden of Disease, pada tahun 2010 CKD menjadi penyebab kematian ke-18 yang paling umum.[5] Setidaknya 10% dari populasi dunia mengalami CKD dan jutaan meninggal setiap tahunnya karena susahnya akses pengobatan CKD serta biaya yang tinggi.[6]
Terapi CKD, baik di negara berpenghasilan tinggi dan menengah menghadapi beberapa tantangan. Populasi pasien CKD yang semakin menua akan meningkatkan kemungkinan progesivitas CKD menjadi end-stage renal disease (ESRD). CKD juga dianggap sebagai salah satu faktor risiko dari semua penyakit tidak menular. Hal tersebut diperparah dengan pemeriksaan fungsi ginjal, contohnya serum kreatinin yang hanya dapat dilakukan pada rumah sakit sekunder/tersier dan sangat jarang ditemukan pada pusat layanan kesehatan primer.[7]
Pada negara berkembang, CKD dikaitkan dengan usia tua, diabetes, hipertensi, obesitas, dan penyakit kardiovaskular.[2] Banyak penelitian
melaporkan rendahnya estimated glomerular filtration rate (eGFR) dan peningkatan proteinuria yang diasosiasikan dengan penyakit kardiovaskular.[8,9]
Saat ini, pengobatan CKD difokuskan pada kontrol gula darah penderita dengan diabetes atau pengobatan tekanan darah pada pasien dengan hipertensi. Pengobatan ini dirasa kurang efektif karena hanya sebatas memperlambat perburukan CKD menjadi ESRD.[7]
Terapi adjuvan untuk pasien CKD diperlukan untuk meningkatkan efektivitas pengobatan. Pentoxyfilline (PTX), non-specific phosphodiesterase inhibitor yang telah dijadikan sebagai terapi pada pasien dengan penyakit pembuluh darah perifer yang memiliki fungsi untuk menurunkan kekentalan darah dan meningkatkan deformabilitas sel darah merah.[10] Pemberian terapi jangka panjang dengan PTX juga menunjukkan efek penurunan terhadap risiko kardiovaskular. [11]
Melihat pengobatan konvensional yang saat ini digunakan untuk menangani CKD masih belum memberikan efek yang efekif dan dapat menimbulkan efek jangka panjang, seperti risiko terhadap mortalitas kardiovaskular, maka sangat diperlukan pengobatan adjuvan dalam penanganan CKD. Beberapa studi berhasil menunjukkan bahwa PTX berpotensi sebagai terapi adjuvan untuk membantu dalam mencegah dan menghambat progresivitas CKD.
PEMBAHASAN
Chronic Kidney Disease
CKD merupakan kondisi umum yang merujuk pada kehilangan fungsi ginjal dalam waktu yang lama.[12] CKD umumnya tanpa gejala pada perawatan primer serta patologi dasarnya sering tidak diketahui. CKD diidentifikasi dan didefinisikan sebagai adanya abnormalitas pada struktur ataupun fungsi ginjal maupun keduanya yang berlangsung minimal 3 bulan.[13] CKD diklasifikasikan berdasarkan derajat disfungsi ginjal dengan mengukur glomerular filtration rate (GFR) dan berdasarkan ada atau tidaknya abnormalitas struktur ginjal ataupun adanya kerusakan ginjal kronis dan mikro albuminuria.[14]
Risiko terjadinya gangguan kardiovaskular lebih tinggi daripada risiko progresi menuju ESRD pada mayoritas penderita CKD.[8] Terapi ESRD, kebutuhan untuk dialisis, serta transplantasi membutuhkan biaya yang besar dan dapat menjadi beban bagi keluarga pasien. Deteksi dini dilakukan dengan intervensi primary care untuk mengurangi risiko terjadiya progresivitas.[15]
Pentoxifylline
PTX merupakan turunan dari dari methylxanthine yang digunakan kurang lebih dari tiga dekade untuk mengobati intermittent claudication.[16] Dosis klinis yang digunakan 400 mg tiga kali sehari.[17] PTX dapat meningkatkan sifat reologi dari darah dengan berbagai cara, seperti penurunan plasma dan viskositas darah. Komulatif dari efek reduksi dalam viskositas plasma, meningkatkan fleksibilitas eritrosit, dan supresi aktivasi neutrophil merupakan peningkatan aliran darah kapiler.[18] Biologi molekuler yang mendasari efek tersebut adalah inhibitor non-spesifik cyclic adenosine-3, 5-monoposphate (cAMP) phosphodiesterase dan meregulasi efek dari cAMP.[19]
Mekanisme Aksi dari Pentoxyfilline Terhadap Chronic Kidney Disease
PTX dalam mengatasi CKD berperan sebagai antiinflamasi, sehingga dapat memberikan efek renoprotektif. Salah satu target dari PTX adalah
dengan menghambat kinerja dari phosphodieterase (PDEs). Terhambatnya kinerja dari PDEs tersebut akan mengakibatkan peningkatan level dari cAMP. Peningkatan dari cAMP ini mengakibatkan aktifnya protein kinase a (PKA). Teraktivasinya PKA tersebut menimbulkan ubiquitination yang menurunkan sintesis sitokin proinflamasi. Sitokin yang disintesis, seperti monocyte chemoattractan protein-1 (MCP-1), interleukin 1 (IL-1), interleukin 6 (IL-6), dan tumor necrosis factor alpha (TNF-α).[11,20,21,22]
Dalam studi yang dilakukan oleh Juan et al. (2018), dinyatakan bahwa pemberian terapi PTX pada penderita CKD dapat meningkatkan konsentrasi dari klotho serum dan urin. Temuan tersebut juga didukung oleh hasil penelitian yang menunjukkan bahwa PTX mencegah timbulnya down-regulasi dari ekspresi klotho protein dan messenger RNA (mRNA). Timbulnya down-regulasi tersebut terjadi karena induksi dari albumin, TNF-α, dan TNF-like weak inducer of apoptosis (TWEAK) yang terdapat dalam sel tubular ginjal, sehingga dapat dinyatakan bahwa PTX memberikan efek antiinflamasi dan antialbuminuria. Meningkatnya kadar klotho serum dan urin yang ditimbulkan dari terapi PTX memberikan efek nefroprotektif dan anti-aging, yang mana efek nefroprotektif dibuktikan dengan memperlambat penurunan eGFR dan meningkatnya penurunan albuminuria.[23]
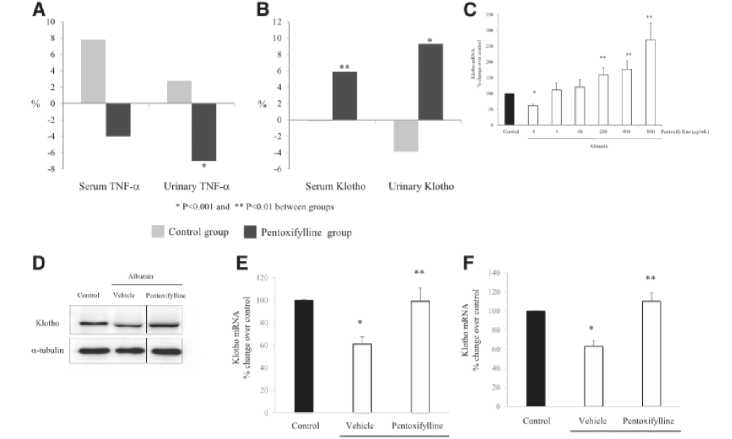
Gambar 1. Gambaran Grafik Efek Pentoxifylline Secara Klinis dan In Vitro. A-B: perubahan persentase rata-rata dari TNF-α dan soluble klotho sehubungan dengan baseline; C-F: pentoxifylline mencegah penurunan dari klotho expression dalam respon terhadap albumin dan TWEAK sitokin inflamasi dan TNF-α secara in vitro; C: sel tubulus ginjal yang terstimulasi dengan berbagai konsentrasi dari pentoxifylline untuk 1 jam dan 10 mg/ml albumin untuk 3 jam. Kadar klotho mRNA expression mengalami penurunan setelah stimulasi albumin saja, tetapi ditingkatkan dalam sel yang diterapi dengan pentoxifylline.[23]
Efek Klinis dari Pentoxifylline Pada CKD
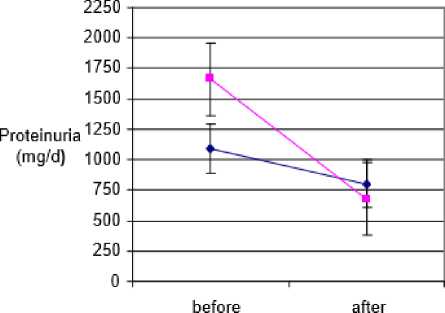
Berdasarkan studi yang dilakukan oleh Farshid et al. (2011), didapatkan hasil bahwa pemberian PTX dapat mengatasi proteinuria pada nefropati diabetik. Proteinuria adalah manifestasi dari nefropati diabetik, yang merupakan ciri klinis tradisional dari CKD pada penyakit mikrovaskular diabetik di ginjal. Dalam studi
tersebut, disebutkan bahwa PTX secara signifikan dapat menurunkan proteinuria dibandingkan dengan kelompok kontrol dengan p= <0,001. Apabila dilihat dari segi creatinine clearance rate, tidak ditemukan perbedaan yang signifikan antara kelompok dengan terapi PTX dan kelompok kontrol.[24]
Tabel 1. Perbandingan Kadar Proteinuria dan Creatinine Clearance Rate Antara Kelompok Placebo dengan Kelompok yang Mendapatkan Terapi Pentoxifylline.[24]
|
Groups (n = 28) |
Reduction of Proteinuria (mg/d) (before & after treatment) |
CrCL (ml/min) Before treatment |
CrCL (ml/min After treatment |
|
Placebo |
-294.14 ± 497.43 |
80.9 ± 19.92 |
79.36 ± 19.92 |
|
Treated |
-979.25 ± 695.44 |
80.18 ± 24.80 |
80.62 ± 22.84 |
|
Pvalue |
0.001 |
0.8 |
0.7 |
Gambar 2. Grafik Perbandingan Kadar Proteinuria Antara Klompok Placebo dengan Kelompok yang Mendapatkan Terapi Pentoxifylline. (A) Placebo group, yang mana hanya pendapatkan angiotensin system inhibitors. (B) Treated group, yang mana mendapatkan angiotensin system inhibitor dan pentoxifylline 400 mg 3 kali dalam sehari.[24]
Menurut penelitian yang dilakukan oleh Ali et al. (2012), ditunjukkan juga bahwa PTX dapat menurunkan proteinuria secara signifikan. Penelitian ini membandingkan kelompok kontrol dengan kelompok terapi. Kelompok kontrol adalah kelompok yang hanya mendapatkan losartan dan enalapril, sedangkan kelompok terapi merupakan kelompok yang mendapatkan tambahan terapi PTX 400 mg setiap harinya selama 6 bulan.[25]
Studi yang dilakukan oleh Juan et al. (2015) melihat efek dari PTX terhadap fungsi ginjal dan urinary albumin excretion pada pasien diabetic kidney disease. Diabetic kidney disease merupakan penyebab tersering dari timbulnya CKD dan ESRD pada penderita diabetes melitus tipe 2. Dalam studi ini, digunakan dua kelompk besar, yaitu kelompok kontrol dan kelompok yang mendapat terapi PTX. Kelompok kontrol hanya mendapatkan terapi berupa renin-angiotensin system (RAS) inhibitor, yakni angiotensin-converting enzyme inhibitor (ACEI) atau angiotensin II receptor blocker (ARB), sedangkan kelompok terapi mendapatkan tambahan terapi PTX dengan dosis 1200 mg per hari selama 2 tahun. Hasil penelitian ini menunjukkan bahwa PTX secara signifikan dapat meberikan efek terhadap UAE, dimana pada kelompok kontrol memiliki persentase UAE sebesar 5,7%, sedangkan kelompok terapi sebesar 14,9% dengan nilai p= 0,001. PTX juga berhasil dibuktikan dapat memperlambat penurunan dari eGFR dengan P< 0,001.[26]
Studi yang dilakukan oleh Alejandra et al. (2019) berhasil menunjukkan bahwa penggunaan PTX sebagai terapi jangka panjang pada penderita CKD dapat memberikan efek penurunan risiko mortalitas penyakit kardiovaskuler. Penelitian tersebut membandingkan dua kelompok, yaitu kelompok kontrol dan kelompok yang mendapatkan terapi PTX 400 mg per 2 kali sehari. Hasil studi menunjukkan PTX secara signifikan dapat menurunkan mortalitas
kardiovaskuler (2 pasien berbanding 10 pasien pada kelompok kontrol) (log Rank 5.0977, p= 0.024). PTX dinyatakan dapat menurunkan mortalitas kardiovaskuler pada 55% yang disesuaikan untuk kategori diabetes melitus dan usia (HR 0.45 (0.210.48), p = 0.044).[11]
Berdasarkan studi yang dilakukan oleh Seung Jin Han (2015), didapatkan hasil bahwa PTX secara signifikan dapat mengurangi kadar hemoglobin A1c (HbA1c), kadar gula darah puasa (fasting glucose level), dan HOMA-IR dibandingkan dengan kelompok placebo (p< 0.05). Dalam studi ini juga dilakukan analisis multivariat regresi untuk melihat efek dari PTX terhadap penurunan kadar glukosa. Hasilnya menunjukkan bahwa PTX sebagai variabel bebas dan parameter klinis sebagai variabel independen. Hasil tersebut mengindikasikan bahwa PTX adalah faktor independen yang berhubungan dengan perubahan HbA1c setelah disesuaikan dengan baseline HbA1c, usia, jenis kelamin, perubahan body mass index (BMI), dan durasi menderita diabetes (p= 003).[27]
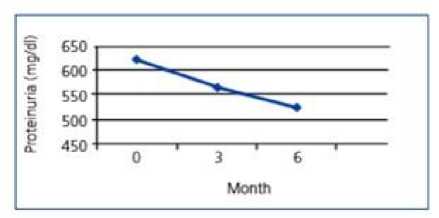
Gambar 3. Grafik yang Menunjukkan Gambaran Kadar Proteinuria pada Kelompok Kontrol. [25]
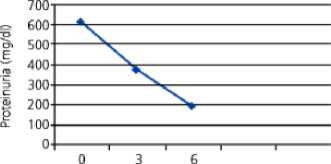
Month
Gambar 4. Grafik yang Menunjukkan Gambaran Kadar Proteinuria pada Kelompok Terapi pentoxifylline.[25]
Tabel 2. Tabel yang Menunjukkan Efektivitas Pentoxifylline Terhadap Mortalitas Kardiovaskular. [11]
|
HR |
95% CI | |
|
P |
|
PTF treatment (yes) 0.044 |
0.45 |
(0.21-0.98) |
|
Age (years) 0.086 |
1.09 |
(0.98-1.20) |
|
Diabetes (yes) 0.024 |
4.11 |
(1.20-14.02) |
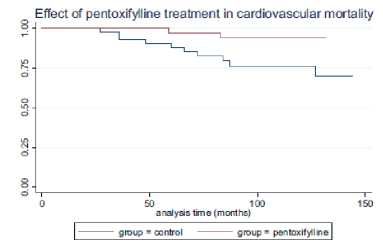
Gambar 5. Grafik yang Menunjukkan Efek Pentoxifylline Terhadap Mortalitas Kardiovaskular.[11]
Tabel 3. Tabel yang Menujukkan Perbandingan Variabel yang Diteliti Antara Kelompok Kontrol dan Kelompok yang Mendapat Terapi Pentoxifylline.[27]
|
Placebo (n = 70) |
Pentoxifylline (n = 52) |
P-value | |
|
BMI (kg/m2) |
0.22 ± 1.75 |
-0.25 ± 0.80 |
0.079 |
|
Systolic BP (mmHg) |
3.9 ± 18.3 |
1.3 ± 15.7 |
0.417 |
|
Diastolic BP (mmHg) |
0.3 ± 11.8 |
1.8 ± 10.9 |
0.473 |
|
HbA1c (%) |
0.09 ± 0.72 |
-0.34 ± 0.74 |
0.002 |
|
Fasting plasma glucose (mg/dL) |
8.4 ± 37.4 |
-10.0 ± 38.9 |
0.009 |
|
HOMA-IRa |
0.24 ± 2.61 |
-0.79 ± 2.03 |
0.041 |
|
Hs-CRP (mg/L) |
0.70 ± 4.33 |
0.51 ± 4.32 |
0.818 |
|
Serum TNF-α (pg/mL) |
0.14 ± 0.71 |
-0.24 ± 3.11 |
0.322 |
|
AST(U/L) |
0.33 ± 13.33 |
-1.31 ± 7.84 |
0.432 |
|
ALT(U/L) |
-0.30 ± 14.38 |
-1.37 ± 8.75 |
0.637 |
|
r-GT(U/L) |
1.19 ± 25.27 |
-3.90 ± 8.88 |
0.216 |
SIMPULAN 3.
PTX dalam beberapa penelitian dinyatakan mampu secara signifikan memperlambat penurunan eGFR, meningkatkan penurunan proteinuria, menurunkan 4.
kadar HbA1c, kadar gula darah puasa, dan HOMA-IR
(tolok ukur dari resistensi insulin). Oleh karena itu, PTX dapat dinyatakan mampu menjadi terapi adjuvan dalam mencegah dan menghambat progresivitas
CKD. 5.
SARAN
Berdasarkan simpulan, diharapkan informasi yang disampaikan dapat bermanfaat untuk menambah
ilmu pengetahuan mengenai obat PTX yang dapat 6.
digunakan sebagai potensial terapi dalam menangani
CKD. Serta diharapkan akan banyak penelitian yang dilakukan untuk meneliti lebih lanjut potensial terapi PTX dalam menangani CKD.
7.
DAFTAR PUSTAKA
-
1. Levey AS, Coresh J. Chronic kidney disease. The lancet. 2012 Jan 14;379(9811):165-80.
-
2. Gansevoort RT, Correa-Rotter R, Hemmelgarn
BR, Jafar TH, Heerspink HJ, Mann JF, Matsushita 8.
K, Wen CP. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. The Lancet. 2013 Jul 27;382(9889):339-52.
Webster AC, Nagler EV, Morton RL, Masson P. Chronic kidney disease. The lancet. 2017 Mar 25;389(10075):1238-52.
Abdel-Kader K, Unruh ML, Weisbord SD. Symptom burden, depression, and quality of life in chronic and end-stage kidney disease. Clinical Journal of the American Society of Nephrology. 2009 Jun 1;4(6):1057-64.
Jha V, Garcia-Garcia G, Iseki K, Li Z, Naicker S, Plattner B, Saran R, Wang AY, Yang CW. Chronic kidney disease: global dimension and
perspectives. The Lancet. 2013 Jul
20;382(9888):260-72.
Day WK. Chronic kidney disease [Internet]. https://www.worldkidneyday.org/. 2019 [cited 2019 Dec 10]. p. 1. Available from: https://www.worldkidneyday.org/facts/chronic-kidney-disease/
Wang, J., Zhang, L., Tang, S.C.W., Kashihara, N., Kim, Y.S., Togtokh, A., Yang, C.W. and Zhao, M.H., 2018. Disease burden and challenges of chronic kidney disease in North and East Asia. Kidney international, 94(1), pp.22-25.
Chronic Kidney Disease Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a
collaborative meta-analysis. The Lancet. 2010 Jun 12;375(9731):2073-81.
-
9. Van Der Velde, M., Matsushita, K., Coresh, J., Astor, B.C., Woodward, M., Levey, A.S., de Jong, P.E., Gansevoort, R.T. and Chronic Kidney Disease Prognosis Consortium, 2011. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative metaanalysis of high-risk population cohorts. Kidney international, 79(12), pp.1341-1352.
-
10. Leporini C, Pisano A, Russo E, de Sarro G, Coppolino G, Bolignano D. Effect of pentoxifylline on renal outcomes in chronic kidney disease
patients: a systematic review and meta-analysis. Pharmacological research. 2016 May 1;107:315-32.
-
11. de Morales AM, Goicoechea M, Verde E, Carbayo J, Barbieri D, Delgado A, Verdalles U, de Jose AP, Luño J. Pentoxifylline, progression of chronic kidney disease (CKD) and cardiovascular mortality: Long-term follow-up of a randomized clinical trial. Journal of Nephrology. 2019 Aug 1;32(4):581-7.
-
12. Fraser SD, Blakeman T. Chronic kidney disease: identification and management in primary care. Pragmatic and observational research. 2016;7:21.
-
13. National CG. Chronic kidney disease (partial update): early identification and
management of chronic kidney disease in adults in primary and secondary care. 2014.
-
14. Eknoyan G, Lameire N, Eckardt K, Kasiske B, Wheeler D, Levin A, Stevens PE, Bilous RW, Lamb EJ, Coresh J, Levey AS. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int. 2013 Jan 1;3(1):5-14.
-
15. Radhakrishnan J, Remuzzi G, Saran R, Williams DE, Rios-Burrows N, Powe N, Brück K, Wanner C, Stel VS, Venuthurupalli SK, Hoy WE. Taming the chronic kidney disease epidemic: a global view of surveillance efforts. Kidney international. 2014 Aug 1;86(2):246-50.
-
16. Hood SC, Moher D, Barber GG. Management of intermittent claudication with pentoxifylline: metaanalysis of randomized controlled trials. CMAJ: Canadian Medical Association Journal. 1996 Oct 15;155(8):1053.
-
17. Salhiyyah K, Forster R, Senanayake E, Abdel‐ Hadi M, Booth A, Michaels JA. Pentoxifylline for intermittent claudication. Cochrane Database of Systematic Reviews. 2015(9).
-
18. McCarty MF, O'Keefe JH, DiNicolantonio JJ. Pentoxifylline for vascular health: a brief review of the literature. Open Heart. 2016 Feb 1;3(1):e000365.
-
19. Windmeier C, Gressner AM. Pharmacological aspects of pentoxifylline with emphasis on its inhibitory actions on hepatic fibrogenesis. General Pharmacology: The Vascular System. 1997 Aug 1;29(2):181-96.
-
20. Donate-Correa J, Tagua VG, Ferri C, Martín-Núñez E, Hernández-Carballo C, Ureña-Torres P, Ruiz-Ortega M, Ortiz A, Mora-Fernández C,
Navarro-González JF. Pentoxifylline for renal
protection in diabetic kidney disease. A Model of old drugs for new horizons. Journal of clinical medicine. 2019 Mar;8(3):287.
-
21. Navarro JF, Milena FJ, Mora C, León C, García J. Renal pro-inflammatory cytokine gene expression in diabetic nephropathy: effect of angiotensinconverting enzyme inhibition and pentoxifylline administration. American journal of nephrology. 2006;26(6):562-70.
-
22. Sönmez MF, Dündar M. Ameliorative effects of pentoxifylline on NOS induced by diabetes in rat kidney. Renal failure. 2016 Apr 20;38(4):605-13.
-
23. Navarro-González JF, Sánchez-Niño MD, Donate-Correa J, Martín-Núñez E, Ferri C, Pérez-Delgado N, Górriz JL, Martínez-Castelao A, Ortiz A, Mora-Fernández C. Effects of pentoxifylline on soluble klotho concentrations and renal tubular cell expression in diabetic kidney disease. Diabetes Care. 2018 Aug 1;41(8):1817-20.
-
24. Oliaei F, Hushmand S, Khafri S, Baradaran M. Efficacy of pentoxifylline for reduction of proteinuria in type II diabetic patients. Caspian journal of internal medicine. 2011;2(4):309.
-
25. Ghorbani A, Omidvar B, Beladi-Mousavi SS, Beladi Mousavi SS, Lak E, Vaziri S. The effect of pentoxifylline on reduction of proteinuria among patients with type 2 diabetes under blockade of angiotensin system: a double blind and
randomized clinical trial. Nefrología (English Edition). 2012 Nov 1;32(6):790-6.
-
26. Navarro-González JF, Mora-Fernández C, de Fuentes MM, Chahin J, Méndez ML, Gallego E, Macía M, del Castillo N, Rivero A, Getino MA, García P. Effect of pentoxifylline on renal function and urinary albumin excretion in patients with diabetic kidney disease: the PREDIAN trial. Journal of the American Society of Nephrology. 2015 Jan 1;26(1):220-9.
-
27. Han SJ, Kim HJ, Kim DJ, Sheen SS, Chung CH, Ahn CW, Kim SH, Cho YW, Park SW, Kim SK, Kim CS. Effects of pentoxifylline on proteinuria and glucose control in patients with type 2 diabetes: a prospective randomized double-blind multicenter study. Diabetology & metabolic syndrome. 2015 Dec 1;7(1):64.
26
Discussion and feedback