POTENSI LUMBROKINASE DENGAN CARRIER N,N,N-TRIMETIL KITOSAN KLORIDA (TMC) MENGGUNAKAN LIGAND C-RGD SEBAGAI AGEN FIBRINOLITIK DAN ANTI-PLATELET TERBARUKAN
on
ARTIKEL TINJAUAN PUSTAKA

Essence of Scientific Medical Journal (2021), Volume 19, Number 1:27-33
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI LUMBROKINASE DENGAN CARRIER N,N,N-TRIMETIL KITOSAN KLORIDA (TMC) MENGGUNAKAN LIGAND C-RGD SEBAGAI AGEN FIBRINOLITIK DAN ANTI-PLATELET
TERBARUKAN
Naufal Nandita Firsty,1 Muhammad Furqan,1 Ilman Arif Aritonang,1
ABSTRAK
Pendahuluan: Trombosis vena merupakan penyakit kardiovaskular nomor tiga terbanyak di dunia. Pemberian agen fibrinolitik seperti streptokinase merupakan terapi pilihan pada penyakit tersebut. Namun, kekurangannya yaitu waktu paruhnya yang pendek, tidak spesifik terhadap fibrin, penargetan yang buruk, harganya yang mahal, dan mudah menyebabkan perdarahan. Oleh karena itu diperlukan agen fibrinolitik yang dapat mengatasi beberapa kekurangan dan efek samping agen fibrinolitik saat ini. Literature review ini bertujuan untuk menjelaskan potensi lumbrokinase dengan carrier TMC dan ligand c-RGD sebagai agen fibrinolitik dan antiplatelet terbarukan. Metode yang digunakan dalam penyusunan literature review ini adalah studi pustaka dengan menggunakan jurnal 10 tahun terakhir yang diperoleh dari mesin pencarian seperti Sciencedirect, PubMed, Google Scholar dan ClinicalKey.
Pembahasan: Lumbrokinase merupakan enzim hasil ekstraksi dari saluran cerna cacing tanah yang terdiri dari beberapa isoenzim protease serin. Lumbrokinase mempunyai fungsi utama sebagai agen fibrinolitik dengan 2 mekanisme kerja yaitu berperan menghidrolisis fibrin dan fibrinogen serta mengaktifkan plasminogen menjadi plasmin. Selain itu, lumbrokinase juga memiliki efek antiplatelet seperti aspirin. Penggunaan TMC sebagai carrier dapat meningkatkan bioavailabilitas lumbrokinase. Sementara itu, penambahan ligand c-RGD dapat meningkatkan spesifitas terhadap reseptor GPIIb/IIIa yang mencegah fibrinogen berikatan dengan reseptor tersebut sehingga menghambat pembentukan trombus.
Simpulan: Dari berbagai penelitian secara in vitro dan in vivo disimpulkan bahwa lumbrokinase dengan carrier TMC dan ligand c-RGD dapat mempercepat trombolisis, dan mengurangi risiko perdarahan sehingga berpotensi sebagai agen fibrinolitik dan antiplatelet terbarukan. Namun, diperlukan penelitian lebih lanjut mengenai dosis terapi, efek samping, dan studi toksisitas.
Kata Kunci: c-RGD, Fibrinolitik, Kitosan, Lumbrokinase, TMC
ABSTRACT
Introduction: Venous thrombosis is the third most cardiovascular disease in the world. Administration of fibrinolytic agents such as streptokinase is the chosen treatment of the disease. However, the disadvantages are short halftime, unspecific to fibrin, poor targeting, expensive price, and tend to cause bleeding. Therefore another fibrinolytic agent is needed to cope with some of the deficiencies and side effects of current fibrinolytic agents. This literature review aims to explain the potential of lumbrokinase with TMC carrier and c-RGDligand as a renewable fibrinolytic and antiplatelet agent. The method used in this literature review is a literature study using the last 10 years of journal gained from some search engines such as ScienceDirect, PubMed, Google Scholar, and ClinicalKey.
Discussion: Lumbrokinase is an enzyme from the extraction of the earthworm’s digestive tract which consists of several serine protease isoenzymes. As a fibrinolytic agent, lumbrokinase can hydrolyze both fibrin or fibrinogen and also activate plasminogen into plasmin. Besides, lumbrokinase is known as has an antiplatelet effect as aspirin has. The use of TMC as the carrier can increase the bioavailability of lumbrokinase. Meanwhile, the addition of c-RGD ligand can increase the specificity preventing fibrinogen to bind the GPIIb/IIIa receptor thereby inhibiting thrombus formation.
Conclusion: From various in vitro and in vivo studies, it was concluded lumbrokinase with carrier TMC and c-RGD ligand can accelerate thrombolysis, and reduce the risk of bleeding so that it’s potentially a renewable fibrinolytic and antiplatelet agent. However, further research is needed regarding therapeutic doses, side effects, and toxicity studies.
Keywords: Chitosan, c-RGD, Fibrinolytic, Lumbrokinase, TMC
1 Pendidikan Dokter, Fakultas Kedokteran, Universitas Sumatera Utara, Medan
PENDAHULUAN
Penyakit kardiovaskular merupakan penyebab utama kematian di seluruh dunia.[1] Menurut data World Health Organization (WHO) pada tahun 2016, diperkirakan 17,9 juta orang meninggal akibat penyakit ini, yang mewakili 31% dari seluruh kematian secara global.[2] Penyakit kardiovaskular seperti Infark Miokard Akut (MI), stroke iskemik, dan tromboemboli vena (Venous Thromboembolism / VTE) terjadi akibat tersumbatnya aliran darah dalam sistem sirkulasi dan pembentukan bekuan darah (trombus).[3]
Trombosis adalah pembentukan massa abnormal berupa bekuan darah yang umumnya terjadi pada vena dalam dan dapat menutupi lumen pembuluh darah secara penuh ataupun sebagian.
Trombosis terdiri dari zat-zat penyusun darah khususnya sel darah merah dan fibrin yang diikuti oleh reaksi inflamasi dinding pembuluh darah serta jaringan perivaskular sekitarnya.[4,5]
Trombosis terdiri atas trombosis arteri dan vena. Trombosis pada arteri dapat menyebabkan iskemia dan stroke iskemik. Sedangkan trombosis pada vena dapat menyebabkan VTE yang terdiri atas trombosis vena dalam (Deep Vein Thrombosis / DVT) dan tromboemboli pada pembuluh darah di paru (Pulmonary Thromboembolism / PE).[6-8]
Trombosis vena merupakan penyakit Cerebral Venous Sinus Thrombosis (CVST) nomor tiga di dunia setelah penyakit jantung koroner atau Coronary Heart Disease (CHD) dan stroke. Insidensi trombosis vena berdasarkan usia secara keseluruhan lebih
sering terjadi pada pria dengan angka 130/10.000 orang dibandingkan wanita dengan angka 110/10.000 orang. Namun pada usia produktif (16-44 tahun) secara reproduksi, insidensi trombosis vena lebih tinggi pada wanita.[5] Angka mortalitas akibat VTE pada beberapa negara cukup bervariasi yaitu di Amerika Serikat terdapat 60.000 – 100.000 orang sedangkan di Benua Eropa terdapat 544.000 orang setiap tahunnya.[9,10] Sementara itu, insidensi trombosis di Indonesia belum dapat diketahui secara pasti dikarenakan belum adanya data yang mencatat insidensi berskala nasional. Menurut data penelitian yang dilakukan di Rumah Sakit Cipto Mangunkusumo tahun 2008, prevalensi DVT di Indonesia pada pasien pasca operasi ginekologi mencapai 33.3%.[11]
Pendekatan yang digunakan pada terapi trombosis saat ini bertujuan untuk membuat revaskularisasi cepat dari arteri yang tersumbat dengan intervensi angioplastik dan bedah. Selanjutnya pemberian agen fibrinolitik seperti streptokinase, urokinase dan Tissue Plasminogen Activator (t-PA) yang memfasilitasi pemulihan cepat patensi lumen pembuluh darah, secara rutin digunakan bersama dengan prosedur invasif. Saat ini agen fibrinolitik yang digunakan bekerja dengan mengubah atau mengaktifkan plasminogen menjadi plasmin dan dengan demikian memicu mekanisme internal tubuh untuk melarutkan bekuan darah dan mengembalikan suplai aliran darah arteri koroner atau pembuluh darah lain yang terlibat.[12]
Namun, penggunaan agen fibrinolitik yang saat ini digunakan dalam klinis memiliki beberapa kekurangan yaitu waktu paruh yang pendek, tidak spesifik terhadap fibrin, spesifisitas yang buruk, harga yang mahal, dan mudah menyebabkan perdarahan.[13]
Pada tahun 1991, Mihara dkk. berhasil mengekstraksi enzim dari saluran cerna cacing tanah Lumbricus rubellus. Enzim ini terdiri dari enam isoenzim protease serin yang secara kolektif diberi nama lumbrokinase. Lumbrokinase memiliki aktivitas fibrinolitik yang kuat karena dapat secara langsung melarutkan fibrin atau mengaktifkan profibrinolysin untuk melarutkan fibrin secara tidak langsung.[14] Selain itu, beberapa penelitian telah menunjukkan bahwa lumbrokinase mengandung beberapa komponen aktif yang dapat mengubah plasminogen menjadi plasmin dengan menginduksi aktivitas dari t-PA endogen untuk melarutkan bekuan fibrin. Dibandingkan dengan urokinase dan streptokinase, lumbrokinase dapat dikatakan sangat spesifik terhadap fibrin sebagai substrat dan tidak menyebabkan perdarahan yang berlebihan. Selain itu, lumbrokinase relatif stabil pada rentang pH yang luas, memiliki ketahanan terhadap denaturasi termal, dan dapat diberikan secara oral.[15]
Namun, lumbrokinase oral diketahui memiliki waktu paruh yang sangat singkat maka perlu diberikan per-oral 2-3 kali sehari. Penyakit trombosis adalah penyakit akut, pemberian obat secara oral tidak dapat dijadikan pilihan pertama karena bioavailabilitasnya yang rendah dan penyerapan yang lambat dalam tubuh manusia.[16]
Kitosan atau chitosan (CS) adalah suatu kelompok polisakarida linear yang terdiri dari monomer glukosamin dan N-asetilglukosamin yang dihubungkan oleh ikatan glikosidik β (1→ 4). Kitosan diperoleh dari deasetilasi parsial polisakarida alami, kitin, yang pada dasarnya adalah poli-N-
asetilglukosamin. Kitosan bersifat biokompatibel, biodegradabel dan tidak toksis.[17] Kitosan memiliki keistimewaan yang bisa diharapkan sebagai zat pembantu dalam penghantar obat. Berbeda dengan polisakarida biodegradabel lainnya, hanya kitosan yang memiliki sifat kationik dan banyak dijumpai di alam.[18]
Nanopartikel kitosan dapat digunakan sebagai penghantar obat, tidak hanya dapat diberikan melalui rute biasa (oral dan parenteral) namun dapat diberikan melalui mukosa (nasal, paru, vagina) dan okular.[17] Akan tetapi, kitosan hanya dapat larut dalam larutan asam sehingga bermasalah dengan pengangkutan protein obat.[19] N,N,N-Trimetil Kitosan Klorida (TMC) adalah turunan kuartener kitosan yang memiliki kelarutan yang baik dalam rentang pH yang luas. Biodegrabilitas, biokompabititas, muko-adhesivitas dan non-toksititas TMC menjadikannya sebagai biopolimer pilihan untuk berbagai jenis aplikasi farmasi dan biomedis, salah satunya sebagai carrierlumbrokinase.[20]
Aktivasi dari reseptor glikoprotein IIb/IIIa (GPIIb/IIIa) pada membran platelet adalah jalur umum akhir dalam proses agregasi platelet yang berperan penting dalam proses pembentukan trombus. Urutan/sekuen peptida c-RGD (Arg-Gly-Asp-Phe-Lys) seperti ligand spesifik untuk aktivasi reseptor GPIIb/IIIa, memiliki kecenderungan untuk berikatan pada platelet aktif pada thrombus dan berkompetisi dengan fibrinogen untuk menghambat agregasi platelet. c-RGD dapat digunakan sebagai ligand dan hasil penelitian menunjukkan bahwa siklik-RGD berikatan pada platelet aktif lebih banyak dibanding dengan linear-RGD.[19]
Tulisan ini akan menjabarkan mengenai kitosan yang sudah dimodifikasi menjadi TMC dan ditambahkan ligand c-RGD sebagai komponen yang meningkatkan potensi dari lumbrokinase bekerja pada reseptor GPIIb/IIIa. Oleh karena itu, agen fibrinolitik ini dapat bekerja lebih spesifik.
PEMBAHASAN
Struktur Kimia Lumbrokinase
Lumbrokinase merupakan enzim dengan struktur berupa polipeptida yang berasal dari berbagai spesies cacing tanah (earthworm) seperti Lumbricus rubellus dan Eisenia Andrei. Komponen lumbrokinase yang berasal dari Lumbricus rubellus terdiri atas enam protease (LrPI-0, LrPI- 1, LrP-I-2, LrP-II, LrP-III-1, dan LrP-III-2). Massa molekular isozim tersebut berturut-turut adalah 23,013; 24,196; 24,220; 24,664; 29,667; dan 29,662 kDa. Lumbrokinase adalah rantai peptida tunggal yang sebagian besar terdiri dari residu asam aspartat dan sedikit lisin. Isozim tersebut memiliki kisaran ketahanan pH 1.0-11.0 dan strukturnya dapat tetap stabil sampai suhu 60oC. Struktur kimia dari lumbrokinase dapat dikatakan cukup stabil dikarenakan adanya sisa atau residu dari rantai peptida yaitu asam aspartate yang memiliki asam aminolysinedan asparagine yang sedikit. Urutan dari sebuah isoform lumbrokinase yang bernama Earthworm Fibrinolytic Protease II (EF P-II(EFEa)) sangat mirip dengan struktur protease serin yang diketahui dari spesies cacing tanah lainnya.[14,21]
Farmakokinetik Lumbrokinase
Sebanyak 15% LrP-III-1 mampu diabsorpsi melalui epitel usus. Sekitar 10% dari lumbrokinase
ditranspor melalui peritoneum setelah dilakukannya injeksi intraperitoneal pada tikus. Konsentrasi maksimum pada darah dapat dideteksi dalam 60 menit setelah injeksi. Hal ini juga telah terbukti pada penelitian oleh Yan XM dkk. pada lumbrokinase yang diisolasi dari spesies Eisenia andrei. Pada penelitian diperlihatkan bahwa sebagian besar lumbrokinase dengan berat molekul 33,6 dan 54,7 kDa dapat diabsorpsi oleh epitel intestinal tikus. Vilhardt dan Lundin menginvestigasi enzim fibrinolitik III-1 (EFE-III-1) yang diisolasi dari Lumbricus rubellus dan diduga mampu untuk ditranspor ke darah melalui epitel saluran pencernaan. Mereka juga menduga adanya kenaikan antibodi terhadap EFE-III-1 pada sirkulasi.Tes imunologi yang dilakukan mendukung pernyataan 10-15% dari EFE-III-1 yang utuh mampu diabsorbsi oleh epitel pencernaan. Pembuktian lebih lanjut mengenai absorpsi dari lumbrokinase menggunakan teknik immunohistokimia dengan membuktikan adanya penanda (marker) immunohistokimia tersebut pada sel epitel pencernaan. Eksperimen tersebut dilakukan pada hewan coba, hasil yang didapatkan dari tes immunoreaktif tersebut adalah EFE-III-1 yang utuh ditemukan pada serum dan plasma setelah injeksi intraperitoneal dilakukan pada hewan coba tersebut. Studi lainnya juga mengatakan 10% dari enzim utuh tersebut dapat ditransport melalui epitel saluran pencernaan.[14,21]
Farmakodinamik Lumbrokinase
Lumbrokinase mempunyai fungsi utama sebagai agen fibrinolitik. Mekanisme fibrinolitik terjadi ketika plasminogen diubah atau teraktivasi menjadi plasmin (yang berfungsi untuk melisis bekuan darah (clot)). Aktivasi dari plasminogen tersebut dapat berasal dari aktivator endogen seperti urokinase dan t-PA (Tissue-Plasminogen Activator) serta juga dapat diaktifkan oleh aktivator eksogen seperti streptokinase dan lumbrokinase. Plasmin memiliki suatu inhibitor yaitu anti-plasmin yang berfungsi untuk menekan aktivitas fibrinolitik dengan cara mengikat plasmin secara irreversible sehingga membentuk komponen antiplasmin-plasmin yang stabil dan inaktif. Lumbrokinase diduga memiliki kemampuan untuk menghidrolisis fibrin dan fibrinogen menjadi fibrinogen degradation product. Lumbrokinase juga memiliki efek antiplatelet dengan mekanisme kerja meningkatkan kadar cAMP dan meningkatkan pelepasan Ca dari dalam sel. Selain itu, lumbrokinase diduga memiliki efek yang sama dengan aspirin sebagaianti-platelet.[14,22]
Efek Samping Lumbrokinase
Pada kisaran dosis 400-500 mg yang diberikan tiga kali secara oral belum ditemukan adanya efek samping sebagai akibat dari penggunaan lumbrokinase. Namun, dijelaskan bahwa lumbrokinase tidak disarankan untuk pasien yang diketahui memiliki riwayat alergi khusus terhadap cacing tanah dan komponen-komponennya. Lumbrokinase diketahui memiliki efek antiplatelet, penggunaannya dalam dosis besar diperkirakan memiliki efek samping yang berhubungan dengan obat antiplatelet lain seperti perdarahan. Penggunaan lumbrokinase yang dikombinasi dengan sediaan obat lain juga belum diketahui interaksi yang akan terjadi. Oleh karena itu, diharapkan agar dilakukan penelitian mengenai lumbrokinase di masa depan agar efek samping dan interaksi dari lumbrokinase dengan
sediaan obat lain dapat diketahui. Penelitian lain juga mengonfirmasi bahwa tidak ditemukan efek samping oleh lumbrokinase pada sistem saraf pusat, sistem pernafasan, sistem kardiovaskular, atau hati dan ginjal.[14,22]
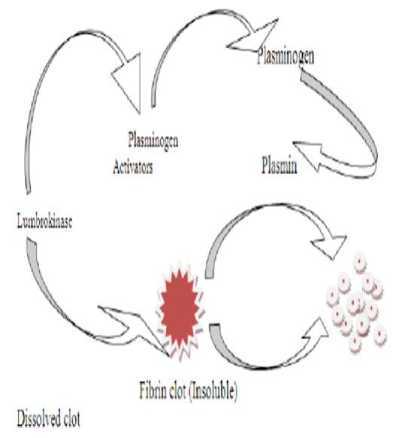
Gambar 1. Mekanisme kerja lumbrokinase sebagai agen fibrinolitik[22
Proses Ekstraksi Lumbrokinase dari Cacing Tanah Lumbricus rubellus
Terdapat beberapa tahapan dalam proses ekstraksi lumbrokinase menggunakan metode konvensional yang dilakukan oleh Mihara dkk.yaitu: a. Cacing tanah Lumbricus rubellus dikumpulkan sebanyak 1 Kg (Sekitar 20.000 ekor cacing tanah)
-
b. 1 Kg cacing tanah tersebut dibersihkan menggunakan air mengalir untuk membersihkan lumpur yang ada pada permukaan cacing-cacing tersebut.
-
c. Cacing tanah tersebut akan ditinggalkan semalaman dengan kondisi di dalam air dan dibawah cahaya terang untuk memisahkan komponen saluran pencernaan cacing dengan isinya.
-
d. Setelah isi dari saluran pencernaan cacing dibuang, cacing tersebut dicampur hingga homogen menggunakan alat ultrahomomixer dan diliofikasi (dikeringkan dalam suasana suhu dingin).
-
e. Produk akhir yang didapatkan dari ekstraksi lumbrokinase secara konvensional adalah bubuk cacing murni yang siap digunakan untuk
kepentingan penelitian atau klinis.[22]
Pada beberapa bagian dari cacing tanah Lumbricus rubellus, penelitian pada bagian-bagian tersebut menunjukkan adanya aktivitas fibrinolitik. Diketahui bahwa regio pharyngeal, crop, gizzard, clitellum, dan usus atau saluran pencernaan mensekresikan enzim yang berperan dalam melarutkan fibrin dalam jumlah yang lebih besar dibandingkan bagian lainnya sehingga diketahui memiliki aktivitas fibrinolitik yang lebih besar pula. Cara kerja dari penelitian tersebut adalah potongan-potongan dari cacing tanah diletakkan pada cawan petri yang mengandung fibrin artifisial dan diinkubasi pada suhu 37°C semalaman. Human tissue
plasminogen (t-PA) (5 unit) digunakan sebagai kontrol positif. Sementara itu, air deionisasi dan Phosphate Buffered Saline (PBS) digunakan sebagai kontrol negative. Bigger lysis halos (lingkaran lisis yang lebih besar) (3-7) mengindikasikan lebih tingginya aktivitas fibrinolitik pada potongan tersebut.[22]
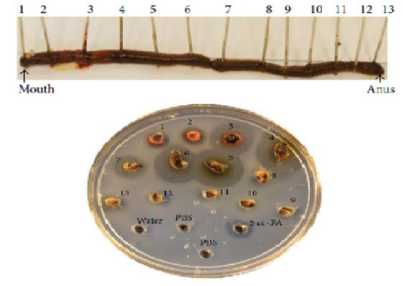
Gambar 2. Gambaran mengenai potensi aktivitas fibrinolitik tiap bagian tubuh cacing tanah[22]
Potensi Lumbrokinase sebagai Agen Fibrinolitik
Lumbrokinase memiliki efek fibrinolitik ganda yaitu berperan sebagai aktivator plasminogen yang berfungsi untuk mengaktifkan plasminogen serta berperan sebagai fibrinolitik dengan efek langsung terhadap fibrin dan menghancurkan trombus. Efek utama dari lumbrokinase adalah memproteolisis fibrinogen dan fibrin serta diketahui cukup sulit untuk menhidrolisis protein plasma lain seperti plasminogen dan albumin.[14]
Lumbrokinase berpotensi untuk digunakan sebagai fibrinolitik dan antiplatelet pada berbagai penyakit akibat thrombosis. Hal ini telah terbukti pada beberapa studi pada hewan coba. Kim dkk. melakukan penelitian awal menggunakan bubuk cacing tanah Lumbricus rubellus yang diberikan secara oral pada model hewan coba tikus dengan arteriovenous shunt. Bubuk cacing tanah diberikan selama 8 hari dengan dosis 0,5 gram/kgBB/hari dan 1 gram/kgBB/hari. Pada penelitian tersebut disimpulkan bahwa bubuk cacing tanah bermanfaat untuk mencegah dan/atau mengatasi keadaan trombosis. Kesimpulan yang sama juga diperoleh pada penelitian yang dilakukan oleh Lee dkk.yang membandingkan efek antitrombotik dan fibrinolitik lumbrokinase SPP-501 (diekstraksi dari cacing tanah Eisenia andrei) dengan urokinase dan t-PA pada model thrombosis vena tikus. SPP-501 diberikan satu kali per hari selama 14 hari dengan dosis 5, 15, dan 45 mg/kg/hari secara per oral. Pada akhir penelitian diperoleh hasil berupa penurunan berat trombus, pemendekan euglobulin lysis time (ELT), dan penghambatan agregasi trombosit pada hewan coba yang diberi SPP-501.[14]
Simpulan yang diperoleh dari beberapa uji klinik sejalan dengan penelitian pada hewan coba. Hasil randomized controlled-trial yang dilakukan oleh Jin dkk. pada 51 pasien infark serebri yang diberi lumbrokinase 3 x 400 mg selama 28 hari, diperoleh berupa pemanjangan kaolin partial thromboplastintime (KPTT), peningkatan t-PA dan D-Dimer, serta penurunan kadar fibrinogen. Berdasarkan hasil tersebut, Jin dkk. menyimpulkan bahwa mekanisme lumbrokinase sebagai antiplatelet
dan fibrinolitik adalah melalui inhibisi jalur intrinsik koagulasi dan aktivasi fibrinolisis melalui peningkatan aktivitast-PA. Efek fibrinolitik juga disimpulkan oleh Rey yang melakukan uji klinis pada 28 subjek dengan ulkus kaki diabetik. Pada kelompok yang diberi lumbrokinase 3 x 500 mg per hari (n = 14) selama tujuh hari didapatkan peningkatan rata-rata D-dimer jika dibandingkan dengan kelompok plasebo.[14]
Lumbrokinase yang diberikan pada beberapa penelitian diatas masih dilakukan secara oral sehingga tidak dapat menggantikan agen fibrinolitik intravena seperti streptokinase dan t-PA yang digunakan untuk mengatasi keadaan trombosis akut. Untuk mengatasi hal tersebut, Xu dkk. melakukan penelitian menggunakan lumbrokinase rekombinan (r-LK) dan membandingkan efek anti trombotiknya dengan t-PA yang diberikan baik secara oral maupun intravena pada model trombosis tikus dengan arteryvein by pass. Lumbrokinase diberikan dengan dosis 2, 4, dan 8 kIU/kg dua kali sehari selama tiga hari. Pada akhir penelitian diperoleh hasil berupa penurunan berat trombus secara signifikan pada hewan coba yang diberi r-LK.[23]
Mekanisme Ekstraksi Kitosan dari Kitin
Kitosan adalah polisakarida linear yang terdiri dari monomer glukosamin dan N-asetilglukosamin yang dihubungkan oleh ikatan glikosidik β (1→ 4). Kitosan merupakan hasil dari proses deasetilasi kitin.[24] Kitosan larut dalam larutan encer dari banyak asam organik dan asam anorganik (pH<6) karena protonasi gugus amino-nya. Karakter polikationnya memungkinkannya berinteraksi dengan polianion membentuk kompleks polielektrolit.[25]
Kitin atau poli (β-(1→4)-N-asetil-D-glukosamin) adalah polisakarida alami yang disintesis oleh banyak makhluk hidup dan polimer alami terbanyak setelah selulosa. Kitin terdapat pada mikrofibril kristal yang merupakan komponen pembentuk eksoskeleton pada arthropoda atau pada dinding sel jamur dan ragi. Kitin memiliki aplikasi yang luas ketika dalam bentuk kitosan.[26]
Sumber bahan baku utama untuk produksi kitin adalah kutikula dari berbagai krustasea, terutama kepiting dan udang. Isolasi kitin dari kerang memerlukan penghapusan dua konstituen utama dari kulitnya, protein melalui proses deproteinisasi dan anorganik kalsium karbonat melalui proses demineralisasi. Dalam beberapa penelitian, langkah tambahan dekolorisasi diterapkan untuk menghilangkan sisa pigmen yang ada.[26]
Pengolahan
Isolasi kitin dimulai dengan pemilihan kerang. Idealnya, kerang dengan ukuran dan jenis yang sama dipilih. Cangkang yang dipilih kemudian dibersihkan, dikeringkan dan digiling menjadi potongan cangkang kecil.[26]
Demineralisasi
Demineralisasi adalah proses pelepasan mineral, terutama kalsium karbonat.[3] Demineralisasi dilakukan dengan menambahkan 1L HCl 1M ke 100 cangkang udang. Reaksi dilakukan pada suhu kamar selama 30 menit, 1 jam atau 2 jam. Kemudian cangkang-demineralisasi, difiltrasi dan dicuci menggunakan air suling hingga pH netral. Kemudian diputihkan menggunakan etanol selama 10 menit dan dikeringkan dalam oven pada suhu 70oC.[27]
Deproteinisasi
Deproteinisasi merupakan tahapan yang sulit karena gangguan ikatan kitin dan protein. Penghilangan protein secara komplit terutama sangat penting dalam aplikasi biomedikal, karena komponen protein merupakan penyebab alergi pada Krustasea.[3] Deproteinisasi dilakukan dengan menambahkan NaOH 1M ke cangkang-demineralisasi yang dikeringkan pada rasio padat/cair 1:10 (g/mL). Reaksi dilakukan pada suhu 80oC selama 3 jam. Kemudian difiltrasi dan dicuci dengan air suling hingga mencapai pH netral. Kemudian, direndam dalam etanol selama 10 menit untuk dilakukan proses pemutihan lebih lanjut, dan kitin yang dihasilkan dikeringkan dalam oven pada suhu 70oC.[27]
Deasetilisasi
Deasetilasi kitin dilakukan dengan mereaksikan kitin dengan NaOH 12,5 M pada rasio padat/cair 1:15 (g/mL). Campuran reaksi didinginkan dan disimpan pada suhu -83oC dalam ultra-freezer selama 24 jam. Kemudian suhu campuran dinaikkan menjadi 1150C, dan reaksi berlanjut dengan agitasi pada 250 rpm selama 4 jam atau 6 jam. Kitosan yang dihasilkan difiltrasi, dicuci dengan air suling sampai pH netral dan dikeringkan dalam oven pada suhu 700C.[27]
Mekanisme Modifikasi Kitosan Menjadi TMC dan c-RGD-TMC
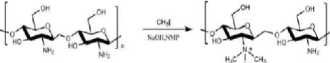
Trimetil Kitosan Klorida (TMC) adalah turunan kitosan yang selalu bermuatan positif, Bersifat kationik kuat dan memiliki rentang kelarutan pada pH yang lebih luas dibandingkan kitosan yang tak termodifikasi karena memiliki gugus yang terprotonisasi (-N+(CH3)3).[28] Nanopartikel TMC menunjukkan penyerapan yang lebih baik dibandingkan dengan Nanopartikel kitosan melalui peningkatan kontak dengan epitel usus dan mukoadhesi dengan kemampuan untuk meningkatkan penyerapan transeluler dan paraseluler.[19]
Campuran Kitosan (2g) dan N-metil-2-pirolidinon (80 mL) diaduk pada suhu kamar semalaman. Kemudian, natrium iodida (4,8g) dan 15% larutan NaOH (11 mL) ditambahkan dan diaduk pada suhu 60 oC selama 20 menit, selanjutnya ditambahkan iodometana (12 mL). Setelah 2 jam reaksi, 15% larutan NaOH (11 mL) dan iodometana (6 mL) ditambahkan ke campuran reaksi. Reaksi ini ditunggu selama dua jam. Kemudian, campuran reaksi didinginkan dan dituangkan ke dalam etanol (600 mL). Endapan disaring dan dilarutkan dalam larutan NaCl 10% (30 mL), yang kemudian dituangkan ke dalam etanol (150 mL). Endapan disaring dan dilarutkan dalam air ultra murni (16 mL). Kemudian didialisis dengan air deionisasi selama dua hari dan akhirnya diliofilisasi.[29]
c-RGD-TMC disintesis dengan beberapa modifikasi. Spesifiknya, TMC (50mg) dilarutkan dalam larutan buffer fosfat 0,1 M (10 mL) dan diaduk hingga rata. Kemudian, ditambahkan sejumlah L-sistein 1-etil-3-(3dimetilaminopropil)-karbodiimida hidroksi-klorida (EDC) dan N-hidroksil-suksinamida (NHS) dengan perbandingan rasio molar 3:1 kedalam larutan sebelum ditambahkan c-RGD (20mg). Setelah pengadukan dan inkubasi pada suhu kamar dilakukan dalam kondisi gelap selama 48 jam, campuran didialisis dengan air deionisasi selama 3
hari. Setelah pengeringan beku (freeze-drying), c-RGD-TMC disimpan pada suhu -20°C sampai digunakan. Kemudian, c-RGD-TMC diverifikasi dengan mendeteksi karakteristik puncak trimetil amina di Spektroskopi 1H NMR.[19]
CS TMC
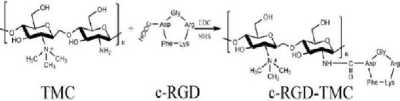
Gambar 3. Skema tahapan sintesis c-RGD-TMC[19]
Mekanisme Konstruksi Lumbrokinase dengan Carrier TMC dan Ligand c-RGD
Dua jenis nanopartikel yaitu N-N-N-Trimetil Kitosan Klorida yang membawa Lumbrokinase (LK-NPs) dan N-N-N-Trimetil Kitosan Klorida dengan ligand c-RGD yang membawa lumbrokinase (c-RGD-LK-NPs) dibuat melalui gelasi ionik dengan menggunakan TMC dan Tripolifosfat (TPP) dalam air netral. Beberapa formulasi dilakukan dalam pembuatan c-RGD-LK-NPs. Pertama, c-RGD-TMC (3,0 mL, 0.5 – 2.0 mg/mL) dicampur dengan LK (2,0 mL, 1.0 – 4.0 mg/mL), dan kemudian larutan TPP (2 mL, 0.2 – 1.0 mg/mL) ditambahkan per tetes. Larutan diaduk dengan kecepatan 200 rpm pada suhu kamar selama 20 menit kemudian diinkubasi selama 20 menit untuk membentuk c-RGD-LK-NPs. LK-NPs dibuat dengan prosedur yang sama, kecuali konsentrasi TPP dinaikkan sepantasnya.[19]
Potensi Lumbrokinase dengan CarrierN,N,N-Trimetil Kitosan KloridadanLigand c-RGD Sebagai Agen Fibrinolitik dan Antiplatelet
N,N,N- Trimetil Kitosan Klorida (TMC) dapat digunakan sebagai carrier lumbrokinase dalam mencapai targetnya. TMC adalah turunan kuarterner kitosan yang memiliki kelarutan yang baik dalam rentang pH yang luas dan dapat meningkatkan densitas muatan. Lumbrokinase bermuatan negatif dalam larutan sehingga dapat dengan mudah dilapisi ke TMC yang bermuatan positif. Selain itu, TMC berperan terhadap potensial zeta positif pada permukaan nanopartikel, yang membantu dalam penetrasi bekuan darah melalui interaksi elektrostatik dengan fibrin yang bermuatan negatif.[30] Sementara itu, urutan peptida c-RGD (Arg-Gly-Asp-Phe-Lys) seperti ligand spesifik untuk aktivasi reseptor GPIIb/IIIa, memiliki kecenderungan untuk berikatan dengan platelet aktif pada thrombus, dan berkompetisi dengan fibrinogen untuk menghambat agregasi platelet.[19] Penggunaan ligand c-RGD dapat mengurangi risiko perdarahan pada penggunaan lumbrokinase. Hal ini dapat dilihat pada penelitian Pan dkk. yang menggunakan model perdarahan ekor tikus. Pada akhir penelitian, diperoleh hasil berupa penurunan waktu perdarahan yang signifikan pada kelompok lumbrokinase yang menggunakan ligand. Sehingga Pan dkk. menyimpulkan bahwa penggunaan ligand berperan penting dalam mengurangi waktu perdarahan dengan membawa lumbrokinase yang ditargetkan ke lokasi lesi.[31]
Untuk mengetahui potensi lumbrokinase dengan carrier TMC dan ligand c-RGD sebagai agen fibrinolitik, Liao dkk. melakukan penelitian untuk melihat lisis bekuan darah secara in vitro pada beberapa kelompok. Pada penelitian tersebut campuran larutan (buffer fosfat 0,8 ml dan larutan c-RGD-TMC, LK bebas, LK-NPs, dan c-RGD-LK-NPs 0.2 mL) ditambahkan ke dalam 2 mL vial yang mengandung bekuan darah kemudian menentukan efisiensi trombolisis dengan mengukur absorbansi supernatan pada panjang gelombang serapan maksimum 405 nm (OD405) setelah 0 menit, 30 menit, dan 60 menit reaksi. Pada akhir penelitian diperoleh efisiensi trombolisis dari kelompok lumbrokinase dengan carrier TMC dan ligand c-RGD (c-RGD-LK-NP) secara signifikan lebih tinggi dari kelompok lainnya. Liao dkk.menyimpulkan bahwa c-RGD dapat mengarahkan nanopartikel ke reseptor GPIIb / IIIa yang aktif, menargetkan pada trombus dengan berikatan pada trombosit yang aktif dan akhirnya memberikan efek trombolisis yang lebih baik.[19]
Lebih lanjut pada studi in vivo menggunakan model trombosis arteri karotid tikus.Liao dkk. memberikan dosis terapi 90 U/Kg pada empat kelompok yaitu c-RGD-TMC, LK bebas, LK-NPs, dan c-RGD-LK-NPs. Pada akhir penelitian ditemukan bahwa trombus lebih banyak larut pada kelompok lumbrokinase dengan carrier TMC dan ligand c-RGD (c-RGD-LK-NPs) dibandingkan dengan kelompok lainnya. Liao dkk. menyatakan bahwa c-RGD dapat menargetkan lumbrokinase pada trombus dan berikatan pada trombosit yang aktif, sehingga memberikan efek terapi yang lebih baik. Selain itu, kelompok c-RGD-LK-NP memiliki residu trombosis terkecil dan intensitas fluoresensi yang tinggi dibandingkan dengan kelompok lainnya. Berdasarkan hasil penelitian in vitro dan in vivo, Liao dkk. menyimpulkan bahwa lumbrokinase dengan carrier TMC dan ligand c-RGD dapat mempercepat trombolisis, dan mengurangi risiko perdarahan.[19]
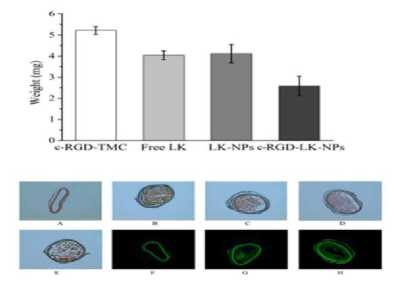
Gambar 4. Berat trombus pada beberapa
kelompok dan residu trombosis pada potongan arteri karotis[19]
SIMPULAN
Lumbrokinase memiliki efek fibrinolitik ganda yaitu berperan sebagai aktivator plasminogen yang berfungsi untuk mengaktifkan plasminogen serta berperan sebagai fibrinolitik dengan efek langsung terhadap fibrin dan menghancurkan trombus. Penggunaan TMC sebagai carrier dapat meningkatkan bioavailabilitas lumbrokinase. Sementara itu, penambahan ligand c-RGD dapat meningkatkan spesifitas terhadap reseptor GPIIb/IIIayang mencegah fibrinogen berikatan
dengan reseptor tersebut sehingga menghambat pembentukan trombus. Oleh karena itu, lumbrokinase dengan carrier TMC dan ligand c-RGD berpotensi sebagai agen fibrinolitik dan antiplatelet terbarukan.
SARAN
Perlu dilakukan penelitian lebih lanjut mengenai dosis terapi, efek samping, dan studi toksisitas pada topik terkait dikarenakan belum ditemukannya informasi tersebut pada studi literatur ini.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada kedua orang tua penulis dan teman-teman sesama anggota unit kegiatan mahasiswa SCORE PEMA FK USU yang telah memberikan dukungan selama penyusunan manuskrip literature review ini.
DAFTAR PUSTAKA
-
1. Shi A, Tao Z, Wei P, Zhao J. Epidemiological aspects of heart diseases (Review). Exp Ther Med. 2016;12(3):1645–50.
-
2. World Health Organization. 2016.
Cardiovascular diseases (CVDs)[Internet].
Available from: https://www.who.int/news-
room/fact sheets/detail/cardiovascular-
diseases-(cvds)
-
3. Siddiqui T, Dikshit D. Platelets and atherothrombosis: causes, targets and
treatments for thrombosis. Current medicinal chemistry. 2013;20(22):2779
-
4. Kesieme, Kesieme. Deep vein thrombosis: a
clinical review. J Blood Med [Internet]. 2011;59.
-
5. Andriani R, Wahid I. Defisiensi Protein S pada
Trombosis Vena Dalam. J Kesehatan Andalas. 2018;7(Supplement 4):100–3.
-
6. Najihah.Penggunaan Compression Stocking Terhadap Pencegahan Deep Venous(DVT): Literatur Review. Journal of Islamic nursing. 2017;1(1): 0–4.
-
7. Ali MR, Salim Hossain M, Islam MA, Saiful Islam Arman M, Sarwar Raju G, Dasgupta P, et al. Aspect of thrombolytic therapy: A review. Sci World J. 2014;2014(1).
-
8. Darotin R, Nurdiana, Nasution TH. Analisis Faktor Prediktor Mortalitas Stroke Hemoragik di Rumah Sakit Daerah dr.Soebandi Jember. Nurseline J. 2017;2(1):1–10.
-
9. Center for Disease Control and Prevention.
2019.Data and Statistics on Venous
Thromboembolism [Internet]. Available from : https://www.cdc.gov/ncbddd/dvt/data.html
-
10. European Thrombosis & Haemostasis Alliance.
European Thrombosis & Haemostasis Alliance Consensus Statement. 2018;1-2.
-
11. Tambunan KL, Hutagalung EU, Sukrisman L, Saleh I, Gunawan SB, Sofyanuddin S, et al.
Venous thromboembolism in 13 Indonesian patients undergoing major orthopedic surgery. Med J Indones. 2009;18(4):249.
-
12. Absar S, Nahar K, Kwon YM, et al. Thrombus-targeted nanocarrier attenuates bleeding complications associated with conventional thrombolytic therapy.Pharmaceutical research. 2013;30(6):1663-1676.
-
13. Kim J-Y, Kim J-K, Park J-S, et al. The use of PEGylated liposomes to prolong circulation
lifetimes of tissue plasminogen activator. Biomaterials. 2009;30(29):5751-5756.
-
14. Gayatri A, Purwantyastuti. Penggunaan Lumbrokinase sebagai Fibrinolitik dan Antitrombotik Oral. 2013;40(3):167–70.
-
15. Jin M, Jin G, Huang WEI, Gao Z. PEGylation of Lumbrokinase improves pharmacokinetic profile and enhances anti ‑ thrombotic effect in a rat carotid artery thrombosis model. 2017;4909–14.
-
16. Jin M, Chen W, Huang W, et al. Preparation of pegylated lumbrokinase and an evaluation of its thrombolytic activity both in vitro and in vivo. Acta Pharmaceutica Sinica B. 2013;3(2):123-129.
-
17. Quiñones JP, Peniche H, Peniche C. Chitosan based self-assembled nanoparticles in drug delivery. Polymers (Basel). 2018;10(3):1–32.
-
18. Bernkop-Schnürch A, Dünnhaupt S. Chitosan-based drug delivery systems. Eur J Pharm Biopharm. 2012;81(3):463–9.
-
19. Liao J, Ren X, Yang B, Li H, Zhang Y, Yin Z. Targeted thrombolysis by using c-RGD-modified N,N,N-Trimethyl Chitosan nanoparticles loaded with lumbrokinase. Drug Dev Ind Pharm [Internet]. 2019;45(1):88–95. Available from: http://dx.doi.org/10.1080/03639045.2018.15223 24
-
20. Srinivasan R, Marchant RE, Gupta AS. In vitro and in vivo platelet targetting by cyclic RGD -Modified liposomes. Journal of biomedical
materials research Part A. 2010;93(3):1004-
1015.
-
21. Verma MK, Pulicherla KK. Lumbrokinase - a potent and stable fibrin-specific plasminogen activator. Int J Bio-Science Bio-Technology. 2011;3(2):57–70.
-
22. Wang KY, Tull L, Cooper E, Wang N, Liu D. Recombinant Protein Production of Earthworm Lumbrokinase for Potential Antithrombotic Application. Evidence-Based Complement Altern Med. 2013;2013:1–8.
-
23. Xu Z rong, Yang Y mei, Gui Q feng, Zhang L na, Hu L. Expression, purification, and characterization of recombinant lumbrokinase PI239 in Escherichia coli. Protein Expr Purif [Internet]. 2010;69(2):198–203. Available from: http://dx.doi.org/10.1016/j.pep.2009.08.013
-
24. Antonino RSCMDQ, Fook BRPL, Lima VADO, Rached RÍDF, Lima EPN, Lima RJDS, et al. Preparation and characterization of chitosan obtained from shells of shrimp (Litopenaeus vannamei Boone). Mar Drugs. 2017;15(5):1–12.
-
25. Younes I, Rinaudo M. Chitin and chitosan preparation from marine sources. Structure, properties and applications. Mar Drugs. 2015;13(3):1133–74.
-
26. Ways TMM, Lau WM, Khutoryanskiy V V. Chitosan and its derivatives for application in mucoadhesive drug delivery systems. Polymers (Basel). 2018;10(3).
-
27. Chen G, Svirskis D, Lu W, Ying M, Huang Y, Wen J. N-trimethyl chitosan nanoparticles and CSKSSDYQC peptide: N-trimethyl chitosan conjugates enhance the oral bioavailability of gemcitabine to treat breast cancer. J Control Release [Internet]. 2018;277(March):142–53. Available from:
https://doi.org/10.1016/j.jconrel.2018.03.013
-
28. Xu J, Xu B, Shou D, Xia X, Hu Y. Preparation and evaluation of vancomycin-loaded N-trimethyl chitosan nanoparticles. Polymers (Basel). 2015;7(9):1850–70.
-
29. Abdassah M. Nanopartikel Dengan Gelasi Ionik. Farmaka. 2012;15(1):45–52
-
30. Ilinskaya AN, Dobrovolskaia MA. Nanoparticles and the blood coagulation system. Part I: benefits of nanotechnology. Nanomedicine. 2013;8(5):773-784.
-
31. Pan Y, Wang X, Yin Z. Synthesis and evaluation of cationic polymeric micelles as carriers of lumbrokinase for targeted thrombolysis. Asian J Pharm Sci [Internet]. 2019;14(2):144–53. Available from:
https://doi.org/10.1016/j.ajps.2018.03.004
https://ojs.unud.ac.id/index.php/essential/index
33
Discussion and feedback