CHIMERIC ANTIGEN RECEPTOR (CAR) T-CELLS THERAPY UNTUK PENYAKIT AUTOIMUN
on
ARTIKEL TINJAUAN PUSTAKA

Essence of Scientific Medical Journal (2020), Volume 18, Number 1:6-11
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
CHIMERIC ANTIGEN RECEPTOR (CAR) T-CELLS THERAPY UNTUK PENYAKIT AUTOIMUN: MASA DEPAN PENANGANAN PEMPHIGUS VULGARIS
Roihan Mohamad Iqbal,1 Anindya Intan Ardanari,1 Muthia Fahiratunnisa Amany,1 Dyah Ayu Mira Oktarina,2
ABSTRAK
Pendahuluan: Pemphigus vulgaris (PV) merupakan penyakit autoimun bolus kronis yang jarang ditemukan namun dapat berpotensi mengancam nyawa melalui adhesi protein autoantibodi desmoglein 3. Pengobatan PV yang paling sering digunakan saat ini adalah imunosupresan yang memiliki efek samping seperti penurunan respon imun dan kemudian dapat kambuh kembali atau terjadi relapse. Oleh karena itu, dibutuhkan inovasi baru dalam pengobatan penyakit autoimun yang lebih spesifik dan dapat mencegah relaps pada jangka waktu yang lama.Tujuan penilitian ini adalah untuk melihat pengobatan terbaru yaitu penggunaan CAR T-cell dalam PV.
Pembahasan : Pada pasien PV akan ditemukan adanya autoantibodi yang melawan desmoglein 3 (αDsg3). αDsg3 sering ditemukan pada membran mukosa dan mucocutaneous. Aktivasi berlebih dari sel CD4+ Th2 menyebabkan adanya autoantibodi. CAR T-cell merupakan hasil dari rekayasi sel T yang dibantu vektor yang membawa reseptor chimera sesuai dengan yang ditargetkan . Pengobatan menggunakan CAR T-cell semakin menjanjikan setelah persetujuan FDA terhadap dua obat untuk kanker hematologi. Peneliti tertarik dalam mengembangkan CAR T-cell sebagai pengobatan penyakit autoimun. Hasil in vitro dari CAAR T-cell (modifikasi CAR T-cell) menunjukkan aktivitas sitotoksik sensitif melawan αDsg3 BCR. Hasil in vivo menunjukkan potensi terhadap eliminasi spesifik dari B cells Dsg3 berdasarkan serum dan sukses dalam mempertahankan intergritas epidermal pada tikus.
Kesimpulan : CAR T-cell menunjukkan potensi sebagai pilihan terapi PV di masa depan. Akan tetapi, pengembangan dan penelitian lebih lanjut terhadap penggunaan CAR T-cell diperlukan untuk terapi PV sehingga dapat dihasilkan pilih pengobatan yang spesifik dengan efek samping minimum bagi pasien.
Kata kunci: autoantibodi, desmoglein, pemphigus vulgaris, penyakit autoimun, terapi CAR T-cell
ABSTRACT
Introduction: Pemphigus vulgaris (PV) is a rare and potentially life-threatening chronic bullous autoimmune disease caused by the presence of desmoglein 3 adhesion protein autoantibodies. The most commonly used PV treatment remains immunosuppressants which have adverse effects such as decreased immune responses and relapse later on. Therefore, innovative therapeutic strategy that more targeted and can prevent relapse in the long term are needed for autoimmune diseases treatment. The objectives of this study is to review current trends of CAR T-cell applications in PV.
Discussion: The presence of autoantibodies against desmoglein 3 (αDsg3) is commonly found in patients with PV. αDsg3 is localized to the mucous membrane and mucocutaneous. Autoantibodies appear due to overactivation of CD4+ Th2 cells. CAR T-cell is the result of the engineering of vector-assisted T cells that carry the chimera receptor according to what is targeted. This treatment with CAR T-cell is increasingly promising after FDA approval of two drugs for haematological cancer. Researchers are interested in developing CAR T-cell as a treatment for autoimmune disease. In vitro results from CAAR T-cell (which is modification of CAR T-cell) showed specific cytotoxicity activity against αDsg3 BCR. The results of the study in vivo discussed the potential for specific elimination of B cells Dsg3 based on serum and succeeded in maintaining epidermal integrity in mice.
Conclusion: CAR T-cell shows the potential to be applied as a choice for PV therapy in the future. Nevertheless, further development of the application of CAR T-cell is needed for PV therapy so that specific treatment options can be obtained with minimal adverse effects for patients.
1Program Studi Kedokteran, Fakultas Kedokteran, Kesehatan Masyarakat, dan Keperawatan, Universitas Gadjah Mada 2Departemen Dermatologi dan Venereologi, Fakultas Kedokteran, Kesehatan Masyarakat, dan Keperawatan, Universitas Gadjah Mada
Keywords: autoantibody, autoimmune disease, CAR T-cell thearpy, desmoglein, pemphigus vulgaris
PENDAHULUAN
Pemphigus vulgaris (PV) merupakan penyakit autoimun bulosa kronis yang disebabkan oleh autoantibodi terhadap protein adhesi desmoglein (Dsg) 3 pada sel keratin. PV ini memiliki potensi untuk menyebabkan kematian.[1,2,3] PV merupakan bentuk klinis pemphigus yang paling dominan dengan persentase 70% dari total kasus pemphigus.[1] PV di seluruh dunia memiliki insidensi yang bervariasi mulai dari 0.5 sampai dengan 3.2 kasus per 100.000 populasi dengan angka mortalitas sebesar 5-15%. Kematian pada pasien dengan PV 3 kali lebih tinggi dibandingkan dengan populasi umum.[1]
Selama ini, terapi farmakologi pada PV bertujuan mengurangi respons inflamasi dan produksi autoantibodi.[1] Terdapat 3 tiga pilihan pengobatan yang diterapkan saat ini, yakni dengan menggunakan imunosupresan, rituximab, dan intravenous
immunoglobulin (IVIg). Imunosupresan seperti kortikosteroid memiliki efek imunosupresif dan antiinflamasi yang kuat sehingga dapat menyebabkan mortalitas dan morbiditas yang tinggi pada pasien berkaitan dengan efek samping terapi. Oleh karena itu, perlu dikombinasikan dengan adjuvant corticosteroid-sparing seperti azatioprin (AZA), metotreksat, dapson, siklosporin, dan mikofenolat mofetil (MMF)[4]. Pasien yang menerima kortikosteroid sistemik jangka panjang berisiko mengalami osteoporosis, mempercepat penyebaran infeksi, gejala cushingoid, diabetes mellitus, hipertensi, insomnia, dan lain-lain.[1, 3, 4]
Alternatif terapi PV datang setelah ditemukannya rituximab. Rituximab merupakan antibodi monoklonal anti-CD20 yang diekspresikan pada permukaan limfosit B pra-B dan dewasa. Limfosit B bekerja pada proses autoimun, termasuk aktivasi limfosit T
dan/atau produksi sitokin proinflamasi.[1] Rituximab disetujui oleh FDA untuk mengobati limfoma nonHodgkin sel B pada tahun 1997, mengobati rheumatoid arthritis pada tahun 2006, dan mengobati PV pada Juni 2018.[1] Rituximab dapat digunakan sendiri maupun bersamaan dengan MMF, prednisone, AZA, plasmapheresis, atau IVIg. Rituximab saat ini diketahui memiliki toleransi yang sangat baik dan efek samping yang serius jarang terjadi. Reaksi injeksi seperti anafilaksis, demam, hipotensi, kedinginan, sakit kepala, mual, pruritus, dan ruam kulit, serta neutropenia, hipogammaglobulinemia, dan infeksi, termasuk sepsis, jarang dilaporkan.[3,4]
Agen biologis lain yang berperan sebagai terapi adalah immunoglobulin intravena (IVIg). IVIg telah disetujui FDA sebagai defisiensi imun primer. IVIg bekerja dengan menetralkan dan memperlambat produksi antibodi pemfigus dalam sirkulasi. Amagai et al melaporkan keberhasilan penggunaan imunoglobulin intravena pada pasien pemfigus yang tidak sepenuhnya menanggapi steroid sistemik, dan Asarch et al melaporkan penggunaannya pada pasien anak.[1] IVIg digunakan bersamaan dengan kortikosteroid. Efek samping yang dihasilkan oleh IVIg adalah sakit kepala, lymphopenia, mual, konstipasi, hepatitis C, dan lain-lain.[3] Target eliminasi sel memori B anti-Dsg-3 harus mengobati PV tanpa risiko imunosupresi umum.[2]
Terapi PV yang sedang dikembangkan saat ini adalah menggunakan chimeric antigen receptor (CAR). CAR merupakan reseptor rekombinan yang memiliki reseptor permukaan kimerik.[5] Rekayasa sel T dengan CAR menggabungkan rangkaian gen antibodi monoklonal spesifik untuk memberikan spesifisitas epitop dan reseptor sel T lainnya dan aktivasi domain untuk menciptakan fragmen vektor rantai tunggal dengan tujuan menghasilkan respons yang sangat spesifik, seperti terlihat pada CAR yang diarahkan pada CD19 Sel T yang digunakan dalam terapi keganasan sel B yang mengekspresikan CD19.[6] CAR telah disetujui oleh FDA pada tahun 2017 sebagai pengobatan keganasan hematologis dan merevolusi terapi kanker[2,5]. Penggunaan sel T yang dimodifikasi oleh CAR telah dilakukan pada terapi keganasan hematologis, yaitu leukemia limfoblastik akut (ALL) dengan menargetkan CD19, leukemia limfoblastik kronis (CLL) dengan menargetkan CD19, myeloma dengan menargetkan CD19, limfoma dengan menargetkan CD19 atau CD20, dan leukemia myeloid akut (AML) dengan menargetkan antigen Lewis Y atau CD33.[5]
Sebuah CAR spesifik CD19, yang terdiri dari antibodi fragmen vektor rantai tunggal ekstraseluler (scFv) terhadap CD19 yang menyatu dengan domain persinyalan sitoplasma sel T, menyebabkan pengaktifan sitotoksisitas sel T setelah mengalami kontak dengan sel B CD19+. Hal ini menyebabkan eliminasi sel B spesifik dan permanen. Pada PV, sel B memori mengekspresikan reseptor sel B (BCR) dengan anti-Dsg3 (αDsg3). Ekspresi Dsg3 sebagai domain ekstraseluler dari imunoreseptor kimerik, menyebabkan sitotoksisitas menjadi spesifik untuk sel-sel B yang mengandung BCR αDsg3, hal ini mampu memberikan terapi yang spesifik untuk PV tanpa risiko imunosupresi umum seperti yang terjadi pada penggunaan kortikosteroid. Spesifisitas metode ini akan lebih tinggi karena berfokus hanya pada BCR αDsg3 dibandingkan dengan penggunaan rituximab yang bekerja dengan menginduksi apoptosis semua
sel yang mengekspresikan CD20, yang berarti akan berdampak pada semua sel B karena semua lini sel B mengekspresikan CD20.[2,7]
CAR mampu mengenali antigen yang tidak diproses secara independen dari ekspresi antigen major histocompatibility (MHC), tidak seperti reseptor sel T fisiologis (TCR) sehingga sel T CAR mampu menghindari mekanisme tumor melarikan diri dari MHC dan TCR. Selain itu, CAR juga tidak hanya mampu mengikat protein tetapi juga karbohidrat, ganglioside, proteoglikan, dan protein glikosilasi berat, sehingga memperluas jangkauan target potensial. CAR biasanya melibatkan target scFv yang berasal dari antibodi.[8]
Studi pustaka ini akan membahas mengenai pengembangan terapi CAR T-cell dalam penanganan penyakit autoimun khususnya pemphigus vulgaris. Tujuan penulisan studi literatur ini adalah untuk membuka wawasan mengenai pengembangan terapi PV yang lebih spesifik dan lebih memberikan manfaat kepada pasien PV kedepannya.
PEMBAHASAN
Pathogenesis PV
PV merupakan penyakit autoimun bulosa yang menyerang area kulit dan mukosa. Adanya lesi lunak dan erosi intraepithelial menjadi ciri dari penyakit ini. Patogenesis penyakit ini belum sepenuhnya diketahui.[9] Meski demikian, kerusakan desmosom akibat autoantibodi terhadap domain ekstraselular desmoglein 3 (Dsg 3) dengan deposisi imun intraepithelial memiliki andil dalam patogenesis dan perkembangan PV.[9,10] Desmoglein merupakan protein target dari antibodi pada pemphigus, bersama desmocollin (Dsc), yang memiliki fungsi memediasi kontak antarsel melalui adhesi.[11] (Gambar 1)
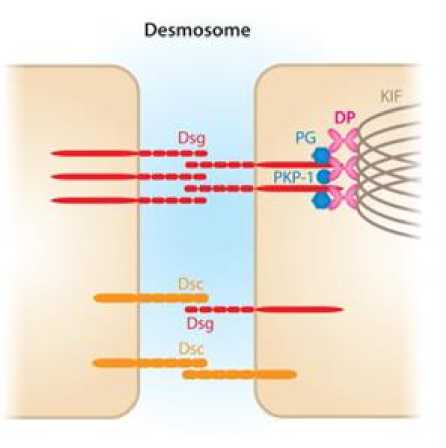
Gambar 1. Skema Desmosom Interseluler pada Keratinosit[11]
Pembentukan autoantibodi pada PV menyerang protein desmosomal di lapisan epidermal sistem integumen, meliputi kulit, mukosa oral, dan esofagus.[11,12] Teori kompensasi desmoglein yang merupakan konsep awal patogenesis PV menyebutkan bahwa keberadaan Dsg akan menjaga integritas epidermis dan mukosa. Dsg3 banyak diekspresikan di regio parabasal epidermis dan epitel mulut, karena itulah keberadaan autoantibodi
terhadap Dsg3 secara histopatologi akan tampak sebagai pembentukan celah intraepithelial di atas lamina basalis sehingga terbentuklah lesi pemphigus.[9]
Antibodi spesifik αDsg3 ditemukan pada pasien PV dengan lesi yang terlokalisasi pada membran mukosa, sedangkan pasien dengan lesi mukokutan memiliki antibodi tidak hanya αDsg3 namun juga antibodi spesifik αDsg1. Profil autoantibodi ini merujuk pada model kompensasi desmoglein yang menjelaskan lokalisasi lesi PV karena αDsg3 dan αDsg1 akan menginaktivasi Dsg spesifik masing-masing. Dsg 1 pada kulit lebih banyak dibandingkan Dsg3, sehingga aktivitas αDsg3 akan terkompensasi oleh keberadaan Dsg1 dan integritas lapisan epidermis masih terjaga. Namun jika αDsg3 bersama αDsg1 terdapat pada profil antibodi, akan muncul PV pada area mukokutaneus karena kedua inaktivasi Dsg1 dan Dsg3 sehingga tidak dapat terjadi kompensasi.[11]
Autoantibodi yang berperan dalam patogenesis PV muncul sebagai akibat dari aktivasi berlebihan sel CD4+ T helper 2 (Th2). Genotipe human leukocyte antigen (HLA) yang berperan dalam perkembangan/aktivasi sel B untuk autoantibodi spesifik menggambarkan kerentanan genetik PV. Aktivasi sel B di sini memerlukan interaksi kompleks dengan Th2. Th2 memiliki fungsi sekresi atas berbagai macam interleukin (IL), salah satunya IL-4 yang memiliki fungsi sistem imun humoral, yang juga memiliki peran dalam patogenesis pemphigus. Pada pemphigus, IL-4 memacu produksi antibodi oleh sel B dan isotype switching dari IgG1 ke IgG4 yang penting dalam fase aktif PV. IL-4 juga merupakan sinyal diferensiasi sel T CD4+ menjadi Th2 sehingga kembali memperbanyak jumlah Th2 yang berperan dalam PV. Produksi autoantibodi dan ikatan epitop menyebabkan hilangnya adhesi antar desmosom sehingga terjadi lepasnya keratinosit pada PV.[10] Hal ini menunjukan peran sel T dalam patogenesis PV.
Pembuatan Chimeric Antigen Receptor T-cell
Chimeric Antigen Receptor T-cell (CAR T-cell) adalah sel T yang mengalami rekayasa molekular melalui bantuan vektor (biasanya lentivirus) yang membawa reseptor kimerik. Pertama-tama, sel T pasien diambil dari darah pasien dengan metode leukapheresis, kemudian dilakukan modifikasi ex vivo dengan cara mengenalkan CAR pada genom dan menginduksi ekspresi CAR pada permukaan sel T. Sel T ini kemudian diinfusikan kepada pasien sehingga didapatkan respons imun spesifik.[13]
CAR T-cell tersusun atas domain ekstraselular, transmembran, dan persinyalan intraselular. Domain ekstraselular CAR terdiri atas single chain fragment variable (scFv) (Gambar 2). Gambaran CAR generasi pertama memberi sinyal melalui rantai CD3ζ saja.[14] Meskipun spesifisitas tinggi, ternyata efek CAR T-cell masih kurang baik sehingga dikembangkan desain generasi kedua. Generasi kedua, menambahkan domain sinyal dari molekul kostimulan seperti CD28 atau 4-1BB, sedangkan generasi ketiga menggabungkan kedua domain secara berurutan dengan rantai CD3ζ. CAR T-cell dimodelkan untuk mensekresikan sitokin pro inflamasi.[14]
Perjalanan terapi CAR T-cell mencapai keberhasilannya ketika obat tisagenlecleucel (Kymriah™–Novartis) disetujui untuk digunakan dalam terapi leukemia (Agustus 2017) dan limfoma (Mei 2018) serta axicabtagene ciloleucel (Yescarta™–Kite) untuk limfoma (Oktober 2017).[15] Mekanisme obat tersebut adalah penggabungan CAR spesifik CD19+ dengan domain persinyalan sitoplasmik sel T yang akan mengaktifkan sitotoksisitas sel T terhadap sel B CD19+.
Keberhasilan CAR T-cell untuk kasus kanker hematologi memicu keinginan para peneliti untuk memperluas spektrum treatment CAR T-cell ke dalam penyakit lain seperti penyakit autoimun. Hal ini mengingat terapi autoimun saat ini masih terbatas dan pilihan terapi baru dapat memberi harapan yang lebih baik.[16]
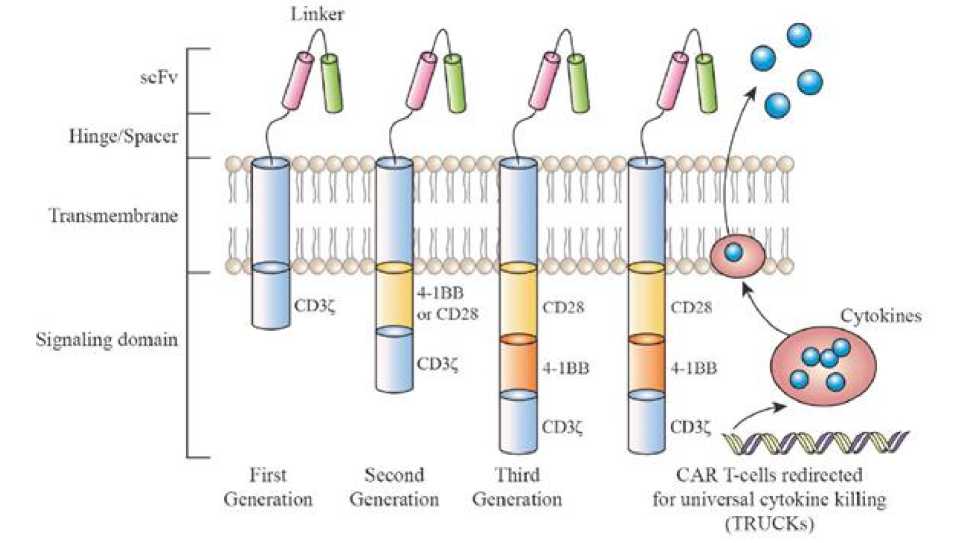
Gambar 2. Reseptor Antigen Kimerik Generasi 1 sampai dengan 4.[14]
Pengembangan CAR T-cell therapy pada PV
Penelitian dalam penggunaan CAR T-cell untuk terapi selain kanker mulai dikembangkan untuk penyakit autoimun seperti PV.[16] Sejauh ini, PV adalah salah satu penyakit autoimun manusia yang sudah dikarakterisasi dengan baik karena perjalanan penyakitnya yang cukup jelas. Sehingga, PV dikatakan ideal untuk dilakukan pendekatan terapi tertarget.[17]
Pada jaringan kulit, protein Dsg3 terdiri atas lima domain extracellular cadherin (EC) yakni EC1, EC2, EC3, EC4, dan EC5. EC1 dan EC2 merupakan domain yang penting untuk adhesi sel. Pada PV, sel B memori patogenik mengekspresikan anti-Dsg3 B cell receptor (BCR). Dihubungkan dengan konsep CAR T, ekspresi Dsg3 sebagai domain ekstraselular dari imunoreseptor artifisial, akan memunculkan efek sitotoksisitas spesifik untuk sel B yang memiliki anti-Dsg3 BCR. Dengan demikian, sel B memori dengan surface immunoglobulin (sIg) + anti-Dsg3 serta sel plasma dengan sIg- Dsg3 yang menghasilkan autoantibodi pada PV akan tereliminasi.[2] Metode ini merupakan pengembangan CAR T yang berbasis antigen menjadi chimeric auto antibody receptor T-cell (CAAR T-cell) yang berbasis autoantibodi.
Sebuah studi mendesain CAAR Dsg3 dengan menggunakan domain ekstraselular EC1-3, EC1-4, dan EC1-5. CD137-CD3ζ digunakan sebagai domain sinyal dalam sitoplasma model. Secara in vitro, digunakan hibridoma AK23 yang menarget EC1, AK19 yang menarget EC2, AK18 yang menarget EC3-4, serta K562/Nalm-6 yang mengekspresikan F779 (anti-EC1) atau PVB28(anti-EC2) patogenik. CAAR T Dsg3 EC1-4 menampilkan sekresi interferon-γ (IFN-γ), memiliki efek sitolitik spesifik terhadap anti-EC1/EC2, dan juga melisiskan target anti-EC3/42 (Gambar 3). IFN sendiri memiliki kapasitas untuk mengaktivasi apoptosis sel melalui jalur persinyalan JAK/STAT.[18] Dengan adanya sitolisis anti-EC1/EC2 diharapkan dapat menyelamatkan EC1 dan EC2 sehingga adhesi sel melalui Dsg3 dapat dijaga.
IgG anti-Dsg3 yang ada pada serum pasien PV memiliki kemungkinan untuk menetralkan atau malah menstimulasi aktivitas Dsg3 CAAR T. Diketahui, bahwa aktivitas CAAR T dalam lingkungan dengan IgG anti-Dsg3 terlarut tidak akan menghambat aktivitas CAAR T dan justru akan meningkatkan efikasinya. Sitotoksisitas CAAR T terhadap target poliklonal dalam kondisi tersebut tetap ditunjukan dengan Dsg3EC1-3 dan Dsg3EC1-4 CAAR T tetap dapat membunuh sel Nalm-6 yang mengekspresikan anti-Dsg3.[2]
Pada PV, sel B memori patogenik akan mengekspresikan reseptor sel B anti-Dsg3. Ketika sel T direkayasa untuk mengekspresikan Dsg3 pada domain ekstraselular dari imunoreseptor kimera, maka sel akan menarget secara spesifik sel B dengan reseptor anti-Dsg3 sehingga mampu menjadi terapi tertarget untuk PV. Imunosupresi ini bersifat selektif sehingga pasien tidak mengalami supresi imun secara menyeluruh.[2]
Uji in vivo pada model mencit PV dilakukan untuk menilai efikasi Dsg3 CAAR-T terhadap AK23/AK19/AK18. Model hewan ini memiliki serum anti Dsg3 IgG poliklonal dari hibridoma yang bisa menetralkan CAAR T, menyerupai kondisi pasien PV. Pada hari kelima, model mencit diberi injeksi Dsg3 CAAR-T ataupun kontrol negatif. Hasil ditunjukkan pada gambar di bawah ini.
Hasil menunjukkan adanya penurunan signifikan (p<0,05) dari αDsg3 serum pada kelompok mencit dengan terapi CAAR T-cell seiring berjalannya waktu pada mencit yang diberi sel hibridoma, dibandingkan dengan kontrol negatif (Gambar 4.).[2] Dsg3 CAAR T-cell terlihat mampu mengontrol hibridoma PV sehingga terjadi penurunan titer autoantibodi serum, yang juga berdampak pada kondisi histologi mukosa oral mencit (Gambar 5).
Hasil histologis pada mencit mendukung adanya integritas epidermis dan dermis kulit yang tetap baik pada kelompok mencit yang diberi CAAR T-cell. Penurunan αDsg3 ini sejalan dengan penelitian sebelumnya dengan menggunakan mencit neonatus yang ternyata tidak membentuk bula ketika mencit dilakukan dilakukan immunoadsorpsi terhadap αDsg3 dengan hDsg3[19].
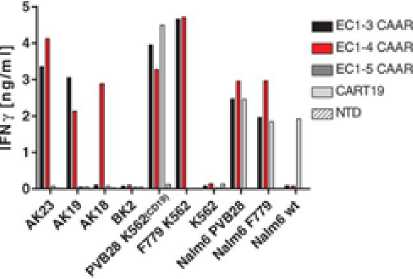
Gambar 3. Produksi IFN-γ oleh Masing-Masing Model CAAR T Diukur dengan ELISA.[2]
Serum Dsg3 ELISA
• Dsg3 CAAR
• control CAR
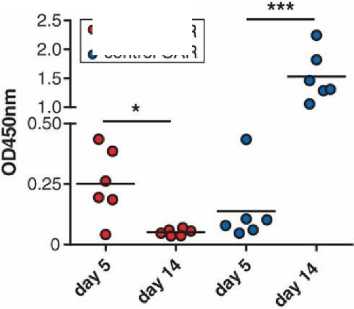
Gambar 4. Profil Serum Αdsg3 pada Mencit Ketika Sebelum dan Sesudah Diberi Perlakuan CAAR T-Cell atau Kontrol Negatif pada Hari ke-5 dan ke-14.[2]
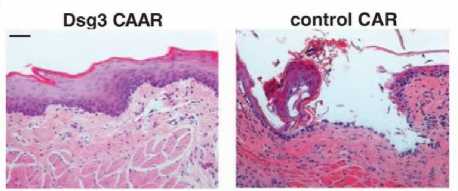
Gambar 5. Penilaian Akantolisis secara Histologis.[2]
Pengembangan CAR T pada penyakit autoimun lainnya
Ekspansi penerapan CAR T-cell di luar kanker juga diterapkan melalui sel T regulator, alih-alih sel T sitotoksik. Terapi ini dikenal dengan CAR Treg cells therapy. Sel T regulator ini akan melindungi sel target dari serangan oleh sistem imun tubuh. Contoh penggunaan CAR Treg ini ada pada penanganan hemofilia A. Kadangkala terjadi respons penolakan pasca imunisasi FVIII pada pasien karena sel B yang reaktif. CAR Treg dikembangkan untuk “menoleransi” sel B yang reaktif tersebut.[20]
Aspek Keamanan
Potensi pengembangan pemanfaatan CAR T-cell tidak lepas dari risiko adanya efek samping yang dapat terjadi. Perbaikan model CAR T-cell demi mencapai luaran yang baik terus dilakukan, hal ini bisa dilihat dari perubahan susunan dari generasi pertama hingga ketiga. CAR T-cell generasi ketiga menggunakan dua molekul kostimulatorik untuk meningkatkan aktivitas in vivo sebagai bentuk perbaikan atas generasi sebelumnya. Namun sebagai akibat dari peningkatan aktivitas in vivo, peningkatan mendadak dari sitokin karena cytokine release syndrome (CRS) menjadi efek samping parah yang perlu dicegah kejadiannya dalam penggunaan terapi CAR T-cell.[21]
Sampai saat ini belum terdapat uji klinis dari pemanfaatan CAR T-cell sebagai terapi PV sehingga belum diketahui efek samping yang dapat terjadi dari terapi CAR T-cell pada PV. Namun, laporan kasus dari Morgan et al yang menggunakan terapi CAR T-cell pada pasien kanker kolon yang mengekspresikan ERBB2 dengan sel yang ditransduksi dengan ERBB2 CAR diketahui sampel serum yang diperoleh dari pasien menunjukkan adanya cytokine storm. Empat jam setelah sel dimasukkan, ditemukan peningkatan cepat dari IFN-γ, granulocyte macrophage-colony stimulating factor (GM-CSF), tumor necrosis factor-α (TNF-α), IL-6, and IL-10. Dalam empat jam ini IFN-γ mencapai konsentrasi maksimal dalam serum.[22]
Kalos et al, dalam uji klinis terapi CART19 pada 3 pasien chronic lymphocytic leukemia (CLL), juga menunjukan temuan peningkatan konsentrasi IL-6, IFN-γ, IL-8, and IL-10 sebesar tiga kali lipat dari baseline. Selain itu juga terjadi peningkatan serupa pada kemokin seperti macrophage inflammatory protein –1α (MIP-1α), MIP-1β, monocyte chemotactic peptide–1 (MCP-1), CXC chemokine ligand 9 (CXCL9), dan CXCL10. Pada penelitian ini, IFN-γ menjadi sitokin dengan perubahan relatif yang paling besar. Perubahan konsentrasi sitokin kembali ke baseline relatif cepat dan TNF-α yang sering terlibat dalam pasien dengan cytokine storm tidak begitu signifikan aktivitasnya. Meskipun begitu dua pasien mengalami pelepasan sitokin dengan konsentrasi yang cukup membahayakan, namun tidak tampak efek cytokine storm karena CAR T-cell dimasukkan ke tubuh pasien secara bertahap dan domain sinyal yang digunakan tidak memicu sekresi IL-2 dan TNF-α.[23]
Pada penelitian Ellebrecht et al, seperti yang telah disebutkan sebelumnya, juga diamati adanya peningkatan IFN-γ pada pemberian Dsg3 CAAR T-cell. Namun pada studi tersebut tidak dilakukan pengamatan peningkatan pada sitokin lainnya seperti TNF-α dan limitasi pengamatan model preklinis yang periodenya pendek sehingga tidak diketahui kemungkinan kejadian badai sitokin. Meskipun begitu, penelitian ini juga menunjukkan bahwa CAAR T-cell
pada PV memunculkan kematian target sel αDsg3 yang spesifik walaupun dalam lingkungan dengan IgG anti Dsg3 tanpa adanya toksisitas di luar target. Tumor lysis syndrome dan CRS sebenarnya juga tidak mungkin terjadi mengingat sel B dengan αDsg3 diperkirakan hanya menyusun sebagian kecil dari populasi sel B sehingga lisis dan apoptosis sel B dengan αDsg3 diperkirakan tidak akan menyebabkan peningkatan pelepasan sitokin yang berdampak besar.[2]
Perspektif dan tantangan ke depan
Meskipun membawa cerita kesuksesan besar dari CAR spesifik CD19 untuk kanker, ternyata ditemukan varian kanker yang “terhindar” dari terapi tersebut sehingga ada sejumlah pasien mengalami rekurensi. Oleh karena itu, perlu antisipasi hal tersebut dengan cara mencari target antigen lain.[24] Hal ini juga sangat berpotensi terjadi pada penyakit autoimun termasuk PV. Patofisiologi PV yang umum ternyata tidak mampu menjelaskan akantolisis pada pasien yang tidak memiliki autoantibodi desmoglein. Dari hasil teknik proteomik terhadap 701 gen yang mengkode protein permukaan keratinosit, didapat 10 antigen yang paling relatif lebih banyak terekspresi oleh pasien pemphigus, dibandingkan populasi sehat.[25] Hal ini tentu menjadi tantangan dalam pembuatan kimera, mengingat tiap pasien PV dapat memiliki karakteristik autoantibodi yang unik.
Pada kasus kanker, strategi pembuatan bispecific CAR seperti CD19/CD20 tandem dapat membunuh sel spesifik terhadap kedua antigen dapat memberikan solusi terhadap masalah tersebut.[24] Strategi ini diharapkan dapat juga dikembangkan untuk penanganan penyakit autoimun.
Keterbatasan studi
Sejauh ini belum banyak literatur yang dapat dijadikan referensi dalam penulisan studi pustaka ini mengingat penelitian mengenai terapi PV menggunakan CAR T-cell maupun CAAR T-cell masih terbatas. Penelitian yang ada mengenai terapi PV dengan CAAR T-cell baru mencapai model pra klinis sehingga belum diketahui pasti dampak intervensi CAAR T-cell pada pasien PV dibandingkan pengobatan yang ada.[2] Meskipun begitu, tinjauan pustaka ini diharapkan dapat membuka wawasan untuk pengembangan terapi PV terutama dengan CAR T-cell atau pun turunannya yakni CAAR T-cell yang memiliki potensi menjadi terapi yang spesifik tanpa menyebabkan supresi imun secara umum.
SIMPULAN
Terapi autoimun saat ini memiliki potensi terapi dengan outcome lebih besar dengan adanya teknologi CAR T-cell therapy. Dengan ditetapkannya obat kanker berbasis CAR T-cell, semakin mendorong potensi penerapan CAR T-cell untuk penyakit lain termasuk autoimun seperti PV. Hasil studi in vitro dan in vivo memperlihatkan hasil pengembangan CAR T-cell yang diterapkan pada model PV, yakni Dsg3 CAAR T-cell menunjukan aktivitas sitotoksisitas spesifik terhadap αDsg3 BCR secara in vitro dan berkembang, serta bertahan pada lingkungan in vivo dengan tetap menunjukkan potensi eliminasi spesifik terhadap sel B Dsg3.
Hal ini menunjukan bahwa CAR T-cell atau pun CAAR T-cell menunjukkan potensi untuk diaplikasikan sebagai pilihan terapi PV kedepannya. Meskipun begitu, tetap diperlukan pengembangan
lebih lanjut dari penerapan CAR T-cell dan pengembangannya yaitu CAAR T-cell untuk terapi PV agar benar benar dapat diperoleh pilihan terapi yang spesifik dengan efek samping minimal bagi pasien.
DAFTAR PUSTAKA
-
1. Zeina B. Pemphigus Vulgaris: Practice Essentials, Background, Pathophysiology [Internet]. eMedicine Medscape. 2018 [cited 2 July 2019]. Available from:
https://emedicine.medscape.com/article/1064187 -overview#a1
-
2. Ellebrecht C, Bhoj V, Nace A, Choi E, Mao X, Cho M et al. Reengineering chimeric antigen receptor T cells for targeted therapy of autoimmune disease. Science. 2016;353(6295):179-184.
-
3. Cholera M, Chainani-Wu N. Management of Pemphigus Vulgaris. Advances in Therapy. 2016;33(6):910-958.
-
4. Porro A, Hans Filho G, Santi C. Consensus on the treatment of autoimmune bullous dermatoses: pemphigus vulgaris and pemphigus foliaceus -Brazilian Society of Dermatology. Anais Brasileiros de Dermatologia. 2019;94(2 suppl 1):20-32.
-
5. Han X, Wang Y, Han W. Chimeric antigen receptor modified T-cells for cancer treatment. Chronic Diseases and Translational Medicine.
2018;4(4):225-243.
-
6. Wilkins O, Keeler A, Flotte T. CAR T-Cell Therapy: Progress and Prospects. Human Gene Therapy Methods. 2017;28(2):61-66.
-
7. Kanwar AJ, Vinay K. Rituximab in pemphigus. Indian J Dermatol Venereol Leprol 2012;78:671-6
-
8. Dai H, Wang Y, Lu X, Han W. Chimeric Antigen Receptors Modified T-Cells for Cancer Therapy. JNCI: Journal of the National Cancer Institute. 2016;108(7).
-
9. Madala J, Bashamalla R, Kumar M. Current concepts of pemphigus with a deep insight into its molecular aspects. Journal of Oral and Maxillofacial Pathology. 2017;21(2):260
-
10. Dimarco C. Pemphigus : Pathogenesis to
Treatment. Rhode Island Medical Journal [Internet]. 2016 [cited 30 June 2019];:28-31. Available from: http://www.
rimed.org/rimedicaljournal/2016/12/2016-12-28-autoimmune-dimarco.pdf
-
11. Hammers C, Stanley J. Mechanisms of Disease: Pemphigus and Bullous Pemphigoid. Annual Review of Pathology: Mechanisms of Disease. 2016;11(1):175-197.
-
12. Takahashi H, Kouno M, Nagao K, Wada N, Hata T, Nishimoto S et al. Desmoglein 3–specific CD4+ T cells induce pemphigus vulgaris and interface dermatitis in mice. Journal of Clinical Investigation. 2011;121(9):3677-3688.
-
13. Español-Rego M, Marzal B, Juan M, Castella M, Boronat A. Future of Chimeric Antigen Receptors (Cars): Could it Drive Solutions Beyond Cancer?
Examples in Autoimmune Diseases [Internet]. Pdfs.semanticscholar.org. 2019 [cited 2 July 2019]. Available from:
https://pdfs.semanticscholar.org /48ab/192bdef6328fb84f861546e42ed20a3c204a .pdf
-
14. Miliotou A, Papadopoulou L. CAR T-cell Therapy: A New Era in Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 2018;19(1):5-18.
-
15. Watanabe K, Kuramitsu S, Posey A, June C. Expanding the Therapeutic Window for CAR T Cell Therapy in Solid Tumors: The Knowns and Unknowns of CAR T Cell Biology. Frontiers in Immunology. 2018;9.
-
16. Tahir A. Is Chimeric Antigen Receptor T-cell Therapy the Future of Autoimmunity Management?. Cureus. 2018
-
17. Ellebrecht C, Payne A. Setting the target for pemphigus vulgaris therapy. JCI Insight. 2017;2(5).
-
18. Kotredes K, Gamero A. Interferons as Inducers of Apoptosis in Malignant Cells. Journal of Interferon and Cytokine Research [Internet]. 2013 [cited 2 July 2019];33(4):162-170. Available from: https://www.
ncbi.nlm.nih.gov/pmc/articles/PMC3624694/
-
19. Hofrichter M, Dworschak J, Emtenani S, Langenhan J, Weiß F, Komorowski L et al. Immunoadsorption of Desmoglein-3-Specific IgG Abolishes the Blister-Inducing Capacity of Pemphigus Vulgaris IgG in Neonatal Mice.
Frontiers in Immunology. 2018;9.
-
20. Zhang AH, Yoon J, Kim YC, and Scott DW. Targeting Antigen-Specific B Cells using AntigenExpressing Transduced Regulatory T Cells. J. Immunol 18 July 2018
-
21. Kim M, Kim D, Suh S, Park Z, Choi M, Oh Y. Current status and regulatory perspective of chimeric antigen receptor-modified T cell therapeutics. Archives of Pharmacal Research. 2016;39(4):437-452.
-
22. Morgan R, Yang J, Kitano M, Dudley M, Laurencot C, Rosenberg S. Case Report of a Serious Adverse Event Following the Administration of T Cells Transduced With a Chimeric Antigen Receptor Recognizing ERBB2. Molecular Therapy. 2010;18(4):843-851.
-
23. Kalos M, Levine B, Porter D, Katz S, Grupp S, Bagg A et al. T Cells with Chimeric Antigen Receptors Have Potent Antitumor Effects and Can Establish Memory in Patients with Advanced Leukemia. Science Translational Medicine. 2011;3(95):95ra73-95ra73.
-
24. Xu D, Jin G, Chai D, Zhou X, Gu W, Chong Y et al. The development of CAR design for tumor CAR-T cell therapy. Oncotarget. 2018;9(17).
-
25. Kalantari-Dehaghi M, Anhalt G, Camilleri M, Chernyavsky A, Chun S, Felgner P et al.
Pemphigus Vulgaris Autoantibody Profiling by Proteomic Technique. PLoS ONE.
2013;8(3):e57587.
https://ojs.unud.ac.id/index.php/essential/index
11
Discussion and feedback