BISPESIFIK IL-17A DAN IL-17F (IL-17A/F) SEBAGAI INOVASI TERAPI TERBARU BAGI PARA PENDERITA PSORIASIS: SEBUAH TELAAH PUSTAKA SISTEMATIS
on
ARTIKEL TINJAUAN PUSTAKA

Essence of Scientific Medical Journal (2020), Volume 18, Number 1:32-40
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
BISPESIFIK IL-17A DAN IL-17F (IL-17A/F) SEBAGAI INOVASI TERAPI TERBARU BAGI PARA PENDERITA PSORIASIS: SEBUAH TELAAH PUSTAKA SISTEMATIS
Rexel Kuatama,1 Rivaldi Ruby,1 Ghea Mangkuliguna1
ABSTRAK
Pendahuluan: Psoriasis adalah penyakit inflamasi kulit kronis yang ditandai dengan kemerahan, scaling, indurasi, kegatalan, dan penebalan kulit dan memperburuk kualitas hidup penderitanya, secara khusus, penderita sedang dan berat. Meskipun kemunculan molekul biologis telah menjadi pengobatan revolusioner pada terapi pasien psoriasis sedang dan berat, sejumlah pasien menunjukan ketidakefektivitasan. Berbagai studi terbaru menunjukkan molekul biologis bispesifik sebagai alternatif yang efektif dan efisien. Telaah pustaka ini bertujuan untuk menilai efektivitas dan efek samping bispesifik IL-17A/F pada berbagai studi klinis.
Pembahasan: Dari hasil telaah, ~100% dan >80% dari pasien yang diterapi dengan bispesifik IL-17A/F berhasil mencapai PASI75 dan PASI90, secara berturut-turut, pada minggu ke 12 studi fase I dan II. Terlebih lagi, bispesifik IL-17-A/F berhasil menurunkan indikator inflamasi secara signifikan pada biopsi lesi kulit penderita psoriasis. Efek samping yang dilaporkan tergolong ringan dan tidak ada imunogenisitas terdeteksi.
Simpulan: Bispesifik IL-17A/F memberikan terapi efektif dengan efek samping yang minimal dalam jangka waktu yang lebih singkat. Studi fase lanjut diperlukan untuk membandingkan keefektivitasannya dengan molekul biologis lain.
Kata kunci: bimekizumab, biologics, bispecific IL17A/F, M1095, psoriasis
ABSTRACT
Introduction: Psoriasis is a chronic inflammatory skin disease characterized with redness, scaling, induration, itchiness, and thickness of skin that worsen quality of life, particularly in moderate to severe psoriatic patients. Although the emergence of biologics has provided revolutionary therapy in the management of moderate to severe psoriasis, significant number of patient has shown ineffectiveness. Recent studies suggest the use of bispecific antibodies as an effective and efficient alternatives . This review aims to evaluate the effectiveness and adverse side effects of bispecific IL-17A/F in various clinical studies.
Discussion: This paper yields results that ~100% and >80% of patients treated with bispecific IL-17A/F is able to achieve PASI75 and PASI90, respectively, by week 12 in phase I and II studies. Moreover, bispecific IL-17A/F is able to significantly reduce inflammatory response in psoriatic skin biopsies. Only mild treatment-related adverse events is reported and no immunogenicity is detected.
Conclusion: Bispecific IL-17A/F provides effective therapy with minimal adverse side effects within a short amount of time. Further study is needed to compare its effectiveness against other biologics.
Keywords: bimekizumab, biologics, bispecific IL17A/F, M1095, psoriasis
1Program Studi Pendidikan Dokter, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Katolik Indonesia Atma Jaya
PENDAHULUAN
Psoriasis merupakan penyakit inflamasi kulit kronis yang ditandai dengan timbulnya penebalan kulit yang mudah terkelupas dan disertai kemerahan, rasa gatal, serta nyeri di berbagai bagian tubuh. Menurut data dari World Health Organization, prevalensi psoriasis di dunia mencapai 0.09%-11.4%.[1] Sebagian besar penderita psoriasis sedang hingga berat mengalami penurunan kualitas hidup. Psoriasis biasa disertai dengan beberapa komorbiditas lain, seperti arthritis, depresi, penyakit kardiovaskular, dan radang usus.[2]
Terapi sistemik yang digunakan selama ini memiliki efektivitas yang rendah dan hanya meringankan gejala. Penderita psoriasis sedang dan berat terpaksa harus menjalani terapi sistemik dalam kurun waktu yang lama dengan efek samping yang besar. Selama dua dekade terakhir, peneliti berhasil menemukan molekul biologis yang dapat membawa harapan baru bagi semua penderita psoriasis. Namun sayangnya, molekul biologis tersebut tidak memberikan respon yang baik bagi semua penggunanya.[3] Keterbatasan alternatif pengobatan membuat sejumlah besar penderita psoriasis sedang dan berat terus mengalami penurunan kualitas hidup. Oleh karena itu, inovasi dalam perkembangan terapi
psoriasis sangatlah diperlukan untuk menjamin pengobatan yang efektif bagi semua orang.
Artikel ini disusun untuk memberikan gambaran umum tentang psoriasis dan masalah yang ada pada terapi sekarang. Secara khusus, telaah pustaka sistematis dilakukan untuk menelaah efektivitas dan keamanan bispesifik IL-17A/F sebagai inovasi terbaru dalam penanganan psoriasis sedang dan berat.
METODE
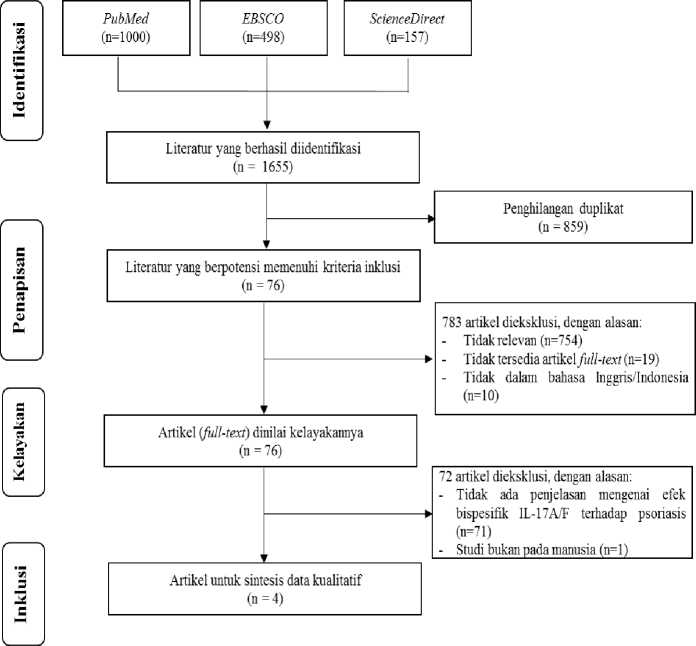
Metode penelitian yang digunakan adalah telaah pustaka sistematis yang berpedoman pada Preferred Reporting Items for Systematic Reviews and Meta-analyses (PRISMA). Telaah sistematis dilakukan untuk mengetahui efek terapeutik dari bispesifik IL-17A/F terhadap psoriasis. Pencarian literatur dilakukan melalui sumber referensi dari PubMed, ScienceDirect, dan EBSCO dengan kriteria literatur dipublikasikan dalam kurun waktu lima tahun terakhir (2015-2019). Literatur dicari menggunakan kata kunci: “anti interleukin 17A/F” OR “anti interleukin 17A interleukin 17F” OR “anti IL 17A/F” OR “anti IL17A anti IL17F” AND “psoriasis”. Kriteria inklusi yang digunakan antara lain: (1) Penggunaan sampel klinis dari orang-orang yang didiagnosis psoriasis; (2) Penggunaan bispesifik IL-17A/F
sebagai terapi untuk penderita psoriasis; (3) Penggunaan Psoriasis Area and Severity Index (PASI) sebagai tolak ukur utama untuk mengetahui efek terapeutik dari penggunaan bispesifik IL-17A/F. Semua literatur yang dipublikasi tidak dalam bahasa Inggris atau Indonesia tidak dimasukkan ke dalam studi. Literatur yang berupa ulasan, laporan kasus, penelitian in vitro/in vivo juga tidak dimasukkan ke dalam studi. Literatur yang diperoleh dari pencarian database elektronik akan ditinjau berdasarkan judul dan abstrak yang tertera. Literatur yang berpotensi memenuhi syarat untuk digunakan dalam telaah sistematis akan dinilai berdasarkan kriteria inklusi dan eksklusi yang sudah ditetapkan. Cochrane risk of bias tool digunakan untuk menilai kualitas dari studi yang dimasukkan ke dalam telaah sistematis ini. Setiap perselisihan yang muncul akan diselesaikan dengan konsensus di antara tim peninjau. Berdasarkan hasil peninjauan akhir, kami menyimpulkan terdapat 4 studi yang sesuai dengan kriteria telaah sistematis ini.
PEMBAHASAN
Patofisiologi Psoriasis
Perjalanan penyakit psoriasis dapat dibagi ke dalam dua fase, yaitu initiation phase dan maintenance phase.[4] Initiation phase merupakan proses dimulainya inflamasi lokal pada epidermis. Proses ini terjadi akibat adanya trauma pada keratinosit epidermis yang mengakibatkan keluarnya DNA bebas serta antimicrobial peptide LL-37. LL-37 akan membentuk kompleks dengan pathogen-derived DNA dan berikatan pada Toll-like receptor 9 yang ada pada plasmacytoid dendritic cells di dermis. Plasmacytoid dendritic cells akan mensekresikan IFN tipe 1, TNF-α, IL-6, dan IL-β yang akan menstimulasi myeloid dendritic cell untuk menuju nodus limfatik serta mensekresikan IL-23, IL-12, dan TNFα yang akan memicu diferensiasi dari naive T helper (TH0) menjadi TH22, TH1, dan TH17.[3]
Kemudian, akan dilanjutkan dengan maintenance phase, berupa dihasilkannya TNF-α, IFN-γ, IL-17A dan F, serta IL-22 oleh sel T-helper. yang akan menstimulasi proliferasi dan diferensiasi tidak sempurna dari keratinosit. Akibatnya, terbentuk akumulasi sel atau epidermal hyperplasia yang berujung pada pembentukan plaque. Selanjutnya, IL-17 akan menginduksi keratinosit untuk mensekresikan chemoattractants seperti CXCL1, CXCL3, CXCL5, CXCL6, CXCL8, CXCL10, dan CXCL20, yang mengundang datangnya berbagai sel imun, yaitu neutrofil dan makrofag yang juga akan mensekresikan IL-17A dan F.[5] IL-17A dan IL-17F memegang peran sentral dalam proses patogenesis psoriasis karena menyebabkan proliferasi dan diferensiasi tidak sempurna pada keratinosit. IL-19 dan IL-36 juga menginduksi terjadinya proliferasi keratinosit dibawah regulasi IL-17. Fungsi primer lain dari IL-17 adalah menjadi salah satu faktor perekrut leukosit seperti neutrofil dan makrofag. Hal ini dapat mengakibatkan terjadinya infiltrasi neutrofil pada epidermis yang disebut dengan Munro’s microabscessess. IL-17 tidak hanya dihasilkan oleh TH17, melainkan oleh berbagai sel lain seperti neutrofil, makrofag, dan natural killer cells.[6]
Keratinosit juga mensintesis Vascular Endothelial Growth Factor yang menyebabkan terjadinya angiogenesis serta menimbulkan warna kemerahan pada kulit.[6] Sensasi gatal pada kulit juga
muncul akibat adanya sekresi senyawa neuropeptides oleh epidermis, seperti substance P dan beta-endorphin yang juga memicu proses inflamasi.[7]
Perkembangan Terkini dari Terapi Psoriasis dan Masalah yang Dihadapi
Pemahaman akan pentingnya peranan sistem imun dalam patogenesis psoriasis mengubah paradigma penanganan pasien psoriasis. Terapi sistemik konvensional (acitretin, siklosporin, fumaric acid esters, dan methotrexate), molekul kecil (apremilast, tofacitinib, ponesimod), dan obat topikal yang menargetkan sistem imun secara non-spesifik menjadi pengobatan lini pertama bagi penderita psoriasis sedang dan berat.[3] Sayangnya, penggunaan terapi tersebut menunjukkan efektivitas yang kurang baik. Sebagai salah satu contoh, penurunan Psoriasis Area and Severity Index sebesar 75% (PASI 75) pada pengguna methotrexate hanya dicapai oleh 35,5-41% pasien.[8] Terapi sistemik dan molekul kecil juga memiliki banyak efek samping yang terus menumpuk pada penggunaan jangka panjang. Menurut sebuah studi prospektif di Swedia, 47,9% pasien tidak dapat melanjutkan terapi sistemik konvensional dalam kurun waktu 1 tahun.[9]
Dalam beberapa dekade terakhir, peneliti berhasil menemukan molekul biologis yang dapat memberikan harapan bagi penderita psoriasis sedang dan berat. Kemunculan molekul biologis seperti inhibitor TNF (etanercept, infliximab, adalimumab), inhibitor IL-12,23 (ustekibumab), dan inhibitor IL-17 (secukinumab dan ixekizumab) meningkatkan standar target terapi psoriasis menjadi PASI 75 hingga sekarang.[10,11] Meskipun molekul biologis terbukti jauh lebih unggul dan relatif lebih aman dibandingkan terapi sistemik konvensional, penggunaan tunggal dari molekul biologis masih mengalami kendala.[12-14] Beberapa studi menunjukkan bahwa hanya 22% dari pasien berhasil mencapai target terapi dengan molekul biologis yang diberikan selama satu tahun.[15,16] Penemuan tersebut juga didukung oleh penelitian oleh Bayaraa dkk. pada tahun 2019. Studi ini menunjukkan bahwa 126 dari 211 pasien tidak melanjutkan pengobatan dengan molekul biologis karena terbukti tidak efektif secara klinis.[17] Sebuah studi data registri di Swedia juga melaporkan bahwa efektivitas penggunaan molekul biologis pada praktik sehari-hari jauh lebih rendah dari laporan studi klinis. Studi ini juga menemukan bahwa PASI 75 dan PASI 90 hanya dicapai oleh 58% dan 36% dari keseluruhan total pasien psoriasis, baik pengguna terapi sistemik maupun molekul biologis.[9] Mengingat besarnya biaya terapi molekul biologis, efektivitas yang rendah menaruh beban besar pada pasien dan fasilitas layanan kesehatan. Menurut April dkk., biaya pengobatan tahunan untuk molekul biologis diestimasikan mencapai ($21,977) dibandingkan dengan terapi sistemik oral ($3413) di Amerika Serikat.[18] Sebuah inovasi dalam penanganan pasien psoriasis sedang dan berat sangat diperlukan untuk menjamin pengobatan yang efektif dan efisien.
Penelitian dalam beberapa tahun ini menggagaskan sebuah ide untuk menggabungkan berbagai molekul biologis atau yang dikenal dengan molekul bispesifik. Molekul bispesifik menjadi inovasi terapi baru yang menjanjikan oleh karena kemampuannya menarget dua jalur patogenesis
yang penting dalam patogenesis psoriasis sekaligus. Hal ini meningkatkan efektivitas terapi dengan mencegah rekurensi melalui jalur inflamasi lain. Alhasil, pemberian terapi dapat dilakukan dengan efisien sehingga dapat mengurangi beban pasien.
Kombinasi Anti-IL17A dan Antil-IL17F sebagai Molekul Bispesifik Terbaru
Belakangan, para peneliti berhasil menemukan kombinasi terbaru yang menggabungkan anti-IL-17A dan anti-IL-17F ke dalam sebuah molekul bispesifik. Molekul kombinasi ini diberi nama bimekizumab dan M1095/ALX-0761 (Gambar 1). Studi in vitro telah menunjukkan bahwa molekul bispesifik IL-17A/F lebih unggul dibandingkan molekul monospesifik anti Il-17A yang merupakan molekul biologis terefektif sekarang ini.[19-23] Penelitian yang dilakukan oleh Maroof dkk. dan Glatt dkk. menunjukkan bahwa bimekizumab mampu menurunkan kadar sitokin IL-6 hingga 28% lebih rendah (Gambar 2a) dan IL-8 hingga 57% lebih rendah (Gambar 2b) jika dibandingkan dengan penggunaan tunggal dari anti-IL17A.[19-22] Selain itu, penggunaan bimekizumab juga menurunkan jumlah monosit (Gambar 3a) dan neutrofil (Gambar 3b) yang menyebabkan kerusakan jaringan pasca inflamasi hingga 1,7 kali lipat lebih rendah.[19] Studi pre-klinik terhadap potensi M1095 untuk memperbaiki kondisi inflamasi juga menunjukkan hasil yang memuaskan, di mana M1095 terbukti mampu menurunkan kadar sitokin IL-15 (Gambar 4a), TNF-α[23] (Gambar 4b), dan IL-6 (Gambar 4c). Bukti-bukti tersebut memperlihatkan IL-17A dan IL-17F bekerja secara sinergis sehingga inhibisi kedua molekul tersebut secara bersamaan mampu memberikan efek inhibisi yang lebih kuat lagi. Efek sinergisme tersebut diduga berawal dari kemiripan IL-17F dan IL-17A, baik secara struktur maupun fungsi biologis. Walaupun efek pro-inflamasi dari IL-17A lebih dominan, akan tetapi IL-17F juga menjadi sitokin yang berperan penting dalam perkembangan penyakit psoriasis. Menurut beberapa studi in vitro yang dilakukan oleh Maroof dkk., IL-17F atau IL-17A bersama dengan TNF-α dapat menginduksi produksi mediator inflamasi, seperti IL-6 dan IL-8.[19-21] Selain itu, aktivasi dari IL-17F akan meningkatkan respon neutrofil terhadap stimulasi antigen dan menyebabkan terjadinya inflamasi jaringan setempat.[24] Data ini juga didukung oleh studi pre-klinik lainnya yang menunjukkan bahwa ekspresi IL-17F 32 kali lipat lebih tinggi dibandingkan IL-17A pada lesi kulit psoriasis.[22] Peneliti semakin yakin bahwa kombinasi bispesifik IL-17A/F adalah yang paling poten dibandingkan kombinasi-kombinasi yang pernah ada sebelumnya. Hal inilah yang mendorong para peneliti untuk meneruskan studi mengenai efek terapeutik bispesifik IL-17A/F ke tahap penelitian klinis.
Gambar 1. Struktur Molekul Bispesifik IL-17A/F (a) Bimekizumab (b) M1095/ALX-0761[27]
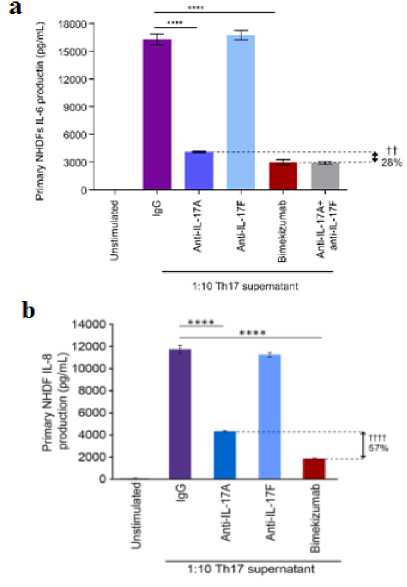
Gambar 2. Efek Bimekizumab terhadap Penurunan Kadar Sitokin (a) IL-6 dan (b) IL-8 yang Diproduksi oleh Fibroblas Dermal Manusia Normal yang Distimulasi oleh Supernatan Th17[28]
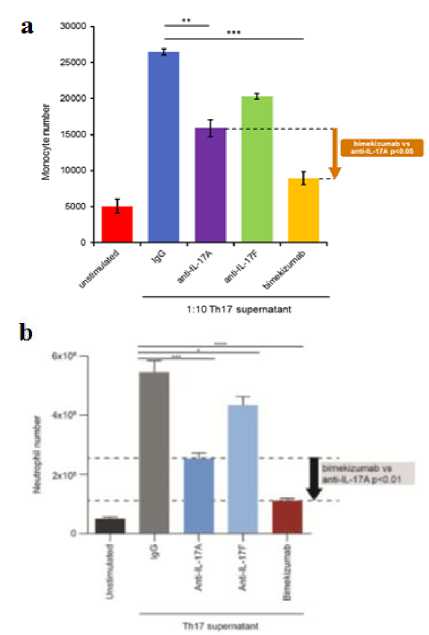
Gambar 3. Efek Bimekizumab terhadap Penurunan Jumlah (a) Monosit dan (b) Neutrofil[22]
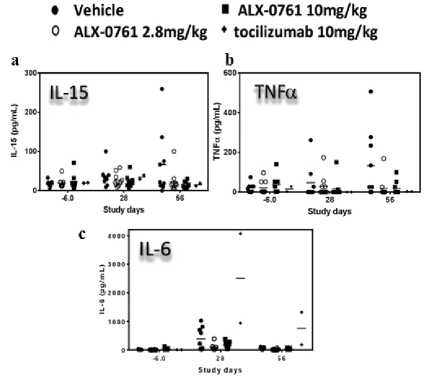
Gambar 4. Efek M1095/ALX-0761 terhadap Penurunan Kadar Sitokin (a) IL-15, (b) TNF-α, dan (c) IL-6[26]
Bispesifik IL-17A/F sebagai Terapi Terbaru bagi Penderita Psoriasis pada Berbagai Studi Klinis
Molekul antibodi/nanobodi bispesifik IL-17A/F (bimekizumab[22,25,26]/M1095[27]) telah melewati uji pre-klinik dan menunjukkan hasil yang sangat memuaskan. Berangkat dari fakta tersebut, beberapa peneliti dan masuk tahap uji klinis. Empat studi klinis yang berbeda berhasil menunjukkan efek terapeutik dari penggunaan bispesifik IL-17A/F untuk pasien psoriasis (Tabel 1). Perbedaan penurunan PASI yang signifikan juga ditemukan pada semua dosis intervensi bila dibandingkan dengan plasebo.
Studi klinis fase I yang dilakukan oleh Glatt dkk. pada tahun 2017 menggunakan sampel pasien yang didiagnosis psoriasis ringan-sedang. Pemberian bimekizumab 160 mg terbukti mampu menurunkan PASI hingga lebih dari 85% pada minggu ke-6. Pasien menunjukkan tanda-tanda hilangnya gejala klinis psoriasis dengan pemberian bimekizumab dengan dosis 480 mg dan 640 mg. Selain itu, efek klinis dari bimekizumab juga ditunjukkan melalui penurunan Lesion Severity Score (LSS) dan Physician’s Global Assessment (PGA). Pasien yang diberi terapi bimekizumab 160 mg menunjukkan penurunan LSS sebesar 80% dan PGA sebesar 75% pada minggu ke-6. Pemberian bimekizumab pada dosis 480 mg dan 640 mg akan menurunkan LSS dan PGA hingga mendekati 100%.[25] Studi fase Ib lanjutan dilakukan pula oleh Glatt dkk. pada tahun 2018. Semua pasien dengan psoriasis sedang-berat yang diberikan terapi bimekizumab pada dosis 160/80/80 mg, 240/160/160 mg, dan 560/320/320 mg mencapai PASI 75 pada minggu ke-8. Dalam jangka waktu yang sama, 86,7% dari ketiga kohort pasien tersebut berhasil mencapai PASI 100.[22]
Studi klinis fase IIb yang dilakukan oleh Papp dkk. pada tahun 2018 juga mendukung hal yang serupa. Sebanyak 61,4% dari pasien yang diberikan bimekizumab dengan dosis 64 mg sudah berhasil mencapai PASI 75 pada minggu ke-12. Apabila dosis tersebut ditingkatkan menjadi 160 mg, 320 mg, dan 480 mg, PASI 75 berhasil dicapai oleh lebih dari 80% pasien. Selanjutnya, lebih dari 70-80% pasien yang diberikan bimekizumab 160 mg (dengan loading dose 320 mg), 320 mg, atau 480 mg berhasil mencapai PASI 90 pada minggu ke-12. Meskipun demikian, PASI 100 baru berhasil diraih oleh 55-60% pasien yang diterapi bimekizumab dengan dosis 160 mg (dengan loading dose 320 mg) ataupun 320 mg. Ketika dilakukan penilaian dengan Investigator’s Global Assessment (IGA), 86% dari pasien yang diberikan bimekizumab 320 mg berhasil mendapat skor 0-1, yang artinya lesi kulit psoriasis hampir atau sudah sepenuhnya hilang.[26]
Studi klinis fase I mengenai efek terapeutik dari M1095 pada pasien psoriasis sedang-berat dilakukan oleh Svecova dkk. pada tahun 2019 silam. Hingga minggu ke-12, pemberian M1095 pada dosis rendah (30 mg) sudah mampu menurunkan PASI hingga 75%. PASI 90 berhasil dicapai oleh 100% pasien yang diterapi dengan M1095 240 mg dalam waktu 12 minggu setelah pengobatan. Sementara itu, sebanyak 50-55% pasien yang diberikan M1095 120 mg atau 240 mg berhasil mencapai PASI 100 pada minggu ke-12. 100% pasien dengan lesi kulit skala sedang ke berat menunjukkan perbaikan klinis yang sangat signifikan. Lesi kulit pasien psoriasis terbukti hampir atau sepenuhnya hilang melalui terapi M1095 120 mg pada minggu ke-7 dan 240 mg pada minggu ke-12.[27]
Penurunan PASI pada studi ini juga didukung oleh studi biopsi kulit pasien yang diberikan terapi bispesifik IL-17A/F. Biopsi menunjukkan adanya penurunan ketebalan epidermal dan jumlah T cell CD3+ epidermal. Pasien yang diterapi dengan bispesifik IL-17A/F (60-240 mg) menunjukkan penurunan ketebalan epidermal hingga ~2 kali lipat (Gambar 5a) dan jumlah T cell CD3+ hingga 4-5 kali lipat lebih rendah (Gambar 5b) pada hari ke-43. Hal ini mendukung hipotesis bahwa penggunaan bispesifik IL-17A/F bekerja tepat pada patogenesis
inflamasi psoriasis. Penemuan ini juga memperlihatkan kemampuan terapi bispesifik IL-17A/F untuk mengubah kondisi kulit yang patologis kembali mendekati kondisi kulit normal pada umumnya.[27]
Bimekizumab menunjukkan efek terapeutik terbaik jika diberikan pada dosis 160 mg (dengan loading dose 320 mg) atau 320 mg setiap 4 minggu (minggu ke-0, 4, 8). M1095 memperlihatkan hasil klinis yang sangat memuaskan jika diberikan pada dosis 120-240 mg setiap 2 minggu (hari ke-1, 15, 29). Pada dosis dan intervensi tersebut, kedua bispesifik ini memperlihatkan efektivitas yang sangat tinggi. Bimekizumab menunjukkan penurunan PASI 75 dan PASI 90 pada 81,4-100% dan 67-79% pasien psoriasis sedang dan berat pad studi fase I dan II. Di sisi lain, M1095 juga menunjukan penurunan yang sama pada 87,5-100% (PASI 75 dan PASI 90) pasien psoriasis sedang dan berat pad studi fase I.
Selain menunjukkan efektivitas yang unggul, pemberian bispesifik IL-17A/F hanya menimbulkan efek samping skala ringan pada sebagian kecil pasien semua studi. Menurut studi yang dilakukan oleh Glatt dkk., efek samping yang timbul pasca terapi bimekizumab antara lain sakit kepala (7/38), pusing (2/38), nyeri orofaring (2/38), nasofaringitis (7/38), konjungtivitis (3/38), otitis media (2/38), neutropenia (5/38), anemia (2/38), diare (3/38), nyeri abdomen (3/38), diare (3/38), atau mual (2/38).[25] Studi lainnya yang dilakukan oleh Papp dkk. juga tidak menunjukkan adanya efek samping terapi bimekizumab yang berbahaya. Adapun efek samping yang muncul, antara lain nasofaringitis (21/208), infeksi saluran napas (5/208), arthralgia (7/208), hipertensi (4/208), neutropenia (5/208), leukopenia (3/208), rhinitis (4/208), tonsilitis (4/208), kandidiasis oral (4/208), sakit kepala (3/208), dan muntah (2/208).[29] Studi yang dilakukan oleh Svecova dkk. juga menunjukkan hasil yang serupa. Efek samping yang ditimbulkan karena terapi M1095 di antaranya pruritus (4/33), sakit kepala (3/33), hipertensi (2/33), nasofaringitis (2/33), somnolen (2/33), bronkitis (2/33), dan arthralgia (1/33).[27] Pemberian bimekizumab juga memunculkan reaksi imunogenisitas yang rendah.[22, 25-27] Imunogenitas yang tinggi memicu timbulnya antibodi-obat yang dapat mengurangi efektivitas obat dan berpotensi menimbulkan efek samping.
SIMPULAN
Antibodi/nanobodi bispesifik IL-17A/F, bimekizumab dan M1095 adalah terapi yang efektif bagi penderita psoriasis. Pada semua studi klinis fase I dan II, molekul bispesifik ini memperlihatkan penurunan PASI 75 dan PASI 90 pada sejumlah pasien psoriasis yang signifikan dalam kurun waktu yang singkat. Efektivitas penurunan PASI ini juga tidak disertai dengan efek samping yang sedang dan besar.
Hasil studi klinis penggunaan antibodi/nanobodi bispesifik IL-17A/F memberikan harapan besar sebagai alternatif terapi pada pasien yang tidak merespon baik terhadap molekul biologis. Meskipun studi preklinik telah menunjukan keunggulan efektivitas bispesifik IL-17A/F dibanding IL17A, penelitian fase lanjut perlu dilakukan untuk membandingkan secara langsung kedua terapi tersebut pada populasi yang lebih besar.
DAFTAR PUSTAKA
-
1. NCDs | Psoriasis. World Health Organization; 2018. [Diakses 2019 Jun 9]. Dari: https://www.who.int/ncds/management/psoriasi s/en/
-
2. Oliveira Mde F, Rocha Bde O, Duarte GV. Psoriasis: classical and emerging
comorbidities. An Bras Dermatol. 2015;90(1):9– 20. doi:10.1590/abd1806-4841.20153038
-
3. Rønholt K, Iversen L. Old and new biological therapies for psoriasis. Int J Mol Sci. 2017;18(11):2297.
-
4. Global report on psoriasis. World Health Organization. [Diakses 2019 Jun 9]. Dari: http://www.who.int/iris/handle/10665/204417
-
5. Owczarczyk-Saczonek A, Placek W.
Interleukin-17 as a factor linking the pathogenesis of psoriasis with metabolic disorders. Int J Dermatol. 2017;56(3):260-268.
-
6. Hawkes JE, Chan TC, Krueger JG. Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol. 2017;140(3):645–653.
-
7. Szepietowski JC, Reich A. Pruritus in psoriasis: An update. Eur J Pain. 2016;20(1):41-6.
-
8. Warren RB, Mrowietz U, Kiedrowski RV, Niesmann J, Wilsmann-Theis D, Ghoreschi K, et al. An intensified dosing schedule of subcutaneous methotrexate in patients with moderate to severe plaque-type psoriasis (METOP): a 52 week, multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet. 2017;389(10068):528–37.
-
9. Maul J-T, Djamei V, Kolios AG, Meier B, Czernielewski J, Jungo P, et al. Efficacy and survival of systemic psoriasis treatments: an analysis of the swiss registry SDNTT.
Dermatology. 2016;232(6):640–7.
-
10. Manalo IF, Gilbert KE, Wu JJ. Time to Raise the Bar to Psoriasis Area Severity Index 90 and 100. J Drugs Dermatol. 2015;14(10):1086-8.
-
11. Cui L, Chen R, Subedi S, Yu Q, Gong Y, Chen Z, et al. Efficacy and safety of biologics targeting IL-17 and IL-23 in the treatment of moderate-to-severe plaque psoriasis: A
systematic review and meta-analysis of randomized controlled trials. International Immunopharmacology. 2018;62:46–58.
-
12. Bilal J, Berlinberg A, Bhattacharjee S, Trost J, Riaz IB, Kurtzman DJB. A systematic review and meta-analysis of the efficacy and safety of the interleukin (IL)-12/23 and IL-17 inhibitors ustekinumab, secukinumab, ixekizumab, brodalumab, guselkumab and tildrakizumab for the treatment of moderate to severe plaque psoriasis. Journal of Dermatological Treatment. 2018;29(6):569–78.
-
13. Jabbar-Lopez ZK, Yiu ZZN, Ward V, et al. Quantitative evaluation of biologic therapy
options for psoriasis: a systematic review and network meta-analysis. J Invest Dermatol.
2017;137(8):1646–1654.
doi:10.1016/j.jid.2017.04.009
-
14. Sbidian E, Chaimani A, Garcia-Doval I, et al. Systemic pharmacological treatments for chronic plaque psoriasis: a network metaanalysis. Cochrane Database Syst Rev. 2017;12(12):CD011535.
-
15. Vide J, Magina S. Moderate to severe psoriasis
treatment challenges through the era of biological drugs. An Bras Dermatol. 2017;92(5):668-674.
-
16. Svedbom A, Dalen J, Mamolo C, Cappelleri JC, Petersson IF, Stahle M. Treatment patterns with topicals, traditional systemics and biologics in psoriasis – a Swedish database analysis. JEADV. 2015;29(2):215-223.
-
17. Bayaraa B, Imafuku S. Sustainability and switching of biologics for psoriasis and psoriatic arthritis at Fukuoka University Psoriasis Registry. J Dermatol. 2019;46(5):389-398.
-
18. Armstrong AW, Foster SA, Comer BS, Lin CY, Malatestinic W, Burge R, et al. Real-world health outcomes in adults with moderate-to-severe psoriasis in the United States: a population study using electronic health records to examine patient-perceived treatment
effectiveness, medication use, and healthcare resource utilization. BMC Dermatol.
2018;18(1):4.
-
19. Maroof A, Okoye R, Smallie T, Baeten D,
Archer S, Simpson C, et al. Bimekizumab dual inhibition of IL-17A and IL-17F provides
evidence of IL-17F contribution to chronic inflammation in disease-relevant cells. Arthritis Rheumatol. 2017; 69 (suppl 10).
-
20. Maroof A, Smallie T, Archer S, Simpson CL, Griffiths M, et al. Dual IL-17A and IL-17F inhibition with bimekizumab provides evidence for IL-17F contribution to immune-mediated inflammatory skin response. J Invest Dermatol. 2017;137:S120.
-
21. Maroof A, Baeten D, Archer S, Griffiths M, Shaw S. IL-17F contributes to human chronic inflammation in synovial tissue: preclinical evidence with dual IL-17A and IL-17F inhibition with bimekizumab in psoriatic arthritis. Ann Rheum Dis. 2017;76:A13-A.
-
22. Glatt S, Baeten D, Baker T, et al. Dual IL-17A and IL-17F neutralisation by bimekizumab in psoriatic arthritis: evidence from preclinical
experiments and a randomised placebo-
controlled clinical trial that IL-17F contributes to human chronic tissue inflammation. Ann Rheum Dis. 2018;77:523–532.
-
23. Vanheusden K, Detalle L, Hemeryck A, et al. Pre-clinical proof-of-concept of ALX-0761, a
nanobody neutralising both IL-17A and IL-17F in a cynomolgus monkey collagen induced arthritis model. Poster n. 1287, presented at the Annual Meeting of the American College of Rheumatology (ACR); 2013 Oct 26–30; San Diego, CA.
-
24. Natsis NE, Gottlieb AB. Bimekizumab for the treatment of psoriatic disease. Expert Opinion on Biological Therapy. 2018;18(12):1193-1197.
-
25. Glatt S, Helmer E, Haier B, et al. First-in-human randomized study of bimekizumab, a humanized monoclonal antibody and selective dual inhibitor of IL-17A and IL-17F, in mild psoriasis. Br J Clin Pharmacol. 2017;83:991– 1001.
-
26. Papp KA, Merola JF, Gottlieb AB, et al. Dual neutralization of both interleukin 17A and interleukin 17F with bimekizumab in patients with psoriasis: results from BE ABLE 1, a 12-week randomized, double-blinded, placebo-controlled phase 2b trial. J Am Acad Dermatol. 2018;79:277–286.e10.
-
27. Svecova D, Lubell MW, Casset-Semanaz F, Mackenzie H, Grenningloh R, Krueger JG. A randomized, double-blind, placebo-controlled phase 1 study of multiple ascending doses of subcutaneous M1095, an anti-interleukin-17A/F Nanobody, in moderate-to severe psoriasis. J Am Acad Dermatol. 2019;S0190-
9622(19):30500–6.
Lampiran 1. Tabel Karakteristik Studi
|
Penulis & Tahun Publikasi |
Desain Studi |
Lokasi |
Karakteristik Pasien |
Bispesifik IL-17A/F |
Intervensi (n) |
Hasil Penelitian | |||
|
Efektivitas |
Efek Samping | ||||||||
|
PASI 75 (% pasien) |
PASI 90 (% pasien) |
PASI 100 (% pasien) | |||||||
|
Glatt et al (2017)* |
Randomized, double-blinded, placebo-controlled, single-dose, dose-escalating, phase I study |
Inggris |
Usia: 21,4–65,0 (mean: 39,53) Gender: Laki-laki (n=30), perempuan (n=9) Ras: Asia (n=1), Kaukasoid (n=37), Lainnya (n=1) PASI baseline: 2,60 3,75 (ringan-sedang) Jumlah Sampel: 39 |
Bimekizuma b |
Plasebo (13) |
↓ PASI ~13% |
Sakit kepala (6/26), nyeri orofaring (5/26), nasofaringitis (4/26) | ||
|
8 mg (4) |
↓ PASI ~13 % | ||||||||
|
40 mg (4) |
↓ PASI ~38% | ||||||||
|
160 mg (6) |
↓ PASI >85% | ||||||||
|
480 mg (6) |
↓ PASI ≥94% | ||||||||
|
640 mg (6) |
↓ PASI ≥94% | ||||||||
|
Glatt et al (2018)** |
Randomized, double-blinded, placebo-controlled, multicenter, phase Ib study |
Republik Moldova, Inggris, Bulgaria |
Usia Rata-rata: 43,7 Gender: Laki-laki (n=26), Perempuan (n=26) PASI baseline: 15,9 (sedang-berat) Jumlah Sampel: 50 |
Bimekizuma b |
Plasebo (12) |
0 |
ND |
0 |
Sakit kepala (7/38), pusing (2/38), nyeri orofaring (2/38), nasofaringitis (7/38), konjungtivitis (3/38), otitis media (2/38), neutropenia (5/38), anemia (2/38), diare (3/38), nyeri abdomen (3/38), diare (3/38), mual (2/38) |
|
80 mg/40 mg/40 mg (6) 160 mg/80 mg/80 mg (6) 240 mg/160 mg/160 mg (20) 560 mg/320 mg/320 mg (6) |
100 |
ND |
87 | ||||||
|
Papp et al (2018)*** |
Randomized, double-blinded, placebo-controlled, parallel group, dose- |
Kanada, Republik Ceko, Hungaria , Jepang, Polandia, |
Usia Rata-rata: 44,3 Gender: Laki-laki (n=163), Perempuan (n=87) |
Bimekizuma b |
Plasebo (42) |
4,8 |
0 |
0 |
Nasofaringitis (21/208), infeksi saluran napas (5/208), arthralgia (7/208), hipertensi (4/208), neutropenia (5/208), leukopenia (3/208), rhinitis |
|
64 mg (39) |
61,5 |
46,2 |
28,2 | ||||||
|
160 mg (43) |
81,4 |
67,4 |
27,9 | ||||||
|
160 mg, 320 mg (40) |
85,0 |
75,0 |
60,0 | ||||||
|
320 mg (43) |
93,0 |
79,1 |
55,8 | ||||||
|
480 mg (43) |
83,7 |
72,1 |
48,8 | ||||||
38
https://ojs.unud.ac.id/index.php/essential/index
|
ranging, phase IIb study |
Amerika Serikat |
Ras: Kulit putih (n=223), Lainnya (n=17) PASI baseline: 19,1 (sedang-berat) IGA baseline: 3/moderate (n=191), 4/severe (n=59) Jumlah Sampel: 250 |
(4/208), tonsilitis (4/208), kandidiasis oral (4/208), sakit kepala (3/208), muntah (2/208) | ||||||
|
Svecova et al (2019)**** |
Randomized, double-blinded, placebo-controlled, multicenter, phase I study |
Slovakia, Republik Ceko, Hungaria , Polandia |
Usia: 21-69 (mean: 45,1) Gender: Laki-laki (n=35), Perempuan (n=6) Ras: Kulit putih (n=41) PASI baseline: 12,0– 42,0 (mean: 19,56) (sedang-berat) PGA baseline: 3/moderate (n=21), 4/severe (n=12) Jumlah Sampel: 41 |
M1095/ALX-0761 |
Plasebo (n=8) |
0 |
0 |
0 |
Pruritus (4/33), sakit kepala (3/33), hipertensi (2/33), nasofaringitis (2/33), somnolen (2/33), bronkitis (2/33), dan arthralgia (1/33). |
|
M1095 30 mg (n=8) |
87,5 |
50 |
12,5 | ||||||
|
M1095 60 mg (n=8) |
87,5 |
87,5 |
25 | ||||||
|
M1095 120 mg (n=8) |
100 |
87,5 |
50 | ||||||
|
M1095 240 mg (n=9) |
100 |
100 |
55,6 | ||||||
Catatan:
* PASI pada minggu ke-6. Metode Pemberian: infusi intravena sekali. Durasi: ±6 bulan (skrining selama ≤19 hari, penilaian awal sebelum terapi selama 2 hari, follow-up selama 20 minggu)
** PASI pada minggu ke-8. Metode Pemberian: infusi intravena setiap 3 minggu (minggu ke-0, 3, dan 6). Follow-up: 20 minggu
*** PASI pada minggu ke-12. Metode Pemberian: injeksi subkutan setiap 4 minggu (baseline, minggu ke-4, minggu ke-8). Durasi: ±8 bulan (terapi selama 12 minggu, follow-up selama 20 minggu)
**** PASI pada hari ke-85. Metode Pemberian: injeksi subkutan pada dinding abdomen setiap 2 minggu (hari ke-1, 15, dan 29). Durasi: >15 minggu (skrining selama 3 minggu, terapi selama 6 minggu, follow-up selama 6 minggu)
Singkatan:
IGA, Investigator’s Global Assessment ; LD, loading dose; PASI, Psoriasis Area and Severity Index; PASI 75, ≥75% penurunan PASI dari baseline; PASI 90, ≥90% penurunan PASI dari baseline; PASI 100, 100% penurunan PASI dari baseline; PGA, Physician’s Global Assessment; ND, not determine
Lampiran 2. Diagram Alur Preferred Reporting Items for Systematic Reviews and Meta-analyses (PRISMA)
Lampiran 3. Kualitas Studi yang Dimasukkan dalam Telaah Sistematis

40
Discussion and feedback