POTENSI KOEKSPRESI CHIMERIC ANTIGEN RECEPTOR (CAR) DAN GEN FOXP3 PADA SEL T REGULATORS SEBAGAI MODALITAS TERAPI PENATALAKSANAAN AUTOIMUN
on

TINJAUAN PUSTAKA
POTENSI KOEKSPRESI CHIMERIC ANTIGEN RECEPTOR (CAR) DAN GEN FOXP3 PADA SEL T REGULATORS SEBAGAI MODALITAS TERAPI PENATALAKSANAAN AUTOIMUN
Yulia Cahya Khasanah,1
1Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Lampung, Lampung
ABSTRAK
Pendahuluan: Penyakit autoimun merupakan respon imun yang mengakibatkan kerusakan pada jaringan tubuh sendiri serta mengganggu fungsi fisiologis tubuh. Prevalensi penyakit autoimun terus meningkat secara global sejak perang dunia II. Di Amerika Serikat, autoimun merupakan penyebab kematian utama dan lebih sering ditemukan pada wanita. Terapi autoimun konvensional dengan medikamentosa dapat mensupresi sebagian besar sistem imun dan menyebabkan pasien lebih rentan terhadap infeksi oportunistik dan kanker. Berdasarkan fakta tersebut, perlu dilakukan inovasi terapi yang spesifik terhadap sel imun patologis. Terapi molekular dengan memanfaatkan rekayasa Tregs yang stabil dan target-specific berpotensi sebagai modalitas mutakhir terapi autoimun.
Pembahasan: Autoimun terjadi saat respon imun adaptif menyerang self-antigen. Mekanisme autoimun selanjutnya diikuti dengan aktivasi sejumlah besar sel T. Seluruh sel T teraktivasi dikontrol oleh sel T regulators atau Tregs. Tregs memiliki kelemahan yaitu selektifitas dan stabilitas yang rendah. Untuk itu diperlukan rekayasa Treg dengan koekspresi reseptor selektif dan Treg stabilizer. Reseptor selektif yang dapat dimodifikasi dengan sel T adalah Chimeric Antigen Receptor (CAR). CAR diketahui dapat secara selektif menghambat respon imun patologis dan menghentikan inflamasi. CAR dikombinasikan dengan Treg stabilizer yang memberi efek amplifikasi dan stabilisasi yaitu Forkhead box P3 (FoxP3). FoxP3 adalah protein inti yang berfungsi sebagai regulator utama dari perkembangan dan fungsi supresif Tregs dalam mempertahankan self-tolerance.
Simpulan: CAR/FoxP3-Engineered Tregs adalah hasil rekayasa sel Tregs menjadi sel perifer matang. CAR/FoxP3-Engineered Tregs mengkespresikan FoxP3 dan mempunyai afinitas kuat pada self-antigen melalui reseptor CAR. Aplikasi CAR/FoxP3-Engineered Tregs meningkatkan selektifitas dan kestabilan sel Treg dalam mensupresi autoimun.
Kata kunci: Autoimun, CAR, FoxP3, Treg
ABSTRACT
Introduction: Autoimmune disease is immune response that damages self-tissues and disrupts physiological functions of the body. The prevalence of autoimmune diseases has continued to increase globally since World War II. In US, this disease is the leading cause of death and commonly seen in women. Conventional autoimmune medicine suppresses most of immune system and causes patients to be more susceptible to opportunistic infections and cancer. Based on these facts, therapeutic innovations that are specific to pathological immune cells are needed. Molecular therapy using stable, target-specific Tregs engineered is potential as the latest modality for autoimmune therapy.
Discussion: Autoimmune occurs when adaptive immune response attacks self-antigens. The autoimmune mechanism is then followed by activation of a large number of T cells. All activated T cells are controlled by T regulators or Tregs. Tregs have weaknesses which are low selectivity and stability. For this reason, Treg engineering with selective receptor expression and Treg stabilizer is needed. The selective receptors that can be modified with T cells are Chimeric Antigen Receptor (CAR). CAR is known to selectively inhibits pathological immune responses and stops inflammation. CAR is combined with Treg stabilizer which gives the effect of amplification and stabilization, that is Forkhead box P3 (FoxP3). FoxP3 is core protein that functions as the main regulator of Tregs development and self-tolerance.
Conclusion:CAR/FoxP3-Engineered Tregs express FoxP3 that have strong affinity for self-antigens through CAR receptors. The application of CAR/FoxP3-Engineered Tregs increases the selectivity and stability of Treg cells to supress autoimmune.
Keywords: Autoimmune, CAR, FoxP3, Treg
PENDAHULUAN
Penyakit autoimun adalah respon imun yang mengakibatkan kerusakan pada jaringan tubuh sendiri serta mengganggu fungsi fisiologis tubuh.[1] Penyakit autoimun dapat menyerang bagian tubuh manapun dengan tanda klasik autoimun berupa inflamasi.[2] Autoimun dikategorikan sebagai penyakit yang terus meningkat secara global sejak akhir perang dunia II. Pandemi autoimun mencakup 80 penyakit yang mengalami peningkatan baik insidensi dan prevalensinya. Penyakit ini lebih sering ditemukan pada wanita dan merupakan penyebab kematian 10
terbanyak pada anak perempuan dan wanita pada semua usia di Amerika Serikat.[3]
Penderita penyakit autoimun umumnya datang ke pelayanan kesehatan setelah antigen menyebar dan proses autoimun sudah berjalan, sehingga memberikan efek yang buruk pada individu tersebut dan menyulitkan pemberian intervensi.[4] Saat ini sebagian besar terapi yang diberikan bersifat simptomatik.[5] Terapi pada penyakit autoimun bertujuan untuk menghambat respon imun dengan menghilangkan sel imun didapat yang spesifik atau menghambat aktivasi sel imun pada organ target. Akan tetapi strategi ini hanya sedikit membantu

dalam mengatasi respon imun proinflamasi terhadap protein endogen maupun jaringan.[6] Ditambah lagi, pengobatan konvensional dengan prednisone dan rituximab dapat mensupresi sebagian besar sistem imun. Penekanan imun tersebut menyebabkan pasien lebih rentan terhadap infeksi oportunistik dan kanker.[7]
Pengaturan kerja sistem imun terutama yang berperan dalam proses autoimun adalah sel T regulators atau Tregs. Penelitian terkini menunjukkan bahwa Sel T CD4 dapat dimodifikasi dengan penggunaan sistem vektor virus untuk mengekspresikan suatu chimeric antigen receptor (CAR) yang menargetkan suatu jaringan tertentu in trans dengan gen FoxP3 yang memicu diferensiasi Tregs.[8] CAR/FoxP3-Engineered Tregs mengkespresikan FoxP3 dan mempunyai afinitas kuat pada self-antigen melalui reseptor CAR, sehingga memiliki kesamaan dengan natural Tregs. Penelitian tersebut memungkinkan dibuatnya terapi autoimun yang bersifat selektif dan stabil sehingga dapat dimanfaatkan sebagai tata laksana autoimun secara efektif dan mengurangi efek samping terapi konvensional.[9,10]
Metode studi pustaka didapatkan dari hasil studi terhadap berbagai literatur yang telah teruji validitasnya, berhubungan satu sama lain, relevan
dengan kajian tulisan serta mendukung uraian atau analisis pembahasan. Tujuan penulisan tinjauan pustaka ini adalah untuk mengetahui potensi dari sel T regulator dengan koekspresi chimeric antigen receptor dan gen FoxP3 (CAR/FoxP3-Engineered Tregs) sebagai modalitas terapi penyakit autoimun.
PEMBAHASAN
Autoimun
Penyakit autoimun merupakan respon imun yang mengakibatkan kerusakan pada jaringan tubuh sendiri serta mengganggu fungsi fisiologis tubuh. Penyakit autoimun dipengaruhi oleh beberapa faktor diantaranya adalah faktor genetik, infeksi, lingkungan, hormonal, daerah/suku, diet dan toksik/obat.[2,4] Patogenesis autoimun terdiri atas gangguan aktivitas selular dan protein regulator.[11,12] Gangguan aktivitas selular dapat terjadi apabila tubuh gagal mempertahankan toleransi akan self-antigen dan terjadi aktivasi autoreaktif sel imun terhadap self-antigen tersebut. Mekanisme kegagalan toleransi tersebut diperankan oleh sel T perifer dalam berbagai proses (Dapat dilihat pada Tabel 1).[12]
Tabel 1. Mekanisme toleransi sel T perifer.[12]
|
Toleransi sel T perifer |
Kegagalan toleransi |
|
Ketidaktahuan imun |
MHC kelas II
autoantigen/MHC kelas II
|
|
Anergy |
molekul costimulatory |
|
Sel T regulator |
Melepaskan mediator inflamasi |
|
Apoptosis |
|
Selain itu, gangguan aktivitas protein regulator dijelaskan dalam hubungan antara Gen non-HLA yaitu limfosit T sitotoksik dengan antigen-4 (CTLA4), protein tirosin fosfat nonreseptor tipe 22 (PTPN22), lokasi
rentan autoimun (PDCD1, FCRL3, SUMO4, CD25, PADI4 dan SLC22A4), TNF-a dan FOXP3. Interaksi gen non-HLA dengan protein tersebut akan mengubah aktivitas regulator dan menyebabkan kekacauan atau defek pada protein terkait. Keadaan tersebut menjadi target utama dari respon autoimun.[12]
Regulatory T cells
Pembagian sel T berdasarkan status fungsional dibagi menjadi sel T naif, efektor, dan memori. Sementara berdasarkan molekul permukaan co-reseptor utamanya, sel T dibagi menjadi sel T CD4+ dan CD8+. Dalam keadaan teraktivasi, profil sitokin yang dihasilkan oleh sel T CD4+ mengkategorikan CD4+ menjadi sel T helper conventional (Tcon) dan T regulators (Tregs).[13] Sel Tcon adalah sel T yang dihasilkan timus beredar dalam plasma darah dan limfe tanpa kemampuan proliferasi, sedangkan Tregs dapat menekan respon Tcon dalam proliferasi berlebihan yang berpotensi membahayakan tubuh.[14]
T cell regulators atau Tregs didefinisikan sebagai sel T yang berpotensi besar dalam menekan aktivitas kerusakan dari sel T efektor, pengatur homeostasis imun, dan mencegah terjadinya respon imun terhadap
self-antigen.[15,16] Defisiensi dari sel Tregs berkaitan erat dengan penyakit autoimun seperti diabetes melitus tipe 1 (IDDM), lupus eritematosus sistemik (SLE), sindrom Sjogren, sindrom Chrug-Strauss, tiroiditis Hashimoto, penyakit Graves, purpura trombositopenik idiopatik, rheumatoid arthritis (RA) dan alergi.[17]
Mekanisme kerja dari sel T regulator merupakan proses yang kompleks dan berbeda tergantung pada letak reaksi imun, tipe aktivasi dari target supresi, dan status aktivasi Tregs. Dalam tingkat molekular, mekanisme supresi oleh Tregs dibagi menjadi supresi sel T konvensional (Tcon), T cell receptor (TCR)-induced calcium, NFAT, dan NF-κB.[18] Mekanisme kerja Tregs yang pertama yaitu pengeluaran CTLA4 bertarget antigen presenting cell (APC). CTLA4 akan menurunkan CD80 dan CD86 APC sehingga menurunkan kemampuan aktivasi Tcon.[19]
Proses supresi cepat oleh Tregs menekan TCR-induced calcium, sinyal NFAT, dan NF-κB yang bertujuan untuk menekan aktivasi Tcon baik jangka pendek maupun panjang. Mekanisme lain yaitu pengeluaran sitokin yang secara langsung bersifat imunosupresif yaitu IL-10, IL-35, dan TGF-β. Selain itu, Tregs dapat mengaktivasi granzyme sebuah protease serin dan mengonsumsi IL-2 yang sinergis dalam menginduksi apoptosis sel efektor. (Dapat dilihat pada Gambar 1).[18]
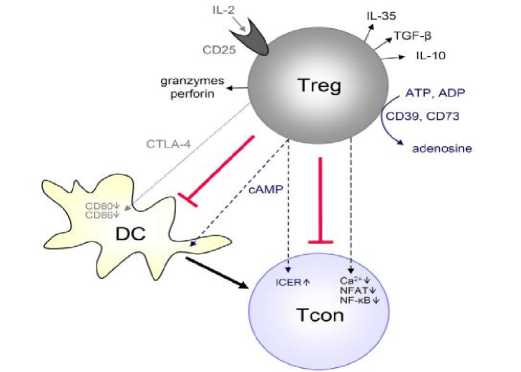
Gambar 1. Mekanisme kerja sel T regulator dalam menekan sel T konvensional.[18]
(Treg dapat menghasilkan adenosin imunosupresif atau mentransfer cAMP ke Tcons. Tregs dengan cepat menekan TCR-induced Ca2 +, NFAT, dan NF-κB signaling. Tregs juga dapat menghasilkan sitokin imunosupresif (IL-10, TGF-β, IL-35), menekan konsumsi IL-2 atau menyebabkan kematian sel efektor melalui granzyme dan perforin. Selanjutnya, Tregs dapat menekan Tcons secara tidak langsung dengan menurunkan regulasi molekul-molekul kostimulatoris pada APC (seperti DC) melalui CTLA-4)
FoxP3
Secara fisiologis, keberadaan Foxp3 mutlak diperlukan agar manusia dapat hidup normal.[20] Pada manusia, Foxp3 dapat diinduksi oleh aktivasi TCR sehingga Tregs dapat diperoleh secara in vivo dan in vitro.[21]
Forkhead box P3 (Foxp3) yaitu core protein sebagai penanda terpenting yang diekspresikan secara selektif oleh sel Tregs. FoxP3 digunakan sebagai marker spesifik yang membedakan sel T regulators dan T conventional. Sementara itu, terdapat penanda lain seperti CD25 dan GITR yang tidak hanya diekspresikan oleh sel T regulator tetapi seluruh sel yang teraktivasi.[22] Struktur FoxP3 yang berhasil diamati
berbentuk winged-helix dengan empat domain fungsional protein yang ikatannya berbeda-beda.[23]
Peran FoxP3 dalam sel Tregs adalah memberi efek amplifikasi dan stabilisasi prekursor Tregs, memelihara fungsi supresif Tregs dalam mempertahankan self-tolerance, dan menangkal efek kerusakan.[21,24] FoxP3 menstabilkan Tregs dengan modifikasi permukaan sel dan molekul pembawa sinyal. Selain itu, ikatan FoxP3 dengan RORγ dapat menghambat transkripsi IL-17 sebagai sitokin inflamasi yang memicu kerusakan. Keberadaan FoxP3 dapat mempertahankan stabilitas, plastisitas, dan daya supresi Tregs dalam berbagai lingkungan inflamasi. Terdapat banyak mekanisme lain yang menjelaskan bagaimana FoxP3 menstabilkan Tregs agar tidak berubah menjadi T efektor dalam biologi molekular.[20]

Penelitian sebelumnya membuktikan bahwa penghapusan gen Foxp3 pada mencit menyebabkan mencit kehilangan sel Tregs. Mutasi pada gen Foxp3 mengakibatkan adanya lesi inflamatorik terkait imun sistemik yang sangat agresif dan fatal. Defek lain pada gen Foxp3 mengakibatkan immunodeficiency, polyendocrinopathy, enteropathy, X-linked syndrome (IPEX).25 Analisis terhadap pasien IPEX menunjukkan hilangnya Foxp3 berdampak pada cacatnya sel Tregs dan hilangnya fungsi Tregs sebagai supresi sel efektor. Akibat hilangnya fungsi supresi Tregs, terjadilah induksi proses autoimun. Mencit yang mengalami autoimun dapat diselamatkan dengan mentransfer sel Tregs CD4+CD25+Foxp3+.[25]
Chimeric Antigen Receptor (CAR)
CAR merupakan reseptor rekombinan yang menyediakan fungsi antigen-binding dan aktivasi Sel T. Target CAR tipikal adalah antigen permukaan sel native. Sel T dengan CAR dapat mengenali dan mematikan sel tumor dengan bebas dari major histiocompatibility complex (MHC), sehingga pengenalan sel target tidak dipengaruhi oleh beberapa mekanisme di mana sel tumor menghindari pengenal sel T yang terikat dengan MHC seperti mekanisme Human Leukocyte Antigen (HLA) kelas I.[26]
Struktur dari CAR pada mulanya terdiri dari bagian variabel (antigen-binding) dari antibodi monoklonal dan bagian konstan dari T-Cell Receptor (TCR) alpha dan beta. Desain CAR dimodifikasi untuk menggunakan suatu ektodomain, dari sebuah single chain variable fragment (scFV) yaitu bagian antigen-binding dari rantai ringan dan berat suatu antibodi monoklonal, suatu domain engsel, suatu domain transmembran, dan suatu endodomain dengan signaling domain yang diperoleh dari CD3-Zeta. [26]
CAR-T Cell mempunyai kemampuan untuk menekan reaksi imun yang tidak diinginkan. CAR-T Cell dapat lebih spesifik terhadap antigen yang diekspresikan oleh jaringan yang terinflamasi, selanjutnya sel ini dapat teraktivasi dan terakumulasi pada lokasi inflamasi autoimun dan pada tubuh manusia menghasilkan supresi autoimun yang efektif dan selektif.[27,28]
CAR/FoxP3-Engineered Tregs
CAR/FoxP3-Engineered Tregs adalah hasil rekayasa sel T berupa sel perifer matang. CAR/FoxP3-Engineered Tregs mengekspresikan FoxP3 dan mempunyai afinitas kuat pada self-antigen melalui reseptor CAR, sehingga memiliki kesamaan dengan natural Tregs. Pasien dengan autoimun dapat mempunyai variasi genetik yang dapat menyebabkan defisit atau disfungsi dari Tregs. Mekanisme kerja CAR/FoxP3-Engineered Tregs adalah dengan menyediakan sel Tregs dalam jumlah yang adekuat dan fungsional. Selain itu, CAR/FoxP3-Engineered Tregs bersifat spesifik sehingga hanya menekan inflamasi dan gejala akibat autoimun, tanpa mengganggu respon inflamasi fisiologis.[8]
Uji fungsi CAR/FoxP3-Engineered Tregs menunjukkan bahwa CAR/FoxP3-Engineered Tregs secara signifikan mengurangi proliferasi sel T efektor. Mekanisme tersebut dapat terjadi bahkan dalam kehadiran makrofag yang berpengaruh dalam transformasi Tregs menjadi sel efektor Th17 dengan bantuan produksi dari aktivasi sitokin. Pengikatan pada
jaringan spesifik oleh CAR juga tidak mengubah fungsi supresif CAR/FoxP3-Engineered Tregs.[8]
Modalitas rekayasa sel T Regulator dengan koekspresi Chimeric Antigen Receptor dan gen FoxP3 (CAR/FoxP3 Engineered Tregs) dapat diadministrasikan baik secara intravena maupun intranasal. Berdasarkan penelitian in vivo menggunakan mencit betina C57BL/6 berumur 5-8 minggu menunjukkan bahwa administrasi CAR/FoxP3-Engineered Tregs optimal secara intravena dengan dosis 1 x 10 5 yang terdilusi dalam 100 μl phosphate-buffered saline (PBS) dan secara intranasal dalam 5 μl PBS. Sel juga dapat bertahan lebih dari 30 hari setelah terapi sel awal. (Dapat dilihat pada Gambar 2).[8] CAR/FoxP3-Engineered Tregs menunjukkan kapasitas supresif in vitro dan mengurangi gejala penyakit pada mencit ensefalomielitis autoimun eksperimental secara in vivo.[9]
PBS Treg CAR
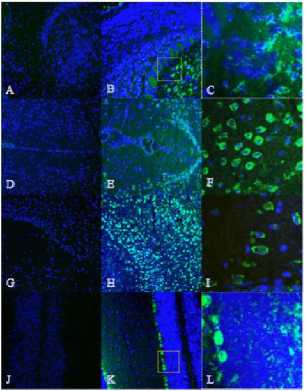
ABC
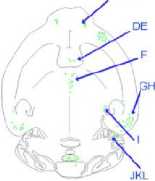
Gambar 2. Mekanisme kerja sel T regulator dalam menekan sel T konvensional.[8]
(Sel Tregs diadministrasikan intranasal pada mencit yang diinduksi Experimental Autoimmune Encephalomyelitis (EAE) dan distribusi dari green fluorescent protein (GFP) pada jaringan beku horizontal dari otak mencit dipelajari 24 jam setelah pemberian. Gambaran skematis menggambarkan imunofluoresens selektif pada berbagai bagian otak (titik hijau). Imunofluoresens GFP terdapat pada lapisan pleksiform eksternal bulbus olfaktorius (B, C), nukleus septal lateral (E) nukleus thalamus medial sentral (F) korteks ektorhinal (H), nukleus genus media (I) dan cerebellum (K,L) dari mencit yang diadministrasikan CAR Tregs. Area serupa menunjukkan tidak ada fluoresens GFP pada mencit yang diadministrasikan PBS (A, D, G, J). Pembesaran area di bulbus olfaktorius dan cerebellum (seperti ditunjukkan kotak) tidak ditunjukkan oleh kotak C dan L. Detail dari imunofluoresens GFP pada nukleus thalamus medial sentral dan nukelus genus meidal (F, I))
SIMPULAN
CAR/FoxP3-Engineered Tregs mengekspresikan FoxP3 dan mempunyai afinitas kuat pada self-antigen melalui reseptor CAR, sehingga memiliki kesamaan
dengan natural Tregs. Konstruksi juga mengandung gen FoxP3 untuk memicu Sel T CD4 yang ditransduksi menjadi Tregs yang stabil. Rekayasa sel Tregs dengan koekspresi CAR/FoxP3 terbukti menunjukkan kapasitas imunosupresif in vitro dan mengurangi gejala inflamasi pada mencit dalam in vivo secara selektif dan stabil.[8,9,28]
Rekayasa Tregs ini memiliki ketrebatasan yaitu pemilihan dan pengembangan populasi sel dikarenakan FoxP3 sebagai biomarker utama terletak dibagian terdalam yaitu intranuklear. Tantangan lainnya adalah untuk menghasilkan Tregs yang spesifik terhadap antigen, membutuhkan stimulasi antigen untuk waktu yang lebih lama.[8]
SARAN (OPSIONAL)
Gagasan ilmiah dalam karya tulis ini berpotensi untuk diterapkan, sehingga memerlukan kajian dan penelitian yang lebih mendalam untuk pengembangan populasi sel, pemilihan dosis yang lebih efektif, lama terapi, serta efek klinis lebih lanjut dalam penatalaksanaan penyakit autoimun, sehingga potensi dari Sel T Regulator dengan koekspresi Chimeric Antigen Receptor dan gen FoxP3 (CAR/FoxP3-Engineered Tregs) menjadi lebih aplikatif.
DAFTAR PUSTAKA
-
1. Bratawidjaya KG. Imunologi Dasar. Edisi ke-10.
Jakarta: Badan Penerbit Fakultas Kedokteran
Universitas Indonesia; 2012.
-
2. National Institute of Arthritis and Musculosceletal and Skin Disease. Understanding Autoimun disease. United states: National Institutes of Health; 2016.
-
3. American Autoimmune Related Diseases Association. Autoimmune Disease Fact Sheet. United states: AARDA; 2016
-
4. Fairweather D. Autoimmune Disease:
Mechanisms. Encycl life Sci. 2007 Jan 21(9):1–6.
-
5. Playfair JH, Chain B. At A Glance Imunologi. Edisi ke-9. Jakarta: Erlangga Medical Series; 2009.
-
6. Arellano B, Graber DJ, Sentman CL. Regulatory T cells-based therapies for autoimmunity. Discov Med. 2016 Aug;22(119):73-80.
-
7. Perelman School of Medicine. New Therapy Treats Autoimmune Disease Without Harming Normal Immunity. United States: University of
Pennsylvania Health System; 2013.
-
8. Fransson M, Piras E, Burman J, Nilsson B, Essand M, Lu B, et al. CAR/FoxP3-engineered T regulatory cells target the CNS and suppress EAE upon intranasal delivery. J Neuroinflammation. 2012 May 30;9(112):1–12.
-
9. Trzonkowski P, Bieniaszewska M, Juschinska J, Dobyszuk A, Krzystyniak A, Marek N, et al. First-inman Clinical Results of the Treatment of Patients with Graft Versus Host Disease with Human ex vivo Expanded CD4 + CD25 + CD127- T Regulatory T Cells. Clin Immunol. 2009 Oct;133(1):22–6.
-
10. Hayes CE, Hubler SL, Moore JR, Barta LE, Praska CE, Nashold FE. Vitamin D actions on CD4+ T Cells in Autoimmune Disease. Front Immunol. 2015 Mar;6(1):1–22.
-
11. Bolon B. Cellular and Molecular Mechanisms of Autoimmune Disease. Toxicol Pathol.
2012;1(1):216–29.
-
12. Immunol JCC, Ray S, Sonthalia N, Kundu S, Ganguly S. Autoimmune Disorders: An Overview of Molecular and Cellular Basis in Today ’ s Perspective. J Clin Cell Immunil. 2012;1(1):1–12
-
13. Broere F, Apasov SG, Sitkovsky M V, Eden W Van. T cell subsets and T cell-mediated immunity. 2011 July;15–28.
-
14. Liston A. Progress in molecular biologi and translational science. edisi ke-1. USA: Elsevier; 2015.
-
15. Corthay A. How do Regulatory T Cells Work?.Scandinavian Journal of Immunology. 2009 Oct;70(1):326–36.
-
16. Rifa M. Perkembangan Sel T Regulator Periferal dan Mekanisme Supresi in vitro. 2010 Okt;1(1):43– 7.
-
17. Widodo J. Penyakit Autoimunitas. JakartaL
Indonesia Med; 2012
-
18. Schmidt A, Oberle N, Krammer PH. Molecular
mechanisms of Treg-mediated T cell suppression. Front Immunol. 2012 Mar;3(1):1–20.
-
19. Dhainaut M, Moser M. Mechanisms of Surveillance of Dendritic Cells by Regulatory T Lymphocytes. Progress in Molcular Biology and Translational Science. 2015 Sept;136:131-154.
-
20. Rudensky AY. Regulatory T cells and Foxp3. Immunol Rev. 2011 Apr;241(1):260–8.
-
21. Rifa’i M. Perkembangan Sel T Regulator Periferal dan Mekanisme Supresi in vitro. J.Exp. Life Sci. 2010 Oct;1(1):43–7.
-
22. Song X, Li B, Xiao Y, Chen C, Wang Q, Liu Y, et al. Structural and biological features of FOXP3 dimerization relevant to regulatory T cell function. HHS Public Access. 2012 Jun;1(6):665–75.
-
23. Bacchetta R, Barzaghi F, Roncarolo M. From IPEX syndrome to FOXP3 mutation: a lesson on immune dysregulation. Ann N Y Acad Sci. 2016 Feb;1–18.
-
24. Devaud C, Darcy P, Kershaw M. FoxP3 expression in T regulatory cells and other cell lineages. Cancer Immunol Immunother. 2014 Sep;63(9):869–76.
-
25. Buckner JH. Mechanisms of impaired regulation by CD4(+) CD25(+) FOXP3(+) regulatory T cells in human autoimmune diseases. Nat Rev Immunol. 2010 Dec;10(12):849–859
-
26. Curran KJ, Pegram HJ, Brentjens RJ. Chimeric Antigen Receptors for T cell Immunotherapy: Current Understanding and Future Direction. J Gene Med. 2012 Jun;14(6):405–15.
-
27. Dotti G, Gottschalk S, Savoldo B, Brenner MK. Design and Development of Therapies using Chimeric Antigen Receptor-Expressing T cells. Immunol Rev. 2014 Jan;257(1):1–35.
-
28. Chae WJ, Bothwell ALM. Therapeutic Potential of Gene-Modified Regulatory T Cells: From Bench to Bedside. Front. Immunol., 2018 Fev;203(9):1-9.
30
Essence of Scientific Medical Journal
Discussion and feedback