PENETAPAN KADAR AMBROKSOL HCL DALAM TABLET MUCOPECT DAN MUCERA DENGAN POTENSIOMETRI
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 10 Nomor 1, Mei 2022
PENETAPAN KADAR AMBROKSOL HCL DALAM TABLET MUCOPECT DAN MUCERA DENGAN POTENSIOMETRI
Ni Wayan Ayu Dwi Pirayanti *, Agus Adi Purnama Putra, Ni Komang Sumarni, Ni Putu Lina Kurniasari
Program Studi Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana Jalan Kampus Unud, Jimbaran, Badung, Bali 80364 *ayupirayanti20@gmail.com
ABSTRAK: Pemeriksaan kadar zat aktif merupakan persyaratan yang harus dipenuhi untuk menjamin kualitas sediaan obat sehingga sesuai dengan persyaratan mutu yang menunjang tercapainya efek terapeutik yang diharapkan. Tablet Mucopect dan Mucera merupakan tablet yang mengandung zat aktif ambroksol hidroklorida (HCl) untuk sekretolitik dimana kadarnya tidak kurang dari 99,0% dan tidak lebih dari 101,0% sesuai dengan aturan British Pharmacopoeia. Oleh karena itu, pada penelitian akan dilakukan uji kesesuaian kadar ambroksol HCl dalam tablet Mucera dan Mucopect yang mengandung 30 mg ambroksol HCl terhadap persyaratan kadar yang telah ditentukan. Penetapan kadar Ambroksol HCl dilakukan dengan metode potensiometri. Titik akhir titrasi potensiometri ditentukan berdasarkan volume yang menyebabkan perubahan relatif besar pada nilai potensialnya. Titik ekivalen tablet Mucopect tercapai pada volume 6,44347826 mL, sedangkan titik ekivalen tablet Mucera tercapai pada volume 9,5467 mL. Dari titik ekivalen tersebut, diperoleh kadar ambroksol HCl dalam tablet Mucopect sebesar 26,714751 mg dengan persen perolehan kembali sebesar 89,04917% dan kadar ambroxol HCl dalam tablet Mucera sebesar 39,580612 mg dengan persen perolehan kembali sebesar 131,935394%. Berdasarkan hasil tersebut kadar ambroksol HCl tidak sesuai dengan kadar yang tertera pada etiket dan persyaratan.
Kata kunci: Ambroksol HCl, penetapan kadar, titrasi, potensiometri.
ABSTRACT: Determination of active substance concentration is one of requirement that must be fulfilled for ensuring drug quality. Mucopect and Mucera tablets contain the active substance ambroxol hydrochloride (HCl) which are indicated for secretolytic. The tablet contains ambroxol HCl that not less than 99.0% and not more than 101.0% according to the British Pharmacopoeia. Thus, this research is conducted to determine the suitability of ambroxol HCl concentrations in Mucopect and Mucera tablets containing 30 mg of ambroxol HCl to the prescribed levels. Determination of Ambroxol HCl levels is examined by potentiometry method. The end point of potentiometric titration is determined by the volume that causes a relatively large change in potential. The equivalence point of Mucopect tablets was achieved at 6.44347826 mL and the equivalence point of Mucera tablets was achieved at 9.5467 mL. From those equivalence point, the ambroxol HCl content in Mucopect tablets was 26,714751 mg with a recovery percentage of 89,04917% and the ambroxol HCl content in Mucera tablets was 39,580612 mg with a recovery percentage of 131,935394%. Based on the results, ambroxol HCl concentrations are not suitable with the levels on the label and standard reference.
Keywords: Ambroxol HCl, level determination, titration, potentiometry.
Sebelum dipasarkan dan selama beredar di pasaran, suatu obat harus memenuhi persyaratan mutu yang sesuai dengan syarat kadar zat berkhasiat. Pemastian mutu sangat penting untuk memastikan bahwa obat yang diproduksi telah sesuai dengan tujuan pemakaiannya. Pemeriksaan kadar zat aktif merupakan persyaratan yang harus dipenuhi untuk menjamin kualitas sediaan obat sehingga dapat menunjang tercapainya efek terapeutik yang diharapkan [1].
Tablet Mucopect dan Mucera merupakan tablet yang banyak beredar di pasaran yang mengandung zat aktif ambroksol hidroklorida (HCl). Ambroksol HCl memiliki rumus molekul C13H18Br2N2O.HCl dan bobot molekul 414,6 g/mol. Ambroksol HCl berbentuk serbuk kristal putih atau sedikit kekuningan. Ambroksol HCl sedikit larut dalam air, larut dalam metanol, dan praktis tidak larut dalam metilen klorida (British Pharmacopoeia, 2009). Ambroksol HCl diindikasikan untuk terapi sekretolitik pada penyakit bronkopulmonalis akut dan kronis dengan sekresi lendir dan transportasi lendir terganggu. Ambroksol HCl diberikan dalam dosis harian 60 – 120 mg melalui oral [1].
Berdasarkan British Pharmacopoeia, Ambroksol HCl mengandung tidak kurang dari 99,0% dan tidak lebih dari 101,0% yang dihitung terhadap zat yang telah dikeringkan. Ambroksol HCl memiliki pH 4,5-6, apabila dilarutkan dalam air bebas CO2 dapat ditetapkan kadarnya secara titrasi potensiometri menggunakan senyawa baku basa seperti NaOH [2].
Potensiometri adalah metode analisis elektrokimia yang memanfaatkan prosedur penggunaan pengukuran tunggal potensial elektroda untuk menetapkan konsentrasi suatu ion yang dirujuk [3]. Prinsip dari potensiometri didasarkan pada pengukuran perbedaan potensial listrik antara elektroda
indikator dan elektroda pembanding yang dicelupkan dalam suatu larutan yang bergantung pada potensial membran [4]. Reaksi yang terjadi dalam potensiometri yaitu penambahan atau pengurangan ion terhadap jenis elektroda yang digunakan [5]. Titik akhir titrasi potensiometri ditentukan berdasarkan volume yang menyebabkan perubahan relatif besar dalam nilai potensial [6]. Potensiometri merupakan aplikasi langsung dari Persamaan Nernst. Pengukuran dalam potensiometri dilakukan dengan cara pengukuran dua elektroda tidak terpolarisasi pada kondisi arus nol sesuai dengan Persamaan Nernst. Persamaan ini menyatakan adanya hubungan antara potensial relatif suatu elektroda dengan konsentrasi spesies ion yang sesuai dalam larutan [5]. Persamaan Nernst yaitu sebagai berikut:
E=Eo +τ÷≡; (1)
E = potensial (V), diperoleh dari elektroda hidrogen normal
E0 = potensial normal
Z = jumlah elektron yang terlibat dalam proses redoks
aOx = aktivitas bentuk teroksidasi
aRed= aktivitas bentuk tereduksi
Titrasi potensiometri memiliki tingkat ketelitian yang lebih tinggi dari titrasi visual, sehingga hasil yang didapatkan akan lebih maksimal. Ambroksol HCl tergolong senyawa elektrolit lemah akan sulit ditentukan titik akhir titrasinya karena menghasilkan kurva titrasi yang tidak mempunyai daerah ekivalen yang terpisah sangat tajam, sehingga tidak dimungkinkan penggunaan indikator warna asam – basa. Berdasarkan hal tersebut, dilakukan penetapan kadar Ambroksol HCl dalam tablet Mucopect dan Mucera dengan metode potensiometri.
Bahan yang digunakan dalam penelitian yaitu tablet Mucopect dan Mucera (mengandung 30 mg ambroksol HCl), asam oksalat, larutan asam klorida, NaOH, etanol, akuades, metanol, larutan buffer ph 4, 7, 10, dan indikator fenolftalein. Peralatan yang diperlukan dalam melakukan penelitian yaitu statif, klem, buret, labu Erlenmeyer, labu ukur, pH meter merek Mettler Toledo, potensiometer, gelas beker, pipet ukur, neraca analitik, mortir dan stamper.
-
2.2 Metode
Pembuatan Larutan Asam Oksalat NaOH 0,1 N
0,63035 gram asam oksalat ditimbang, kemudian dimasukkan ke dalam gelas beker, ditambahkan akuades secukupnya dan diaduk dengan batang pengaduk sampai larut. Larutan tersebut dimasukkan ke dalam labu ukur 100 mL, ditambahkan akuades sampai tanda batas dan dikocok hingga homogen.
Pembuatan Larutan NaOH 1,0 N
0,4 gram NaOH ditimbang di dalam gelas beker, lalu ditambahkan akuades dan diaduk dengan batang pengaduk sampai larut. Larutan NaOH dimasukkan ke dalam labu ukur 100 mL, ditambahkan akuades sampai tanda batas dan dikocok hingga homogen.
Pembuatan Larutan HCl 0,1 N
0,207 mL HCl 37% (b/b) dipipet ke dalam labu ukur 25 mL yang telah diisi dengan sedikit akuades, kemudian ditambahkan akuades kembali hingga tanda batas dan dikocok hingga homogen.
Pembuatan Larutan HCl 0,01 N
-
1 mL HCl 0,1 N dipipet ke dalam labu ukur 10 mL yang telah diisi akuades
secukupnya, kemudian ditambahkan akuades hingga tanda batas labu ukur dan dikocok sampai homogen.
Standarisasi Larutan NaOH 0,5 N
-
10 mL larutan asam oksalat 0,5 N dipipet ke dalam labu Erlenmeyer, kemudian ditambahkan 3 tetes indikator fenolftalein. Larutan tersebut dititrasi dengan larutan NaOH 0,5 N hingga berubah warna menjadi merah muda, kemudian dihitung normalitas NaOH.
Pembuatan Indikator Fenolftalein 1%
Fenolftalein (PP) ditimbang sebanyak 0,05 gram dan dimasukkan ke dalam gelas beker. Kemudian, ditambahkan metanol secukupnya hingga larut sambil diaduk. Larutan indikator tersebut dimasukkan ke dalam labu ukur 5 mL, ditambahkan metanol sampai tanda batas dan dikocok hingga homogen.
Standarisasi Larutan NaOH 0,1 N
-
10 mL asam oksalat dimasukkan ke dalam erlenmeyer 100 mL yang telah ditambahkan 3 tetes indikator fenolftalein, lalu dititrasi dengan NaOH 0,1 N sampai terbentuk warna merah muda yang stabil. Volume NaOH yang digunakan dicatat dan dilakukan pengulangan sebanyak 3 kali dan dihitung normalitas rata – rata NaOH yang digunakan.
Penetapan Kadar Ambroxol HCl dalam Tablet dengan Titrasi Potensiometri
pH meter dikalibrasi terlebih dahulu sebelum dilakukan preparasi sampel. Preparasi sampel dilakukan dengan cara menggerus sejumlah tablet Ambroksol HCl, kemudian 300 mg tablet tersebut ditimbang, dilarutkan dengan 70 mL metanol dan disaring. Pada tablet tersebut ditambahkan 5 mL HCl 0,01 N dan NaOH sedikit demi sedikit hingga terjadi lonjakan pH maupun penurunan potensial yang drastis. Penambahan volume tersebut diamati sampai
mencapai titik ekuivalen untuk menetapkan kadar dari sampel tablet ambroksol HCl. Diketahui bahwa 1 mL 0,1 M NaOH setara dengan 41,46 mg C13H18Br2N2O.HCl [2].
Potensiometri adalah suatu metode analisis elektrokimia yang memanfaatkan prosedur penggunaan pengukuran tunggal potensial elektroda untuk menetapkan konsentrasi suatu ion yang dirujuk [3] Komponen yang digunakan pada potensiometri yaitu elektroda indikator dan elektroda pembanding, alat ukur potensial, pH meter, dan pengaduk magnetik [6]. Reaksi yang terjadi dalam potensiometri adalah penambahan atau pengurangan ion terhadap jenis elektrodanya [5].
Elektroda yang digunakan pada penelitian ini adalah elektroda kalomel jenuh. Elektroda ini merupakan gabungan antara elektroda indikator dan elektroda pembanding yang dimasukkan ke dalam rakitan elektroda membran gelas membentuk satu kesatuan elektroda yang disebut dengan elektroda gabungan [7].
Pada penelitian ini dilakukan pembuatan beberapa larutan yaitu pembuatan larutan standar NaOH 0,1 N sebagai larutan baku sekunder, larutan HCl 1,0 N dan 0,01 N sebagai elektrolit dan standar adisi, larutan standar asam oksalat 0,1 N sebagai larutan baku primer untuk standarisasi NaOH, dan larutan Fenolftalein sebagai indikator yang membantu menentukan titik akhir pada saat standarisasi NaOH yang ditandai dengan perubahan warna larutan menjadi merah muda [8].
Titrasi larutan sampel dilakukan dengan menggunakan larutan NaOH 0,1 N yang ditambahkan sedikit demi sedikit
melalui buret ke dalam gelas beker yang mengandung larutan sampel, dimana reaksi yang terjadi yaitu:
NaOH + C13H18Br2N2O.HCl → C13H18Br2N2O. NaCl + H2O
Mekanisme kerja dari potensiometer dalam mengukur potensial yaitu dengan mencelupkan elektroda gelas ke dalam larutan, sehingga terjadi kesetimbangan antara ion – ion hidrogen yang berada di bagian tipis bola gelas dan ion hidrogen yang terdapat dalam larutan sampel uji.
Semakin tinggi konsentrasi ion hidrogen dalam larutan asam klorida, maka semakin banyak ion hidrogen yang masuk ke dalam lapisan gelas. Hal ini menyebabkan pada saat awal titrasi, nilai potensial besar. Semakin banyak larutan natrium hidroksida yang ditambahkan, semakin sedikit ion hidrogen yang terdapat dalam larutan asam klorida, karena ion hidrogen akan bereaksi dengan ion hidroksida membentuk air. Ion hidrogen yang memasuki lapisan gelas akan semakin sedikit, sehingga muatan elektroda gelas berkurang yang menyebabkan nilai potensial akan menurun dan menandakan titik akhir titrasi telah tercapai [9].
Tablet Mucopect mengalami peningkatan pH pada derivat ke-2 pada penambahan volume NaOH antara 6,4 mL – 6,5 mL dengan nilai pH pada derivat ke-2 dari -50 sampai 65. Pada tablet Mucera terjadi penurunan nilai pH pada derivat ke-2 pada penambahan volume NaOH antara 9,5 mL – 9,6 mL dengan nilai pH pada derivat ke-2 dari 140 sampai -160. Penurunan nilai pH pada derivate ke-2 diakibatkan oleh ion hidrogen yang telah habis bereaksi dengan ion
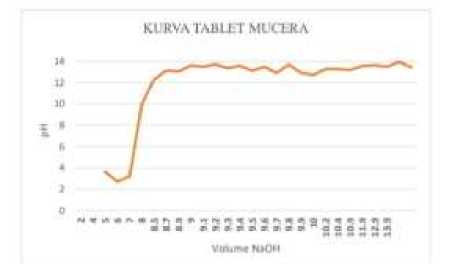
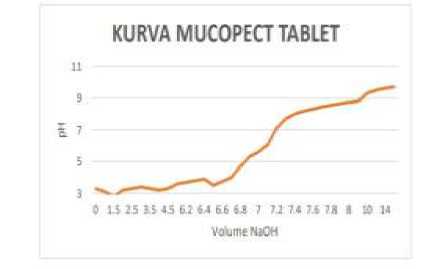
Gambar 1. Kurva Titrasi Perubahan pH Terhadap Volume NaOH Tablet Mucera (kiri) dan Muccopet (kanan)
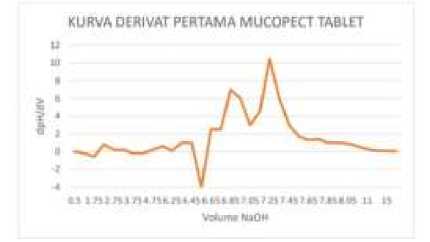
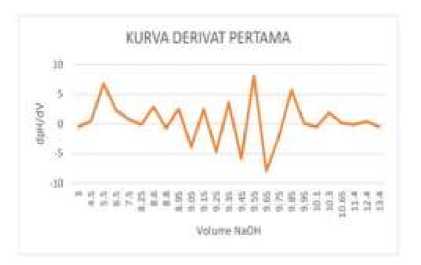
Gambar 2. Kurva Derivat I Perubahan pH Terhadap Volume NaOH Tablet Muccopet (kiri) dan Mucera (kanan)
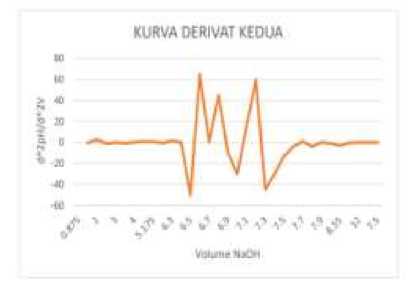
KURVA DERIVAT KEDUA
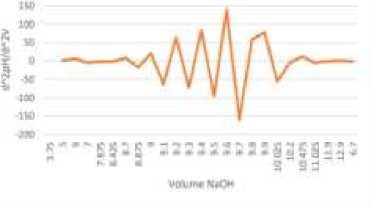
Gambar 3. Kurva Derivat II Perubahan pH Terhadap Volume NaOH Tablet Mucera (kiri) dan Muccopet (kanan)
hidroksida, sehingga konsentrasi ion hidrogen dalam lapisan gelas elektroda indikator berkurang yang menyebabkan meningkatnya arus pada elektroda gelas secara tiba – tiba, kemudian
akan menurun secara tiba – tiba pula. Perhitungan yang dilakukan untuk mengetahui volume titran NaOH 0,1 N yang dibutuhkan untuk mencapai titik akhir titrasi
yaitu perhitungan turunan (derivatisasi) sebanyak dua kali.
Berdasarkan hasil perhitungan titik akhir titrasi, volume NaOH 0,1 N yang diperlukan untuk menetralkan larutan HCl pada tablet Muccopet adalah 6,4435 mL dan tablet Mucera sebesar 9,5467 mL. Kadar ambroksol HCl dalam tablet Muccopet sebesar 26,714751 mg dengan nilai % recovery sebesar 89,04917% dan kadar ambroksol HCl dalam tablet Mucera sebesar 39,580612 mg dengan nilai % recovery sebesar 131,935394%.
Berdasarkan hasil tersebut kadar ambroksol HCl tidak sesuai dengan kadar yang tertera pada etiket dan persyaratan British Pharmacopoeia yaitu mengandung ambroksol HCl tidak kurang dari 99,0% dan tidak lebih dari 101,0%. Hal ini kemungkinan disebabkan dari faktor homogenitas pelarut, sehingga perlu dilakukan optimasi waktu pengadukan.
Kadar ambroksol HCl pada tablet Mucopect dan Mucera tidak sesuai dengan kadar yang tertera pada etiket dan persayaratan kadar yang ditentukan oleh British Pharmacopoeia.
Penulis mengucapkan terima kasih kepada dosen matakuliah kimia analisis dan tim laboratorium kimia analisis Universitas Udayana.
-
[1] Kurniawan, T. B., Fathur, R. H., Misrahanum, dan Sadli. Validation Method of Ultraviolet
Spectrophotometry Determination Of Content in Ambroxol HCl Tablet. Jurnal Natural. 2015, 15(2), 11-17.
-
[2] British Pharmacopoeia. British Pharmacopoeia. Volume I dan II. The British Pharmacopoeia Commission, 2009.
-
[3] Basset, J., Denny, R. C., Jeffrey. G. H., dan Mendham, J. Kimia Analisis Kuantitatif Anorganik. EGC, 1994.
-
[4] Settle, F.A. Handbook of Instrumental Techniques for Analytical Chemistry. Prenticel-Hall Inc, 1997.
-
[5] Khopkar, S.M. Konsep Dasar Kimia Analitik. UI Press, 2003.
-
[6] Day, R.A. dan Underwood, A.L. Analisis Kimia Kuantitaif. Edisi VI. Erlangga, 1998.
-
[7] Sahara, E. Penentuan Cu, Pb, Cd dan Zn dalam Air Secara Stripping Potentiometri dengan Elektroda Konvensional dan Kombinasi. Jurnal Kimia. 2008, 2(2), 105-110.
-
[8] Gandjar, I.G., dan Abdul, R. Kimia Farmasi Analisis. Pustaka Pelajar,
2007.
-
[9] Roth, H.J. dan Blaschke, G. Analisis Farmasi. Universitas Gajah Mada,
1998.
43

Discussion and feedback