DETEKSI MUTASI KODON 510 dan 511 DAERAH RRDR GEN rpoB PADA ISOLAT KLINIK Mycobacterium tuberculosis MULTIDRUG RESISTANT DI BALI DENGAN PCR-RESTRICTION FRAGMENT LENGHT POLYMORPHISM
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 4, Nomor 2, Oktober 2016
F Cakra ■ Kimia
DETEKSI MUTASI KODON 510 dan 511 DAERAH RRDR GEN rpoB PADA ISOLAT KLINIK Mycobacterium tuberculosis MULTIDRUG RESISTANT DI BALI DENGAN PCR-RESTRICTION FRAGMENT
LENGHT POLYMORPHISM
Made Rai Dwitya Wiradiputra1, Sagung Chandra Yowani1,2 , dan I Nengah Wirajana2,3
-
1 Jurusan Farmasi, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia 80361 rai.dwitya@gmail.com
-
2 Kelompok Studi MDR-XDR-TB, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia 80361 cyowani@yahoo.com
-
3 Jurusan Kimia, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia 80361 nwirajana@gmail.com
ABSTRAK: Tujuan penelitian ini adalah untuk melakukan deteksi mutasi daerah RRDR gen rpoB Mycobacterium tuberculosis khususnya pada kodon 510 dan 511 dari isolat klinis Multidrug Resistant Tuberculosis (MDR-TB) di Bali dengan metode Polymerase Chain Reaction – Restriction Fragment Length Polymorphism (PCR-RFLP). Isolat M. tuberculosis H37Rv digunakan sebagai kontrol bakteri yang tidak mengalami mutasi dan empat isolat klinis MDR-TB digunakan sebagai sampel pada penelitian ini. Proses PCR-RFLP meliputi dua tahap, yaitu amplifikasi (PCR) dan digesti. Produk PCR hasil amplifikasi didigesti dengan enzim PvuII (New England Biolabs) melalui proses inkubasi pada suhu 37oC selama 3 jam diikuti dengan inaktivasi ice shock pada suhu -20oC selama 5 menit. Hasil penelitian ini menunjukan bahwa enzim restriksi PvuII dapat mendeteksi mutasi kodon 510 dan 511 daerah RRDR gen rpoB M. tuberculosis dengan teknik PCR-RFLP. Pada isolat 134 diketahui terdapat mutasi pada kodon 510 dan/atau 511 sedangkan pada isolat P10, P11, dan P16 tidak ditemukan adanya mutasi pada kodon 510 dan 511. Berdasarkan hasil penelitian sebelumnya, diketahui pula bahwa mutasi yang terjadi pada isolat 134 adalah mutasi kodon 510 (CAG→CTG).
Kata kunci: MDR-TB, rpoB, RRDR, kodon 510 dan 511, PCR-RFLP.
ABSTRACT: The objective of this study is to detect mutation in the region of RRDR of rpoB gene Mycobacterium tuberculosis particularly at codon 510 and 511 from MDR-TB clinical isolates in Bali using Polymerase Chain Reaction – Restriction Fragment Length Polymorphism (PCR-RFLP) method. Isolate of M. tuberculosis H37Rv was used as control of non-mutated bacteria, and four MDR-TB clinical isolates were used for sample in this study. PCR-RFLP was conducted in two steps which were amplification (PCR) and digestion. PCR products were digested using PvuII restriction enzyme (New England Biolabs) through incubation at 37oC for 3 hours followed by ice shock inactivation at -20oC for 5 minutes. The result of this study showed that PvuII restriction enzyme could detect mutation of codon 510 and 511 in the region of RRDR of rpoB gene M. tuberculosis using PCR-RFLP. In isolate 134, mutation at codon 510 and/or 511 was found while there were no mutation of codon 510 and 511 detected in isolate P10, P11, and P16. Based on previous research, it was found that the mutation occurred in isolate 134 was at codon 510 (CAG→CTG).
Keywords: MDR-TB, rpoB, RRDR, codon 510 dan 511, PCR-RFLP
Tuberkulosis (TB) merupakan salah satu penyakit infeksi yang menjadi penyebab kematian utama di dunia [1]. Pada tahun 2012, WHO merancang program post-2015 global TB strategy yang bertujuan mengeradikasi epidemi TB secara global pada tahun 2035 [2].
Peningkatan kasus resistensi obat antituberkulosis (OAT) merupakan ancaman utama terhadap keberhasilan program pengendalian TB. Salah satu fenomena global resistensi OAT adalah Multidrug Resistant Tuberculosis (MDR-TB), yaitu TB yang disebabkan oleh strain Mycobacterium tuberculosis yang resisten setidaknya terhadap rifampisin (RIF) dan isoniazid (INH) [2,3].
Resistensi RIF disebabkan oleh adanya mutasi pada Rifampicin Resistant Determining Region (RRDR), yaitu daerah sepanjang 81 pasang basa yang meliputi kodon 507-533 dari gen rpoB M. tuberculosis [4,5]. Sebanyak 95-98% isolat klinis yang resisten RIF mengalami mutasi pada RRDR. Resistensi RIF dikatakan sebagai surrogate marker kejadian MDR-TB karena 90% dari isolat klinis yang resisten RIF juga diketahui resisten INH [5,6]. Hal tersebut menandakan bahwa mutasi pada RRDR memiliki arti penting pada deteksi MDR-TB.
Deteksi dini MDR-TB merupakan salah satu upaya yang dapat dilakukan untuk pengendalian epidemi TB. Deteksi dini MDR-TB akan membantu dalam penentuan regimen antibiotik yang tepat bagi pasien dan pencegahan penyebaran MDR-TB [7].
Berbagai metode deteksi MDR-TB secara molekuler seperti teknik PCR telah dikembangkan sebagai alternatif metode konvensional dengan kultur karena kecepatannya dalam memperoleh hasil. Metode molekuler dikembangkan dengan pendekatan adanya mutasi pada DNA M.
tuberculosis yang bertanggung jawab terhadap resistensi OAT [8].
PCR-RFLP merupakan salah satu varian teknik PCR yang dapat dimanfaatkan untuk deteksi mutasi gen pada kasus resistensi antibiotik. Dengan memanfaatkan mekanisme pemotongan spesifik oleh enzim restriksi yang sesuai, metode ini dapat digunakan untuk mengetahui adanya perubahan nukleotida pada suatu sekuen DNA [9]. PCR-RFLP memiliki beberapa keuntungan, yaitu relatif murah, robust, mudah dalam hal pengerjaan dan interpretasi, serta hanya memerlukan peralatan dasar PCR [10].
Teknik PCR-RFLP memerlukan enzim restriksi yang sesuai untuk dapat mendeteksi perubahan nukleotida pada titik mutasi yang diharapkan dalam sekuen DNA. Pada penelitian ini, dilakukan deteksi mutasi pada RRDR gen rpoB M. tuberculosis dengan metode PCR-RFLP menggunakan enzim restriksi PvuII. Dengan situs restriksi 5’-CAG↓CTG-3’, enzim PvuII diketahui dapat digunakan untuk deteksi mutasi kodon 510 dan 511 daerah RRDR secara spesifik.
DNA kromosomal M. tuberculosis H37Rv hasil isolasi dan DNA kromosomal isolat klinik MDR-TB, sepasang primer (IDT) yaitu primer forward (FrTb) 5’-GTC GACGCTGACCGAAGAAGAC-3’ dan primer reverse (RrTb) 5’-GAGCCGATCAG ACCGATGTTGG-3’, dan GoTaq Green Master Mix (Promega) digunakan untuk amplfikasi fragmen 990-1496pb gen rpoB. Pada digesti produk PCR digunakan enzim restriksi PvuII (New England Biolabs) dan NE Buffer 3.1 (New England Biolabs). TopVision Agarose (Thermo Scientific), Buffer TBE 0,5X (Invitrogen), dan GelRed
(Biotium) digunakan untuk deteksi produk PCR dan fragmen restriksi produk PCR.
Peralatan yang digunakan pada penelitian ini antara lain Veriti Thermalcycler (Applied Biosystem), alat elektroforesis (Mupid-exU Submarine Electrophoresis System), inkubator (Binder), dan GelDoc (Bio-Rad).
-
2.2 Metode
Sampel Isolat M. tuberculosis
Isolat M. tuberculosis yang digunakan sebagai sampel pada penelitian adalah empat isolat klinis MDR-TB (P10, P11, P16, 134). Isolat kultur M. tuberculosis H37Rv digunakan sebagai kontrol bakteri yang tidak mengalami mutasi pada daerah RRDR. Isolat sampel dan kontrol tersebut diperoleh dari Bagian Mikrobiologi Klinik Rumah Sakit Umum Pusat (RSUP) Sanglah Denpasar, Bali.
Isolasi DNA Isolat M. tuberculosis H37Rv
Isolasi DNA Isolat M. tuberculosis H37Rv dilakukan dengan menggunakan High Pure PCR Tenplate Preparation Kit (Roche, Germany) sesuai protokol standar untuk isolasi DNA bakteri.
Amplifikasi fragmen 990-1496pb Gen rpoB M. tuberculosis
Reaksi dilakukan pada tabung mikro dengan total volume reaksi 30 μL. Proses amplifikasi fragmen 990-1496 pb Kondisi PCR yang digunakan mengacu pada hasil optimasi yang telah dilakukan pada penelitian sebelumnya [11], yaitu denaturasi awal pada suhu 95ºC selama 15 menit dan dilanjutkan dengan 45 siklus amplifikasi (denaturasi pada suhu 94oC selama 1 menit, annealing pada suhu 58°C selama 1 menit, dan ekstensi pada suhu 72oC selama 1 menit). Proses amplifikasi diakhiri dengan ekstensi akhir pada suhu 72ºC selama 10 menit. Selanjutnya produk PCR dideteksi dengan elektroforesis gel agarosa 1,5%.
Digesti Produk PCR dengan Enzim PvuII
Digesti dilakukan pada volume reaksi 25 μL yang terdiri dari 17 μL H2O; 5 μL produk PCR; 2,5 μL NE Buffer 3.1; dan 0,5 μL enzim PvuII (New England Biolabs). Campuran digesti diinkubasi pada suhu 37oC selama 3 jam dalam inkubator. Proses inaktivasi dilakukan dengan ice shock pada suhu -20oC selama 5 menit. Fragmen restriksi kemudian dianalisis dengan elektroforesis gel agarosa 1,6%.
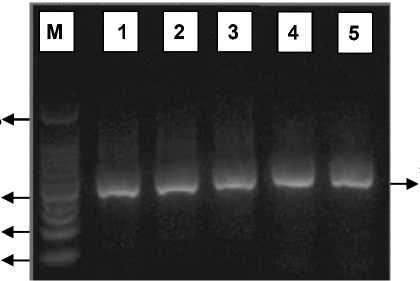
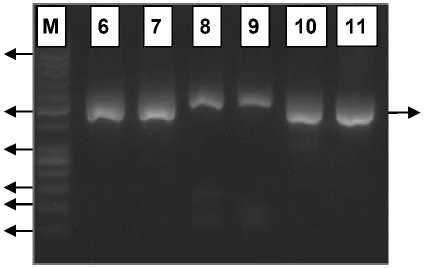
Hasil amplifikasi fragmen 990-1496 pb gen rpoB dari sampel isolat M. tuberculosis dapat dilihat pada Gambar 1 dan Gambar 2. Pada elektroforegram hasil amplifikasi tersebut dapat dilihat bahwa proses amplifikasi fragmen target dengan ukuran amplikon yang diharapkan sebesar ±507 pb telah berhasil diperoleh pada seluruh isolat. Hasil amplifikasi tersebut juga
mengonfirmasi bahwa primer dan kondisi PCR hasil optimasi pada penelitian sebelumnya dengan DNA template isolat 86 telah sesuai untuk proses amplifikasi fragmen 990-1496 pb gen rpoB dari isolat kultur MDR-TB [11]. Produk PCR yang diperoleh dari tahap amplifikasi digunakan sebagai substrat DNA untuk proses digesti dengan enzim restriksi PvuII.
Enzim restriksi PvuII digunakan pada penelitian ini untuk deteksi mutasi di daerah RRDR gen rpoB M. tuberculosis khususnya mutasi kodon 510 dan 511 dengan metode PCR-RFLP. PvuII merupakan enzim restriksi tipe II yang diisolasi dari bakteri Proteus vulgaris. Enzim ini memotong pada sekuen DNA palindrom 5’-CAG↓CTG-3’
menghasilkan fragmen blunt end [12,13].
1000 pb
500 pb
200 pb
100 pb
±507 pb
Gambar 1. Elektroforegram hasil amplifikasi isolat H37Rv dan 134; M : marker DNA 100 pb; 1-3 : isolat H37Rv; 4-5: isolat 134.
1000 pb
500 pb
300 pb
150 pb
100 pb
50 pb
±507 pb
Gambar 2. Elektroforegram hasil amplifikasi isolat P10, P11, dan P16; M : marker DNA 50pb; 6-7 : isolat P10; 8-9 : isolat P11; 10-11 : isolat P16.
Pada sekuen fragmen rpoB yang diamplifikasi dalam penelitian ini, enzim PvuII memotong hanya pada satu titik yaitu diantara kodon 510 (CAG) dan 511 (CTG) dari RRDR. Fragmen restriksi yang yang dihasilkan memiliki ukuran 191 pb dan 306 pb. Perubahan nukleotida pada kodon 510 dan 511 akan mengubah situs restriksi enzim PvuII, sehingga tidak dapat memotong fragmen gen rpoB yang mengalami mutasi pada kedua kodon tersebut.
Digesti produk PCR dengan enzim PvuII
dilakukan melalui inkubasi pada suhu optimum enzim PvuII selama 3 jam. Pada proses inkubasi, enzim PvuII akan bekerja memotong substrat DNA dalam kondisi optimum. Setelah proses inkubasi, dilakukan inaktivasi pada kondisi ekstrim untuk menghentikan reaksi enzim restriksi. Inaktivasi enzim restriksi dapat dilakukan dengan pemanasan pada suhu tinggi (heat inactivation), penambahan stop solution yang mengandung EDTA, dan ekstraksi dengan fenol [14]. Inaktivasi dengan panas yang umum digunakan pada inaktivasi enzim restriksi tidak dapat dilakukan untuk enzim PvuII karena suhu inaktivasinya 95oC [15], sehingga akan menyebabkan denaturasi fragmen restriksi.
Inaktivasi digesti pada penelitian ini dilakukan dengan ice shock, yaitu dengan mengkondisikan produk digesti pada es dengan suhu -20oC selama 5 menit segera setelah proses inkubasi selesai. Hal tersebut didasarkan pada sifat buffer Tris-HCl yang digunakan untuk reaksi digesti dengan enzim PvuII. pH buffer Tris-HCl bersifat sensitif terhadap suhu, yaitu pada penurunan suhu tiap 1oC akan menurunkan pH buffer Tris sebesar 0,028 unit [16]. Dengan adanya perubahan suhu yang ekstrim dari suhu inkubasi, maka aktivitas enzim PvuII akan menurun karena berada pada kondisi non-optimal untuk reaksi restriksi.
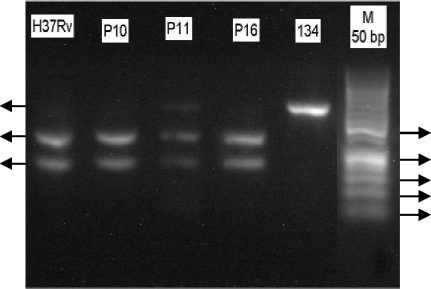
Hasil digesti produk PCR dengan enzim PvuII ditunjukan pada Gambar 3. Hasil digesti tersebut menunjukan bahwa pada isolat H37Rv yang merupakan kontrol fragmen rpoB yang tidak mengalami mutasi terjadi pemotongan oleh enzim restriksi yang berarti bahwa enzim PvuII dapat bekerja memotong substrat DNA sampel berupa produk PCR pada kondisi reaksi digesti yang digunakan.
Pada Gambar 3, hasil digesti produk PCR isolat P10, P11, dan P16 menunjukan adanya pemotongan oleh enzim PvuII dengan tampaknya pita fragmen restriksi
dengan ukuran ±316 pb dan ±191 pb.
±507 pb
±316 pb
±191 pb
500 pb
250 pb
150 pb
100 pb
50 pb
Gambar 3. Elektroforegram hasil digesti produk PCR; M : marker DNA 50pb; H37Rv : isolat H37Rv; P10 : isolat P10; P11 : isolat P11; P16 : isolat P16; 134 : isolat 134.
Hal tersebut menandakan tidak ada mutasi kodon 510 dan 511 pada ketiga isolat klinis tersebut. Pada elektroforegram hasil digesti produk PCR isolat P11, diketahui pula bahwa complete digestion belum tercapai karena masih tampak adanya pita produk PCR pada elektroforegram dengan ukuran ±507 pb. Hal tersebut mungkin disebabkan karena belum tercapainya keseimbangan jumlah enzim PvuII dengan substrat DNA serta waktu digesti yang kurang lama. Pada digesti produk PCR secara langsung tanpa proses pemurnian terlebih dahulu, aktivitas enzim restriksi juga mungkin dapat terhambat oleh adanya primer dan MgCl2 yang berlebih pada produk PCR [25].
Sementara itu, elektroforegram hasil digesti isolat 134 pada Gambar 3 menunjukan tidak adanya pemotongan oleh enzim restriksi karena hanya tampak satu pita dengan ukuran ±507 pb yang merupakan pita produk PCR. Sehingga, dapat diketahui bahwa pada isolat 134 terjadi mutasi pada kodon 510 dan/atau 511.
Hasil PCR RFLP isolat MDR-TB pada
penelitian ini telah sesuai dengan hasil sekuensing produk PCR isolat tersebut yang dilakukan pada penelitian sebelumnya, yang mana ditemukan adanya mutasi isolat 134 berupa perubahan nukleotida pada kodon 510 (CAG→CGG) dan pada sekuen produk PCR isolat P10, P11, serta P16 tidak ditemukan adanya mutasi pada kodon 510 dan 511 [18, 19].
Mutasi pada kodon 511 daerah RRDR telah dilaporkan terjadi pada isolat di 8 negara [20]. Sedangkan mutasi pada kodon 510 memiliki frekuensi yang cukup tinggi pada beberapa daerah seperti di Belarusia sebesar 47,7% [21]; Iran sebesar 27% [22]; dan Filipina sebesar 15% [23]. Selain itu, mutasi pada kodon 510 dan 511 dapat dikaitkan dengan kejadian resistensi tingkat tinggi (high level resistance) rifampisin. Hal tersebut dikarenakan pada beberapa penelitian, nilai minimum inhibitory concentration (MIC) rifampisin dari isolat yang mengalami mutasi pada kodon tersebut setara dengan MIC rifampisin isolat yang mengalami mutasi pada kodon 513, 526, dan 531. Mutasi pada kodon 513, 526, dan 531 sering dikaitkan dengan kejadian high level resistance [4]. Isolat yang mengalami mutasi pada kodon 511 diketahui memiliki nilai MIC rifampisin yang sama dengan isolat yang mengalami mutasi pada kodon 513, 526, dan 531 [24]. Sementara itu, isolat yang mengalami mutasi pada kodon 510 diketahui memiliki MIC rifampisin yang setara dengan isolat yang mengalami mutasi pada kodon 531 [25].
Hasil PCR-RFLP dengan enzim PvuII menunjukan adanya mutasi kodon 510 atau 511 pada isolat 134. Berdasarkan hasil penelitian sebelumnya, diketahui bahwa mutasi yang terjadi pada isolat tersebut adalah mutasi kodon 510 (CAG→CGG).
Sementara itu, pada isolat P10, P11, dan P16 tidak ditemukan adanya mutasi pada kodon 510 atau 511.
Ucapan terima kasih penulis sampaikan kepada staf Laboratorium Biomolekuler Fakultas Kedokteran Universitas Udayana, staf Bagian Mikrobiologi Klinik Rumah Sakit Umum Pusat Sanglah, serta pihak-pihak yang telah membantu baik secara langsung maupun tidak langsung sehingga penelitian ini dapat dilaksanakan dengan baik.
6. DAFTAR PUSTAKA
|
[1] |
World Health Organization. |
Global |
|
Tuberculosis Report 2015. 2015. |
WHO, | |
|
[2] |
World Health Organization. |
Global |
|
Tuberculosis Report 2013. 2013. |
WHO, | |
|
[3] |
World Health Organization. |
Global |
|
Tuberculosis Report 2014. 2014. |
WHO, | |
|
[4] |
Ramaswamy, S. dan J. M. |
Musser. |
Molecular genetic basis of
antimicrobial agent resistance in Mycobacterium tuberculosis: 1998
update. Tubercle and Lung Disease. 1998, 79(1): 3–29.
-
[5] Yam, W. C., et al. Direct Detection of Rifampin-Resistant Mycobacterium tuberculosis in Respiratory Specimens by PCR-DNA Sequencing. J. Clin. Microbiol. 2004, 42(10): 4438–4443.
-
[6] Siu, G. K. H., Y. Zhang, T. C. K. Lau, R. W. T. Lau, P. L Ho, W. W. Yew, S. K. W. Tsui, V. C. C. Cheng, K. Y. Yuen, dan W. C. Yam. Mutations
outside the rifampicin resistancedetermining region associated with rifampicin resistance in
Mycobacterium tuberculosis. J Antimicrob Chemother. 2011, 66: 730–733.
-
[7] Leung, E. T. Y., K. M. Kam, A. Chiu, P. L. Ho, W. H. Seto, K. Y. Yuen, dan W. C. Yam. Detection of katG Ser315Thr substitution in respiratory specimens from patients with isoniazid-resistant Mycobacterium tuberculosis using PCR-RFLP.
Journal of Medical Microbiology.
2003, 59: 999–1003.
-
[8] Mathuria, J. P., G. Nath, J. K.
Samaria, dan S. Anupurba. Molecular characterization of INH-resistant Mycobacterium tuberculosis isolates by PCR-RFLP and multiplex-PCR in North India. Infection, Genetics and Evolution. 2009, 9: 1352-1355.
-
[9] Leonard, D. G. B. Molecular Pathology in Clinical Practice. Springer, 2007.
-
[10] Caws, M., et al. PCR-Restriction Fragment Length Polymorphism for Rapid, Low-Cost Identification of Isoniazid-Resistant Mycobacterium tuberculosis. J. Clin. Microbiol. 2007, 45(6): 1789-1793.
-
[11] Rusyanthini, N. P., I. N. Wirajana, dan S. C. Yowani. Optimization of Annealing Temperature for
Amplification of 507 bp fragment of rpoB Gene of Clinical MultidrugResistant Mycobacterium tuberculosis Isolate 86. Indonesia Journal of Biomedical Science. 2015, 9(2):
DOI:10.15562/ijbs.v9i2.20.
-
[12] Tao, T. dan R. M. Blumenthal. Sequence and Characterisation of pvuIIR, the PvuII Endonuclease Gene, and of pvuIIC, Its Regulatory Gene. J. Bacteriol. 1992, 174(10): 3395-3398.
-
[13] Spyridaki, A., et al. Structural and [21]
Biochemical Characterization of a New Mg2+ Binding Site Near Tyr94 in the Restriction Endonuclease PvuII. J.
Mol. Biol. 2003, 331: 395-406.
-
[14] Brown, T. A. Gene Cloning and DNA Analysis: An Introduction, Seventh Edition. Wiley Blackwell, 2016. [22]
-
[15] Bloch, K. D., dan B. Grossmann.
Digestion of DNA with Restriction Endonucleases. Current Protocols in Molecular Biology. 1995, 31: Suppl. 3.1.1-31.21.
-
[16] Harisha, S. An Introduction to [23]
Practical Biotechnology. Laxmi Publications, 2006.
-
[17] Gerstein, A. S. Molecular Biology Problem Solver: A Laboratory Guide. Wiley-Liss, 2001.
-
[18] Yowani, S. C dan I. N. Wirajana. Identifikasi Mutasi Gen rpoB Isolat MDR Mycobacterium tuberculosis di Bali dengan Metode Nested PCR.
Jurnal Farmasi Indonesia. 2014, 7(2). [24]
-
[19] Wijaya, M. D., I. N. Wirajana, dan S.
-
C. Yowani. Amplifikasi dan Identifikasi Mutasi Pada Fragmen 0,5 kb Gen rpoB Isolat 134 Mycobacterium tuberculosis
Multidrug Resistant dengan Metode Nested Polymerase Chain Reaction.
Jurnal Kimia. 2014, 8(2): 166-170. [25]
-
[20] Chen, L., X. Gan, N. Li, J. Wang, K.
-
Li, dan H, Zhang. rpoB gene mutation profile in rifampicin-resistant
Mycobacterium tuberculosis clinical isolates from Guizhou, one of the highest incidence rate regions in China. J. Antimicrob. Chemother.
2010, 65(6): 1299-1301.
Saeed, Z. B., et al. Characterization of molecular evolution in multi-drug resistant Mycobacterium tuberculosis in patients with active pulmonary tuberculosis of different regions in Belarus. Biology and Medicine. 2009, 1 (4): 39-49.
Bostanabad, S. Z., et al. Study of Genetic Evolution in Mycobacterium tuberculosis Isolates from Patients with Active Pulmonary Tuberculosis in the Iran and Belarus. The Open Microbiology Journal. 2011, 5: 32-42. Agdamag, D. M. D., S. Kageyama, R. Solante, A. S. Espantaloen, J. C. E. Sangco, dan Y. Suzuki.
Characterization of clinical isolates of Mycobacterium tuberculosis resistant to drugs and detection of RpoB mutation in multidrug-resistant tuberculosis in the Philippines. Int. J. Tuber. Lung. Dis. 2003, 7(11): 1104 -1108.
Bodmer, T., G. Zurcher, P. Imboden, dan A. Telenti. Mutation position and type of substitution in the β-subunit of the RNA polymerase influence in-vitro activity of rifamycins in rifampicin-resistant Mycobacterium tuberculosis. J. Antimicrob.
Chemother. 1995, 35: 345-348.
Sirgel, F. A., R. M. Warren, E. C. Bottger, M. Klopper, T. C. Victor, dan P. D. Helden. The Rationale for Using Rifabutin in the Treatment of MDR and XDR Tuberculosis Outbreaks. PLoS ONE. 2013, 8(3): e59414.
167
Discussion and feedback