SINTESIS KOMPOSIT ZnO-BENTONIT dan PENGGUNAANNYA DALAM PROSES DEGRADASI METHYL ORANGE
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 4, Nomor 2, Oktober 2016

SINTESIS KOMPOSIT ZnO-BENTONIT dan PENGGUNAANNYA
DALAM PROSES DEGRADASI METHYL ORANGE
Olivia Carolyn Sitepu1*, Oka Ratnayani2, Iryanti Eka Suprihatin2
1Program Sarjana Kimia Jurusan Kimia, Fakultas MIPA, Universitas Udayana, Bukit Jimbaran-Badung, Bali, Indonesia
2Jurusan Kimia, Fakultas MIPA, Universitas Udayana, Bukit Jimbaran-Badung, Bali, Indonesia
*email:olivia.sitepu@gmail.com
ABSTRAK: Penelitian ini bertujuan untuk menentukan kondisi optimum proses degradasi methyl orange dengan menggunakan komposit ZnO-bentonit. Komposit ZnO-bentonit telah disintesis melalui proses sonikasi menggunakan ultrasonic batch selama 3 jam. Komposit tersebut dikarakterisasi menggunakan FTIR, XRD dan SEM, dan kemudian diaplikasikan sebagai fotokatalis dalam proses degradasi methyl orange menggunakan iradiasi sinar UV. Kondisi optimumnya didapat pada pH 5, konsentrasi komposit ZnO-bentonit sebesar 10 g/L dan waktu iradiasi selama 15 menit. Pada kondisi optimum tersebut, dihasilkan degradasi methyl orange menggunakan komposit ZnO-bentonit sebesar 56,71±0,65%.
Kata kunci : Komposit, ZnO-bentonit, degradasi, methyl orange.
ABSTRACT: This research aims to determine the optimum conditions of degradation of methyl orange by using ZnO-Bentonite composite. ZnO-bentonite composite had been synthesized through sonicationby using ultrasonic batch for 3 hours. The particles were characterized by FTIR, XRD and SEM, and then applied as photocatalyst for degradation of methyl orange with UV irradiation. The optimum conditions were obtained at pH 5, composite concentration of 10 g/L, and irradiation time of 15 minutes. The result showed that at the optimum conditions, the percentage of degradation of methyl orange by using ZnO-bentonit composite was 56,71±0,65%.
Keywords : Composite, ZnO-bentonite, degradation, methyl orange.
Methyl orange adalah suatu molekul anionik yang merupakan zat warna azo yang diketahui dapat menyebabkan alergi hipersensitivitas [1]. Zat warna azo merupakan zat warna yang sangat stabil dan tidak mudah mengalami biodegradasi sehingga sulit untuk dihilangkan dari air buangan limbah.
Bentonit merupakan salah satu jenis tanah liat yang kini banyak digunakan dalam mengadsorpsi limbah-limbah organik. Bentonit adalah mineral alami dengan aluminium hidro silikat dan memiliki struktur berlapis yang terdiri dari silikat (Si2O5) terikat aluminium
oksida/hidroksida (Al2(OH)4), juga disebut lembar gibsit. Zat warna congo red mampu didegradasi hingga lebih dari 90% dengan penambahan 0,2 g Ca-bentonit [2]. Iraqi bentonit mampu mendegradasi zat warna methyl orange dengan kondisi adsorbansi methyl orange meningkat saat konsentrasi methyl orange berkurang dan konsentrasi bentonit ditingkatkan [3].
Metode lainnya yang ditawarkan dalam mendegradasi limbah zat warna yakni fotodegradasi yang berfokus pada reaksi reduksi oksidasi oleh fotokatalisis heterogen dengan melibatkan Proses Oksidasi Lanjut (AOPs) [4]. Oksida logam ZnO merupakan salah satu yang sering
digunakan. Secara energetik berdasarkan teori pita energi, tepung halus berukuran nano (nanoparticles) ZnO memiliki energi celah (band gap) sebesar 3,42 eV atau setara 329,98 kJ/mol sehingga memungkinkan terjadinya eksitasi elektron dari pita valensi ke pita konduksi setelah menyerap foton (fotokonduksi) membentuk pasangan h+PV dan e-PK [5]. Penelitian yang dilakukan Syukri, dkk. (2008) menunjukkan bahwa efisiensi fotodegradasi zat warna metilen biru dapat ditingkatkan hingga empat lipat dengan menggunakan ZnO sebagai fotokatalis [6]. Penggunaan katalis ZnO dalam proses fotodegradasi metilen biru dengan kondisi berat katalis ZnO optimum 40 mg, waktu penyinaran 5 jam, dan pH larutan 12 menghasilkan % degradasi sebesar 94,67% [7]. Zat warna methyl orange mampu didegradasi oleh nanopartikel ZnO dengan jumlah ZnO optimum yaitu 2,5 g/L dan pH optimum yaitu 7. Persentase degradasi methyl orange yang diperoleh dengan menggunakan nanopartikel ZnO ini mencapai hingga 90% [8].
Partikel nano ZnO yang diemban pada bentonit mampu mendegradasi Acid Yellow 11 hingga mencapai 90% [9].Bentonit yang dimodifikasi dengan menambahkan semikonduktor TiO2 dan ZnO dapat meningkatkan % degradasi masing-masing sebesar 98,9% dan 98,6% [10].Kemampuan kapasitas tukar kation yang tinggi pada bentonit membuat bentonit mampu dimodifikasi dengan semikonduktor. Berdasarkan penelitian yang telah dilakukan, sintesis komposit bentonit dengan beberapa jenis semikonduktor dapat meningkatkan kemampuannya dalam mendegradasi polutan-polutan yang terdapat dalam limbah.
Dengan demikian, pada penelitian ini komposit ZnO-bentonit akan disintesis untuk mendegradasi zat warna methyl orange.
-
2. PERCOBAAN
-
2.1 Bahan dan Peralatan
-
Bahan: seng asetat dihidrat; N,N-dimetilformamide (DMF); bentonit; zat warna methyl orange; akuades; akua DM; NaOH; dan alkohol.
Alat: alat-alat gelas, ayakan berukuran 53 µm, furnace/tanur oven, ultrasonic bath (S 450 H Elmasonic 37 kHZ), timbangan analitik, pengaduk magnetik, oven, pH meter, adaptor, botol vial, kotak radiasi, plastik hitam, lampu Philips TUV 15 W/G15 T8 dengan panjang gelombang 253,47 nm, XRD (X-ray Diffraction), spektroskopi FTIR Shimadzu/IR Prestige-21, Spektrofotometer UV-Vis 1800 Shimadzu, dan SEM (Scanning Electron Microscope).
Pada tahap pertama ini disebut dengan tahap pemurnian bentonit. Sampel bentonit digiling dan diayak dengan ukuran pengayak 53 µm kemudian dicuci dengan air sebanyak 3-4 kali. Selanjutnya bentonit tersebut diaduk selama 1 jam, dibiarkan satu malam, disaring dengan menggunakan vakum dan hasilnya diuapkan sampai didapatkan material yang kering.
Sintesis komposit ZnO-bentonit
Sintesis komposit ZnO-bentonit dilakukan dengan langkah sebagai berikut: 10 gram bentonit yang telah dimurnikan ditambahkan ke dalam larutan yang mengandung 2 gram seng asetat dihidrat yang dilarutkan dalam 250 mL DMF. Kemudian campuran ini disonikasi sekitar 3 jam hingga menghasilkan suspensi yang homogen. Kemudian ke dalam larutan ini ditambahkan 100 mL larutan NaOH 0,1 M dengan pengadukan yang konstan selama 1 jam. Selanjutnya, dilakukan sentrifugasi dengan kecepatan 3000-3500 rpm selama 10 menit. Endapan yang diperoleh dipisahkan dari supernatannya dan didispersikan dalam alkohol kemudian disaring. Padatan ini dikeringkan pada suhu 75ºC pada vakum selama 4 jam dan dikalsinasi pada suhu 200ºC selama 2-3
jam [11]. Selanjutnya bentonit dan komposit ZnO-bentonit yang telah diperoleh dikarakterisasi dengan
menggunakan FTIR, XRD, dan SEM.
Penentuan pH optimum
Sebanyak 4 buah gelas beker 100 mL yang telah dibungkus dengan plastik hitam masing-masing diisi dengan 50 mL methyl orange 25 ppm. Selanjutnya ke dalam masing-masing gelas beker tersebut ditambahkan komposit ZnO-bentonit sebanyak 100 mg dan pH kelima larutan diatur masing-masing yaitu pH 4; pH 5; pH 7; pH 9 dan pH 11. Masing-masing gelas beker dimasukkan ke dalam kotak radiasi dan plastik hitam dilepaskan. Selanjutnya larutan methyl orange dalam gelas beker diaduk dengan pengaduk magnet dan disinari dengan sinar ultraviolet dengan waktu penyinaran selama 3 jam. Kemudian, larutan dipisahkan dari komposit dan supernatannya dianalisis dengan spektrofotometer UV-Vis pada panjang gelombang 463,4 nm.
Penentuan konsentrasi komposit ZnO-bentonit optimum
Sebanyak 6 buah gelas beker 100 mL yang telah dibungkus dengan plastik hitam masing-masing diisi dengan 50 mL larutan methyl orange 25 ppm. Selanjutnya ke dalam gelas beker tersebut masing-masing ditambahkan komposit ZnO-bentonit sebanyak 100, 200, 300,400,500, dan 600 mg dan pH larutan diatur sesuai dengan pH. Masing-masing gelas beker dimasukkan ke dalam kotak radiasi dan plastik hitam dilepaskan. Selanjutnya larutan methyl orange dalam gelas beker tersebut diaduk dengan pengaduk magnet dan disinari dengan sinar ultraviolet dengan waktu penyinaran selama 3 jam.Kemudian, larutan dipisahkan dari komposit dan supernatannya dianalisis dengan spektrofotometer UV-Vis pada panjang gelombang 463,4 nm.
Penentuan waktu penyinaran optimum
Sebanyak 7 buah gelas beker 100 mL yang telah dibungkus dengan plastik hitam masing-masing diisi dengan 50 mL methyl orange 25 ppm. Selanjutnya ke dalam masing-masing gelas beker tersebut ditambahkan komposit ZnO-bentonit dengan konsentrasi dan pH larutan diatur sesuai dengan pH optimum. Masing-masing gelas beker dimasukkan ke dalam kotak radiasi dan plastik hitam dilepaskan. Selanjutnya larutan methyl orange dalam gelas beker diaduk dengan pengaduk magnet dan disinari dengan sinar ultraviolet dengan waktu penyinaran masing-masing yaitu 5, 15, 30, 60, 90,120, dan 180 menit.Kemudian, larutan dipisahkan dari komposit dan supernatannya dianalisis dengan spektrofotometer UV-Vis pada panjang gelombang 463,4 nm.
Bentonit yang telah dipreparasi dan komposit yang telah disintesis dikarakterisasi dengan menggunakan spektrofotometer FTIR, XRD, dan SEM yang bertujuan untuk mengetahui perbedaan yang terjadi antara bentonit dan komposit ZnO-bentonit.
Spektra hasil karakterisasi FTIR bentonit dan komposit ZnO-bentonit dapat dilihat pada Gambar 1 dan bilangan gelombang yang muncul pada spektra FTIR dapat dilihat pada Tabel 1.
Berdasarkan Gambar 1 terlihat bahwa muncul perbedaan puncak antara bentonit dan komposit. Puncak yang hanya muncul pada spektra komposit ZnO-bentonit terdapat pada bilangan gelombang 1417 cm-1 dan 1392 cm-1. Bilangan gelombang tersebut menurut Meshram et.al (2011) merupakan ciri dari gugus C-H yang berasal dari ligan monodentat asetat sebagai akibat dari penambahan Zn-asetat [11]. Beberapa penelitian menunjukkan puncak ZnO muncul pada bilangan
gelombang antara 400-500 cm-1[12,13] dan pada komposit ZnO-bentonit ini, keberadaan ZnO dikonfirmasi pada bilangan gelombang 491 cm-1.
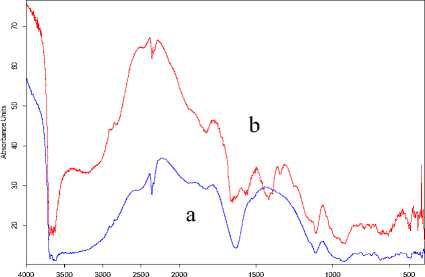
Gambar 1. Spektra FTIR (a) bentonit dan (b) komposit ZnO-bentonit
Tabel 1. Bilangan Gelombang Bentonit dan ZnO-bentonit
|
Bentonit (cm-1) |
ZnO-Bentonit (cm-1) |
Prediksi Gugus Fungsi |
|
3626 |
3624 |
OH stretching |
|
2358 |
2358 |
CO2 |
|
1826 |
1822 |
C=O |
|
stretching | ||
|
gugus karbonil | ||
|
organik | ||
|
1633 |
1666 |
H2O yang terikat pada permukaan/ OH bending |
|
1417 |
C-H bending | |
|
1392 | ||
|
1112 |
Si-O | |
|
491 |
Zn-O |
Gambar 2 menunjukkan difraktogram dari (a) bentonit dan (b) komposit ZnO-bentonit. Hasil karakterisasi dengan XRD diperoleh tiga puncak dengan intensitas kuat yang menyatakan kehadiran montmotrillonit. Tabel 2 menunjukkan nilai 2θdari bentonit dan komposit ZnO-
bentonit dan yang diperoleh tersebut sesuai dengan penelitian yang dilakukan oleh Fazmar (2009) [14].Puncak yang menunjukkan kehadiran dari ZnO dapat dilihat pada Tabel 3. Besar d spacing yang diperoleh tersebut telah sesuai dengan data JCPDS NO. 5-664. Nilai 2θ yang diperoleh juga telah sesuai dengan penelitian yang dilakukan oleh Fazmar (2009) [14].
Munculnya nilai d spacing ZnO pada data XRD menunjukkan bahwa komposit ZnO-bentonit telah berhasil disintesis.
Gambar 2. Spektra XRD (a) Bentonit dan(b) ZnO-bentonit
Tabel 2. Nilai 2θ Bentonit dan
Komposit ZnO-Bentonit
|
Bentonit |
ZnO-bentonit |
|
19,11 |
18,96 |
|
25,78 |
25,68 |
|
20 |
60,90 |
Tabel 3. d Spacing dan 2θ ZnO
ZnO
|
d spacing |
2θ |
|
2,816 |
31,74 |
|
1,911 |
47,54 |
|
1,406 |
66,41 |
|
1,359 |
69,04 |
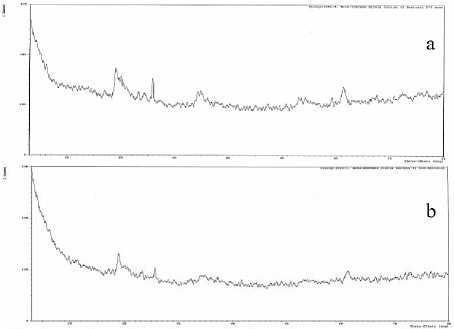
Karakterisasi menggunakan SEM ditunjukkan pada Gambar 3penampakan dari permukaan material komposit ZnO-Bentonit, dapat dilihat pada gambar A dengan perbesaran 5000x, bentuk kristal komposit tidak teratur dan pada gambar B dengan perbesaran 100.000 x terlihat dua jenis material dari perbedaan warna yang dapat kita asumsikan warna hitam sebagai permukaan dari bentonit dan warna putih yang timbul di atas warna hitam dapat kita asumsikan sebagai permukaan dari ZnO. Hal ini sesuai dengan formulasi pembentukan ZnO-bentonit, komposisi material bentonit lebih banyak dibandingkan ZnO.

(a)
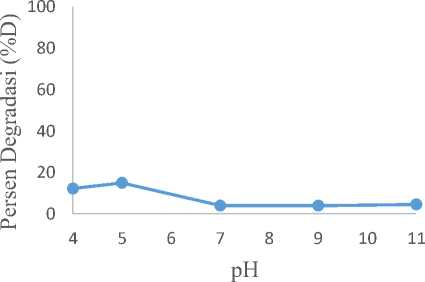
yangterlihat pada Gambar 4 ditunjukkan bahwa pH optimum yang diperoleh dalam proses degradasi methyl orange adalah 5. Pada Gambar 4 terlihat persentase degradasi methyl orange mengalami peningkatan saat larutan menunjukkan pH 5, namun setelahnya mengalami penurunan persentase degradasi. Hasil pengamatan ini dapat dijelaskan berdasarkan muatan yang dimiliki oleh komposit ZnO-bentonit danmethylorange.
Pada kondisi asam, permukaan komposit ZnO-bentonit bermuatan positif (Meshram, et. al, 2011) [11] dan methyl orange berada dalam bentuk anionnya pada jarak pH yang cukup lebar [15]. Reaksi yang terjadi pada ZnO dalam kondisi asam adalah sebagai berikut
ZnO + 2H+ → Zn2+ + H2O
Sedangkan, kondisi asam juga menyebabkan dihasilkannya H+ lebih banyak sehingga memungkinkan terjadinya pertukaran kation K+, Na+, dan Ca2+ oleh H+ pada bentonit [16]. Keberadaaan ion H+ mengakibatkan terjadinya ikatan hidrogen dengan atom oksigen pada molekul methyl orange.

(b)
11:22:32 AM 25.00 kV 1O0 OOOx 0.9 mm 1.7 ETD OoI StateUnivefSitvOfMaIam
Gambar 3. SEM komposit ZnO-bentonit (a) 5000x dan (b) 100.000x
Salah satu parameter yang berperan penting dalam proses degradasi adalah pH. Penentuan pH optimum dalam proses degradasi methyl orange dilakukan pada pH 4, 5, 7, 9, dan 11. Grafik hubungan antara pH dengan persentase degradasi
Gambar 4. Grafik pH Optimum ZnO-bentonit
Perbedaan muatan yang terjadi membuat methyl orange mudah menempel pada permukaan komposit ZnO-bentonit. Selain memungkinkan penempelan methyl orange pada permukaan komposit ZnO-bentonit, penelitian yang dilakukan oleh Niu (2012) pada permukaan TiO2 dapat
mempercepat transfer elektron pada kondisi asam, memfasilitasi pembentukan pasangan elektron-hole[17]. Elektron tersebut akan bereaksi dengan O2 yang teradsorp pada permukaan nanokompsit ZnO-bentonit membentuk H2O2. H2O2 yang bereaksi dengan elektron pada pita konduksi akan terbentuk radikal OH∙. Hal inilah berlaku pula pada proses degradasi methyl orange pada pH 5.
Hasil degradasi methyl orange dengan variasi konsentrasi komposit ZnO-bentonit dapat dilihat pada Gambar 5.
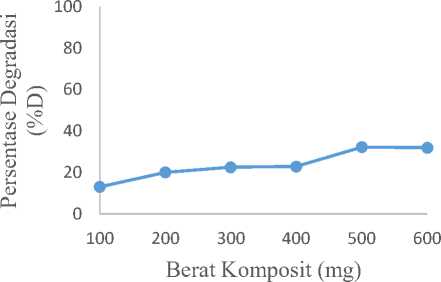
Gambar 5. Grafik berat komposit ZnO-bentonit optimum.
Berdasarkan hasil yang diperoleh terlihat bahwa persentase degradasi methyl orange meningkat seiring bertambahnya berat komposit ZnO-bentonit dan persentase degradasi terbesar diperoleh pada 500 mg komposit ZnO-bentonit, yang berarti bahwa konsentrasi komposit optimum yang dibutuhkan adalah 10 g/L. Namun persentase degradasi methyl orange menurun ketika 600 mg komposit ZnO-bentonit ditambahkan ke dalam larutan methyl orange. Hal ini disebabkan karena penambahan komposit yang terlalu banyak dapat menyebabkan kekeruhan pada larutan methyl orange sehingga sinar UV yang dipancarkan tidak dapat terserap secara maksimal ke permukaan komposit ZnO-bentonit dan menghalangi terjadinya proses fotokatalisis [18].
Penentuan waktu penyinaran optimum dilakukan bertujuan untuk mengetahui berapa lama waktu yang diperlukan komposit ZnO-bentonit dalam mendegradasi methyl orange dalam jumlah besar. Hasil degradasi methyl orange dengan variasi konsentrasi kompositZnO-bentonit dapat dilihat pada Gambar 6.

0 30 60 90 120 150 180
Waktu Penyinaran (menit)
Gambar 6. Grafik waktu penyinaran Optimum.
Pada grafik tersebut ditunjukkan bahwa persentase degradasi methyl orange terbesar diperoleh pada menit ke-15 dengan besar persentase degradasi yaitu 55,48%. Setelah menit ke-15, persentase degradasi methyl orange terus mengalami penurunan. Penurunan persentase degradasi ini menunjukkan bahwa proses yang terjadi dalam degradasi methyl orange didominasi oleh adsorpsi methyl orange pada bentonit, sedangkan fotokatalis ZnO yang terdapat pada bentonit kurang berperan aktif dalam mendegradasi methyl orange. Penyebaran ZnO yang tidak merata pada bentonit merupakan salah satu faktor yang menyebabkan kurang berperannya ZnO dalam proses degradasi methyl orange. Senyawa methyl orange yang awalnya menempel pada permukaan komposit ZnO-bentonit terlepas kembali dalam bentuk larutannya akibat ikatan hidrogen yang terjadi antara ion H+ pada bentonit dengan atom oksigen pada molekul methyl orange. Terlepasnya methyl orange dari permukaan
komposit ZnO-bentonit mengindikasikan terjadinya adsorpsi fisika dalam proses degradasi methyl orange. Adsorpsi fisika sendiri melibatkan ikatan-ikatan lemah, sehingga adsorbat dapat terlepas dari adsorbennya.
Kondisi optimum yang diperoleh dalam proses degradasi methyl orange yaitu pada pH 5 dengan konsentrasi komposit ZnO-bentonit sebesar 10 mg/L dan dengan waktu penyinaran selama 15 menit dengan hasil persentase degradasi sebesar 56,71±0,65%.
Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah banyak membantu, memberikan dukungan dan nasehat selama dilakukannya penelitian ini.
-
[1] Deligeer W., Gao Y. W., and Asuha
S., 2011, Adsorption of Methyl
orange on Mesoporous γ-Fe2O3/SiO2 Nanocomposite, Appl Sur Sci, 257 (8) : 3524-3528.
-
[2] Lian, L., Guo L., and Guo C., 2009, Adsorption of Congo Red from Aqueous Solutions onto Ca-bentonite, Journal of Hazardous Materials 161: 126–131.
-
[3] Al-heetimi, D. T. A., Dawood, A. H.,
Khalaf, Q. Z., Himdan, T. A., 2012, Removal of Methyl orange From Aqueous Solution By Iraqi Bentonite Adsorbent, Ibn Al-Haitham Journal for Pure and Applied Science, 25 (2) : 328-339.
-
[4] Cent, G. and S. Perathone,2009,
One-step H2O2 and Phenol Syntheses: Examples of Challenges for New Sustainable Selective Oxidation Processes, Catal, Today, 143 (1–2) : 145–150.
-
[5] Hoffmann, M. R., Martin, S. T.,
Choi, W., and Bahnemannt, D.W.,
1995, Environmental Applications of Semiconductor Photocatalysis,Chem. Rev., 95: 69-96.
-
[6] Syukri, D., Aziz, H., dan Alif, A.,
2008, Seng Oksida (ZnO) Sebagai Fotokatalis Pada Proses Degradasi Senyawa Biru Metilen, Jurnal Ris.Kimia, 1 (2) : 179-186.
-
[7] Diantariani, N.P., Widihati, I.A.G.,
dan Ratih M.I.G.A.A., 2014,
Fotodegradasi Metilen Biru dengan Sinar Ultraviolet dan Katalis ZnO, Jurnal Kimia 8 (1) : 137-143.
-
[8] Chen, C., Liu, J., Liu, P., and Yu, B., 2011, Investigation of Photocatalytic Degradation of Methyl Orange by Using Nano-Sized ZnO Catalysts, Advances in Chemical Engineering and Science, 1 : 9-14.
-
[9] Xu, H., Yu, T., Liu, J., 2014, Photodegradation of Acid Yellow 11 in Aqueous on Nano-ZnO/Bentonite Under Ultraviolet and Visible Light Irradiation, Materials Letters, 117 : 263-265.
-
[10] Al-Jobouri, I. S., Dhahir, S. A., and Al-Saade, K. A., 2013, Adsorption Study of Rhodamin B Dye on Iraqi Bentonite and Modified Bentonite by Nanocompounds TiO2, ZnO, Al2O3, and Sodium Dodecyl Sulfate, American Journal Of Environmental Science, 9 (3) : 269-279.
-
[11] Meshram, S., Limaye, R., Ghodke, S., Nigam S., Sonawane, S., and Chikate, R., 2011, Continuous Flow Photocatalytic Reactor Using ZnO-bentonite Nanocomposite for Degradation of Phenol, J. Chem. Engineering, 172 : 1008-1015.
-
[12] Saraswati, I. G. A. A., Diantariani, N. P., dan Suarya, P., 2015, Jurnal Kimia, 9 (2) : 175-182.
-
[13] Yulianti, C. H., 2012, Sintesis dan Karakterisasi Kristal Nano ZnO, Jurnal Teknika, 4 (2).
[14]Fazmar, A. F., 2009, Sintesis dan
Karakterisasi ZnO-Bentonit Serta Aplikasinya Sebagai Fotokatalis,
Skripsi, Universitas Indonesia, Depok.
-
[15] Apollo, S., Moyo, S., Mabuoa, G., and Aoyi, O., 2014, Solar
Photodegradation of Methyl Orange and Phenol Using Silica Supported ZnO Catalyst, International Journal of Innovation, Management, and
Technology, 5 (3) : 203-206.
-
[16] Susilawati, 2014, Adsorpsi Zat
Warna Biru Metilena oleh Lempung Bentonit Aktif, Jurnal Ris.Kimia, 7 (2) : 169-173.
-
[17] Niu, P., 2012, Photocatalytic
Degradation of Methyl Orange i Aqueous TiO2 Suspensions, Asian Journal of Chemistry, 25 (2) : 11031106.
-
[18] Widiantini, N. L. P., 2010,
Fotodegradasi Congo Red dengan Sinar UV, Katalis ZnO, dan Oksidator H2O2, Skripsi, Universitas Udayana, Denpasar.
160
Discussion and feedback