AKTIVITAS ANTIOKSIDAN BIJI KAKAO (Theobroma cacao L.) DALAM MENURUNKAN KADAR 8-HIDROKSI-2’-DEOKSIGUANOSIN DALAM URIN TIKUS SETELAH TERPAPAR ETANOL
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 4, Nomor 2, Oktober 2016
I Ca⅛ra ■ rIQimia
AKTIVITAS ANTIOKSIDAN BIJI KAKAO (Theobroma cacao L.) DALAM MENURUNKAN KADAR 8-HIDROKSI-2’-DEOKSIGUANOSIN DALAM URIN TIKUS SETELAH TERPAPAR ETANOL
Mahardika Aprilia Iflahah 1, Ni Made Puspawati1,2, Ni Made Suaniti1,2
-
1 Magister Kimia Terapan, Pascasarjana Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali
-
2 Jurusan Kimia FMIPA, Universitas Udayana, Bukit Jimbaran, Telp. (0361)703137, Bali mahardika.aprilia@gmail.com
ABSTAK: Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan biji kakao pada fraksi yang memiliki aktivitas antioksidan paling tinggi secara in vitro dalam menurunkan kadar 8-OHdG dalam urin tikus yang terpapar etanol. Uji aktivitas antioksidan dilakukan dengan metode DPPH dan pengukuran kadar 8-OHdG dalam urin tikus dilakukan dengan metode ELISA. Biji kakao dimaserasi dengan pelarut etanol dan selanjutnya dipartisi dengan pelarut n-heksana, etil asetat, dan n-butanol. Uji aktivitas antioksidan secara in vitro dengan metode DPPH menunjukkan bahwa fraksi n-butanol memiliki aktivitas antioksidan paling tinggi dengan nilai IC50 170 ppm. Berdasarkan analisis statistik, data kadar 8-OHdG pada kelompok pemberian fraksi n-butanol berbeda nyata (p<0,05). Sehingga, pemberian fraksi n-butanol berpengaruh terhadap penurunan kadar 8-OHdG dalam urin tikus yang terpapar etanol dibandingkan dengan kelompok kontrol negatif dengan efektivitas penurunan kadar 8-OHdG untuk dosis 50 mg/kg BB; dosis 100 mg/kg BB; dan 200 mg/kg BB berturut-turut adalah 21,20%, 31,34%, dan 35,28%.
Kata Kunci: Theobroma cacao L., antioksidan, 8-OHdG
ABSTRACT: This study aimed to determine antioxidant activity of cocoa beans in fraction that has the highest antioxidant activity in lowering 8-OHdG level in urine after exposuring to ethanol. Antioxidant activity test was conducted using DPPH and measurement 8-OHdG level in urine was carried out by ELISA. Cocoa beans was macerated with ethanol and partitioned with n-hexane, ethyl acetate, and n-butanol. Antioxidant activity test by DPPH method showed that n-butanol fraction has the highest antioxidant activity with IC50 value of 170 ppm. Based on statistical analysis, n-butanol fraction was significantly reduced the urinary level of 8-OHdG (p<0,05) in rats after exposuring to ethanol compared to negative control group. The level effectiveness of n-butanol fraction in decreasing the level of urinary 8-OHdG was 21,20% at dose 50 mg/kg of BW; 31,34% at dose 100 mg/kg of BW; and 35,28% at dose 200 mg/kg of BW.
Keywords: Theobroma cacao L., antioxidant, 8-OHdG
Gaya hidup yang berpengaruh buruk terhadap kesehatan salah satunya adalah mengonsumsi minuman beralkohol. Bahan aktif dari minuman beralkohol adalah etanol yang memiliki efek depresan yaitu berpengaruh menekan susunan saraf pusat [1]. Metabolisme etanol di dalam sel hati menyebabkan peningkatan produksi radikal bebas dengan berbagai mekanisme [2].
Radikal bebas berbahaya yang disebabkan oleh kedua sifat radikal bebas, yaitu reaktivitas yang tinggi dan kecenderungannya membentuk radikal baru. Radikal bebas yang banyak terlibat dalam proses patologis adalah Radical Oxygen Species (ROS) [3]. Radikal bebas sering menjadi pemicu timbulnya berbagai masalah kesehatan seperti penyakit jantung koroner, kanker, liver, katarak, menurunnya fungsi ginjal, dan proses penuaan dini. Sasaran oksidasi oleh ROS
adalah makromolekul seperti lipid, karbohidrat, protein, dan DNA (Deoxy Nucleic Acid) [4]. Kenaikan kadar ROS dapat menimbulkan kondisi yang dinamakan stres oksidatif [5]. Antioksidan adalah senyawa yang mampu menangkal atau meredam dampak negatif oksidan dalam tubuh [6].
Biji buah kakao mengandung cukup tinggi senyawa yang aktif sebagai antioksidan, diantaranya adalah katekin 3342 %, leukosianidin 23- 25%, dan antosianin 5%. Sedangkan pada biji kakao bubuk bebas lemak mengandung 5-18% senyawa polifenol seperti katekin dan antosianin [7]. Sebanyak 60% dari total fenolik pada biji kakao mentah adalah monomer flavanol (epikatekin dan katekin) dan oligomer proanidin (dimer hingga decamer) [8].
Senyawa 8-OHdG merupakan senyawa yang mudah larut dalam air dan secara langsung diekskresikan melalui urin sebagai penanda kerusakan DNA yang paling banyak terdeteksi dalam urin [9]. Di dalam tubuh, 8-OHdG dihasilkan dari oksidasi DNA yaitu nukleotida guanin oleh ROS. Hal ini menyebabkan keadaan yang disebut mutasi DNA [10]. Oleh karena itu, dilakukan penelitian mengenai aktivitas antioksidan dalam biji buah kakao dan pengaruhnya terhadap penurunan tingkat stres oksidatif yang ditunjukkan dengan penurunan kadar 8-OHdG dalam sampel urin tikus yang dipaparkan etanol dengan ELISA (Enzyme Linked Immunosorbent Assay.
Bahan – bahan kimia yang digunakan dalam derajat pro analisis yaitu etanol, n-heksana, etil asetat, n-butanol, metanol, akuades, NaOH, H2SO4, asam asetat, DPPH, reagen ELISA, sampel biji kakao matang, hewan uji tikus, dan sentrat untuk makanan tikus.
Alat-alat yang digunakan adalah ELISA kit 8-OHdG, ELISA reader, kandang tikus, wadah penampung urin, sarung tangan, sonde, neraca analitik, gelas ukur, gelas beker, pipet volume, pipet mikro, labu ukur, botol vial, corong pisah, blender, batang pengaduk.
Biji buah kakao yang telah dihaluskan direndam dengan pelarut etanol 70% hingga semua terendam sempurna, kemudian dibiarkan selama 24 jam, sesekali diaduk setiap 2 jam sekali. Ekstrak yang diperoleh kemudian dipisahkan dari ampasnya dengan cara disaring. Kemudian ampas dimaserasi kembali dengan pelarut yang sama. Selanjutnya filtrat digabung dan dipekatkan dengan rotatory vacum evaporator. Ekstrak pekat dilarutkan dalam etanol dan air (3:7), etanol diuapkan sehingga menghasilkan ekstrak biji buah kakao dalam fase air (larutan ekstrak).
Larutan ekstrak dipartisi dengan n-heksana, etil asetat, dan n-butanol.Sehingga didapatkan fraksi n-heksana (FH), fraksi etil asetat (FE), dan fraksi n-butanol (FB). Selanjutnya dilakukan uji aktivitas antioksidan secara in vitro dengan metode DPPH. Fraksi yang memiliki aktivitas antioksidan paling tinggi selanjutnya diberikan pada hewan uji untuk uji secara in vivo untuk mengetahui pengaruh biji buah kakao dalam menurunkan kadar 8-OHdG.
Penentuan Aktivitas Antioksidan dengan DPPH
FH, FE, dan FB dengan berbagai konsentrasi ditambahkan masing-masing sebanyak 1 mL DPPH, lalu divortex dan didiamkan selama 30 menit. Absorbansi diukur secara spektrofotometri UV-Vis pada panjang gelombang 517 nm.
Perlakuan Hewan Uji
Hewan uji yang digunakan sebanyak 20 ekor dan dibagi menjadi 5 kelompok. Masing-masing kelompok diberi perlakuan etanol sebanyak 1 mL selama 28 hari. Selanjutnya, pada hari ke-29 urin ditampung dan digunakan sebagai uji pre test. Kelompok P1 dijadikan sebagai kontrol negatif, P2 diberikan vitamin E dosis 100 mg/kg BB, P3 diberikan fraksi dosis 50 mg/kg BB, P4 diberikan fraksi dosis 100 mg/kg BB, dan P5 diberikan fraksi dengan dosis 200 mg/kg BB. Masing-masing perlakuan diberikan selama 14 hari. Selanjutnya, urin ditampung dan digunakan sebagai uji post test.
Analisis 8-OHdG dalam Urin
Analisis dilakukan secara immunoassay menggunakan kit ELISA dan dilakukan pembacaan dengan elisa reader pada 450 nm.
Analisis Data
Aanalisis statistik dengan software SPSS for windows 16.0, meliputi analisis deskriptif, uji normalitas dengan Shapiro-Wilk, uji homogenitas dengan Levene Test, Uji komparasi dengan uji one way Anova untuk mengetahui perbedaan antara kelompok dan dilanjutkan dengan Least Significant Differences (LSD) test. Derajat kemaknaan pada penelitian ini adalah 0,05.
-
3. HASIL DAN PEMBAHASAN
Ekstraksi dan Fraksinasi
Sebanyak 4,5 kg biji kakao dilakukan ekstraksi menggunakan metode ekstraksi padat-cair yaitu maserasi sebanyak 2 kali dengan total menggunakan 15L pelarut etanol 70%. Proses maserasi menghasilkan 303 g ekstrak pekat etanol. Hasil uji fitokimia ekstrak etanol menunjukkan positif senyawa golongan fenolik, flavonoid, terpenoid, steroid, saponin, dan alkaloid. Golongan senyawa tersebut kemungkinan dapat berpotensi sebagai antioksidan yaitu flavonoid dan fenolik.
Hasil partisi menggunakan n-heksana menghasilkan FH dengan warna coklat muda sebanyak 99,5g. Hasil partisi menggunakan etil asetat menghasilkan FE dengan warna coklat sebanyak 11,625g. Hasil partisi menggunakan n-butanol menghasilkan FB dengan warna kuning kecoklatan sebanyak 7,05g.FH, FE, dan FB dilakukan uji fitokimia yang ditampilkan pada Tabel 1.
Penentuan Aktivitas Antioksidan dengan DPPH
Metode DPPH digunakan untuk mengukur kemampuan antioksidan untuk mengikat radikal bebas yang ditunjukkan dengan nilai IC50.Nilai IC50 menunjukkan konsentrasi sampel yang dapat meredam radikal bebas sebesar 50%.Semakin rendah
nilai IC50 makin tinggi pula aktivitas antioksidan dari sampel.Nilai IC50 dari FH, FE, FB ditunjukkan dalam Gambar 1.
Fraksi n-butanol memiliki aktivitas antioksidan yang paling tinggi daripada fraksi etil asetat dan fraksi n-heksana. Aktivitas antioksidan dari FB paling tinggi diantara FH dan FE juga dapat terlihat dari uji fitokimia. Bahwa, pada uji senyawa golongan flavonoid dan fenolik yang merupakan senyawa antioksidan pada FB memiliki intensitas warna yang lebih tinggi daripada FE sedangkan pada FH negatif.
Aktivitas antioksidan ekstrak etanol biji kakao pada fraksi n-butanol masih dikatakan lemah. Tingkatan aktivitas antioksidan berdasarkan nilai IC50 dengan metode DPPH dibagi menjadi 4.Antioksidan sangat kuat memiliki nilai IC50 kurang dari 50 ppm, antioksidan kuat memiliki nilai IC50 50-100 ppm, antioksidan sedang memiliki nilai IC50 101-150 ppm, dan antioksidan lemah memiliki nilai IC50 lebih dari 150 ppm [10].
Tabel 1. Hasil Uji Fitokimia FH, FE, dan FB
|
Senyawa Golongan |
FH |
FE |
FB |
|
Fenolik |
- |
+ |
++ |
|
Flavonoid |
- |
+ |
++ |
|
Terpenoid |
+ |
+ |
- |
|
Alkaloid |
- |
+ |
- |
Ket : (-) = negatif/tidak mengandung senyawa yang diuji
(+) = positif/mengandung senyawa yang diuji (++) = mengandung senyawa yang diuji dengan intensitas warna lebih pekat
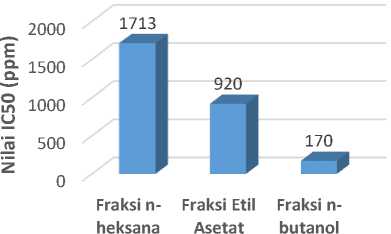
Gambar 1. Nilai IC50 dari FH, FE, dan FB
Kemampuan antioksidan dalam meredam DPPH ditentukan oleh struktur kimia, jumlah dan posisi gugus hidroksil pada cincin.
Molekul tersubstitusi gugus hidroksil semakin banyak semakin kuat menangkap radikal bebas DPPH karena kemampuan mendonorkan atom hidrogen semakin besar [11]. Makin banyak jumlah hidroksil dalam senyawa makin tinggi pula kepolarannya. Sehingga, dalam penelitian ini senyawa dengan aktivitas antioksidan lebih tinggi lebih banyak larut dalam pelarut n-butanol daripada pelarut n-heksana dan etil asetat.
Analisis 8-OHdG dalam Urin
Analisis senyawa 8-OHdG dalam urin dilakukan dengan metode ELISA. ELISA KIT yang digunakan dalam penelitian ini dari “Elabscience”. Menurut uji pendahuluan, terjadi peningkatan kadar 8-OHdG dalam urin tikus yang terpapar etanol dibandingkan dengan tikus yang tidak diberi perlakuan etanol.
Pemberian perlakuan fraksi n-butanol terhadap hewan uji berpengaruh terhadap penurunan kadar 8-OHdG dalam urin. Data kadar 8-OHdG baik sebelum dan sesudah perlakuan dilakukan uji normalitas dengan uji Shapiro-Wilk. Hasilnya menunjukkan data berdistribusi normal (p>0,05). Data kadar 8-OHdG baik sebelum dan sesudah dilakukan uji homogenitas dengan menggunakan uji Levene-Test. Hasilnya menunjukkan data homogen (p>0,05). Hasil uji ANOVA pada masing-masing kelompok setelah pemberian fraksi n-butanol menunjukkan berbeda secara bermakna (p<0,05).
Untuk mengetahui kelompok yang berbeda dengan kelompok kontrol dan kelompok perlakuan perlu dilakukan uji lanjutan dengan LSD. Hasil dari uji LSD menunjukkan bahwa tiap kelompok perlakuan berbeda secara bermakna. Sehingga, masing-masing perlakuan memiliki perbedaan kemampuan dalam menurunkan kadar 8-OHdG dalam urin. Kadar 8-OHdG setelah pemberian perlakuan ditampilkan dalam Tabel 2. Kadar 8-OHdG pada setiap kelompok sebelum dan sesudah perlakuan pemberian fraksi n-butanol disajikan dalam Gambar 2 yang menunjukkan bahwa terjadi penurunan kadar 8-OHdG dalam urin tikus setelah pemberian fraksi n-butanol dibandingkan dengan kelompok kontrol negatif.
Prosentase penurunan kadar 8-OHdG dalam urin tikus disajikan dalam Gambar 3. Hasil penelitian menunjukkan bahwa, dengan peningkatan dosis pada fraksi n-butanol dapat meningkatkan efek penghambatan peningkatan kadar 8-OHdG dalam urin tikus yang terpapar etanol
Kelompok kontrol negatif mengalami kenaikan kadar 8-OHdG karena pada kelompok tersebut hewan uji hanya diberikan etanol selama 28 hari dan setelah itu tidak diberi perlakuan apapun. Hal tersebut dapat menaikkan kadar stres oksidatif pada kelompok tersebut yang ditandai dengan kenaikan kadar 8-OHdG pada urin. Kelompok kontrol positif, kelompok perlakuan dosis 50 mg/kg BB, kelompok perlakuan dosis 100 mg/kg BB, dan kelompok perlakuan dosis
Tabel 2. Kadar 8-OHdG setelah perlakuan
|
Kelompok |
Rerata |
p |
|
Kontrol negatif Kontrol positif (vitamin E) |
6,023a 5,124b |
0,000* |
|
Dosis 50 |
4,709c | |
|
Dosis 100 |
4,341d | |
|
Dosis 200 |
3,972e |
Ket: * = berbeda secara bermakna (p<0,05). Nilai rerata yang diikuti dengan huruf berbeda berarti berbeda secara bermakna.
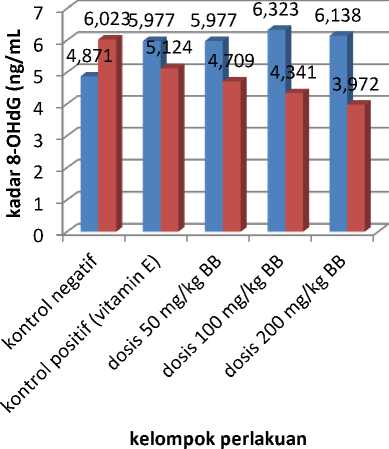
Gambar 2.Grafik Kadar 8-OHdG pada kelompok perlakuan
Ket: = sebelum perlakuan
= sesudah perlakuan
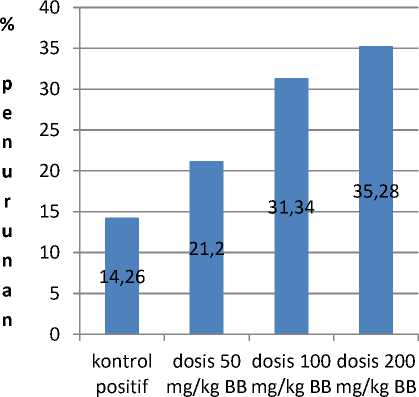
kelompok perlakuan
Gambar 3. Prosentase penurunan kadar 8-OHdG setelah pemberian vitamin E dan fraksi n-butanol
200 mg/kg BB mengalami penurunan kadar 8-OHdG setelah pemberian perlakuan. Hal tersebut karena kandungan antioksidan yang terdapat pada kelompok kontrol positif yaitu vitamin E dan pada kelompok perlakuan berdasarkan hasil uji fitokimia adalah golongan flavonoid dan fenolik.
Etanol yang tertelan selanjutnya mengalami proses absorbsi dan metabolisme. Metabolisme etanol di hati akan menghasilkan asetaldehid dengan proses oksidasi oleh alkohol dehidrogenase (ADH), kemudian menjadi asam asetat oleh aldehid dehidrogenase (ALDH). Untuk melengkapi reaksi ini, hidrogen yang dilepaskan selama proses oksidasi harus ditransfer ke substansi yang dapat berperan sebagai aseptor hidrogen. Pada ADH dan ALDH, yang berperan sebagai aseptor hidrogen adalah koenzim Nikotamida Adenin Dinukleotida (NAD). Setelah menerima hidrogen, NAD berubah menjadi NADH. NADH ini dapat kembali melepaskan hidrogen yang baru saja diperoleh untuk reaksi metabolisme lainnya, sehingga NAD tersedia kembali sebagai aseptor hidrogen.Regenerasi NAD dan NADH yang terjadi dalam mitokondria inilah yang mendorong terbentuknya ROS.
Konsumsi etanol dapat meningaktkan radikal bebas di dalam tubuh karena etanol
dapat merangsang sitokrom P450 menghasilkan radikal superoksida. Asetaldehid yang dihasilkan dari oksidasi etanol berikatan dengan glutation dapat menurunkan kemampuan glutation dalam melindungi tubuh dari H2O2 sehingga dapat meningkatkan pembentukan radikal hidroksil [12]
Jumlah teroksidasinya guanosin pada untai DNA berbanding lurus dengan banyaknya ROS. Ini berarti, makin tinggi jumlah ROS makin tinggi pula jumlah guanosin yang teroksidasi menjadi 8-OHdG. ROS menyerang atom C nomor 8 pada basa nukleotida. Meskipun basa nukleotida yang lain dapat juga teroksidasi oleh ROS dengan cara yang sama, namun hasil dari oksidasi guanosin menjadi 8-OHdG hasilnya paling melimpah karena relatif mudah terbentuk promutagenik, sehingga dijadikan biomarker terjadinya stres oksidatif yang potensial [13].
Mekanisme penghambatan peningkatan kadar 8-OHdG karena flavonoid (epicatechin, catechin dan procyanidin) yang terdapat pada ekstrak biji kakao bekerja dengan menangkap radikal bebas (free radical scavenger) terhadap radikal hidroksil, anion superoksida, radikal peroksil serta sebagai pengkelat Fe (chelating agent) yang merupakan katalis dalam pembentukan radikal hidroksil dari peroksida [16]. Flavonoid dapat meregenerasi α-tokoferol dan antioksidan lainnya dengan mendonorkan atom hidrogen kepada radikal α-tokoferol dan dapat berperan sebagai chelating agent serta mengikat logam redoks aktif termasuk Fe2+ dan Cu2+ yang terlibat pada pembentukan radikal bebas, sehingga mengurangi terbentuknya radikal OH [14].
Flavonoid merupakan senyawa antioksidan yang dapat pula menginduksi status antioksidan tubuh, termasuk SOD dan katalase. SOD (Superoxide Dismutase) merupakan enzim yang dapat mengkatalisis dismutasi superoksida menjadi oksigen dan hidrogen peroksida. Katalase merupakan enzim yang dapat mendekomposisi hidrogen peroksida menjadi air dan oksigen [6]
Kemungkinan penurunan 8-OHdG disebabkan oleh perbaikan DNA yang telah rusak (teroksidasi) oleh radikal bebas. Berikut adalah mekanisme perbaikan pada kerusakan
DNA untai tunggal yang memberikan kontribusi pada ekskresi 8-OHdG dalam urin.Perbaikan penghilangan basa (Base Excision Repair; BER) memperbaiki kerusakan pada satu nukleotida yang disebabkan oleh oksidasi.Basa dipotong oleh glikosilase dan digantikan dengan sintesis perbaikan dengan DNA ligase [15].
Berdasarkan hasil dari penelitian ini dapat disimpulkan bahwa fraksi n-butanol pada ekstrak etanol biji kakao memiliki aktivitas antioksidan paling tinggi secara in vitro dengan metode DPPH dibandingkan dengan fraksi n-heksana dan fraksi etil asetat dengan nilai IC50 = 170 ppm. Pemberian fraksi n-butanol berpengaruh terhadap penurunan kadar 8-OHdG dalam urin tikus yang terpapar etanol dibandingkan dengan kelompok kontrol negatif dengan efektivitas penurunan kadar 8-OHdG untuk dosis 50 mg/kg BB; dosis 100 mg/kg BB; dan 200 mg/kg BB berturut-turut adalah 21,20%, 31,34%, dan 35,28%.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada Prof. Dr. Drs. I Made Dira Swantara, M.Si; Dr. Dra Wiwik Susanah Rita, M.Si; serta Dr. Drs. I Made Oka Adi Parwata, M.Si yang telah memberikan masukan serta kritikan demi kesempurnaan dan kelancaran penelitian, penulisan tesis, hingga penyusunan jurnal ini.
-
[1] Joewana, S. 2001. Narkoba Petunjuk Praktis bagi Keluarga untuk Mencegah Penyalahgunaan Narkoba. Yogyakarta: Media Presindo
-
[2] Hernawati. 2009. Gambaran Efek Toksik Etanol pada Sel Hati. Bandung:
Universitas Pendidikan Indonesia
-
[3] Suryohudoyo, P. 1993. Oksidan, Antioksidan, dan Radikal Bebas.
Surabaya: Fakultas Kedokteran
Universitas Airlangga
-
[4] Sudjarwo. 2004. 8-hidroksi-
deoksiguanosin sebagai Salah Satu
Indikator Infertilitas Pria. Ber Penel Hayati. 10:43-47
-
[5] Wresdiyati, T. 2003. Aktivitas Anti Inflamasi Oleoresin Jahe (Zingiber officinale) pada Ginjal Tikus yang Mengalami Perlakuan Stres.Teknologi Industri Pangan. XIV(2).
-
[6] Winarsi, H. 2007. Antioksidan Alami dan Radikal Bebas Potensi dan Aplikasinya dalam Kesehatan. Yogyakarta: Kasinus
-
[7] Misnawi, S. 2005. Effect of Cocoa Liquor Roating on Polyphenol Content Hydrophobicity Astrigenc.ASEAN Food Journal. 12(2): 103-113.
-
[8] Dreosti, I. E. 2000. Antioxidant Capacity and Phenolic Content of Cocoa Beans.Food Chemistry. 100(4): 1523
1530.
-
[9] Boonla, C., Wunsuwan, R., and Tosukhowong, P. 2007. Urinary 8-hydroxydeoxyguanosine is Elevated in Patients with Neprholithiasis. Urol Res. 35(4): 185-191.
-
[10] Nihlati, I.A., Rohman, A., Hertiani, A. 2010. Daya Antioksidan Ekstrak Etanol Rimpang Temu Kunci [Boesenbergia Pandurata (Roxb.) Schlecth] Dengan Metode Penangkapan Radikal Dpph (1,1-Difenil-2-Pikrilhidrazil). Majalah Obat Tradisional. 58: 730-734.
-
[11] Widyawati, P.S., Wijaya, C.H., Harjosworo, P.S., Sajuthi, D. 2010. Pengaruh Ekstraksi Dan Fraksinasi Terhadap Kemampuan Menangkap Radikal Bebas DPPH (1,1-Difenil-2-Pikrilhidrazil) Ekstrak Dan Fraksi Daun Beluntas (Pluchea Indica Less). Rekayasa Kimia dan Proses. 18: C1-C7.
-
[12] Marks DB, Marks AD, Smith CM. The fed or absorptive state.1996. In: Basic Medical Biochemistry-A Clinical
Approach. Baltimore. MD: Williams & Wilkins
-
[13] Valavanidis, A., Vlachogianni, T., and Fiotakis, C. 2009. 8-hidroxy-2’-deoksiguanosin (8-OHdG): A Critical Biomarker of Oxidative Stress and Carcinogenesis. Journal of
Environmental Science and Health. 10590501.
-
[14] Zhu, Q.Y., Holt, R.R., Lazarus, S.A., Orozco, T.J., dan Keen, C.L. 2002. Inhibitory Effects of Cocoa Flavanols and Procyanidin Oligomers on Free Radical-Induced Erythrocyte Hemolysis. Exp Biol Med. 227 (5): 321-329.
-
[15] Tudek, B., Swoboda, M., Kowalcyzk, P., Olinskp, R. 2006. Oxidative DNA Damage Repair by The Diet, Inflamation and Neoplastic Transformation.Journal of Physiology and Pharmacology. 57: 3349.
-
[16] Baba, S., Osakabe, N., Kato, Y., Natsume, M., Yasuda, A., Kido, T., Fukuda, K., Muto, Y., dan Kondo, K. 2007. Continuous Intake of Polyphenolic Compounds Containing Cocoa Powder Reduces LDL Oxidative susceptibility and Has Beneficial Effects on Plasma HDL-Cholesterol Concentrations in Humans. Am. J. Clin. Nutr.. 85: 709-717
119
Discussion and feedback