COPROLOGICAL STUDY OF TREMATODE INFECTION IN REHABILITATED GREEN TURTLES AT THE TURTLE CONSERVATION AND EDUCATION CENTER BALI
on
Buletin Veteriner Udayana Volume 15 No. 5: 971-981
pISSN: 2085-2495; eISSN: 2477-2712 Oktober 2023
Online pada: http://ojs.unud.ac.id/index.php/buletinvet https://doi.org/10.24843/bulvet.2023.v15.i05.p34
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Studi Koprologi Infeksi Trematoda pada Penyu Hijau yang Direhabilitasi di Turtle Conservation and Education Center Bali
(COPROLOGICAL STUDY OF TREMATODE INFECTION IN REHABILITATED GREEN TURTLES AT THE TURTLE CONSERVATION AND EDUCATION CENTER BALI)
Aditia Permadi1, Ida Bagus Windia Adnyana2*, I Gusti Ayu Agung Suartini3
-
1Mahasiswa Sarjana Pendidikan Dokter Hewan Fakultas Kedokteran Hewan Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
2Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
3Laboratorium Biokimia, Fakultas Kedokteran Hewan Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia.
*Email: windiaadnyana@unud.ac.id
Abstrak
Infeksi trematoda dapat mempengaruhi dinamika populasi C. mydas di alam liar. Diversifikasi dan dinamika spatio-temporal lingkungan pesisir dan laut di Indonesia dapat menyebabkan komposisi komunitas trematoda yang berbeda di antara berbagai populasi C. mydas. Studi ini bertujuan untuk mengetahui jenis-jenis trematoda pada C. mydas yang hidup di salah satu ruaya pakan di Perairan Indonesia. Penelitian dilaksanakan di Turtle Conservation and Education Center (TCEC) Serangan, Bali. Sampel berjumlah sembilan ekor C. mydas remaja dengan panjang lengkung karapas antara 41 – 66 cm. Penyu-penyu tersebut adalah sitaan polisi dari upaya penyelundupan ke Bali, yang sebelumnya ditangkap di sekitar perairan Pulau Sapeken, Jawa Timur. Pemeriksaan parasit dilakukan dengan teknik koprologi Mini-Flotac® yang dikombinasikan dengan Fill-Flotac®. Telur diidentifikasi berdasarkan karakteristik morfologi dan morfometrinya dan jumlah telur per gram (EPG) feses dihitung sesuai dengan petunjuk teknis yang tersedia. Telur-telur trematoda yang ditemukan identik dengan Learedius learedi (Spirirorchiidae), Diaschistorchis pandus (Pronocephalidae), Octangium sagita (Pronocephalidae), serta Enodiotrema megachondrus (Plagiorchiidae). Prevalensi L. learedi dan D. pandus adalah 100%, sementara O. sagita dan E. megachondrus 77,7% dan 66,6%. EPG tertinggi ditemukan pada L. learedi (104±57), diikuti oleh D. pandus (42±14), O. sagita (32±28), dan E. megachondrus (23±19). Secara statistik, rerata EPG L. learedi berbeda nyata (P<0,05) dengan ketiga jenis parasit lainnya, sementara kepadatan EPG ketiga jenis parasit selain L. learedi tidak berbeda nyata (P>0,05). Hasil penelitian ini memberikan informasi dasar terkini tentang jenis dan prevalensi trematoda pada C. mydas yang hidup di Perairan Sapeken, Jawa Timur. Studi serupa yang melibatkan populasi penyu dari wilayah lain diperlukan untuk lebih memahami dinamika hubungan inang-parasit antar stok populasi penyu dari berbagai wilayah perairan di Indonesia.
Kata kunci: Koprologi; mini-flotac; penyu hijau; trematoda;
Abstract
Trematode infection can affect population dynamics of C. mydas in the wild. Diversification and spatio-temporal dynamics of coastal and marine environments in Indonesia can lead to different trematode community compositions among various populations of C. mydas. This study aims to determine the types of trematodes in C. mydas that live in one feeding ground of the Indonesian waters. The research was conducted at the Turtle Conservation and Education Center (TCEC) Serangan, Bali. Nine juveniles C. mydas with the curved carapace lengths between 41 – 66 cm were observed. The turtles are confiscated by the police from a smuggling attempt to Bali, which was previously caught in the waters around Sapeken Island, East Java. Parasite examination was carried out using the Mini-Flotac® coprology technique in combination with Fill-Flotac®. Eggs were identified based on their morphological and morphometric characteristics and the number of eggs per gram (EPG) of feces was
calculated according to available technical guidelines. Trematode eggs found were identical to Learedius learedi (Spirirorchiidae), Diaschistorchis pandus (Pronocephalidae), Octangium sagita (Pronocephalidae), and Enodiotrema megachondrus (Plagiorchiidae). The prevalence of L. learedi and D. pandus was 100%, while O. sagita and E. megachondrus were 77.7% and 66.6%. The highest EPG was found in L. learedi (104±57), followed by D. pandus (42±14), O. sagita (32±28), and E. megachondrus (23±19). Statistically, the mean EPG of L. learedi was significantly higher (P<0.05) from the other three types of parasites, while the EPG density of the three types of parasites other than L. learedi was not significantly different (P>0.05). The result provides an up-to-date baseline information on the type and prevalence of trematodes in C. mydas inhabited Sapeken waters of East Java. Similar studies involving turtle populations from other areas are needed to enhance the understanding of the host-parasite dynamics between turtle population stocks from various waters in Indonesia.
Keywords: Coprology; green turtles; mini-flotac; trematode
PENDAHULUAN
Wilayah cakupan hidup penyu hijau (Chelonia mydas) sangat luas, meliputi darat dan laut. Satwa ini berenang ratusan hingga ribuan kilometer selama masa hidup mereka yang panjang ketika berpindah dari ruaya pakan ke ruaya peneluran (Adnyana et al., 2008). Mereka menunggu puluhan tahun sampai bisa bereproduksi (Stubbs et al., 2020), bermigrasi ke pantai yang sama tempat mereka ditetaskan untuk bertelur (Lee et al., 2007). Penyu betina dapat bertelur ratusan telur dalam satu musim bertelur (Adnyana et al., 2008), namun hanya sedikit yang akan menghasilkan tukik yang bertahan hidup di tahun pertama kehidupannya (Hirth and Schaffer, 1974). Di luar tantangan alam yang signifikan ini, penyu hijau menghadapi berbagai ancaman seperti kerusakan habitat, perubahan iklim, polusi, akibat interaksi dengan aktivitas perikanan (fisheries bycatch), penangkapan penyu dan pengambilan telurnya secara berlebihan, serta penyakit (Adnyana dan Hitipeuw, 2009).
Penyu hijau membutuhkan pantai untuk bertelur. Pembangunan pesisir yang tidak terkendali, lalu lintas kendaraan di pantai, dan aktivitas manusia lainnya telah secara langsung merusak atau mengganggu habitat penelurannya (Santos et al., 2011). Di China, review komprehensif tentang kerusakan habitat penyu laut pernah dilakukan oleh Simon Kin-Fung Chan et al. (2007). Lampu dari jalan dan bangunan membuat tukik menjauh dari laut, dan lalu
lintas kendaraan di pantai memadatkan pasir, sehingga penyu betina tidak dapat menggali sarang telur. Ruaya pakan penyu seperti terumbu karang dan padang lamun rusak dan hancur oleh aktivitas di darat, termasuk sedimentasi dari pembukaan lahan dan aliran nutrisi dari pertanian. Proyek restorasi pantai untuk melindungi bangunan tepi laut juga dinyatakan membuat habitat peneluran menjadi hilang.
Selain kerusakan habitat, semua tahapan kehidupan penyu dipengaruhi oleh temperatur lingkungan. Peningkatan suhu yang berkepanjangan yang disebabkan oleh perubahan iklim mengganggu rasio kelamin tukik yang menetas di suatu pantai peneluran, mengakibatkan lebih sedikit tukik jantan (Suastika et al., 2012). Suhu permukaan laut yang lebih hangat juga dapat menyebabkan hilangnya ruaya pakan yang penting bagi penyu, terjadinya badai yang semakin parah dan kenaikan permukaan laut yang menghancurkan pantai-pantai yang kritis untuk bertelur dan merusak sarang (Esteban et al., 2020).
Polusi adalah ancaman serius bagi penyu laut. Penyu dapat salah mengira bahan plastik yang mengapung sebagai ubur-ubur dan dapat berdampak fatal saat mereka memakannya (Wilcox et al., 2018). Alat tangkap nelayan yang rusak dan dibuang ke laut (sering disebut jaring hantu) akan menjerat penyu dan dapat menenggelamkannya. Demikian pula dengan sampah plastik di pantai yang dapat menjebak tukik dan mencegahnya
mencapai laut (Kripa et al., 2023). Tumpahan minyak juga meracuni dan menyebabkan kematian penyu (Maulid et al., 2018).
Di Indonesia, diduga ribuan penyu secara tidak sengaja tertangkap pukat udang, di kail rawai, dan di jaring insang ikan setiap tahun (Zainudin et al., 2007). Mereka menjadi tangkapan sampingan perikanan hewan yang secara tidak sengaja tertangkap di jaring yang ditujukan untuk spesies lain. Penyu harus mencapai permukaan untuk bernapas dan karena itu banyak yang tenggelam begitu tertangkap. Penangkapan yang tidak disengaja oleh alat tangkap merupakan ancaman terbesar bagi sebagian besar penyu, terutama penyu lekang, penyu hijau, dan penyu belimbing yang terancam punah. Ancaman ini tampaknya semakin meningkat seiring dengan meluasnya aktivitas penangkapan ikan.
Penyu terus ditangkap secara tidak berkelanjutan baik untuk konsumsi manusia maupun perdagangan bagian-bagian tubuhnya. Daging dan telur penyu merupakan sumber makanan dan penghasilan bagi banyak orang di berbagai tempat. Ada juga yang memanfaatkan penyu untuk upacara keagamaan (Adnyana et al., 2010). Puluhan ribu penyu mati dengan cara ini setiap tahun, menghancurkan populasi penyu hijau dan penyu sisik yang sudah terancam punah. Pembunuhan penyu untuk pasar domestik dan internasional juga terus berlanjut. Perdagangan internasional semua spesies penyu dan bagian-bagiannya dilarang berdasarkan Konvensi Perdagangan Internasional Spesies Flora dan Fauna Liar yang Terancam Punah (CITES), suatu kesepakatan global antar pemerintah untuk mengatur atau melarang perdagangan internasional spesies yang terancam punah. Namun, perdagangan ilegal tetap ada, termasuk di Bali, satu wilayah yang sejak lama dikenal sebagai sentra dari perdagangan ilegal penyu laut di Indonesia (Adnyana et al., 2010).
Penyebab lain penurunan populasi penyu hijau adalah penyakit. Salah satu dari agen penyakit yang dewasa ini mendapat perhatian seksama adalah parasit, karena berhubungan erat dengan pola makan penyu hijau yang bersifat herbivora. Peran parasit telah menarik perhatian besar dalam konservasi satwa liar (Preston dan Johnson, 2010) dan parasitisme dipertimbangkan sebagai salah satu faktor utama yang mendasari dinamika populasi satwa liar (Irvina, 2006). Secara teoritis, parasit dapat mengatur ukuran (jumlah) populasi suatu spesies melalui dampaknya pada potensi reproduksi inang (Anderson dan May, 1978) dan pada mortalitas inang (Anderson dan May, 1978). Penyebaran parasit juga dapat meningkat pada populasi satwa liar, terutama ketika situasi dan kondisi ekologi serta faktor antropogenik mendukung (Kołodziej-Sobocińska, 2019). Ini dapat menjadi aspek yang sangat penting dalam konservasi spesies terancam punah (Thompson et al., 2010). Oleh karena itu, prevalensi dan komposisi komunitas spesies parasit pada populasi satwa liar perlu diketahui, agar pengelolaan status konservasinya lebih dapat dipahami.
Penelitian tentang parasit pada penyu laut sangat jarang di Indonesia. Satu-satunya kajian tentang hal itu pernah dilakukan pada tahun 1994 pada tempat pemotongan penyu di Tanjung Benoa - Bali (Adnyana et al., 2020). Saat itu, pemotongan penyu laut masih belum dilarang di Indonesia sehingga ada kesempatan bagi peneliti tersebut melakukan survey prevalensi trematodiasis di lokasi tempat pemotongan penyu (turtle abattoir) di Tanjung Benoa - Bali untuk memeriksa ada/tidaknya parasit dewasa pada berbagai organ tubuh penyu. Mengingat diversifikasi dan dinamika spatio-temporal lingkungan dan pesisir di perairan Indonesia, komposisi komunitas parasit mungkin berbeda di antara berbagai populasi penyu hijau. Oleh karena itu, ada kemungkinan bahwa populasi penyu hijau di Indonesia dengan ruaya pakan dan peneluran yang berbeda dapat memiliki
pola endoparasit yang berbeda. Dengan demikian, dalam rangka memberikan wawasan lebih lanjut, maka tujuan survei koprologi saat ini adalah untuk menetapkan garis dasar (baseline) endoparasit C. mydas di lokasi perairan Indonesia tertentu serta membahas potensi relevansi infeksi parasit yang terdeteksi dengan kesehatan penyu. Penelitian ini adalah bagian dari penelitian yang lebih besar tentang upaya untuk mengetahui status kesehatan penyu laut di Indonesia.
METODE PENELITIAN
Lokasi Penelitian
Penelitian ini dilaksanakan di Turtle Conservation and Education Center (TCEC) yang terletak di Pulau Serangan, Kabupaten Badung, Provinsi Bali (8o43’26” LS; 115o14’17” BT), yang berjarak ± 10 kilometer dari Kota Denpasar. TCEC yang dibangun pada tahun 2006 ini adalah pusat edukasi penyu laut di Bali yang juga dipergunakan sebagai lokasi rehabilitasi penyu-penyu laut terdampar atau hasil sitaan aparat penegak hukum sebelum kembali dilepas-liarkan ke habitat alamiahnya. Komplek ini dilengkapi dengan puluhan kolam-kolam kecil berdimensi 2 x 2 x 1 m (Panjang x lebar x dalam) untuk menampung penyu secara individual, serta satu kolam besar berdimensi 8 x 5 x 2 m untuk menampung penyu secara berkelompok.
Sampel
Sampel penelitian berjumlah sembilan ekor penyu hijau (C. mydas), berasal dari sitaan aparat penegak hukum pada tanggal 25 Oktober 2021 dari upaya penyelundupan penyu untuk tujuan konsumsi di Bali. Penyu-penyu tersebut diakui oleh pengangkut ditangkap di sekitar perairan Sapeken, Jawa Timur. Semua penyu berkategori juvenile (remaja) dengan rerata panjang lengkung karapas 55,9±9,2 cm (kisaran: 41 – 66 cm). Sesaat setelah tiba di TCEC, semua penyu diperiksa secara klinis, direhidrasi dengan terapi cairan, diberikan vitamin dan selanjutnya
dipelihara di kolam individu yang diisi air laut. Pemeriksaan klinis yang dilakukan meliputi pemeriksaan vitalitas, evaluasi sensorik, tonus otot atau kelenturan, keadaan gizi dan nafsu makan, tidak adanya cedera atau trauma pada jaringan keras, sirip dan kepala, serta kemampuan menyelam dan posisi mengambang. Karena metode untuk mendiagnosis infeksi trematoda didasarkan pada pemeriksaan feses untuk mendeteksi telur, sampel feses dikumpulkan sesegera mungkin (dari saat defekasi spontan pertama pasca dipelihara di kolam individu) dari setiap penyu. Masing-masing sampel dikumpulkan dalam pot penampung feses, diberi label nomor identifikasi penyu, disimpan dalam lemari pendingin sebelum diperiksa lebih lanjut.
Analisis kopromikroskopik kualitatif dan kuantitatif
Setiap sampel feses diperiksa dengan menggunakan teknik Mini-Flotac®, dikombinasikan dengan Fill-Flotac® dan larutan flotasi ZnSO4 (gravitasi spesifik 1.360). Metode ini dilaporkan memiliki sensitivitas analitik 5 telur per-gram (EPG) tinja (Cringoli et al., 2017). Untuk tujuan penelitian ini, teknik disesuaikan dengan volume feses yang kecil dari setiap penyu, seperti yang dianjurkan oleh Pace et al. (2019).
Telur diidentifikasi berdasarkan karakteristik morfologi dan morfometrinya sesua dengan “kunci identifikasi” yang disediakan oleh Greiner (2013). Jumlah EPG tinja dihitung sesuai dengan petunjuk teknis praktis yang dianjurkan oleh Cringoli et al. (2017). Secara ringkas prosedur pemeriksaan dilakukan dengan cara sebagai berikut. Sebanyak 1g feses penyu dimasukkan kedalam mini-flotac kemudian ditambahkan 1 ml formalin 5% dan dihomogenkan. Setelah itu, ditambahkan larutan pengapung zinc sulfate hingga mencapai 20 ml. Setelah larutan yang terbentuk dihomogenkan, kemudian disaring untuk mengisi dua ruang pengapungan. Setelah dibiarkan ± 5 - 10
menit, kemudian diperiksa di bawah mikroskop.
Analisis Statistik
Prevalensi masing-masing trematoda ditentukan sebagai jumlah penyu positif koprologi/jumlah penyu yang diperiksa X 100. Rerata, standar deviasi rerata, dan kisaran EPG dari feses dihitung. Selain itu, prevalensi dari infeksi oleh beberapa genus trematoda juga ditentukan. Perbedaan antara kepadatan EPG jenis satu dengan yang lainnya di analisis dengan Analisis Varian, yang jika hasilnya berbeda nyata, dilanjutkan dengan Uji Beda Nyata Terkecil (Least Significant Different, LSD).
HASIL DAN PEMBAHASAN
Hasil
Secara keseluruhan, telur cacing terdeteksi pada 9 (100%) dari 9 sampel feses penyu hijau yang diperiksa dengan teknik Mini-Flotac® yang dimodifikasi. Tiga tipe telur yang berbeda ditemukan (Gambar 1). Telur tipe 1 berbentuk memanjang dengan dua prosesus terminal pada masing-masing ujungnya, berwarna coklat kekuningan dan tanpa operkulum (Gambar 1a). Telur tipe 2 berbentuk ovoid (oval), berwarna kuning, tanpa operkulum (Gambar 1b). Telur tipe 3 berbentuk ovoid (oval) berwarna coklat kekuningan, dengan operkulum pada salah satu sisinya (Gambar 1c dan d). Morfologi dan morfometri telur-telur tersebut identik dengan telur trematoda Learedius learedi (Familia Spirirorchiidae, Gambar 1a),
Diaschistorchis pandus (Familia
Pronocephalidae, Gambar 1b dan c), Octangium sagita (Familia
Pronocephalidae, Gambar 1c), serta Enodiotrema megachondrus (Familia
Plagiorchiidae, Gambar 1d).
Prevalensinya, secara berurutan adalah L. learedi (100%), D. pandus (100%), O. sagita (77,7%), dan E. megachondrus (66,6%). Derajat infeksi yang diindikasikan dari jumlah telur per gram (EPG) tertinggi ditemukan pada L. learedi (104±57), diikuti oleh D. pandus (42±14), O. sagita (32±28),
dan E. megachondrus (23±19). Secara statistik, rerata EPG L. learedi berbeda nyata (P<0,05) dengan ketiga jenis parasit lainnya. Kepadatan EPG ke-tiga jenis parasit selain L. learedi tidak berbeda nyata (P>0,05) (Tabel 1).
Masing-masing penyu terinfeksi oleh 2 – 4 jenis trematoda. Infeksi oleh dua jenis trematoda terdeteksi pada 1 (11,1%) sampel feses penyu hijau sedangkan infeksi oleh tiga dan empat jenis trematoda dideteksi pada 3 (33,3%) dan 5 (55,6%) sampel feses penyu hijau (Tabel 2).
Pembahasan
Hasil penelitian ini memberikan informasi dasar (baseline) terkini tentang infeksi cacing pada C. mydas yang ditangkap dari salah satu perairan di Indonesia (Perairan Sapeken). Dalam penelitian ini, teknik Mini-Flotac® yang dimodifikasi dan dikombinasikan dengan Fill-Flotac® sukses digunakan untuk mendeteksi telur cacing dan jumlah EPG pada feses C. mydas. Teknik Flotac® sebelumnya dilaporkan berhasil digunakan dalam survei koprologi untuk mendeteksi parasit gastrointestinal pada Caretta caretta (Pace et al., 2019), kura-kura (tortoise) (Dipineto et al., 2012), berbagai jenis cetacea (Federica et al., 2022), burung eksotik (Lozano et al., 2021), serta berbagai satwa di kebun binatang (MB da Silva et al., 2022). Sepengetahuan penulis, aplikasi teknik diagnostik koprologi ini pada C. mydas belum pernah dilakukan, dan studi ini tampaknya bisa dianggap sebagai yang pertama kalinya.
Mini-Flotac®, saat ini, dapat dianggap sebagai salah satu metode yang paling akurat untuk diagnosis koprologi infeksi endoparasit dan penghitungan telur pada satwa dan orang (Godber et al., 2014). Oleh karena itu, hasil survey koprologi yang dilakukan ini dapat diinterpretasikan dengan akurat. Cringoli et al. (2017) menyatakan bahwa kelemahan dari teknik ini adalah rendahnya kemampuan untuk mendeteksi trematoda. Namun demikian, kelemahan ini bisa diatasi dengan mengubah larutan pengapung dari natrium
klorida jenuh (NaCl, berat jenis 1.20) dengan pengapung dengan density yang lebih tinggi seperti zinc sulphate (ZnSO4, berat jenis 1.35) (Barda et al., 2014; Catalano et al., 2019; Federica et al., 2022).
Pada penelitian ini ditemukan empat jenis telur cacing trematoda yang termasuk didalam tiga familia, yaitu Spirorchiidae (L. learedi), Pronocephalidae (D. pandus dan O. sagita), serta Plagiorciidae (E. megachondrus). Variasi ini jauh lebih rendah dibandingkan dengan temuan yang dilaporkan oleh Adnyana et al. (2020) di Indonesia maupun Werneck et al. (2015) di Brazil. Adnyana et al. (2020) menemukan trematoda familia spirorchiidae, Pronocephalidae, Microscaphiidae, Angiodictyidae, Rhytidodiidae, Paramphistomiidae, Gorgoderidae, Telorchiidae, serta familia lain yang tidak bisa diidentifikasi dari C. mydas di Indonesia. Sementara itu, Werneck et al. (2015) menemukan trematoda familia Brachycoeliidae, Cladorchiidae, Microscaphidiidae, Pronocephalidae, Rhytidodidae, dan Spirorchiidae pada C. mydas remaja di salah satu perairan di Brazil. Perbedaan ini tampaknya disebabkan oleh salah satu atau kombinasi
dari berbedanya jumlah sampel, asal sampel, ukuran tubuh (perbedaan umur) serta metodologi penelitian. Jumlah sampel yang diamati oleh Adnyana et al. (2020) adalah 134 C. mydas yang berasal dari berbagai lokasi perairan di Indonesia, dengan ukuran tubuh bervariasi dari kategori remaja, sub-adult, dan dewasa. Sementara itu, pada penelitian ini, jumlah sampel adalah sembilan ekor C. mydas yang semuanya berkategori remaja dan berasal dari satu lokasi perairan di Indonesia. Perbedaan lokasi hidup telah diketahui menyebabkan perbedaan pada distribusi dan prevalensi trematoda pada penyu (Marangi et al., 2020) yang kemungkinan dipengaruhi oleh perbedaan ketersediaan dan kepadatan inang antara di masing-masing lokasi perairan (Santoro et al., 2020). Metodologi identifikasi parasit yang dipergunakan oleh Adnyana et al.
(2020) adalah dengan pemeriksaan langsung terhadap adanya parasit dewasa pada organ tubuh pasca-nekropsi. Sementara itu, metodologi yang dipergunakan pada studi kali ini adalah dengan kopromikroskopi (pemeriksaan feses); suatu metodologi yang diketahui dapat memberikan hasil negatif palsu dan memberikan hasil rendah dalam kasus infeksi prepaten, infeksi cacing berjenis kelamin tunggal untuk spesies dengan jenis kelamin terpisah, pelepasan telur intermiten, parasit yang menghasilkan telur dalam jumlah rendah (lebih rendah dari 5 telur per gram untuk mini-flotac) atau untuk beban parasit rendah (Federica et al., 2022).
Ko-infeksi yang ditemukan pada semua sampel yang diperiksa pada studi ini sejalan dengan data yang dilaporkan sebelumnya untuk C. mydas di Indonesia. Adnyana et al. (2020) melaporkan bahwa ko-infeksi trematoda umum terjadi pada C. mydas. Rerata jumlah EPG yang ditemukan pada penelitian ini juga serupa dengan yang dilaporkan oleh Pace et al. (2019). Mereka menemukan jumlah EPG feses berkisar antara 35–180, serupa dengan EPG dari yang terdeteksi dalam survei ini untuk setiap infeksi cacing (dari 20-180). EPG kemungkinan dipengaruhi oleh fekunditas parasit atau beban parasit. Kisaran yang lebar dalam beban parasit tergantung pada beberapa faktor seperti siklus hidup parasit, ketersediaan inang yang diperlukan untuk menyelesaikan siklus hidup, interaksi antara spesies parasit, respon imun inang, dan kepadatan populasi inang (Pace et al., 2019). EPG feses tidak menunjukkan perkiraan beban parasit yang akurat pada reptil. Dengan demikian, dalam survei ini, tidak mungkin menilai hubungan antara EPG feses dengan intensitas infeksi cacing.
Prevalensi semua jenis trematoda yang ditemukan pada penelitian ini umumnya lebih tinggi dibandingkan dengan yang dilaporkan oleh Adnyana et al. (2020). Demikian pula halnya dengan yang dilaporkan oleh peneliti lain, misalnya Binoti et al. (2016) yang melakukan studi pada C. mydas di Brazil dan Santoro et al.
(2006) di Costa Rica. Prevalensi, variasi jenis, dan kepadatan parasit diketahui dipengaruhi oleh berbagai faktor terkait inang (misalnya ukuran/umur dan jenis kelamin inang) dan faktor lingkungan (misalnya kepadatan inang antara, suhu dan kadar garam air laut) (Mahony et al., 2022). Perbedaan prevalensi dan tingkat kepadatan trematoda yang ditemukan pada studi ini dengan studi-studi lainnya barangkali berhubungan dengan satu atau lebih dari faktor-faktor tersebut. Selain itu, perbedaan prevalensi mungkin juga disebabkan oleh perbedaan metode deteksi parasit. Seperti disebutkan sebelumnya, pada studi ini, deteksi parasit dilakukan dengan metode koprologi, sementara itu, Adnyana et al. (2020), Binoti et al. (2016), maupun Santoro et al. (2006) melakukan deteksi parasit dewasa dengan pemeriksaan langsung pada organ-organ dalam pasca nekropsi. Semua Teknik identifikasi parasit, baik yang berbasis identifikasi telur maupun cacing dewasa memiliki keterbatasan. Kondisi pengawetan hewan yang buruk dapat menghambat deteksi parasit kecil selama nekropsi. Proses pencucian dan penyaringan kandungan gastrointestinal dan organ-organ lainnya juga dapat mengubah integritas parasit sehingga tidak terdeteksi saat penghitungan parasit (Federica et al., 2022).
Telur trematoda yang ditemukan pada survey ini diketahui berasal dari parasit dewasa yang menghuni berbagai organ seperti kardio-vaskuler (L. learedi) (Adnyana et al., 2020) serta saluran pencernaan bagian atas, tengah dan bawah (D. pandus, O. sagita, E. megachondrus) (Greiner, 2013). D. pandus, O. sagita, dan E. megachondrus dilaporkan dapat hidup “harmonis” dengan inang (Greiner, 2013). Sementara itu, L. learedi dianggap sebagai parasit yang berpotensi menyebabkan penyakit (Adnyana et al., 2020) dan banyak dilaporkan berhubungan dengan kematian pada berbagai jenis penyu laut, terutama C. mydas di Florida, Australia dan Brazil (Gordon et al., 1998; Jacobson et al., 2006; Stacy et al., 2010; Flint et al., 2010; Flint et
al., 2015, Adnyana et al., 2020). Pada penelitian ini, semua penyu remaja yang diambil fesesnya tidak ada yang menunjukkan klinis penyakit yang berarti, padahal prevalensi L. learedi ditemukan 100%. Saat pemeriksaan klinis, kondisi tubuhnya dikategorikan ada dalam kondisi “baik”. Namun demikian, apakah infeksi L learedi berpengaruh secara tidak langsung (atau menunggu faktor pencetus lainnya seperti stress) terhadap kelangsungan hidup dan kebugaran C. mydas dalam jangka panjang belum diketahui. Penelitian yang dilakukan oleh Work et al. (2015) di Hawai, Santoro et al. (2007a, 2015) di Costa Rica, dan Santoro et al. (2007b) di Karibia menunjukkan bahwa walaupun terdeteksi adanya perubahan patologi pada penyu oleh infeksi spirorchid (termasuk L. learedi), jejas tersebut dinyatakan “tidak cukup” untuk membunuh penyu. Penelitian yang lebih seksama tentang hal ini tampaknya perlu dilakukan.
SIMPULAN DAN SARAN
Simpulan
Pada studi ini ditemukan empat jenis trematoda menginfeksi penyu asal perairan Sapeken Jawa Timur yang sedang direhabilitasi di TCEC Serangan. Mereka adalah L. learedi (100%), D. pandus (100%), O. sagita (77,7%), serta E. megachondrus (66,6%). Prevalensinya, secara berurutan adalah L. learedi (100%), D. pandus (100%), O. sagita (77,7%), dan E. megachondrus (66,6%). EPG tertinggi ditemukan pada L. learedi (104±57), diikuti oleh D. pandus (42±14), O. sagita (32±28), dan E. megachondrus (23±19). Rerata EPG L. learedi berbeda nyata (P<0,05) dengan ketiga jenis parasit lainnya, namun EPG ketiga jenis parasit selain L. learedi tidak berbeda nyata (P>0,05). Masing-masing penyu terinfeksi oleh 2 – 4 jenis trematoda. Koinfeksi oleh L. learedi dan D. pandus terdeteksi pada 1 (11,1%) C. mydas, sedangkan koinfeksi oleh L. learedi, D. pandus, dan O. sagita atau L. learedi, D. pandus, dan E. megachondrus ditemukan pada dua ekor (22,2%) dan seekor (11,1%)
C. mydas. Koinfeksi oleh empat jenis trematoda (L. learedi, D. pandus, O. sagita, dan E. megachondrus) dideteksi pada 5 (55,6%) C.mydas.
Saran
Studi serupa yang melibatkan kelompok ukuran/umur berbeda dari populasi C. mydas di Perairan Sapeken perlu dilakukan. Demikian pula halnya sampel dari habitat lain di Indonesia untuk lebih memahami dinamika hubungan inang-parasit antar stok populasi penyu dari berbagai wilayah perairan di Indonesia.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Turtle Conservation and Education Center, atas izin penggunaan fasilitas pada penelitian ini.
DAFTAR PUSTAKA
Adnyana W, Soede LP, Gearheart G, Halim M. 2008. Status of green turtle (Chelonia mydas) nesting and foraging populations of Berau, East Kalimantan, Indonesia, including results from tagging and telemetry. Indian Ocean Turtle Newsletter. 7: 2-11.
Adnyana W, Hitipeuw C. 2009. Panduan Melakukan Pemantauan Populasi
Penyu di Pantai Peneluran di Indonesia. Diterbitkan oleh WWF-Indonesia,
Jakarta. Pp. 1-31.
Adnyana W, Damriyasa IM, Trilaksana IGNB, Ratha IMJ, Hitipeuw C. 2010. Laporan Sigi Pemanfaatan dan Perdagangan Penyu di Bali dan Rekomendasi Pengentasannya.
Fakultas Kedokteran Hewan
Universitas Udayana dan WWF Indonesia, Pp. 1-10.
Adnyana IBW, Ladds PW, Blair D. 2020.
Prevalence and clinico-pathological studies on trematodiasis in marine turtles in Indonesia. Int. J. Sci. Res. Pub. 10(8): 274-295.
Anderson RM, May RM. 1978. Regulation and stability of host - parasite
population interactions. I. Regulatory processes. J. Anim. Ecol. 47(1): 219247.
Barda B, Cajal P, Villagran E. 2014. Mini-FLOTAC, Kato-Katz and McMaster: three methods, one goal; highlights from north Argentina. Parasites Vectors. 7(271): 1-7.
Binoti E, Gomes MC, Junior A. De C, Werneck MR, Martin IVF, Boeloni JN. 2016. Helminth fauna of Chelonia mydas (Linnaeus, 1758) in the South of Espirito Santo State in Brasil. Helminthologia. 53(2):195-199.
Godber OF, Phythian CJ, Bosco A, Ianniello D, Coles G, Rinaldi L, Cringoli G. 2015. A comparison of the FECPAK and Mini-FLOTAC faecal egg counting techniques. Vet. Parasitol. 207(3-4): 342-345.
Catalano S, Symeou A, Marsh KJ. 2019. Mini-FLOTAC as an alternative, non-invasive diagnostic tool for Schistosoma mansoni and other trematode infections in wildlife reservoirs. Parasites Vectors. 12(439): 1-9.
Cringoli G, Maurelli MP, Levecke B, Bosco A, Vercruysse J, Utzinger J, Rinaldi L. 2017. The Mini-FLOTAC technique for the diagnosis of helminth and protozoan infections in humans and animals. Nat. Protocols. 12(9): 1723– 1732.
Dipineto L, Rinaldi L, Bosco A, Russo TP, Fioretti A, Cringoli G. 2013. Coinfection by Escherichia coli O157 and gastrointestinal strongyles in sheep. The Vet. J. 197(3): 884–885.
Esteban N, Mortimer JA, Stokes HJ. 2020. A global review of green turtle diet: sea surface temperature as a potential driver of omnivory levels. Mar. Biol. 167(183): 1-17.
Federica M, Rudi C, Nancy P, Cinzia T, Erica M. 2022. A comparative study of Mini-FLOTAC with traditional coprological techniques in the analysis of cetacean fecal samples. Front. Vet. Sci. 9: 1-7.
Flint M, Patterson-Kane JC, Limpus CJ, Mills PC. 2010. Health surveillance of stranded green turtles in Southern Queensland, Australia (2006-2009): an epidemiological analysis of causes of disease and mortality. Eco. Health. 7: 135-145.
Flint M, Patterson-Kane JC, Limpus CJ, Mills PC. 2015. Trends in marine turtle strandings along the east Queensland, Australia coast, between 1996 and 2013. J. Mar. Biol. 2015: 7.
Gordon AN, Kelly WR, Cribb TH. 1998.
Lesions caused by cardiovascular flukes (Digenea: Spirorchidae) in stranded green turtles (Chelonia mydas). Vet. Pathol. 35: 21–30.
Greiner EC. 2013. Parasites of Marine Turtles. In: Wyneken J, Lohmann KJ, Musick JA, editors. The Biology of Sea Turtles. Volume III. CRC Press; Boca Raton, FL, USA, Pp. 249–284.
Hirth HF, Schaffer WM. 1974. Survival Rate of the green turtle, Chelonia mydas. Necessary to Maintain Stable Populations. 1974(2): 544-546.
Irvine RJ. 2006. Parasites and the dynamics of wild mammal populations. Anim. Sci. 82(06): 775-781.
Jacobson ER, Homer BL, Stacy BA, Greiner EC, Szabo NJ, Chrisman CL, Origgi F, Coberley S, Foley AM, Landsberg JH. 2006. Neurological disease in wild loggerhead sea turtles Caretta caretta. Dis. Aqua. Org. 70: 139–154.
Kołodziej-Sobocińska M. 2019. Factors affecting the spread of parasites in populations of wild European terrestrial mammals. Mammal Res. 64: 301–318.
Kripa V, Prema D, Varghese, Molly N, Rekha KS, Sobhana R, Vidya B, Vivekanand S, Uma. 2023 Book of Abstracts & Success Stories National Conference on Marine Debris COMAD 2018. Marine Biological Association of India, Kochi.
http://eprints.cmfri.org.in/id/eprint/127 00 .
Lee PL, Luschi P, Hays GC. 2007. Detecting female precise natal philopatry in green turtles using assignment methods. Mol. Ecol. 16(1): 61-74.
Lozano J, Almeida C, Victório AC, Melo P, Rodrigues JP, Rinaldi L, Cringoli G, Gomes L, Oliveira M, Paz-Silva A, Madeira de Carvalho L. 2021. Implementation of Mini-FLOTAC in routine diagnosis of coccidia and helminth infections in domestic and exotic birds. Vet. Sci. 8(8):1-12.
Mahony KE, Sian E, Sharon AL, Hugues B, Anouk G, Emily G, Nicolas S, Xavier M, Shelagh KM, Sarah CC. 2022. Drivers of growth in a keystone fished species along the European Atlantic coast: The common cockle
Cerastoderma edule. J. Sea Res. 179: 19.
Marangi M, Carlino P, Profico C, Olivieri V, Totaro G, Furii G, Marzano G, Roberto AP. 2020. First multicenter coprological survey on helminth parasite communities of free-living loggerhead sea turtles Caretta caretta from the Adriatic Sea and Northern Ionian Sea. Int. J. Parasitol. Parasites and Wildlife. 11: 207-212.
Maulid D, Dwi S, Fidry RI, Kusuma D. 2018. Cause of the death sea turtle stranded in nesting beach (Paloh, West Kalimantan) period from February to April 2018. Paper presented Proc. of the 20th FAVA Congress & The 15th KIVNAS PDHI, Bali Nov 1-3, 2018.
MB da Silva, DF de Oliveira, FV Santos, CDS Aguiar, IS Prado, DA Brandão, AA Pereira, TS de Queiroz, L Tomazi, br Ricardo Evangelista Fraga.2022. Gastrointestinal parasites in wild and exotic animals from a zoo in the State of Bahia, Brazil - first record. Res. Soc. Develop. 11(13): 1-22.
Pace A, Rinaldi L, Ianniello D, Borrelli L, Cringoli G, Fioretti A, Hochscheid S, Dipineto L. 2019. Gastrointestinal investigation of parasites and Enterobacteriaceae in loggerhead sea
turtles from Italian coasts. BMC Vet. Res. 15(370): 1-9.
Preston D, Johnson P. 2010. Ecological Consequences of Parasitism. Nat. Edu. Knowledge. 1(8): 39
Santoro M, Greiner E, Morales J, Rodriguez-Ortiz B. 2006. Digenetic Trematode Community in nesting green sea turtles (Chelonia mydas) from Tortuguero National Park, Costa Rica. J. Parasitol. 92(6): 1202-1206.
Santoro M, Morales JA, Rodriguez-Ortiz B. 2007a. Some digenetic trematodesof the olive ridley sea turtle, Lepidochelys olivacea (Testudines:Cheloniidae) in Costa Rica. Helminthologia. 44(1): 25 – 28.
Santoro M, Morales JA, Rodriguez-Ortiz B. 2007b. Spirorchiidiosis (Digenea: Spirorchiidae) and lesions associated with parasites in Caribbean green sea turtles (Chelonia mydas). Vet. Rec. 161(14): 482 – 486
Santoro M, Morales J, Bolaáos F, Chaves G, Stefano M. 2015. Helminths of hawksbill turtle (Eretmochelys
imbricata) from the Pacific coast of Costa Rica. Helminthologia. 52(1): 6770.
Santoro M, Iaccarino D, Bellisario B. 2020. Host biological factors and geographic locality influence predictors of parasite communities in sympatric sparid fishes off the southern Italian coast. Sci. Rep. 10(1): 13283.
Santos RG, Martins AS, Farias JN, Horta PA, Pinheiro HT, Torezani E, Baptistotte C, Seminoff JA, Balazz GH, Work TM. 2011. Coastal habitat degradation and green sea turtle diets in Southeastern Brazil. Marine Pollut. Bul. 62(6): 1297-1302.
Simon Kin-Fung Chan, I-Jiunn Cheng, Ting Zhou, Hua-Jie Wang, He-Xiang Gu, Xiao-Jun Song. 2007. A comprehensive overview of the population and conservation status of sea turtles in China. Chelonian Conserv. Biol. 6(2): 185–198.
Stacy BA, Foley AM, Greiner E, Herbst LH, Bolten A, Klein P, Manire CA, Jacobson ER. 2010. Spirorchiidiasis in stranded loggerhead Caretta caretta and green turtles Chelonia mydas in Florida (USA): Host pathology and significance. Dis. Aquat. Orgs. 89: 237– 259.
Stubbs JL, Marn N, Vanderklift MA, Fossette S, Mitchell NJ. 2020. Simulated growth and reproduction of green turtles (Chelonia mydas) under climate change and marine heat wave scenarios. Ecol. Modelling. 431: 304380.
Suastika P, Adnyana IBW, Suprapti D. 2012. Profil seks rasio tukik penyu hijau (Chelonia mydas) pada penetasan alami dan non-alami di pantai Sukamade Kabupaten Banyuwangi. Bul. Vet. Udayana. 4(2): 47-53.
Thompson AN, Kennedy AJ, Holmes J, Kearney G. 2010. Arrow leaf clover improves lamb growth rates in late spring and early summer compared with subterranean clover pastures in southwest Victoria. Anim. Prod. Sci. 50(8): 807-816.
Werneck M, Silva R. 2015. Helminth Parasites of Juvenile Green Turtles Chelonia mydas (Testudines:
Cheloniidae) in Brazil. The J. Parasitol. 101(10): 160-780.
Wilcox CP, Melody S, Qamar T, Kathy H, Britta. 2018. A quantitative analysis linking sea turtle mortality and plastic debris ingestion. Sci. Rep. 8(12836): 1-11.
Work TM, Balazs GH, Summers TM, Hapdei JR, Tagarino AP. 2015.
Causes of mortality in green turtles from Hawaii and the insular Pacific exclusive of fibropapillomatosis. Dis. Aquat. Org. 115: 103-110.
Zainudin IM, Pet-Soede L, Hitipeuw C, Adnyana IBW. 2007. Interaction of Sea Turtles with Indonesian Fisheries – Preliminary Finding. Indian Ocean Turtle Newsletter. 6: 1-10.
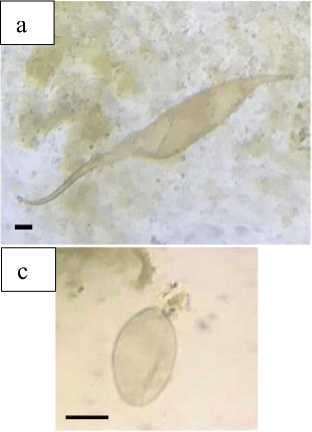
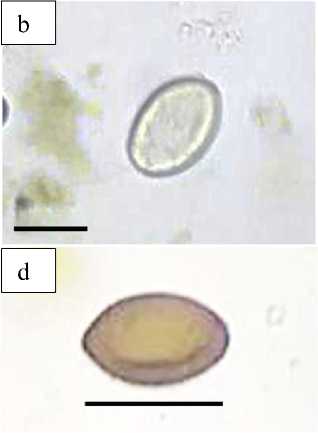
Gambar 1. Fotomikrograf jenis telur cacing yang ditemukan pada pemeriksaan koproparasitologi. (a) telur tipe 1, (b) telur tipe 2, (c) dan (d) telur tipe 3. Bar = 40 µm
Tabel 1. Jenis trematoda, prevalensi, dan kepadatan telur per gram (EPG) yang ditemukan pada penyu hijau yang direhabilitasi di TCEC Serangan (n = 9 ekor). Penyu diduga ditangkap di perairan Pulau Sapeken, Jawa Timur
|
Trematoda |
Jumlah Positip |
Kepadatan Telur Per Gram (EPG) | |
|
Rerata±Standar Deviasi |
Kisaran | ||
|
L. learedi. |
9 |
104±57a |
40 - 180 |
|
D. pandus |
9 |
42±14b |
20 - 60 |
|
O. sagita |
7 |
32±28b |
0 - 80 |
|
E. megachondrus |
6 |
23±19b |
0 - 50 |
Catatan: Hurup kecil yang sama pada kolom Rerata±Standar Deviasi mengindikasikan perbedaan tidak nyata (P>0,05), sebaliknya huruf yang berbeda menunjukkan perbedaan nyata (P<0,05).
Tabel 2. Jumlah sampel positip dan prevalensi ko-infeksi oleh tiga dan empat jenis trematoda pada penyu hijau yang direhabilitasi di TCEC Serangan (n = 9 ekor). Penyu diduga ditangkap di perairan Pulau Sapeken, Jawa Timur.
Jumlah Trematoda Jumlah Sampel Prevalensi
Penginfeksi Positip (%)
|
Dua jenis |
L. learedi, D. pandus |
1 |
11,1% |
|
Tiga jenis |
L. learedi, D. pandus, O. sagita. |
2 |
22,2% |
|
L. learedi, D. pandus, E. megachondrus |
1 |
11,1% | |
|
Empat jenis |
L. learedi, D. pandus, O. sagita, E. |
5 |
55,6% |
|
megachondrus | |||
|
Total |
9 |
100% |
981
Discussion and feedback