GROSS PATHOLOGY AND HISTOPATHOLOGY DESCRIPTION OF NERVOUS SYSTEM OF BALI DUCK AFTER EXPERIMENTAL INFECTION WITH AVIAN ORTHOAVULAVIRUS 1 TABANAN-1/ARP/2017 ISOLATE
on
Buletin Veteriner Udayana Volume 15 No. 1: 10-19
pISSN: 2085-2495; eISSN: 2477-2712 Pebruari 2023
Online pada: http://ojs.unud.ac.id/index.php/buletinvet DOI: 10.24843/bulvet.2023.v01.i01.p02
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal
Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Gambaran Patologi Anatomi dan Histopatologi Sistem Saraf Itik Bali
Pascainfeksi Buatan Avian orthoavulavirus 1 Isolat Tabanan-1/ARP/2017
(GROSS PATHOLOGY AND HISTOPATHOLOGY DESCRIPTION OF NERVOUS SYSTEM OF BALI DUCK AFTER EXPERIMENTAL INFECTION WITH AVIAN
ORTHOAVULAVIRUS 1 TABANAN-1/ARP/2017 ISOLATE)
Yeni Ratna Sari1, Anak Agung Ayu Mirah Adi2*, Ida Bagus Oka Winaya2
-
1Mahasiswi Sarjana Pendidikan Dokter Hewan, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234;
-
2Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB.
Sudirman, Denpasar, Bali, Indonesia, 80234.
*Email: aaa_mirahadi@unud.ac.id
Abstrak
Penelitian ini dilakukan untuk mengetahui perubahan patologi anatomi dan histopatologi organ cerebrum, cerebellum, medulla spinalis, dan nervus ischiadicus itik bali yang diinfeksi Avian orthoavulavirus 1 isolat Tabanan-1/ARP/2017. Penelitian ini menggunakan 15 ekor itik bali jantan umur 21 hari yang telah diaklimatisasi selama dua minggu. Sepuluh ekor itik perlakuan terinfeksi (P1) diinfeksikan dengan AOAV-1 isolat Tabanan-1/ARP/2017 dengan dosis 0,5 ml/27 HAU secara intraokular, serta 5 ekor itik kontrol (P0), diberikan larutan Phosphate Buffered Saline sebanyak 0,5ml secara intraokular. Itik yang mati kemudian dinekropsi untuk dilakukan pemeriksaan patologi anatomi. Organ saraf diproses dan diwarnai dengan pewarnaan Hematoksilin-Eosin, kemudian dalakukan pemeriksaan histopatologi. Pada pemeriksaan patologi anatomi ditemukan perubahan encephalomalacia pada cerebrum dan cerebellum. Perubahan histopatologi didominasi oleh kongesti, edema perivascular, proliferasi endotel, vakuolisasi neuropil, vaskulitis, dan gliosis pada organ sistem saraf pusat. Sedangkan gambaran histopatologi pada nervus ischiadicus berupa kongesti.
Kata kunci: newcastle disease; itik bali; patologi anatomi; histopatologi; organ sistem saraf.
Abstract
The present study aims to determine the gross pathology and histopathological changes in the organs of the cerebrum, cerebellum, spinal cord, and sciatic nerve in bali ducks infected with Avian orthoavulavirus type 1 Tabanan-1/ARP/2017 isolate. The present study used 15 male bali ducks aged 21 days which had been acclimatized for two weeks. Ten ducks were treated for infection (P1) were infected with AOAV-1 Tabanan-1/ARP/2017 isolate at a dose of 0.5 ml/27 HAU intraocularly, and 5 control ducks (P0) were given Phosphate Buffered Saline solution as much as 0.5 ml intraocularly. Then the dead ducks were necropsied for gross pathology examination. The nervous organs were processed and stained for hematoxylin-Eosin, then performed histopathological examination. Gross pathological change was found encephalomalacia in the cerebrum and cerebellum. Histopathological changes were dominated by congestion, perivascular edema, endothelial proliferation, neuropil vacuolization, vasculitis, and gliosis of central nervous system organs. Meanwhile, the histopathological appearance of sciatic nerve is congestion.
Keywords: newcastle disease; bali duck; gross pathology; histopathology; nervous system organs
PENDAHULUAN
Salah satu jenis itik yang diternakkan oleh masyarakat di Indonesia adalah itik bali (Anas platyrhynchos domestica). Itik bali lebih banyak dimanfaatkan telurnya
dibandingkan dengan dagingnya dan seringkali dimanfaatkan sebagai sarana upacara agama Hindu. Dalam perkembangannya, peternak terkendala oleh berbagai penyakit yang dapat
menyerang itik salah satunya adalah Newcastle Disease atau Tetelo. Meskipun berisfat subklinis, infeksi virus ND pada itik berpotensi sebagai sumber penyebaran dan penularan virus pada unggas disekitarnya sehingga disebut reservoir alami dari virus penyakit ND (Kencana, 2012). Penyakit ND telah mewabah hampir di seluruh Indonesia termasuk juga Provinsi Bali. Penyebaran penyakit ND dapat terjadi secara kontak langsung dari itik yang terinfeksi ke unggas sehat dan melalui feses yang diekskresikan oleh itik yang terinfeksi (Kencana et al.,2012).
Newcastle Disease disebabkan oleh virus ND atau Avian orthoavulavirus 1 dari famili Paramyxoviridae (Amarasinghe et al., 2019). Penyakit Newcastle disease bersifat akut dan menular, menimbulkan gejala pada sistem pernafasan, pencernaan dan saraf pada unggas dengan angka mortalitas dan morbiditas tergantung strain virulensinya. Unggas yang terinfeksi virus ND virulen biasanya menimbulkan gejala saraf berupa tortikolis, tremor kepala, depresi, paralisis dan opisthotonus (Ecco et al., 2011). Mengingat strain virus ND yang ada di Indonesia adalah viscerotropic velogenic dimana lesi dominan pada sitem pencernaan, namun gejala saraf dan lesi pada susunan saraf umum ditemukan pada ayam dengan fase infeksi kronis (Adi et al., 2010). Pada itik infeksi virus ND dapat menunjukkan adanya perubahan patologis pada organ saraf itik (Dai et al., 2014).
Isolat Tabanan-1/ARP/2017 merupakan virus ND virulen dari genotipe VIII yang diisolasi dari sebuah peternakan ayam petelur di Kabupaten Tabanan, Bali pada tahun 2017 (Adi et al., 2019b). Patogenisitas virus ND isolat Tabanan 1/ARP/2017 pada organ sistem saraf itik bali secara makroskopis maupun mikroskopis masih belum diteliti. Penelitian ini bertujuan untuk mengetahui perubahan patologi anatomi dan histopatologi pada organ cerebrum, cerebellum, medulla spinalis, dan nervus ischiadicus itik bali yang diinfeksi Avian
orthoavulavirus 1 isolat Tabanan-1/ARP/2017.
METODE PENELITIAN
Sampel Penelitian
Penelitian ini menggunakan 15 ekor itik bali jantan umur satu minggu yang dipelihara dalam kandang isolasi steril untuk proses aklimatisasi selama dua minggu. Tiga hari sebelum masa aklimatisasi berakhir, serum itik dikoleksi untuk dilakukan pengukuran terhadap titer antibodi ND menggunakan uji hambatan hemaglutinasi (HI). Sampel darah diambil menggunakan spuit 3 ml dilakukan pada daerah vena jugularis kemudian dimasukkan ke tabung vacutainer.
Selanjutnya sampel darah diletakkan pada suhu kamar ± 1-2 jam setelah itu diletakkan pada suhu 40C selama 18-24 jam. Kemudian serum dipisahkan dari bekuan darah dan ditampung pada tabung ependorf. Uji HI dilakukan untuk memastikan bahwa titer antibodi ND dalam tubuh itik telah rendah (< 23 HI unit) sehingga proses infeksi oleh virus dapat berjalan dengan baik.
Rancangan Penelitian
Selanjutnya itik dibagi ke dalam dua perlakuan secara acak. Itik perlakuan kontrol (P0) berjumlah 5 ekor dan diberi kode A1-A5. Sementara itik perlakuan terinfeksi (P1) berjumlah 10 ekor dan diberi kode B1-B10. Itik P1 diinfeksikan dengan virus AOAV-1 isolat Tabanan-1/ARP/2017 dengan dosis 0,5 ml/27 HA unit ke tubuh itik secara intraokular, sedangkan itik P0 ditetesi dengan larutan PBS sebanyak 0,5 ml secara intraokular. Kedua perlakuan dipelihara secara terpisah di dalam kandang isolasi. Itik P1 yang mati kemudian segera dinekropsi untuk diamati perubahan patologinya. Sedangkan itik P0 dan P1 yang belum mati sampai hari ke-30, dieuthanasi menggunakan metode dekapitasi kemudian dilakukan nekropsi. Sampel organ cerebrum, cerebellum, medulla spinalis, dan nervus ischiadicus kemudian dimasukkan ke dalam pot-pot
yang berisi NBF 10% yang selanjutnya dilakukan pembuatan preparat histologi.
Pembuatan Preparat Histologi
Jaringan yang telah difiksasi menggunakan NBF 10% selama 24 jam, selanjutnya didehidrasi dengan alkohol secara bertingkat dengan lama perendaman ± 2 jam pada masing–masing perendaman. Kemudian proses clearing dilakukan dengan merendam jaringan dalam larutan xylene. Setelah itu dilakukan embedding set dan blocking menggunakan parafin cair kemudian didinginkan. Blok paraffin kemudian dipotong dengan microtome dengan ketebalan 4-5 mikron. Potongan organ tersebut kemudian diwarnai dengan pewarnaan Harris Hematoksilin-Eosin. Blok spesimen yang telah diwarnai kemudian diletakkan dalam object glass, direkatkan menggunakan media mounting, dan ditutup menggunakan cover glass. Selanjutnya, sediaan dapat diamati dibawah mikroskop (Kiernan, 2015).
Parameter Penelitian
Perubahan patologi anatomi organ cerebrum, cerebellum, medulla spinalis dan nervus ischiadicus diamati secara langsung pada saat nekropsi. Perubahan makroskopis yang ditemukan disajikan secara deskriptif. Preparat histologi organ tersebut diamati di bawah mikroskop dengan perbesaran 10 kali dan 40 kali pada 5 lapang pandang yang berbeda dari tiap preparat. Pencatatan terhadap perubahan histopatologi yang ditemukan difokuskan berdasarkan gangguan sirkulasi, nekrosis, dan peradangan, kemudian dikategorikan berdasarkan derajat keparahannya (- : tidak ada lesi, + : ringan, ++ : sedang, +++ : berat). Perubahan mikroskopis yang ditemukan ditabulasi dan dianalisis secara deskriptif.
Analisis Data
Perubahan makroskopis yang
ditemukan disajikan secara deskriptif. Hasil pemeriksaan lesi histopatologi yang diamati kemudian ditabulasi dan dikategorikan berdasarkan tingkat
keparahannya yang selanjutnya dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil Tanda Klinis
Tanda klinis pada itik terinfeksi mulai teramati pada hari ke-4 pascainfeksi berupa diare putih kehijauan (Gambar 1 A), diikuti dengan penurunan aktivitas dan nafsu makan, kelesuan, terhambatnya pertumbuhan, serta bulu kusam. Gejala saraf muncul dua hari sebelum kematian itik. Gejala saraf yang teramati berupa depresi dan tremor otot. Sesaat sebelum kematian, itik akan jatuh ke samping, kaki bergerak seperti mengayuh, dengan posisi opisthotonus dan tortikolis (Gambar 1 B). Itik juga mengalami kesulitan bernafas (dyspnea) sebelum akhirnya mengalami kematian. Semua itik perlakuan kontrol tampak normal selama periode pengamatan. Kematian itik terinfeksi dimulai pada hari ke-7 hingga hari ke-15 pascainfeksi, dengan rincian pada Tabel 1. Dikarenakan itik terinfeksi terakhir mati pada hari ke-15 pascainfeksi, maka seluruh itik kontrol dieuthanasi dan dinekropsi pada hari yang sama.
Gambaran Patologi Anatomi
Hasil pemeriksaan patologi anatomi itik terinfeksi yang telah dinekropsi, ditemukan perubahan berupa
encephalomalacia pada organ cerebrum dan cerebellum (Gambar 2). Kedua bagian otak hemisphere kanan dan kiri mengalami pelunakan dan terlihat cekung. Pada organ medulla spinalis dan nervus ischiadicus pengamatan patologi anatomi tidak menunjukkan adanya perubahan.
Gambaran Histopatologi
Pemeriksaan histopatologi pada organ cerebrum itik terinfeksi ditemukan lesi kongesti dan edema perivascular masing-masing sebanyak 100% dengan tingkat keparahan ringan hingga sedang; proliferasi sel endotel sebanyak 100% dengan tingkat keparahan cenderung ringan dengan hipertrofi sel endotel; vakuolisasi neuropil sebanyak 70% dengan
tingkat keparahan cenderung ringan, yang disertai dengan gliosis sebanyak 100% dengan tingkat keparahan berat, dan vasculitis sebanyak 100% dengan tingkat keparahan cenderung ringan (Gambar 3).
Pada cerebellum ditemukan lesi kongesti sebanyak 100% dengan tingkat keparahan ringan hingga sedang; edema perivascular sebanyak 100% dengan tingkat keparahan cenderung ringan; proliferasi sel endotel sebanyak 100% dengan tingkat keparahan ringan; vakuolisasi neuropil sebanyak 100% dengan tingkat keparahan cenderung ringan; nekrosis sel purkinje sebanyak 100% dengan tingkat keparahan cenderung ringan; demielinasi akson pada substansia alba; vasculitis sebanyak 40% dengan tingkat keparahan ringan, serta gliosis sebanyak 100% dengan tingkat keparahan cenderung berat (Gambar 4).
Pada organ medulla spinalis ditemukan lesi gangguan sirkulasi berupa kongesti sebanyak 80% dengan tingkat keparahan cenderung ringan; edema perivascular sebanyak 90% dengan tingkat keparahan cenderung ringan; proliferasi sel endotel sebanyak 60% dengan tingkat keparahan ringan; nekrosis sel saraf; degenerasi; demielinasi akson; vasculitis sebanyak 30% dengan tingkat keparahan ringan; gliosis sebanyak 100% dengan tingkat keparahan cenderung berat (Gambar 5).
Pada organ nervus ischiadicus itik terinfeksi, hasil pemeriksaan histopatologi hanya ditemukan lesi kongesti sebanyak 90% dengan tingkat keparahan cenderung ringan (Gambar 6).
Pembahasan
Itik yang terinfeksi mengalami gejala awal diare putih kehijauan, penurunan aktivitas dan nafsu makan (anoreksia), kelesuan, terhambatnya pertumbuhan, dan bulu kusam. Kemudian diikuti oleh gejala saraf seperti depresi, tremor otot, kejang, opisthotonus, dan trotikolis. Tanda klinis tersebut juga terjadi pada itik yang terinfeksi ND virulen secara eksperimental yang dilaporkan oleh Kingston et al.
(1978), Dai et al. (2013), dan Dai et al. (2014). Namun menurut Onapa et al. (2006) dan Nishikawa et al. (2007), infeksi eksperimental virus ND virulen tidak memunculkan gejala klinis. Perbedaan hasil tersebut dapat terjadi karena perbedaan jenis itik, umur itik, strain virus, dosis virus, dan rute infeksi yang digunakan. Kematian itik terjadi pada hari ke-7 hingga 15 pascainfeksi. Pada penelitian sebelumnya, isolat Tabanan-1/ARP/2017 menyebabkan kematian pada ayam pada hari ke-5 pascainfeksi (Adi et al., 2019a). Hal tersebut menunjukkan
bahwa tingkat keganasan virus pada itik lebih rendah daripada ayam dalam menimbulkan kematian.
Pada pemeriksaan histopatologi organ saraf itik ditemukan perubahan vaskuler berupa kongesti, edema perivascular, proliferasi dan hipertofi sel endotel pada beberapa pembuluh darah di cerebrum, cerebellum, dan medulla spinalis. Temuan tersebut mengindikasikan bahwa virus ND mempunyai sifat endotheliotrofik atau sel-sel endotel pembuluh darah merupakan salah satu sel target dari virus ND. Hal tersebut juga dibuktikan dengan penelitian yang dilakukan oleh Butt et al. (2019), bahwa virus ND terdeksi di neuron, sel endotel, serta sel glial di otak. Tidak ditemukannya lesi hemorrhagi pada itik bali yang diinfeksi AOAV-1 isolat Tabanan-1/ARP/2017 kemungkinan terjadi karena adanya ekspresi gen IL2 pada itik secara parsial dapat menurunkan patogenisitas virus dengan mengurangi kerusakan jaringan (Susta et al., 2015).
Pemeriksaan makroskopis pada cerebrum dan cerebellum menunjukkan pelunakan jaringan otak dengan kondisi yang sangat rapuh bila disentuh yang menunjukkan cerebrum dan cerebellum mengalami encephalomalacia. Hal
tersebut juga dibuktikan melalui pemeriksaan histopatologi yang
menunjukkan adanya vakuolisasi neuropil dengan tingkat keparahan ringan hingga sedang. Vakuolisasi dicirikan dengan
pembengkakan neuron baik di substansia grisea maupun substansia alba. Sel-sel tersebut terkadang terlihat menggelembung membentuk vakuola dan saling menyatu membentuk area yang lebih luas yang berisi cairan edema rendah protein serta puing-puing nekrotik (Moura et al., 2015). Vakuolisasi neuropil mencerminkan terjadinya degenerasi neural atau matinya sel saraf akibat adanya infeksi virus dan fagositosis oleh sel glial (Salbahaga et al., 2012). Degenerasi neural ini akan mengakibatkan nekrosis pada sel saraf yang kemudian tampak sebagai vakuolisasi pada otak (Jones et al., 1997). Lesi vakuolisasi neuropil serta demielinasi akson pada cerebrum dan cerebellum berkaitan dengan gejala saraf yang muncul pada itik seperti anoreksia, depresi, tremor, dan tortikolis (Mohammed et al., 2019).
Terjadinya gliosis merupakan respon dari kerusakan sel saraf. Sel saraf yang mati akan menghasilkan suatu senyawa kemokin yang dapat menarik sel glial ke lokasi lesi. Sel glial seperti astrosit dan mikroglia akan berproliferasi dan bertambah besar, kemudian sel-sel tersebut akan membentuk suatu jaringan yang mengelilingi sel neuron yang mengalami nekrosis serta mengisi ruang kosong sel pada neuron yang mati (Leme dan Chidi, 2001). Selain itu, adanya antigen virus ND dalam sel glial seperti astrosit, mikroglia, dan oligodendrosit menunjukkan bahwa virus ND dapat bereplikasi dalam sel glial dan berpengaruh terhadap invasi virus dalam sistem saraf (Butt et al., 2019).
Sedikitnya lesi nekrotik dan peradangan yang ditemukan pada medula spinalis serta tidak ditemukannya lesi tersebut pada nervus ischiadicus kemungkinan berhubungan dengan tidak ditemukannya gejala paresis dan paralisis sayap dan kaki belakang pada itik serta isolat virus yang digunakan pada penelitian ini merupakan virus ND viscerotropic velogenic. Pada bentuk neurotropic velogenic umumnya unggas menunjukkan gejala depresi yang lebih parah, dan kemunculan paresis dan paralisis yang lebih cepat (Brown et al.,
1999). Oleh karena itu pada penelitian ini diperkirakan itik mengalami kematian karena gangguan pencernaan dan respirasi.
Pada ayam adanya kerusakan pada organ saraf pusat seperti cerebrum, cerebellum, dan medulla spinalis disebabkan karena adanya antigen virus ND pada organ tersebut yang dapat dibuktikan dengan pewarnaan imunohistokimia (Wulan et al., 2017; Mohammed et al., 2019). Untuk saat ini sebaran antigen virus ND pada itik bali belum diketahui secara pasti. Penelitian lanjutan menggunakan imunohistokimia diperlukan untuk mengetahui sebaran virus ND pada organ sistem saraf itik bali.
Berdasarkan hasil pengamatan patologi anatomi dan histopatologi organ cerebrum, cerebellum, medulla spinalis, dan nervus ischiadicus itik bali menunjukkan bahwa AOAV-1 isolat Tabanan-1/ARP/2017 mampu menyebabkan perubahan mikroskopis berupa gangguan sirkulasi, nekrosis, dan peradangan dengan derajat yang bervariasi pada setiap lesi. Menurut Adi et al. (2019b), virus ND isolat Tabanan-1/ARP/2107 merupakan strain viscerotropic velogenic (VVND) yang mana menyebabkan lesi dominan pada saluran cerna unggas, namun juga dapat menyebabkan kerusakan ringan hingga sedang pada sistem saraf pusat. Hasil identifikasi molekuler dari isolat Tabanan-1/ARP/2017, memiliki motif asam amino pada situs pemotongan protein fusionnya adalah 112R-R-Q-K-R-F117 (Adi et al., 2019b). Menurut kriteria OIE (2014), secara molekuler yang menentukan virulensi adalah susunan asam amino pada F gen cleavage site, virus virulen memiliki motif asam amino sebagai berikut; 112R/ K-R-Q/K/R-K/R-R-F117 dan dinyatakan mampu menimbulkan lesi pada berbagai organ termasuk sistem saraf pusat, walaupun bukan tergolong neurotropik (Yusof dan Tan, 2001). Kemampuan virus untuk mencapai susunan saraf pusat dipengaruhi oleh susunan asam amino pada fusion protein cleavage site, serta adanya gugus asam amino fenilalanin pada
posisi asam amino nomor 117 (Kattenbelt et al., 2006).
SIMPULAN DAN SARAN
Simpulan
Infeksi buatan Avian orthoavulavirus 1 isolat Tabanan-1/ARP/2017 pada itik bali dapat menyebabkan perubahan patologi anatomi berupa encephalomalacia pada cerebrum dan cerebellum. Gambaran histopatologi didominasi oleh kongesti, edema perivascular, proliferasi endotel, vakuolisasi neuropil, vasculitis, dan gliosis pada sistem saraf pusat. Sedangkan gambaran histopatologi saraf tepi berupa kongesti pada nervus ischiadicus.
Saran
Perlu penelitian lebih lanjut mengenai patologi anatomi dan lesi histopatologi sistem saraf itik bali yang terinfeksi Avian orthoavulavirus 1 isolat Tabanan-1/ARP/2017 yang dikaitkan dengan umur, sebaran antigen virus, profil antibodi, dan faktor-faktor lain yang dalam kaitannya terhadap perubahan patologi anatomi dan histopatologi yang ditimbulkan.
UCAPAN TERIMAKASIH
Ucapan terima kasih kepada staf Balai Besar Veteriner Denpasar, Laboratorium Patologi Veteriner Fakultas Kedokteran Hewan Universitas Udayana, dan semua pihak yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Adi AAAM, Astawa INM, Putra IGAA.
2019a. The efficacy of binary ethylenimine-inactivated vaccines of Gianyar-1/AK/2014 virulent strain in protecting chickens against Tabanan-1/ARP/2017 virulent Newcastle disease virus isolates. Vet. World. 12(6): 758764.
Adi AAAM, Astawa NM, Putra KSA, Hayashi Y, Matsumoto Y. 2010. Isolation and characterization of a pathogenic newcastle disease virus
from a natural case in Indonesia. J. Vet. Med. Sci. 72: 313-319.
Adi AAAM, Astawa NN, Wandia IN, Putra IGAA, Winaya IBO, Krisnandika AAK, Wijaya AAGO. 2019b. Karakteristik molekuler virus avian orthoavulavirus 1 genotip vii yang diisolasi dari Tabanan Bali. J. Vet. 20(4): 593-602.
Amarasinghe GK, Ayllón MA, Bào Y, Basler CF, Bavari S, Blasdell KR, Briese T, Brown PA, Bukreyev A, Balkema-Buschmann A. 2019.
Taxonomy of the order
Mononegavirales: update 2019. Arch. Virol. 164(7): 1967–1980.
Brown C, King DJ, Seal BS. 1999. Pathogenesis of Newcastle disease in chickens experimentally infected with viruses of different virulence. Vet. Pathol. 36: 125-132.
Butt SL, Moura VMBD, Susta L, Miller PJ, Hutcheson JM, Cardenas-Garcia S, Brown CC, West FD, Afonso CL, Stanton JB. 2019. Tropism of Newcastle disease virus strains for chicken neurons, astrocytes,
oligodendrocytes, and microglia. BMC Vet. Res. 15: 317.
Dai Y, Cheng X, Liu M, Shen X, Li J, Yu S, Zou J, Ding C. 2014. Experimental infection of duck origin virulent Newcastle disease virus strain in duck. BMC Vet. Res. 10: 164.
Dai Y, Liu M, Cheng X, Shen X, Wei Y, Zhou S, Yu S, Ding C. 2013. Infectivity and pathogenicity of newcastle disease virus strains of different avian origin and different virulence for mallard ducklings. Avian Dis. 57: 8-14.
Ecco R, Susta L, Afonso CL, Miller PJ, Brown C. 2011. Neurological lesions in chickens experimentally infected with virulent Newcastle disease virus isolates. Avian Pathol. 40(2): 145-152.
Jones TC, Hunt RD, King NW. 1997. Rabies. USA. William & Wilkins.
Kattenbelt JA, Stevens MP, Gould AR. 2006. Sequence variation in the
newcastle disease virus genome. Virus Res. 116: 168-184.
Kencana GAY, Kardena IM, Mahardika IGNK. 2012. Peneguhan diagnosis penyakit newcastle disease lapang pada ayam buras di Bali menggunakan teknik RT-PCR. J. Ked. Hewan. 6(1): 28-31.
Kencana GAY. 2012. Penyakit virus unggas. Denpasar. Udayana University Press. Pp. 34-52.
Kiernan JA. 2015. Histological and
histochemica methods: theory and
practice. 5th ed. United Kingdom. Scion Publishing. Pp. 330-334.
Kingston DJ, Dharsana R, Chavez ER. 1978. Isolation of mesogenic Newcastle disease virus from an acute disease in Indonesian ducks. Trop. Anim. Health Prod. 10: 161-164.
Mohammed FF, Mousa MR, Khalefa HS, El-Deeb AH, Ahmed KA. 2019. New insights on neuropathological lesions progression with special emphasis on residence of velogenic newcastle disease viral antigen in the nervous system of experimentally infected broiler chickens. Explor Anim. Med. Res. 9(2): 145-157.
Moura VMBD, Susta L, Cardenas-Garcia S, Stanton JB, Miller PJ, Afonso CL, Brown CC. 2015. Neuropathogenic capacity of lentogenic, mesogenic, and velogenic newcastle disease virus strains in day-old chickens. Vet. Pathol. 53(1): 53–64.
Nishikawa M, Paulillo AC, Nakaghi LSO, Nunes AD, Campioni JM, Doretto JL. 2007. Newcastle disease in white Pekin ducks: response to experimental
vaccination and challenge. Braz. J. Poult. Sci. 9: 123–125.
Onapa MO, Christensen H, Mukiibi GM, Bisgaard M. 2006. A preliminary study of the role of ducks in the transmission of Newcastle disease virus to in-contact rural free-range chickens. Trop. Anim. Health Prod. 38: 285–289.
Salbahaga DP, Supartika IKE, Berata IK. 2012. Distribusi lesi negri’s bodies dan peradangan pada otak anjing penderita rabies di Bali. Indon. Med. Vet. 1(3): 352-360.
Susta L, Diego GD, Sean C, Cardenas-Garcia S, Roy SS, Miller PJ, Brown CC, Afonso CL. 2015. Expression of chicken interleukin-2 by a highly virulent strain of Newcastle disease virus leads to decreased systemic viral load but does not significantly affect mortality in chickens. J. Virol. 12: 122.
Wulan OH, Niken Y, Hastari W, Raden W. 2017. Detection of newcastle disease virus by immunohistochemistry on the brains of laying birds with clinical signs torticollis and curled toe paralysis. The Vet. Med. Int. Conf. 2017: 286–295.
Yusoff K, Tan W. 2001. Newcastle disease virus: Macromolecules and opportunities. Avian Pathol. 30(5): 439455.
Tabel 1 . Waktu kemunculan tanda klinis dan kematian itik perlakuan terinfeksi
|
Itik terinfeksi (P1) B1 B2 B3 B4 B5 B6 B7 B8 B9 B10 | |
|
Waktu muncul tanda klinis (hari pascainfeksi) Waktu kematian (hari pascainfeksi) |
4 5 4 8 7 7 4 5 8 5 9 8 8 14 15 12 7 9 12 8 |
Tabel 2. Derajat Keparahan Lesi Histopatologi pada Organ Cerebrum, Cerebellum, Medulla Spinalis, dan Nervus Ischiadicus Itik Bali
Perlakuan
Lesi P1
|
P0 |
B1 |
B2 |
B3 |
B4 |
B5 |
B6 |
B7 |
B8 |
B9 |
B10 | |
|
Cerebrum | |||||||||||
|
Kongesti |
- |
++ |
++ |
++ |
+ |
++ |
+ |
+ |
++ |
+ |
++ |
|
Edema perivascular |
- |
++ |
++ |
+ |
++ |
++ |
++ |
++ |
++ |
++ |
+ |
|
Proliferasi sel endotel |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
++ |
++ |
|
Vakuolisasi neurofil |
- |
+ |
+ |
- |
+ |
- |
- |
+ |
++ |
+ |
+ |
|
Vasculitis |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
++ |
+ |
+ |
|
Gliosis |
- |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
Cerebellum | |||||||||||
|
Kongesti |
- |
++ |
+ |
+ |
++ |
++ |
+ |
+ |
++ |
++ |
+ |
|
Edema perivascular |
- |
+ |
+ |
+ |
++ |
+ |
+ |
++ |
++ |
+ |
++ |
|
Proliferasi sel endotel |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Vakuolisasi neurofil |
- |
+ |
+ |
+ |
++ |
+ |
++ |
+ |
++ |
++ |
+ |
|
Nekrosis sel purkinje |
- |
+ |
++ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Vasculitis |
- |
+ |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
|
Gliosis |
- |
+++ |
++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
Medulla spinalis | |||||||||||
|
Kongesti |
- |
+ |
+ |
+ |
+ |
+ |
- |
+ |
++ |
+ |
- |
|
Edema perivascular |
- |
+ |
++ |
+ |
++ |
+ |
- |
+ |
+ |
++ |
+ |
|
Proliferasi sel endotel |
- |
+ |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
|
Vasculitis |
- |
- |
+ |
- |
- |
+ |
- |
- |
+ |
- |
- |
|
Gliosis |
- |
+++ |
+++ |
+++ |
++ |
++ |
+ |
+++ |
+++ |
+++ |
+++ |
|
Nervus ischiadicus | |||||||||||
|
Kongesti |
- |
+ |
+ |
++ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
Keterangan: - = tidak ada lesi; + = lesi ringan; ++ = lesi sedang; +++ = lesi berat; P0 = itik kontrol; P1 = itik terinfeksi.

Gambar 1. Tanda klinis itik bali yang diinfeksikan AOAV-1 isolat lapang. (A) Itik mengalami diare putih kehijauan, dan (B) gejala tortikolis dan opisthotonus saat menjelang kematian.
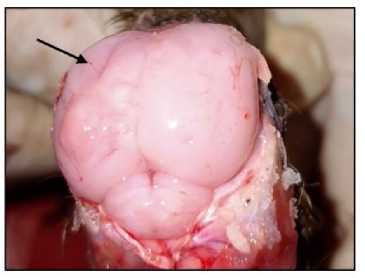
Gambar 2. Otak itik terinfeksi mengalami encephalomalacia.
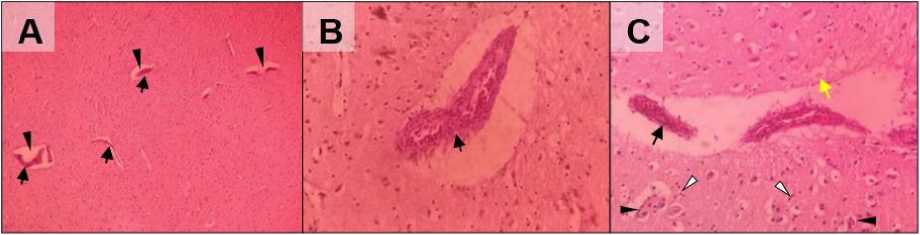
Gambar 3. Gambaran histopatologi cerebrum itik bali yang diinfeksi AOAV-1 isolat lapang. (A) Tampak adanya kongesti (panah) dan edema perivascular multifokal (mata panah) pada korteks cerebri; (B) Proliferasi sel endotel yang disertai dengan hipertrofi sel endotel (panah); (C) Vasculitis (panah hitam) pada pembuluh darah dengan edema perivascular di sekelilingnya, neurophagia dan satellitosis (mata panah hitam), gliosis yang tersebar di berbagai tempat (mata panah putih), serta vakuolisasi neuropil yang berisi materi nekrotik (panah kuning). (A = HE, 10×; B = HE, 40×; C = HE, 40×)
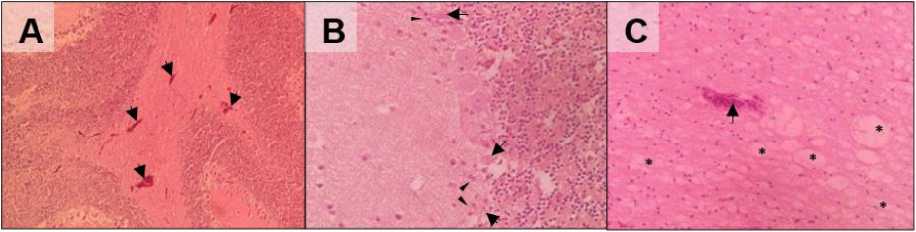
Gambar 4. Gambaran histopatologi cerebellum itik bali yang diinfeksi AOAV-1 isolat lapang. (A) Terlihat adanya kongesti multifokal (panah) pada substansia alba; (B) Nekrosis sel purkinje (panah) dengan sel glial yang mengelilingi sel yang mengalami nekrosis (mata panah); (C) Vasculitis (panah) dan demielinasi akson (bintang) pada substansia alba (A = HE, 10×; B = HE, 40×; C = HE, 40×)
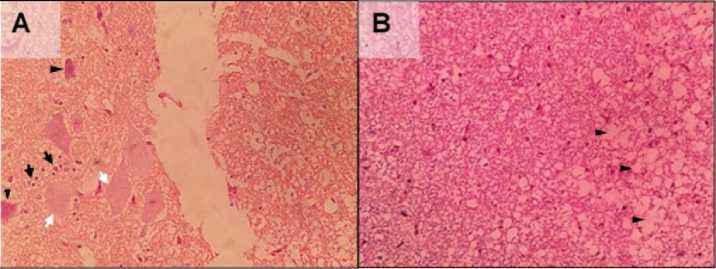
Gambar 5. Gambaran histopatologi medulla spinalis itik bali yang diinfeksi AOAV-1 isolat lapang. (A) Tampak adanya gliosis (panah), nekrosis sel neuron (mata panah), dan degenerasi (panah putih) pada substansia grisea medulla spinalis; (B) Tampak adanya demielinasi akson pada substansia alba medulla spinalis (mata panah)
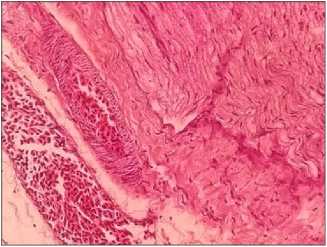
Gambar 6. Gambaran histopatologi nervus ischiadicus itik bali yang diinfeksi AOAV-1 isolat lapang memperlihatkan adanya kongesti. (HE, 40×)
19
Discussion and feedback