GROSS PATHOLOGY AND HISTOPATHOLOGY DESCRIPTION OF IMMUNE ORGANS OF BALI DUCK AFTER EXPERIMENTAL INFECTION WITH AVIAN ORTHOAVULAVIRUS 1 TABANAN-1/ARP/2017 ISOLATE
on
Volume 14 No. 6: 659-667
Desember 2022
DOI: 10.24843/bulvet.2022.v14.i06.p08
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Gambaran Patologi Anatomi dan Histopatologi Organ Pertahanan Itik Bali Pascainfeksi Buatan Avian orthoavulavirus 1 Isolat Tabanan-1/ARP/2017
(GROSS PATHOLOGY AND HISTOPATHOLOGY DESCRIPTION OF IMMUNE ORGANS OF BALI DUCK AFTER EXPERIMENTAL INFECTION WITH AVIAN ORTHOAVULAVIRUS 1 TABANAN-1/ARP/2017 ISOLATE)
M. Farhan Al Ma’arif 1*, Anak Agung Ayu Mirah Adi2, Ida Bagus Oka Winaya2
-
1Mahasiswa Sarjana Pendidikan Dokter Hewan, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. Sudirman, Denpasar, Bali, Indonesia, 80234;
-
2Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. Sudirman, Denpasar, Bali, Indonesia, 80234.
*Email: farhanalmaarif@gmail.com
Abstrak
Penelitian ini bertujuan untuk mengetahui perubahan patologi anatomi dan histopatologi organ timus, bursa Fabricius, dan limpa itik bali yang diinfeksi virus newcastle disease atau Avian orthoavulavirus 1 isolat Tabanan-1/ARP/2017. Penelitian ini menggunakan 15 ekor itik bali jantan berumur satu minggu. Setelah periode aklimatisasi selama dua minggu dan pengukuran titer antibodi ND dalam serum itik menunjukkan hasil di bawah angka 23 HI unit, selanjutnya sejumlah 10 ekor itik diinfeksikan dengan AOAV-1 isolat Tabanan-1/ARP/2017 dengan dosis 0,5ml/27 HA unit secara intraokular (P1) dan 5 ekor itik lainnya diberikan 0,5 ml larutan phosphate buffered saline melalui rute yang sama sebagai kontrol (P0). Nekropsi kemudian dilakukan pada itik yang mati dan dilakukan pemeriksaan patologi anatomi terhadap organ pertahanannya. Selanjutnya organ tersebut diproses dan dipulas dengan pewarnaan Hematoksilin-Eosin, lalu dilakukan pemeriksaan histopatologi. Hasil penelitian menunjukkan bahwa infeksi AOAV-1 isolat Tabanan-1/ARP/2017 pada itik bali dapat menyebabkan perubahan patologi anatomi berupa lesi foki nekrotik pada limpa dan atrofi pada timus. Sementara pada gambaran histopatologi menimbulkan deplesi sel limfoid berderajat parah pada organ timus dan bursa Fabricius, serta deplesi sel limfoid berderajat ringan pada organ limpa.
Kata kunci: virus newcastle disease; itik bali; patologi anatomi; histopatologi; organ pertahanan.
Abstract
This research aims to determine the gross pathological and histopathological changes of the thymus, bursa of Fabricius, and spleen of bali ducks infected with newcastle disease virus or Avian orthoavulavirus 1 Tabanan-1/ARP/2017 isolate. This research used 15 male bali ducks aged one week. After the acclimatization period for two weeks and the measurement of ND antibody titer in duck serum showed results below 23 HI units, 10 ducks were infected with AOAV-1 Tabanan-1/ARP/2017 isolate at a dose of 0.5 ml/27 HA units intraocularly (P1) and 5 other ducks as the control (P0) were given 0.5 ml of phosphate buffered saline by the same route. Then necropsy was performed on the dead ducks and gross pathology examination was performed on its immune organs. That organs were processed and stained for Hematoxylin-Eosin, then performed histopathology examination. The results showed that infection with AOAV-1 Tabanan-1/ARP/2017 isolate in bali ducks could cause gross pathological changes in the form of necrotic foci lesions in the spleen and atrophy in the thymus. Meanwhile, the histopathological appearance showed severe depletion of lymphoid cells in the thymus and bursa of Fabricius, and mild lymphoid cell depletion in the spleen.
Keywords: newcastle disease virus; bali duck; gross pathology; histopathology; immune organ
PENDAHULUAN
Salah satu jenis itik yang diternakkan oleh masyarakat di Indonesia adalah itik bali (Anas platyrhynchos domestica). Itik bali sebagai salah satu jenis unggas yang lebih banyak dimanfaatkan telurnya dibandingkan dengan dagingnya.
Kebutuhan akan telur dan daging itik di Bali tetap tinggi terutama pada hari-hari tertentu karena selain dikonsumsi juga dimanfaatkan sebagai sarana upacara agama Hindu (Udayana, 2012). Itik dikenal memiliki daya tahan yang cukup baik terhadap penyakit, tetapi tidak sedikit itik mengalami serangan agen infeksius dan menyebabkan penyakit yang dapat merugikan peternak (Rohajawati dan Supriyati, 2010). Newcastle disease merupakan penyakit yang sangat merugikan bagi industri peternakan unggas. Newcastle disease (ND) atau tetelo telah mewabah hampir di seluruh Indonesia termasuk juga Provinsi Bali. Penyakit ini disebabkan oleh virus ND atau disebut juga Avian orthoavulavirus 1 (AOAV-1). Itik merupakan salah satu reservoir alami dan sebagai hewan perantara (karier) virus ND. Itik sangat berpotensi untuk menyebarkan dan menularkan virus ND ke ternak lain namun pada kebanyakan kasus itik tersebut sering kali bersifat subklinis yaitu tidak menunjukkan tanda-tanda klinis infeksi ND (Saepulloh dan Darminto, 2005).
Meskipun sering bersifat subklinis, serangan virus ND ternyata pernah dilaporkan dapat mematikan itik yang berumur muda dan menimbulkan beberapa perubahan patologi yang menyertainya (Kingston et al., 1978; Roy et al., 2000). Beberapa hasil penelitian menunjukkan bahwa sistem kekebalan spesifik (humoral dan seluler) tidak dapat berfungsi secara optimal pada ayam, itik, dan angsa yang terinfeksi virus ND karena jaringan limfoid tidak berkembang sehingga menyebabkan kelainan patologi atau kerusakan pada organ limfoid seperti timus, bursa Fabricius, dan limpa unggas (Lu et al.,
2014; Anis et al., 2012; Bharathi et al., 2018; Elbestawy et al., 2019).
Pada tahun 2017, virus ND virulen isolat Tabanan-1/ARP/2017 diisolasi dari sebuah peternakan ayam petelur di Kabupaten Tabanan, Bali (Adi et al., 2019b). Patogenisitas virus ND isolat lapang tersebut pada itik bali masih belum diteliti, terutama mengenai perubahan patologi anatomi dan histopatologi organ pertahanannya. Atas dasar latar belakang tersebut, penelitian ini bertujuan mengetahui perubahan patologi anatomi dan histopatologi organ timus, bursa Fabricius, dan limpa itik bali pascainfeksi buatan virus ND virulen isolat Tabanan-1/ARP/2017.
METODE PENELITIAN
Kelaikan Etik Hewan Coba
Seluruh prosedur pengguaan hewan coba yang digunakan dalam penelitian ini telah mendapatkan persetujuan dari Komite Etik Hewan Fakultas Kedokteran Hewan Universitas Udayana, dengan Sertifikat Persetujuan Etik Hewan nomor: B/214/UN14.2.9/PT.01.04/2021.
Persiapan Hewan Coba
Penelitian ini menggunakan hewan coba berupa 15 ekor itik bali jantan berusia satu minggu yang belum diberikan vaksin ND yang diperoleh dari pembibit yang berasal dari salah satu peternakan itik di Kecamatan Mengwi, Kabupaten Badung, Provinsi Bali. Seluruh sampel itik dipelihara dalam kandang isolasi yang steril untuk proses aklimatisasi selama dua minggu dengan pakan dan air minum diberikan secara ad libitum. Tiga hari sebelum masa aklimatisasi berakhir, serum itik dikoleksi untuk dilakukan pengukuran terhadap titer antibodi ND menggunakan uji hambatan hemaglutinasi (HI). Uji HI bertujuan untuk memastikan bahwa titer antibodi ND dalam tubuh itik telah rendah (< 23 HI unit) sehingga infeksi virus dalam tubuh itik dapat berjalan dengan baik. Serum dikoleksi dari sampel darah yang
diambil menggunakan spuit 3 ml dan dilakukan pada daerah vena jugularis.
Rancangan Penelitian
Setelah dilakukan uji HI dan pengukuran titer antibodi ND dalam serum menunjukkan hasil dibawah angka 8 HI unit (23), kemudian itik dibagi menjadi dua perlakuan secara acak. Itik perlakuan kontrol (P0) berjumlah 5 ekor dan diberi kode A1-A5. Sementara itik perlakuan terinfeksi (P1) berjumlah 10 ekor dan diberi kode B1-B10. Itik P1 diinfeksikan dengan virus AOAV-1 isolat Tabanan-1/ARP/2017 dengan dosis 27HA unit sebanyak 0,5 ml ke tubuh itik secara intraokular dan itik P0 ditetesi dengan PBS sebanyak 0,5 ml melalui rute yang sama. Kedua perlakuan dipelihara secara terpisah di dalam kandang isolasi. Itik P1 yang mati kemudian segera dinekropsi. Sedangkan itik P0 dan P1 yang belum mati sampai hari ke-30, dieuthanasi kemudian dilakukan nekropsi. Metode euthanasia yang digunakan adalah metode dekapitasi (pemutusan leher).
Pemeriksaan Patologi Anatomi dan Histopatologi
Itik yang mati setelah diberi perlakuan kemudian dinekropsi untuk dilakukan pemeriksaan patologi anatomi pada organ timus, bursa Fabricius, dan limpa. Organ tersebut kemudian dikoleksi dalam pot-pot yang berisi NBF 10%. Selanjutnya organ diproses untuk pembuatan preparat histologi dan dipulas dengan pewarnaan Hematoksilin-Eosin. Pembuatan preparat histologi yang dilakukan pada penelitian ini mengikuti metode Kiernan (2015). Pemeriksaan histopatologi pada preparat histologi ketiga organ tersebut dilakukan di bawah mikroskop dengan perbesaran 10 kali dan 40 kali pada 5 lapang pandang yang berbeda dari tiap preparat. Pencatatan terhadap perubahan histopatologi yang ditemukan di organ pertahanan difokuskan pada lesi deplesi sel limfoid, kemudian dikategorikan berdasarkan derajat
keparahannya (normal, ringan, sedang, dan berat). Pada organ timus, derajat keparahan lesi dinilai berdasarkan perbandingan
ukuran korteks dengan medula. Pada organ bursa Fabricius, derajat keparahan lesi dinilai berdasarkan pengurangan jumlah dan ukuran, serta penipisan folikel limfoid. Sementara pada organ limpa, derajat keparahan lesi dinilai berdasarkan dominansi nekrosis/apoptosis sel limfoid dan penipisan jaringan limfoid (Aguanta et al., 2018).
Analisis Data
Perubahan patologi anatomi yang ditemukan disajikan secara deskriptif. Hasil pemeriksaan histopatologi yang diamati berupa deplesi sel limfoid kemudian ditabulasi dan dikategorikan berdasarkan derajat keparahan lesi, lalu disajikan secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil
Tanda Klinis
Itik mulai menunjukkan tanda klinis pada hari ke-4 pascainfeksi berupa anoreksia, bulu kusam, diare putih kehijauan, diikuti dengan gejala saraf seperti depresi, opisthotonus, tortikolis, tremor otot, dan gangguan pernafasan pada hari selanjutnya. Kematian itik terjadi pada hari ke-7 hingga ke-15 pascainfeksi dengan rincian pada Tabel 1.
Gambaran Patologi Anatomi
Perubahan patologi anatomi yang ditemukan pada organ limpa itik terinfeksi berupa adanya foki nekrotik multifokal (Gambar 1-B). Atropi ditemukan pada semua organ timus (Gambar 1-D). Pada bursa Fabricius tidak terlihat adanya perubahan makroskopis, namun
konsistensinya lebih lembek dibandingkan dengan bursa Fabricius kontrol. Pada pemeriksaan makroskopis organ
pertahanan itik kontrol tampak normal dan tidak ditemukan adanya perubahan.
Gambaran Histopatologi
Pemeriksaan histopatologi pada 10 sampel organ timus itik terinfeksi terlihat adanya deplesi sel limfoid pada bagian korteks dan medula (Gambar 2-B). Deplesi
sel limfoid memiliki derajat keparahan berat (severe) pada semua sampel. Derajat keparahan lesi deplesi sel limfoid pada organ pertahanan dapat dilihat pada Tabel 2. Selain itu juga terlihat lobulus timus mengalami atrofi serta hilangnya batas antara korteks dan medula. Nekrosis serta sel makrofag banyak ditemukan di bagian korteks (Gambar 2-C). Lesi lain yang ditemukan adalah gangguan sirkulasi berupa perdarahan. Pada itik kontrol tidak ditemukan adanya lesi histopatologi pada organ timus.
Pemeriksaan histopatologi terhadap 10 sampel bursa Fabricius itik terinfeksi terlihat adanya deplesi folikel limfoid disertai nekrosis dengan derajat keparahan sedang hingga berat (Gambar 3-B). Pada bagian medula folikel yang mengalami deplesi tersebut mengandung banyak makrofag dengan sitoplasma yang membengkak disertai debris sel (Gambar 3-C). Makrofag ini memberikan gambaran medula yang bervakuola pada perbesaran rendah. Lapisan epitel plika tampak berkelok-kelok dan proliferasi jaringan ikat di ruang interfolikuler mengindikasikan terjadinya atrofi (Gambar 3-B). Selain itu juga ditemukan adanya edema, proliferasi sel radang (Gambar 3-C), dan terbentuknya kista nekrotik (Gambar 3-B). Pada itik kontrol tidak ditemukan adanya lesi histopatologi pada organ bursa Fabricius.
Pemeriksaan histopatologi terhadap 10 sampel organ limpa itik terinfeksi menunjukkan adanya deplesi sel limfoid pada pulpa putih terutama di bagian korteks dengan derajat ringan hingga sedang (Gambar 4-C). Pada pulpa putih, terutama pada germinal center populasi sel limfoid tampak lebih sedikit dibandingkan dengan kontrol (Gambar 4-B). Sel-sel limfoid yang mengalami nekrosis juga ditemukan pada pulpa putih yang mengalami deplesi. Pada itik kontrol tidak ditemukan adanya lesi histopatologi.
Pembahasan
Newcastle disease atau tetelo adalah penyakit menular pada unggas dengan
tanda klinis berupa gangguan pernafasan, pencernaan, dan saraf. Pada penelitian ini dipaparkan hasil temuan dari perubahan patologi anatomi dan histopatologi organ pertahanan yang terdiri dari timus, bursa Fabricius, dan limpa itik bali berumur 21 hari yang diinfeksi dengan virus ND virulen atau Avian orthoavulavirus 1 (AOAV-1) isolat Tabanan-1/ARP/2017. Umumnya infeksi virus ND pada unggas air seperti itik baik secara alami maupun eksperimental bersifat subklinis serta perubahan patologi anatomi maupun histopatologi yang ditemukan bersifat ringan dan lebih sedikit dibandingkan dengan pada ayam (Anis et al., 2013).
Secara umum patogenesis infeksi virus famili paramyxoviridae dimulai dari penangkapan virus di mukosa rongga hidung, kemudian difagosit oleh makrofag lokal dan dieliminasi keluar tubuh. Namun, apabila sistem kekebalan tubuh lemah atau virus bersifat virulen maka selanjutnya akan disebarkan oleh makrofag (leukocytic trafficking) ke kelenjar pertahanan regional. Virus bereplikasi pada kelenjar pertahanan regional, diikuti dengan viremia primer. Setelah viremia primer, terjadi viremia sekunder dan kemudian virus disebarkan oleh sistem limfoid hingga mencapai sel-sel epitel mukosa pernafasan, mukosa ginjal, saluran pencernaan, dan sistem saraf (Zachary, 2012).
Pada penelitian ini, tanda klinis yang terlihat pada itik terinfeksi tidak jauh berbeda dengan yang dilaporkan oleh Kingston et al. (1978), Dai et al. (2014), dan Bharathi et al. (2018). Tanda klinis tersebut berawal dari diare putih kehijauan, penurunan nafsu makan (anoreksia), kelesuan, terhambatnya pertumbuhan, dan bulu kusam. Kemudian diikuti oleh gejala saraf seperti depresi, tremor otot, kejang, opisthotonus, tortikolis, hingga kematian.
Hasil pemeriksaan histopatologi menunjukkan bahwa lesi dominan yang ditemukan pada organ timus, bursa Fabricius, dan limpa berupa deplesi sel-sel limfoid. Infeksi AOAV-1 pada itik bali
yang berumur 21 hari menyebabkan pengurangan populasi atau deplesi sel limfoid dalam jumlah yang besar (severe) pada hampir semua sampel organ timus dan bursa Fabricius. Perubahan patologi tersebut serupa dengan penelitian yang dilakukan Bharathi et al. (2018). Pada penelitian ini organ limpa itik terinfeksi mengalami deplesi sel limfoid dengan derajat keparahan ringan. Deplesi tersebut terjadi pada pulpa putih, terutama pada germinal center dan daerah korteks. Pada penelitian sebelumnya virus ND virulen isolat Tabanan-1/ARP/2017 menyebabkan lesi perdarahan, nekrosis serta deplesi sel limfoid pada limpa ayam (Adi et al., 2019a). Pemeriksaan patologi anatomi pada limpa itik terinfeksi menunjukkan adanya foki nekrotik multifokal. Keberadaan virus ND pada jaringan limfoid dapat menyebabkan limfolisis di tengah germinal center dan menghasilkan debris inti sel sehingga pada limpa terlihat nekrosis dan deplesi sel limfoid (Etriwati et al., 2017). Deplesi sel limfoid dapat disebabkan oleh apoptosis, nekrosis, atau migrasi heterofil dan limfosit dari organ-organ limfoid ke tempat inflamasi akibat rangsangan mediator peradangan (Anis et al., 2013). Pada ayam adanya antigen virus ND pada organ pertahanan seperti timus, bursa Fabricius, dan limpa yang menunjukan lesi deplesi folikel limfoid dapat dibuktikan dengan pewarnaan imunohistokima, namun pada organ pertahanan itik antigen virus ND hanya terdeteksi pada limpa dan timus, tidak pada bursa meskipun deplesi limfoid terjadi pada ketiga organ tersebut (Adi et al., 2010; Anis et al., 2013).
Pada pemeriksaan patologi anatomi, timus itik terinfeksi terlihat mengalami atrofi. Secara mikroskopis, atrofi terjadi pada lobus timus, serta folikel dan plika bursa Fabricius. Hal tersebut serupa dengan hasil penelitian Lu et al. (2014) yang menyatakan bahwa atrofi terjadi pada timus dan bursa Fabricius angsa yang terinfeksi virus ND virulen. Terjadinya atrofi seringkali disertai dengan lesi histopatologi berupa penurunan jumlah sel limfoid pada
korteks timus dan degenerasi folikel limfoid bursa Fabricius (Berthault et al., 2018). Timus dan bursa Fabricius adalah organ limfoid primer pada unggas, yang masing-masing berfungsi sebagai tempat pematangan sel limfosit T dan limfosit B. Setelah pematangan, sel limfoid naif masuk ke dalam sirkulasi darah dan mencapai organ limfoid sekunder seperti limpa dan jaringan perifer. Adanya lesi pada organ timus, bursa Fabricius, dan limpa akibat infeksi dapat menyebabkan penekanan sistem kekebalan atau imunodepresi pada unggas sehingga memfasilitasi terjadinya infeksi sekunder dan komplikasi tanda klinis (Harrison et al., 2011).
Kerusakan yang terjadi pada bursa Fabricius berkaitan dengan aktivitas sel T pada bursa Fabricius yang membatasi replikasi virus, mengembangkan kerusakan jaringan, dan menunda pemulihan jaringan dengan cara melepaskan sitokin dan efek sitotoksik, sehingga mengakibatkan apoptosis pada jaringan limfoid (Ravindra et al., 2009). Perubahan histopatologi pada bursa Fabricius unggas yang terinfeksi ND menunjukkan lesi klasik virus ND berupa nekrosis folikel limfoid (Sultan et al., 2016).
Temuan perubahan patologi anatomi dan histopatologi organ pertahanan itik bali yang diinfeksi virus ND virulen pada penelitian ini terlihat cenderung lebih ringan dibandingkan dengan temuan perubahan patologi yang terjadi pada ayam. Pada penelitian sebelumnya perubahan patologi organ pertahanan ayam yang diinfeksi virus ND virulen menunjukkan derajat infeksi yang lebih parah. Ayam yang terinfeksi virus ND virulen menyebabkan splenomegali, hemorrhagi, nekrosis, dan deplesi sel limfoid pada organ limpa; serta kerusakan yang parah pada folikel limfoid timus dan bursa Fabricius (Adi et al., 2019a; Zahid et al., 2021). Namun perubahan yang terjadi pada itik cenderung bersifat ringan sampai sedang (Zahid et al., 2021). Lebih rendahnya derajat keparahan yang terjadi terutama pada organ pertahanan itik dibandingkan
dengan ayam kemungkinan disebabkan karena perbedaan tingkat respon imun yang dimediasi oleh sitokin yang dihasilkan oleh ayam dan itik (Kang et al., 2016).
Meskipun pada umumnya infeksi ND pada itik bersifat subklinis dan menimbulkan derajat keparahan penyakit yang lebih ringan dibandingkan dengan ayam, seperti pada kebanyakan unggas air lainnya, itik merupakan reservoir virus ND dan sangat berpotensi untuk menyebarkan virus ke unggas yang lain. Upaya pengendalian dapat dilakukan dengan cara memelihara sanitasi dan higiene serta tatalaksana kesehatan hewan, biosekuritas yang baik, kontrol biologi, pemusnahan (stamping out) bagi hewan yang merupakan sumber penyakit, dan program vaksinasi secara intensif (Saepulloh dan Darminto, 2005).
SIMPULAN DAN SARAN
Simpulan
Berdasarkan atas hasil penelitian yang diperoleh dapat disimpulkan bahwa infeksi Avian orthoavulavirus 1 isolat Tabanan-1/ARP/2017 pada itik bali dapat menyebabkan perubahan patologi anatomi berupa lesi foki nekrotik pada limpa dan atrofi pada timus. Sementara pada gambaran histopatologi menimbulkan deplesi sel limfoid berderajat parah pada organ timus dan bursa Fabricius, serta deplesi sel limfoid berderajat ringan pada organ limpa.
Saran
Perlu penelitian lebih lanjut mengenai patologi anatomi dan lesi histopatologi organ pertahanan itik bali yang terinfeksi Avian orthoavulavirus 1 isolat Tabanan-1/ARP/2017 yang dikaitkan dengan umur, sebaran antigen virus, profil antibodi, dan faktor-faktor lain yang dalam kaitannya terhadap perubahan patologi anatomi dan histopatologi yang ditimbulkan.
UCAPAN TERIMAKASIH
Ucapan terima kasih kepada staf Balai Besar Veteriner Denpasar, Laboratorium
Patologi Veteriner Fakultas Kedokteran Hewan Universitas Udayana, dan semua pihak yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Adi AAAM, Astawa INM, Putra IGAA. 2019a. The efficacy of binary ethylenimine-inactivated vaccines of Gianyar-1/AK/2014 virulent strain in protecting chickens against Tabanan-1/ARP/2017 virulent Newcastle disease virus isolates. Vet. World. 12(6): 758764.
Adi AAAM, Astawa NM, Putra KSA, Hayashi Y, Matsumoto Y. 2010. Isolation and characterization of a pathogenic newcastle disease virus from a natural case in Indonesia. J. Vet. Med. Sci. 72: 313-319.
Adi AAAM, Astawa NM, Wandia IN, Putra IGAA, Winaya IBO, Krisnandika AAK, Wijaya AAGO. 2019b. Karakteristik molekuler virus avian orthoavulavirus 1 genotipe VII yang diisolasi dari Tabanan Bali. J Vet. 20(4): 593-602.
Aguanta BN, Fuller AL, Milfort MC, Williams SM, Rekaya R, Aggrey SE. 2018. Histologic Effects of Concurrent Heat Stress and Coccidial Infection on the Lymphoid Tissues of Broiler Chickens. Avian Dis. 62: 345–350.
Anis Z, Morita T, Azuma K, Ito H, Itoand T, Shimada A. 2013. Histopathological alterations in immune organs of chickens and ducks after experimental infection with virulent 9a5b newcastle disease virus. J. Comp. Path. 149: 8293.
Berthault C, Larcher T, Härtle S, Vautherot JF, Trapp-Fragnet L, Denesvre C. 2018. Atrophy of primary lymphoid organs induced by Marek’s disease virus during early infection is associated with increased apoptosis, inhibition of cell proliferation and a severe B-lymphopenia. Vet. Res. 49(1).
Bharathi AA, Muthusamy P, Rathnapraba S, Selvan ST, Srinivasan G. 2018. Evaluation of histopathological
changes in ducks infected with
newcastle disease virus. Int. J. Curr. Microbiol. App. Sci. 7(6): 3768-3774.
Dai Y, Cheng X, Liu M, Shen X, Li J, Yu S, Zou J, Ding C. 2014. Experimental infection of duck origin virulent Newcastle disease virus strain in duck. BMC Vet. Res. 10: 164.
Elbestawy AR, Ellakany HF, El-Hamid HSA, Zedan RE, Gado AR, Sedeik ME, El-Hack MEA, Saadeldin IM,
Alowaimer AN, Ba-Awadh H, Swelum AA. 2019. Muscovy ducks infected with velogenic Newcastle disease virus (genotype VIId) act as carriers to infect in-contact chickens. Poult. Sci. 10: 1–8.
Etriwati, Ratih D, Handharyani E, Setyaningsinh S. 2017. Pathology and immunohistochemistry study of Newcastle disease field case in chicken in Indonesia. Vet. World. 10(9): 10661071.
Harrison L, Brown C, Afonso C, Zhang J, Susta L. 2011. Early occurrence of apoptosis in lymphoid tissues from chickens infected with strains of newcastle disease virus of varying virulence. J. Comp. Pathol. 145(4): 327–335.
Kang Y, Feng M, Zhao X, Dai X, Xiang B, Gao P, Li Y, Li Y, Ren T. 2016. Newcastle disease virus infection in chicken embryonic fbroblasts but not duck embryonic fbroblasts is associated with elevated host innate immune response. Virol. J. 13: 41.
Kiernan JA. 2015. Histological and Histochemical Methods: Theory and Practice. 5th Ed. United Kingdom. Scion Publishing. Pp. 330-334.
Kingston DJ, Dharsana R, Chavez ER. 1978. Isolation of mesogenic Newcastle disease virus from an acute disease in Indonesian ducks. Trop. Anim. Health. Prod. 10: 161-164.
Lu A, Diao Y, Chen H, Wang J, Ge P, Sun X, Hao D. 2014. Evaluation of
histopathological changes, viral load, and immune function of domestic geese infected with Newcastle disease Virus. Avian Pathol. 43: 325–332.
Ravindra PV, Tiwari AK, Ratta B, Bais MV, Chaturvedi U, Palia SK, Sharma B, Chauhan RS. 2009. Time course of newcastle disease virus induced apoptotic pathways. Virus Res. 144: 350–54.
Rohajawati S, Supriyati R. 2010. Diagnosis penyakit unggas dengan metode certainty factor. Comm. IT. 4(1): 41-46.
Roy P, Venugopalan AT, Manvell R. 2000. Characterization of Newcastle disease virus isolated from chickens and ducks in Tamilnadu, India. Vet. Res. Comm. 24: 135-142.
Rue CA, Susta L, Cornax I, Brown CC, Kapczynski DR, Suarez DL, King DJ, Miller PJ, Afonso CL. 2011. Virulent Newcastle disease virus elicits a strong innate immune response in chickens. J. Gen. Virol. 92: 931-939.
Saepulloh M, Darminto. 2005. Kajian newcastle disease pada itik dan upaya pengendaliannya. WARTAZOA. 15(2): 84-94.
Sultan S, Osman N, Mohamed MA, Ahmed AI, Abdallah RAM, Faraouk M, Taha M, 2016. Infectious bursal disease vaccine ameliorates velogenic
newcastle disease virus infection in immunopotentiated chickens. Comp. Clin. Pathol. 25(1): 91-100.
Udayana IDGA. 2012. Itik Bali Sebagai Hewan Upacara dan Produksi. Denpasar. Udayana University Press.
Zachary JF. 2012. Nervous System. In: McGavin MD, Zachary JF. (Ed.) Pathologic Basis of Veterinary Disease. 5th ed. St. Louis (US). Mosby Elsivier. Pp. 771-870.
Zahid B, Akhtar R, Ahmed QA, Akram Q, Yasmeen R, Ateeq MK, Raza M, Rizwan HM, Iqbal Z, Saleem MM, Imran M. 2021. Clinico-pathological assessment of virulent Newcastle Disease Virus in ducks. Braz. J. Biol. 84.
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal
Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Tabel 1 . Waktu kemunculan tanda klinis dan kematian itik perlakuan terinfeksi
|
Itik terinfeksi (P1) B1 B2 B3 B4 B5 B6 B7 B8 B9 B10 | |
|
Waktu muncul tanda klinis (hari pascainfeksi) Waktu kematian (hari pascainfeksi) |
4 5 4 8 7 7 4 5 8 5 9 8 8 14 15 12 7 9 12 8 |
Tabel 2. Derajat Keparahan Lesi Deplesi Sel Limfoid pada Organ Pertahanan Itik Bali yang Diinfeksi AOAV-1 Isolat Tabanan-1/ARP/2017
|
Perlakuan | |
|
Organ |
P1 P0 B1 B2 B3 B4 B5 B6 B7 B8 B9 B10 |
|
Timus |
- +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ |
|
Bursa Fabricius Limpa |
- +++ +++ ++ +++ +++ +++ +++ +++ +++ +++ - + + + + ++ + + ++ + + |
Keterangan: - = tidak terjadi deplesi; + = deplesi ringan; ++ = deplesi sedang; +++ = deplesi berat; P0 = itik perlakuan kontrol; P1 = itik perlakuan terinfeksi.
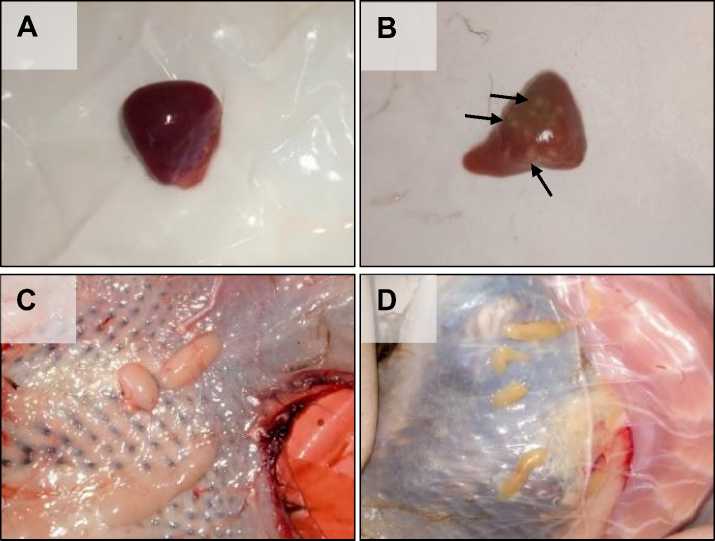
Gambar 1. Gambaran patologi anatomi organ pertahanan itik bali yang diinfeksi AOAV-1 isolat Tabanan-1/ARP/2017. Terlihat adanya foki nekrotik multifokal (panah) pada limpa (B) dan atrofi pada timus (D) itik terinfeksi. Gambaran normal limpa (A) dan timus (C) itik.
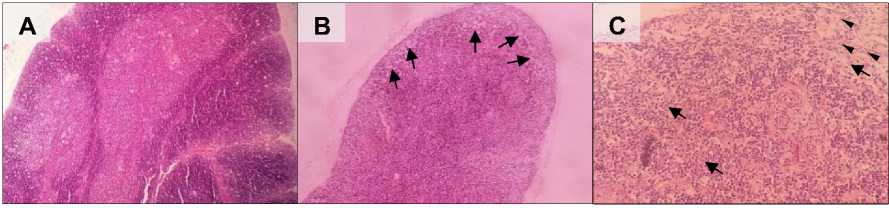
Gambar 2. Gambaran mikroskopis timus itik bali perlakuan (A) kontrol dan (B & C) terinfeksi. (A) Jaringan timus tampak normal; (B) korteks mengalami deplesi dan demarkasi korteks dan medula tidak terlihat jelas (mata panah); (C) Terlihat adanya nekrosis (mata panah) disertai dengan akumulasi sel makrofag (panah) pada bagian korteks timus yang mengalami deplesi. (A = HE, 10×; B = HE, 10×; C = HE, 40×)
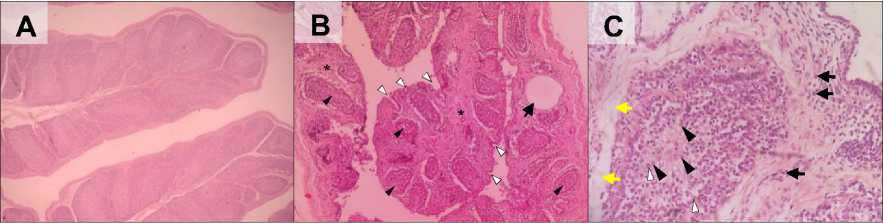
Gambar 3. Gambaran mikroskopis bursa Fabricius itik bali perlakuan (A) kontrol dan (B & C) terinfeksi. (A) Jaringan bursa Fabricius tampak normal; (B) Terlihat seluruh folikel limfoid mengalami deplesi (mata panah hitam), lapisan epitel plika berkelok-kelok (mata panah putih), kista nekrotik (panah) dan proliferasi jaringan ikat interfolikuler (bintang); (C) Terlihat adanya sel makrofag (mata panah hitam) pada medula folikel yang mengalami deplesi, nekrosis sel limfoid (mata panah putih), edema (panah kuning), proliferasi sel radang (panah hitam), dan proliferasi jaringan ikat interfolikuler (bintang). (A = HE, 10×; B = HE, 10×; C = HE, 40×)
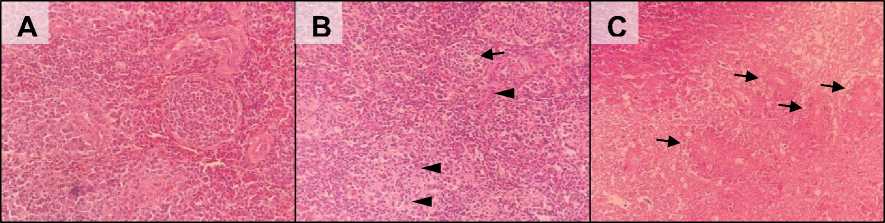
Gambar 4. Gambaran mikroskopis limpa itik bali perlakuan (A) kontrol dan (B & C) terinfeksi. (A) Jaringan limpa tampak normal; (B) Terlihat adanya deplesi sel-sel limfoid pada germinal center (panah) dan sel limfoid yang mengalami nekrosis (mata panah); (C) Terlihat adanya deplesi sel limfoid pada pulpa putih di korteks limpa (panah). (A = HE, 40×; B = HE, 40×; C = HE, 40×)
667
Discussion and feedback