CLINICOPATHOLOGY OF PUPPY WITH ENTERITIS AND MYOCARDITIS DUE TO CANINE PARVOVIRUS INFECTION: A CASE REPORT
on
Volume 14 No. 6: 693-704
Desember 2022
DOI: 10.24843/bulvet.2022.v14.i06.p12
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Laporan Kasus: Klinikopatologi Anak Anjing yang Mengalami Enteritis dan Miokarditis Akibat Infeksi Canine Parvovirus
(CLINICOPATHOLOGY OF PUPPY WITH ENTERITIS AND MYOCARDITIS DUE TO CANINE PARVOVIRUS INFECTION: A CASE REPORT)
Palagan Senopati Sewoyo1,2, Ida Bagus Oka Winaya3*, I Ketut Berata3, Anak Agung Ayu Mirah Adi3, Marissa Divia Dayanti1, Rahmat Grahadi4, Dzikri Nurma’rifah Takariyanti5
1Jl. Pinang No. 42 Kota Blitar, Jawa Timur, Indonesia;
-
2Mahasiswa Pendidikan Profesi Dokter Hewan, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
3Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
4Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Brawijaya. Jl. Veteran, Kota Malang, Jawa Timur, Indonesia 65145;
-
5Praktisi Dokter Hewan, Healthy Pet Clinic, Jl. Mekar Laksana No. 14, Kota Bandung, Indonesia.
*Email: okawinaya@gmail.com
Abstrak
Penyakit canine parvovirus (CPV) merupakan penyakit yang sangat kontagius pada anjing, menyebar melalui rute fekal-oral atau oronasal. Virus ini memiliki tropisme pada sel yang aktif dan cepat membelah. Hewan yang dijadikan studi kasus adalah seekor anjing ras lokal campuran jantan yang berumur tiga bulan, yang berasal dari Denpasar, Bali. Anjing kasus didapatkan dalam keadaan sakit selama empat hari. Pemeriksaan klinis menunjukkan anjing mengalami anoreksia, depresi, muntah-muntah, diare berdarah, batuk, demam, dan dehidrasi. Uji Polymerase Chain Reaction (PCR) menunjukkan anjing positif terhadap infeksi CPV. Hasil pemeriksaan hematologi rutin menunjukkan anjing mengalami anemia normositik normokromik, leukositopenia, monositosis dan neutropenia. Perubahan patologi anatomi yang teramati adalah hiperemia pada meningen otak, hiperemia paru-paru, nekrosis epikardium, kongesti pada hati, hiperemia medula ginjal, dan hiperemia pada usus halus. Secara histopatologi perubahan yang teramati adalah miokarditis nekrotikan, bronkopneumonia emfisematosa, hepatitis hemorrhagis et nekrotikan, deplesi folikel limfoid limpa, atrofi glomerulus ginjal, enteritis hemorrhagis et nekrotikan, dan degenerasi hidrofik epitel transisional vesica urinaria. Berdasarkan gejala klinis, pemeriksaan hematologi, perubahan patologi anatomi, histopatologi, serta isolasi dan identifikasi virus, maka dapat disimpulkan anjing kasus terinfeksi CPV bentuk enteritis dan miokarditis secara bersamaan.
Kata kunci: canine parvovirus; gambaran klinis; hematologi; patologi anatomi; histopatologi
Abstract
Canine parvovirus (CPV) disease is a highly contagious disease in dogs, spread by the fecal-oral or oronasal route. This virus has a tropism in cells that are active and rapidly dividing. The animal used as the case study is a three months old local mixed breed male puppy from Denpasar, Bali. The case puppy was found to be sick for four days. Clinical examination showed the puppy had anorexia, depression, vomiting, bloody diarrhea, cough, fever, and dehydration. Polymerase chain reaction (PCR) assay showed the puppy was positive for CPV infection. The results of the routine hematological examination showed that the CPV-infected puppy had normochromic normocytic anemia, leukocytopenia,
monocytosis, and neutropenia. The gross pathological changes observed were cerebral meninges hyperemia, lung hyperemia, epicardium necrosis, liver congestion, renal medulla hyperemia, and small intestine hyperemia. Histopathologically the changes observed were necrotizing myocarditis, emphysematous bronchopneumonia, hemorrhagic and necrotizing hepatitis, splenic lymphoid follicle depletion, renal glomerular atrophy, hemorrhagic and necrotizing enteritis, and hydropic degeneration of the urinary bladder transitional epithelium. Based on clinical symptoms, hematological examination, gross pathology, histopathology, as well as isolation and identification of the virus, it can be concluded that the puppy was infected with enteritis and myocarditis CPV concurrently.
Keywords: canine parvovirus; clinical findings; hematology; gross pathology; histopathology
PENDAHULUAN
Canine parvovirus (CPV) merupakan virus yang termasuk ke dalam famili parvoviridae dan subfamili parvovirinae yang menyerang hewan vertebrata. Subfamili parvovirinae kemudian terbagi lagi menjadi tiga genera yaitu: parvovirus, erythrovirus, dan dependovirus (Tattersal dan Cotmore, 1990; Ogbu, 2017). Virus ini memiliki kemiripan dengan feline panleukopenia virus (FPLV) dan 98% identik dengan virus ini, hanya berbeda 6-7 asam amino kapsid virus protein VP2. Virus ini juga memiliki hubungan yang dekat dengan mink enteritis virus (MEV), raccon parvovirus (RPV) dan blue fox parvovirus (BFPV) (Ogbu et al., 2017). Karena kemiripannya dengan FPLV, diduga CPV merupakan hasil mutasi/turunan dari virus tersebut (Sykes, 2014). Canine parvovirus merujuk pada tipe-2 (CPV-2) agar membedakan dengan parvovirus anjing yang sebelumnya telah ada, yang dikenal dengan canine minute virus atau CPV-1. Canine minute virus masuk ke dalam genus Bocavirus (Sykes, 2014). Canine parvovirus kemudian berkembang lebih lanjut menjadi CPV-2a pada tahun 1978. Varian lainnya, CPV-2b muncul pada tahun 1984 dan menjadi varian yang paling dominan di seluruh dunia sejak tahun 1988. Pada tahun 2000, CPV-2c pertama kali terdeteksi di Italia dan di beberapa negara didekatnya (Ogbu et al., 2017; Sendow, 2003).
Penyakit CPV bersifat sangat kontagius, menyebar secara cepat diantara anjing melalui rute fekal-oral (transmisi langsung) atau melalui paparan oronasal
melalui barang-barang yang terkontaminasi oleh feses (transmisi indirect/tidak langsung) (Goddard dan Leisewitz, 2010). Canine parvovirus resisten terhadap kondisi lingkungan dan dapat bertahan terhadap suhu panas/dingin yang ekstrim dalam periode yang lama (Gordon dan Angrick, 1986; Kantere, 2021; Khatri et al., 2017). Canine parvovirus merupakan salah satu virus patogenik dengan tingkat morbiditas yang tinggi (100%) dengan tingkat mortalitas sebesar 10% pada anjing dewasa, dan 91% pada anak anjing (Nandi dan Kumar, 2010).
Faktor umur dan status vaksinasi dari anjing berisiko memudahkan terserang CPV di Kota Denpasar. Umur anjing dibawah tiga bulan dan anjing yang tidak divaksinasi terhadap virus ini beresiko lebih tinggi terinfeksi CPV (Suartha et al., 2011). Anak anjing cenderung lebih rentan terinfeksi CPV karena adanya periode yang disebut window of susceptibility. Pada periode ini batas terendah antibodi maternal tidak sanggup melindungi anak anjing dari penyakit ini dan juga vaksin yang diberikan tidak akan merespons secara optimal. Dengan demikian, anak anjing sangat beresiko tinggi terinfeksi (Winaya et al., 2014). Pada fase sapih, enterosit dari kripta usus memiliki indeks mitosis tinggi karena pergantian flora bakteri dan pakan, sehingga lebih rentan terhadap infeksi CPV-2, mengingat tropisme dari virus ini adalah sel yang aktif dan cepat membelah (Goddard dan Leisewitz, 2010).
Pada laporan kasus ini penulis melaporkan anak anjing yang terinfeksi CPV dengan bentuk enteritis dan miokarditis secara bersamaan. Bentuk ini
sangat jarang ditemui karena umumnya infeksi virus ini hanya memiliki salah satu bentuk tersebut (Winaya et al., 2014). Dalam laporan kasus ini akan dibahas mengenai klinikopatologi hewan kasus yang terinfeksi CPV bentuk tersebut.
METODE PENELITIAN
Hewan Kasus
Hewan pada kasus ini adalah anjing jantan ras lokal campuran berumur tiga bulan, berwarna putih dengan corak hitam yang berasal dari Kota Denpasar, Bali. Berdasarkan anamnesis, diketahui bahwa anjing dipelihara dengan dilepasliarkan dengan status vaksinasi belum divaksin apapun, namun sudah diberi obat cacing oleh pemiliknya. Anjing mengalami sakit selama empat hari. Sebelum anjing mati dilakukan pemeriksaan klinis menyeluruh serta dilakukan koleksi darah untuk keperluan pemeriksaan hematologi. Pemeriksaan klinis dilakukan secara menyeluruh meliputi suhu rektal, degup jantung, laju respirasi, kondisi membran mukosa, dan seluruh sistem organ. Anjing mati tanpa perlakuan di Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana. Setelah anjing mati dilakukan prosedur nekropsi untuk melakukan pengamatan situs viscerum serta koleksi sampel untuk keperluan pemeriksaan histopatologi.
Analisis Hematologi
Sampel darah diambil ketika hewan masih hidup melalui intravena. Darah ditampung secara aseptis kemudian dikoleksi ke dalam tabung berisi ethylenediamine tetra-acetic acid (EDTA). Tabung EDTA kemudian disimpan ke dalam coolbox hingga digunakan untuk pemeriksaan hematologi rutin. Sampel darah yang telah dikoleksi kemudian dianalisis menggunakan hematology analyser (RT-7600®, Rayto Ltd., Shenzhen, China) di Laboratorium Parasitologi, Balai Besar Veteriner Denpasar. Analisis menggunakan alat ini dilakukan sesuai instruksi dari manufaktur.
Variabel yang diuji antara lain red blood cell (RBC), hemoglobin (Hb), packed cell volume (PCV), white blood cell (WBC), dan diferensial leukosit. Untuk menghitung diferensial leukosit, dilakukan kalkulasi manual menggunakan preparat ulas darah yang telah diwarnai dengan Giemsa, kemudian diamati menggunakan mikroskop (Olympus BX53, Olympus, Japan). Data hematologi disajikan dalam bentuk tabel.
Histopatologi
Sampel organ yang mengalami perubahan secara patologi anatomi dipotong dengan ukuran 1x1x1 cm kemudian difiksasi dalam neutral buffered formaldehyde (NBF) 10%. Pembuatan preparat histopatologi dilakukan di Laboratorium Patologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana dengan tahap-tahapan sebagai berikut: dehidrasi dengan etanol bertingkat mulai dari 70%; 85%; 95%; dan etanol absolut. Kemudian dilanjutkan tahapan penjernihan mengunakan larutan xylol. Jaringan yang sudah matang kemudian diinfiltrasi menggunakan paraffin cair dan dilakukan embedding dalam paraffin block. Paraffin block kemudian dipotong dengan ketebalan 5 µ menggunakan mikrotom kemudian diwarnai menggunakan pewarnaan rutin Hematoksilin dan Eosin (HE). Preparat yang telah dibuat kemudian diamati di Bagian Histopatologi, Laboratorium Patologi, Balai Besar Veteriner Denpasar menggunakan mikroskop (Olympus BX53, Olympus, Japan).
Polymerase Chain Reaction (PCR)
Untuk konfirmasi infeksi CPV digunakan metode PCR yang dilakukan di Laboratorium Biomedik, Fakultas Kedokteran Hewan, Universitas Udayana. Setelah dilakukan nekropsi hewan kasus, spesimen untuk keperluan amplifikasi DNA yang diambil antara lain usus halus (bagian jejunum dan ileum), jantung, dan limpa. Organ tersebut kemudian digunakan untuk keperluan isolasi DNA virus. Isolasi DNA menggunakan GeneJET Genomic
DNA Purification Kit (Thermo Scientific, Massachusetts, United States). Prosedur tahapan isolasi DNA mengikuti instruksi dari manufaktur. Uji PCR dilakukan menggunakan primer Hfor (5'-
CAGGTGATGAATTTGCTACA-3') (Lin et al., 2014) dan VP reverse (5'-
TTCTAGGTGCTAGTTGAG-3') (Buonavoglia et al., 2001). Produk yang telah teramplifikasi kemudian dianalisis menggunakan elektroforesis pada media 1% gel agarosa dalam tegangan konstan (100 V) selama sekitar 30 menit kemudian DNA divisualisasikan dibawah sinar ultraviolet vansluminator (UV).
HASIL DAN PEMBAHASAN
Hasil
Hasil pemeriksaan klinis menunjukkan anjing mengalami demam, peningkatan laju respirasi disertai batuk dan dyspnea, mengalami dehidrasi, diare berdarah, anoreksia serta muntah-muntah (Tabel 1). Berdasarkan pemeriksaan hematologi dapat disimpulkan anjing kasus menderita anemia normositik normokromik, leukositopenia, monositosis, dan neutropenia (Tabel 2). Perubahan patologi anatomi anjing kasus disajikan pada Tabel 3. Berdasarkan pemeriksaan klinis serta gambaran patologi anatomi anjing kasus diduga menderita CPV dengan diagnosis banding canine distemper dan coccidiosis. Pemeriksaan feses menggunakan metode natif (langsung) maupun konsentrasi didapat hasil bahwa anjing tidak mengalami infeksi parasit cacing maupun coccidia. Setelah dilakukan pemeriksaan PCR, dapat dikonfirmasi bahwa anjing kasus positif terinfeksi oleh CPV.
Secara patologi anatomi, bagian meningen otak mengalami hiperemia, kemudian paru-paru mengalami hiperemia, terjadi nekrosis pada bagian epikardium jantung yang ditandai dengan area kepucatan, medula pada kedua ginjal mengalami hiperemia (bilateral medulla hyperemia), hati berwarna lebih gelap menandakan terjadi kongesti, limpa
Volume 14 No. 6: 693-704 Desember 2022 DOI: 10.24843/bulvet.2022.v14.i06.p12 nampak normal, bagian mukosa usus halus terlihat mengalami hiperemia disepanjang bagian jejunum dan sebagian ileum (segmental). Beberapa bagian mukosa usus halus nampak terasa kasar dan granular, menandakan terjadinya nekrosis dengan area hemoragi dan eksudasi fibrin (Gambar 2).
Secara histopatologi, organ cerebrum, esofagus, trakhea, kolon dan lambung tidak mengalami perubahan. Nampak terlihat struktur histologis normal pada masing-masing organ tersebut. Organ yang mengalami perubahan histopatologis pada anjing kasus ini antara lain adalah paru-paru, jantung ginjal, hati, limpa, usus halus, dan vesica urinaria. Pada paru-paru nampak mengalami penebalan septa alveoli, emfisema, kongesti, serta lumen bronkiolus diinfiltrasi oleh sel radang limfosit. Dapat disimpulkan paru-paru mengalami bronkopneumonia
emfisematosa (Gambar 3 c,d). Jantung
mengalami nekrosis pada kardiomiosit (Gambar 3e) yang ditandai dengan inti sel yang mengecil dan hiperkromatik. Inti sel yang mengecil dan hiperkromatik merupakan salah satu tanda nekrosis yaitu piknosis. Pada ginjal, terjadi dilatasi pada ruang kapsula Bowman yang menandakan terjadinya atrofi pada glomerulus ginjal (Gambar 3f). Sinusoid hati terisi dengan eritrosit serta diinfiltrasi oleh sel radang limfosit dan neutrofil, serta nampak beberapa sel hepatosit mengalami nekrosis yang ditandai dengan piknosis dan karyorhexis (Gambar 4a). Berdasarkan temuan histopatologis pada hati dapat disimpulkan bahwa hati mengalami hepatitis hemorrhagis et nekrotikan. Pada limpa terlihat populasi sel limfoid yang menurun, menandakan terjadinya deplesi dari folikel limfoid (Gambar 4b).
Secara histopatologis perubahan yang signifikan ditemukan pada usus halus. Pada usus halus, bagian jejunum mengalami enteritis hemorrhagis et nekrotikan. Enterosit mengalami deskuamasi,
kemudian villi usus nampak mengalami
kerusakan yang ekstensif, menandakan terjadinya nekrosis. Pada bagian villi usus juga diinfiltrasi sel radang neutrofil serta limfosit. Bagian lamina propria usus juga nampak infiltrasi sel radang limfosit. Kripta lieberkuhn dari usus halus bagian jejunum mengalami kerusakan hampir menyeluruh (Gambar 4c). Usus halus bagian ileum merupakan bagian yang memiliki peyer’s patches lebih banyak dibanding bagian usus halus lainnya. Nampak peyer’s patches pada ileum mengalami nekrosis, kemudian villi usus mengalami atrofi serta hemoragi (Gambar 4e). Pada kantung kemih atau vesica urinaria, ditemukan perubahan pada epitel transisional yaitu degenerasi hidrofik (Gambar 4f).
Pembahasan
Canine parvovirus merupakan salah satu penyebab umum enteritis akut pada anjing (Duffy et al., 2010; Goddard dan Leisewitz, 2010; Miranda et al, 2015). Virus diekskresikan pada feses tiga hari setelah inokulasi virus, dan shedding virus berlanjut hingga 3-4 minggu. Replikasi virus dimulai pada jaringan limfoid orofaring, limfonodus mesenterika, dan timus, dan pada kripta usus halus melalui penyebaran hematogenus (3-4 hari setelah infeksi) (Goddard dan Leisewitz, 2010). Dibutuhkan waktu 3-7 hari setelah infeksi untuk menunjukkan gejala klinis (Mia dan Hasan, 2021). Canine parvovirus memerlukan sel-sel yang memiliki laju proliferasi tinggi untuk bereplikasi, umumnya mereka cenderung berada pada usus halus, sumsum tulang belakang, dan jaringan limfoid (Goddard et al., 2008). Virus ini bereplikasi pada inti sel yang membelah pada fase S akhir atau pada awal fase G2 dari siklus sel (Humm dan Hughes, 2009).
Dengan diinfeksinya jaringan limfoid, CPV menyebabkan imunosupresif secara langsung melalui mekanisme limfositolisis dan secara tidak langsung melalui deplesi prekursor limfosit di sumsum tulang belakang (Boes dan Durham, 2017). Hal ini yang menjelaskan mengapa anjing kasus mengalami leukositopenia dan neutropenia
(Tabel 2). Kejadian ini juga mengakibatkan atrofi pada timus, deplesi folikel limfoid limpa (Gambar 4b), limfonodus, dan kerusakan mucosa-associated lymphoid tissue (MALT), khususnya peyer’s patches (Gambar 4e) (Vural dan Alcigir, 2011). Anak anjing yang mengalami neutropenia rentan mengalami sepsis oleh bakteri (Kilian et al., 2018).
Kripta lieberkuhn menyediakan stem cells untuk pembaharuan sel-sel epitel usus. Sel-sel pada villi umumnya berumur pendek dan siap digantikan oleh sel yang baru (McCandlish et al., 1981; Parrish, 1995). Sel-sel epitel kripta usus akan bermigrasi dari epitel germinal kripta menuju ke ujung villi usus. Setelah mencapai ujung villi usus, mereka mendapatkan kemampuan penyerapan air dan nutrisi. Canine parvovirus menginfeksi epitel germinal dari kripta lieberkuhn, yang menyebabkan penghancuran sel-sel epitel dan menyebabkan kolapsnya villi usus (Goddard dan Leisewitz, 2010). Pada anjing kasus ini, secara histopatologi usus halus nampak mengalami nekrosis pada kripta lieberkuhn dan kerusakan yang ekstensif pada villi usus serta mengalami atrofi. Pada kripta lieberkuhn sudah tidak ditemukan lagi aktivitas mitosis serta diinfiltrasi oleh sel radang neutrofil dan limfosit. Pada bagian villi juga diinfiltrasi oleh sel radang serta mengalami hemoragi. Hemoragi yang ditemukan disebabkan oleh disfungsi endotel, yang diperparah dengan replikasi virus pada sel endothelial (Adi, 2021). Hemoragi yang terjadi menyebabkan hewan mengalami anemia.
Pada kasus infeksi yang berat, villi usus bahkan dapat menghilang (Goddard dan Leisewitz, 2010). Tanpa adanya sel baru yang datang dari kripta lieberkuhn, villi kehilangan kemampuannya untuk menyerap nutrisi dan air, sehingga timbul diare. Hal ini juga menyebabkan mudahnya patogen lain untuk masuk (sebagai port ‘d entry) (Mia dan Hasan, 2021). Kerusakan epitel dari usus dapat memicu infeksi sekunder oleh bakteri flora normal usus yaitu Escherichia coli. Beredarnya bakteri
dan endotoksin dalam aliran darah akan menimbulkan coliform septicemia. Hal ini mengakibatkan septic shock yang dapat menimbulkan kematian (Turk et al., 1990).
Laju pembelahan sel limfoid dan sel intestinal menjadi faktor utama terhadap tingkat keparahan penyakit. Semakin tinggi laju pembelahannya, berkorelasi dengan tingkat replikasi virus dan penghancuran sel. Pada fase sapih, enterosit (sel usus) dari kripta usus memiliki indeks mitosis tinggi karena pergantian flora bakteri dan pakan, sehingga lebih rentan terhadap infeksi virus, karena tropisme dari virus ini adalah sel yang aktif dan cepat membelah (Goddard dan Leisewitz, 2010).
Infeksi pada miokardium umumnya terjadi karena aktifnya pembelahan sel miosit pada minggu-minggu awal pasca kelahiran (MacLachlan dan Edward, 2011). Hal ini dapat menyebabkan kematian mendadak akibat gagal jantung akut (Lenghaus dan Studdert, 1984; Meunier et al., 1984; Needle dan Mietelka, 2014). Namun anjing pada laporan kasus ini sudah berumur tiga bulan dan pada jantungnya juga mengalami nekrosis pada kardiomiositnya. Hal ini dimungkinkan jika infeksi CPV sudah bersifat berat dan sistemik. Selain pada jantung, pada kasus infeksi sistemik CPV dapat diisolasi dari paru-paru, limpa, hati, dan ginjal (Goddard dan Leisewitz, 2010), dan otak (Elia et al., 2007).
Penebalan septa alveoli serta infiltrasi sel radang pada lumen bronkiolus mengindikasikan telah terjadi infeksi sekunder oleh bakteri. umum terjadi pada kasus infeksi akut bakteri. Sedangkan infeksi virus biasanya menyebabkan pneumonia interstisialis yang melibatkan area diantara alveoli (septa alveoli). Bronkopneumonia berkembang saat terjadi ketidakseimbangan jumlah bakteri yang merupakan flora normal, sehingga bakteri mampu mencapai daerah bronkoalveolar. Bakteri yang mencapai daerah bronkoalveolar akan bertambah banyak karena tidak berfungsinya makrofag
alveolar. Faktor yang menyebabkan penurunan fungsi makrofag alveolar salah satunya adalah imunosupresif (Adi, 2014). Canine parvovirus sendiri bersifat imunosupresif sehingga kemungkinan dapat menyebabkan hal tersebut pada anjing kasus ini.
Perubahan yang terjadi pada hati serta ginjal kemungkinan diakibatkan oleh perluasan tropisme virus CPV. Diketahui bahwa CPV mampu bereplikasi pada sel kultur primer dari jaringan hati, ginjal, jantung, limpa, serta epitel usus (Ying et al., 2012). Lesi atrofi glomerulus pada kasus ini juga dijumpai pada laporan Al-Bayati et al. (2016). Terdapat beberapa penyebab atrofi glomerulus, antara lain stenosis arteri ginjal, dan infeksi yang berlangsung kronis.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan gejala klinis, pemeriksaan hematologi, perubahan patologi anatomi, histopatologi, serta isolasi dan identifikasi virus, maka dapat disimpulkan anjing kasus terinfeksi canine parvovirus bentuk enteritis dan miokarditis.
Saran
Perlu dilakukan kajian lebih lanjut mengenai penyebab dan faktor risiko terjadinya bentuk enteritis dan miokarditis secara bersamaan.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih kepada staf bagian Laboratorium Patologi Balai Besar Veteriner Denpasar drh. I Ketut Eli Supartika, M.Sc., APVet. yang telah membantu dalam penyediaan fasilitas pengamatan histopatologi.
DAFTAR PUSTAKA
Adi AAAM. 2014. Buku ajar patologi veteriner sistemik: sistema pernafasan. Swasta Nulus. Denpasar.
Adi AAAM. 2021. Buku ajar patologi gangguan sirkulasi: lesi makroskopis
dan mikroskopis. Swasta Nulus. Denpasar.
Al-Bayati HAM, Odisho SM, Al-Hammed HA. 2016. Study the histopathological changes accompanied with canine parvovirus infection. Al-Qadisiyah J. Vet. Med. Sci. 15(2): 115-118.
Boes KM, Durham AC. 2017. Bone marrow, blood cells, and the lymphoid/lymphatic system. In: Zachary JF (Ed.) Pathologic Basis of Veterinary Disease. 6th Ed. Elsevier. UK. Pp. 724.
Buonavoglia C, Martella V, Pratelli A, Tempesta M, Cavalli A, Buonavoglia D, Bozzo G, Elia G, Decaro N, Carmichael L. 2001. Evidence for evolution of canine parvovirus type 2 in Italy. J. Gen. Virol. 82: 3021-3025.
Duffy A, Dow S, Ogilvie G, Rao S, Hackett T. 2010. Hematologic improvement in dogs with parvovirus infection treated with recombinant canine granulocytecolony stimulating factor. J. Vet. Pharmacol. Ther. 33(4): 352-356.
Elia G, Cavalli A, Desario C, Lorusso E, Lucente MS, Decaro N, Martella V, Buonavoglia C. 2007. Detection of infectious canine parvovirus type 2 by mRNA real-time RT-PCR. J. Virol. Methods. 146(1): 202-208.
Goddard A, Leisewitz AL, Christopher MM, Duncan NM, Becker PJ. 2008. Prognostic usefulness of blood leucocyte changes in canine parvoviral enteritis. J. Vet. Intern. Med. 22(2): 309-316.
Goddard A, Leisewitz AL. 2010. Canine Parvovirus. Vet. Clin. North. Am. Small Anim. Pract. 40(6): 1041-1053.
Gordon JC, Angrick EJ. 1986. Canine parvovirus: environmental effects on infectivity. Am. J. Vet. Res. 47(7): 1464-1467.
Humm KR, Hughes D. 2009. Canine parvovirus infection. In: Silverstein DC & Hopper K (Eds.) Small Animal Critical Care Medicine. Saunders. Pennsylvania, United States. Pp. 482485.
Kantere M, Athanasiou LV,
Giannakopoulos A, Skampardonis V, Sofia M, Valiakos G,
Athanasakopoulou Z, Touloudi A, Chatzopoulos DC, Spyrou V, Billinis C. 2021. Risk and environmental factors associated with the presence of canine parvovirus type 2 in diarrheic dogs from thessaly, central grece. Pathogens. 10(5): 1-13.
Khatri R, Poonam, Mohan H, Minakshi CSP. 2017. Epidemiology,
pathogenesis, diagnosis, and treatment of canine parvovirus disease in dogs: A mini review abstract. J. Vet. Sci. Med. Diagn. 6(3): 2.
Kilian E, Suchodolski JS, Hartmann K, Mueller RS, Wess G, Unterer S. 2018. Long-term effects of canine parvovirus infection in dogs. PLoS ONE 13(3): e0192198.
Lenghaus C, Studdert MJ. 1984. Acute and chronic viral myocarditis. Acute diffuse nonsuppurative myocarditis and residual myocardial scarring following infection with canine parvovirus. Am. J. Pathol. 115(2): 316-319.
Lin CN, Chien CH, Chiou MT, Chueh LL, Hung MY, Hsu HS. 2014. Genetic characterization of type 2a canine parvoviruses from Taiwan reveals the emergence of an Ile324 mutation in VP2. Virol. J. 11: 39.
McCandlish IAP, Thompson H, Fisher EW, Cornwel HJC, Macartney J, Walton IA. 1981. Canine parvovirus infection. In. Pract. 3: 5-14.
MacLachlan NJ, Edward JD. 2011. Fenner’s Veterinary Virology. 4th Ed. Elsevier. UK.
Meunier PC, Cooper BJ, Appel MJ, Slauson DO. 1984. Experimental viral myocarditis: parvoviral infection of neonatal pups. Vet. Pathol. 21(5): 509515.
Mia MM, Hasan M. 2021. Update on canine parvovirus infection: a review from the literature. Veterinary
Sciences: Research and Reviews 7(2): 92-100.
Miranda C, Carvalheira J, Parrish CR, Thompson G 2015. Factors affecting the occurrence of canine parvovirus in dogs. Vet. Microbiol. 180:59-64.
Nandi S, Kumar M. 2010. Canine parvovirus: current perspective. Indian J. Virol. 21(1):31-44.
Needle DB, Mietelka KA. 2014. Pathology in practice. Parvoviral myocarditis. J. Am. Vet. Med. Assoc. 244(10): 11551157.
Ogbu KI, Anene BM, Newze NE, Okoro JI, Danladi MMA, Ochai SO. 2017. Canine Parvovirus: A Review. Int. J. Appl. Sci. 2(2): 74-95.
Parrish CR. 1995. Pathogenesis of feline panleukopenia virus and canine parvovirus. Baillieres Clin. Haematol. 8: 57-71.
Rizzi TE, Meinkoth J, Clinkenbeard KD. Normal Hematology of the Dog. In: Weiss DJ, Wardrop KJ (Eds.) Schalm’s Veterinary Hematology. 6th Ed. Wiley-Blackwell. Iowa, USA.
Sendow I. 2003. Canine Parvovirus pada Anjing. Wartazoa 13(2): 56-64.
Suartha IN, Mustikawati D, Erawan IGMK, Widyastuti SK. 2011. Prevalensi dan faktor risiko penyakit virus parvo pada anjing di Denpasar. J. Vet. 12(3): 235240.
Sykes JE. 2014. Canine and Feline Infectious Diseases. Elsevier. United Kingdom.
Tattersall P, Cotmore SF. 1990. Alternate splicing in a parvoviral nonstructural gene links a common amino-terminal sequence to downstream domains
which confer radically different
localization and turnover
characteristics. Virol. 177: 477-487.
Turk J, Miller M, Brown T. 1990. Coliform septicemia and pulmonary disease associated with canine parvoviral enteritis: 88 cases (1987-1988). J. Am. Med. Assoc. 196: 771-773.
Vural SA, Alcigir G. 2011.
Histopathological and
immunohistological findings in canine parvoviral infection: diagnosis
application. Revue Med. Vet. 162(2): 59-64.
Winaya IBO, Berata IK, Adi AAAM, Kardena IM. 2014. Aspek patologis infeksi parvovirus pada anak anjing di Kota Denpasar. J. Kedokt. Hewan. 8(2): 85-89.
Ying H, Zhang F, Cao W, Zhang M. 2012. The subcelllar and the tissue tropism of canine parvovirus based on the colocalization of transferrin receptor. Asian J. Anim. Vet. Adv. 7: 235-242.
Tabel 1. Pemeriksaan klinis hewan kasus
|
No |
Parameter |
Keterangan |
|
1. |
Suhu Rektal |
39,3 °C |
|
2. |
Degup Jantung |
116 kali/menit |
|
3. |
Laju Respirasi |
40 kali/menit |
|
4. |
Membran mukosa |
Mukosa mata dan mulut pucat, capillary refill time (CRT) > 2 detik |
|
5. |
Sistem Integumen |
Turgor kulit rendah, inspeksi menyeluruh tidak ditemukan adanya infestasi ektoparasit |
|
6. |
Sistem Kardiovaskuler |
Normal |
|
7. |
Sistem Pernafasan |
Mengalami batuk |
|
8. |
Sistem Saraf |
Normal |
|
9. |
Sistem Gastrointestinal |
Anjing terasa nyeri ketika dipalpasi area abdomen, konsistensi feses cair (diare) disertai darah. |
|
10. |
Gejala klinis |
Anoreksia, depresi, muntah-muntah, diare berdarah, batuk |
Tabel 2. Pemeriksaan hematologi rutin
|
Variabel |
Nilai |
Nilai rujukan* |
|
WBC (x 103 μL) |
5,4** |
6-17 |
|
RBC (x 106 μL) |
5,26** |
5,5-8,5 |
|
Hb (g/dL) |
12,1 |
12,0-18,0 |
|
MCH (Pg) |
22,8 |
22-25 |
|
PCV (%) |
37,1 |
37-55 |
|
MCV (fL) |
70,6 |
60-77 |
|
Monosit (x 103 μL) |
1,56*** |
0,15-1,35 |
|
Limfosit (x 103 μL) |
2,26 |
1-4,8 |
|
Neutrofil (x 103 μL) |
1,4** |
3-11,5 |
|
Eosinofil (x 103 μL) |
0,162 |
0,1-1,2 |
|
Basofil |
0 |
Jarang ditemukan |
Keterangan: *) Sumber nilai rujukan: (Rizzi et al., 2010); **Dibawah nilai normal; ***Diatas nilai normal
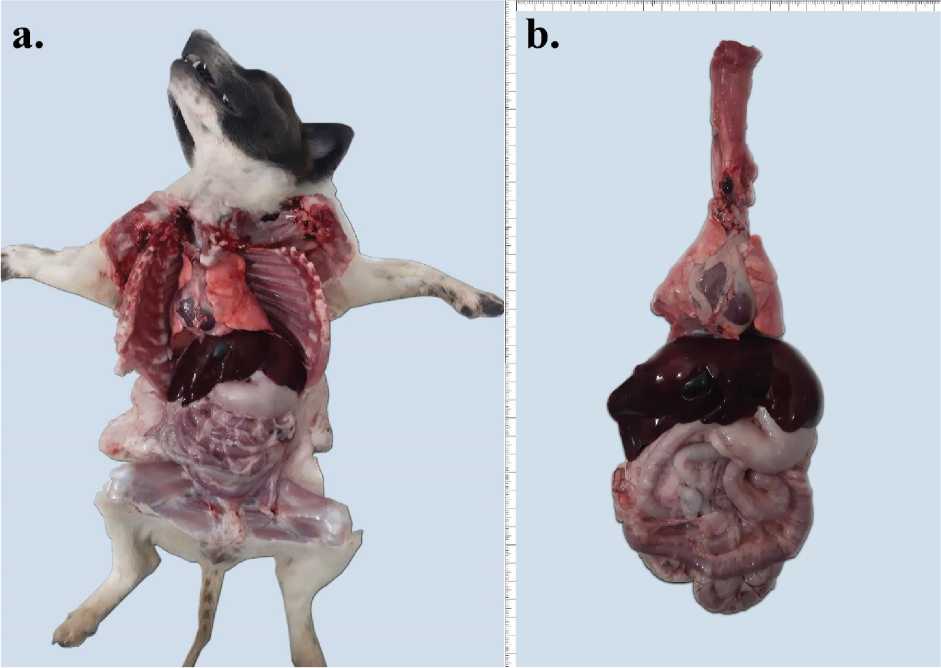
Gambar 1. (a) Gambaran patologi anatomi seluruh organ viscerum anjing in situ (b) organ viscerum anjing ex situ. Nampak paru-paru dan permukaan serosa usus halus mengalami hiperemia, dan hati mengalami kongesti.
Tabel 3. Tabel perubahan patologi anatomi
|
Organ |
Perubahan |
|
Otak Trakhea Esofagus Paru-paru Jantung Hati Limpa Ginjal Usus halus |
Meningen hiperemia Normal Normal Hiperemia Nekrosis epikardium Kongesti Normal Medula ginjal nampak hiperemia Hiperemia dan hemoragi disepanjang bagian jejunum dan awal ileum mengalami hiperemia |
|
Usus besar Vesica urinaria |
Normal Normal |
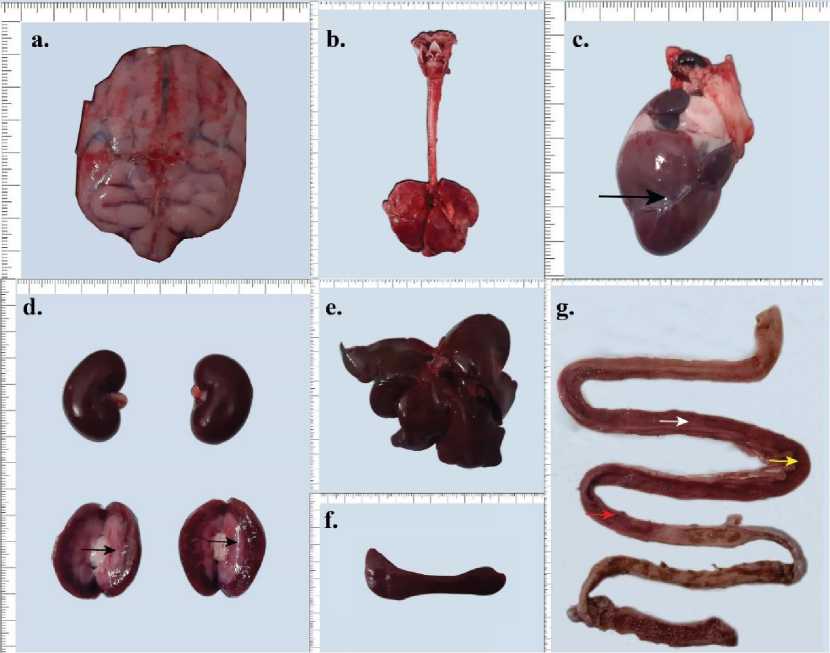
Gambar 2. (a) Hiperemia pada meningen otak (b) Paru mengalami hiperemia (c) Nekrosis epikardium (panah hitam) (d) Hiperemia pada medula ginjal (panah hitam) (e) Hati mengalami kongesti (f) Limpa nampak normal (g) Usus halus, disepanjang mukosa jejunum mengalami hiperemia (panah putih) serta mengalami hemoragi (panah kuning), bagian awal ileum mengalami segmental hiperemia.
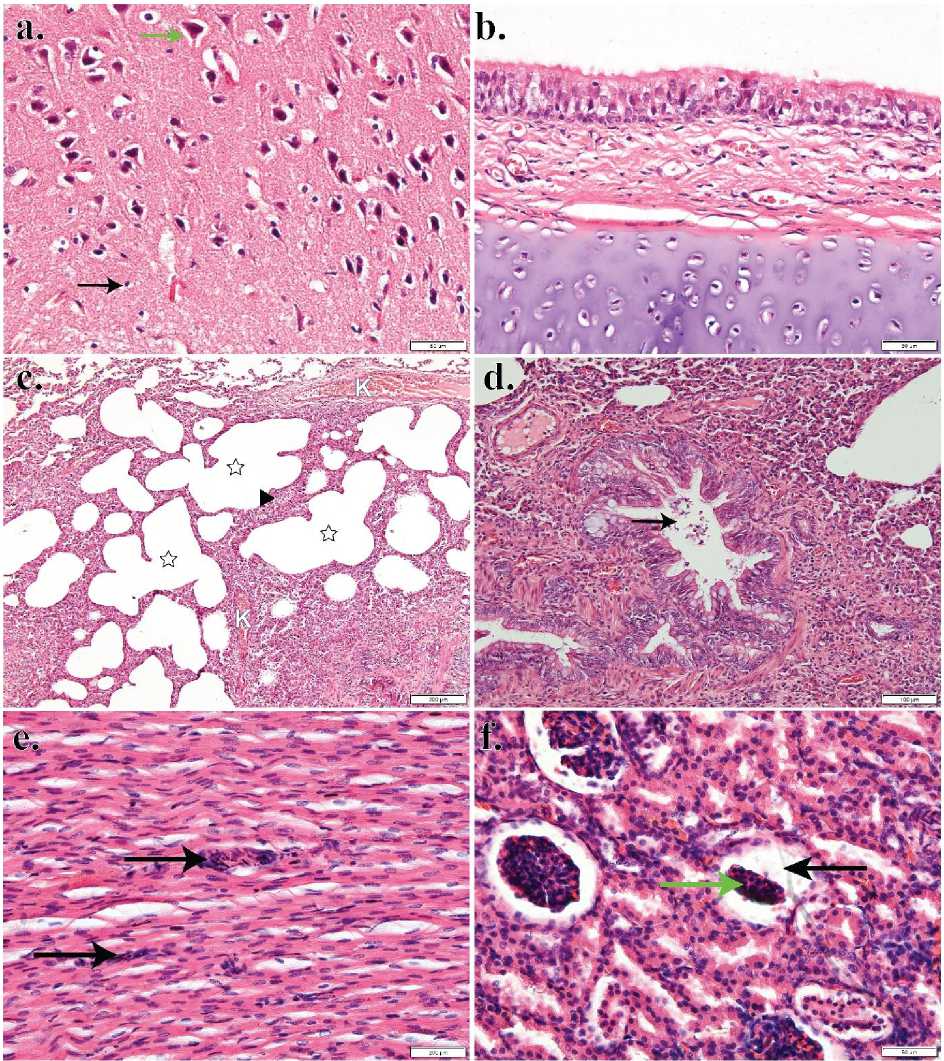
Gambar 3. (a) Piknotik neuronal (panah hitam). Sel piramidal normal (panah hijau) (b) Struktur histologis trakhea. Tidak nampak adanya perubahan patologis (c) Bronkopneumonia emfisematosa. Ditemukan adanya penebalan septa alveoli (kepala panah), kongesti (K), emfisema (☆), dan (d) infiltrasi sel limfosit pada lumen bronkiolus (panah hitam) (e) Miokarditis nekrotikan. Terjadi nekrosis pada kardiomiosit (panah hitam) (f) Atrofi glomerulus (panah hijau) yang ditandai dengan dilatasi ruang kapsula Bowman (panah hitam) Perbesaran 100 kali (Gambar c), Perbesaran 200 kali (Gambar d) Perbesaran 400 kali (Gambar a,b,e, dan f). Pewarnaan HE.
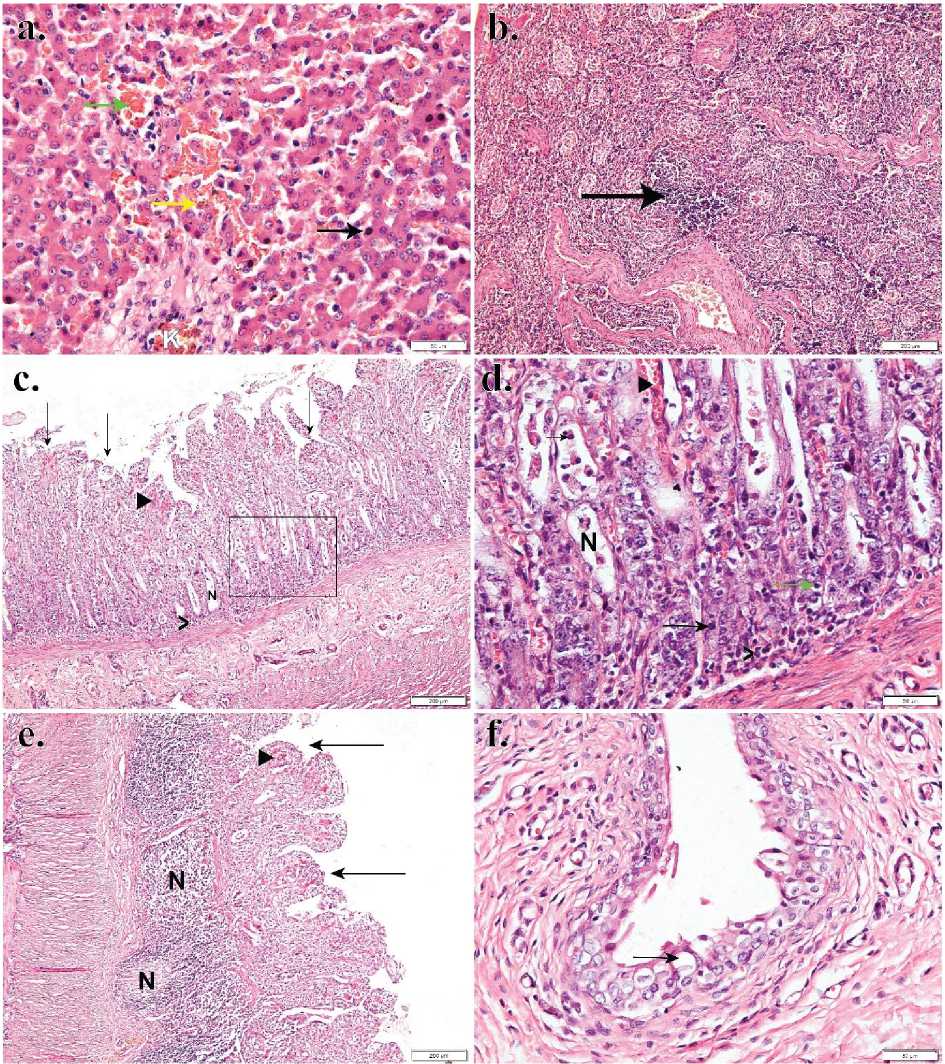
Gambar 4. (a) Hepatitis hemorrhagis et nekrotikan. Ditemukan eritrosit pada sinusoid hati (panah hijau), sel hepatosit mengalami piknosis (panah hitam), karyorhexis (panah kuning), serta pembuluh darah mengalami kongesti (K) (b) Deplesi folikel limfoid limpa (panah hitam) (c) Enteritis hemorrhagis et nekrotikan. Usus halus bagian jejunum mengalami kerusakan villi yang ekstensif, menandakan terjadinya nekrosis (panah hitam), enterosit mengalami deskuamasi serta hemoragi (kepala panah). Kripta lieberkuhn mengalami nekrosis (N) (d) Nampak kripta lieberkuhn yang mengalami nekrosis (N) diinfitlrasi sel radang neutrofil (panah hitam) serta limfosit (panah hijau). Bagian lamina propria juga diinfiltrasi oleh sel radang. (e) Usus halus bagian ileum mengalami nekrosis pada peyer’s patches (N), mengalami atrofi pada villi ususnya (panah hitam) serta hemoragi (kepala panah). (f) Vesica urinaria mengalami degenerasi hidrofik pada epitel transisional (panah hitam). Perbesaran 100 kali (Gambar b,c, dan e). Perbesaran 400 kali (Gambar a, d dan f). Pewarnaan HE.
704
Discussion and feedback