Seroprevalensi Infeksi Toxoplasma gondii Pada Kambing yang Dipotong Di Kampung Jawa, Denpasar
on
Buletin Veteriner Udayana
ISSN : 2085-2495
Volume 5 No. 1 : 7-13
Pebruari 2013
Seroprevalensi Infeksi Toxoplasma gondii Pada Kambing yang Dipotong Di Kampung Jawa, Denpasar
(SEROPREVALANCE OF TOXOPLASMA GONDII IN GOAT THAT SLAUGHTERED IN KAMPUNG JAWA, DENPASAR)
Putu Suma Githa Sanjaya1)
I Made Damriyasa2), I Made Dwinata2)
1Mahasiswa Fakultas Kedokteran Hewan Universitas Udayana 2)Laboratorium Parasitologi Fakultas Kedokteran Hewan Universitas Udayana Email: tekik.kaka@gmail.com
ABSTRAK
Penelitian ini bertujuan untuk mengetahui prevalensi infeksi T. gondii secara serologis pada kambing yang dipotong di Kampung Jawa, Denpasar. Sebanyak 300 sampel serum kambing dilakukan uji serologis dengan Indirect Haemoglutination Assay Test (IHA) untuk menentukan seroprevalensi toksoplasmosis. Titer serum positif terinfeksi T. gondii diukur untuk mengetahui tingkat infeksi yang terjadi. Hasil penelitian diperoleh jumlah sampel serum positif mengandung antibodi T. gondii adalah sebanyak 45, jadi seroprevalensi infeksi T. gondii adalah sebesar 15% dengan titer 1:32 sampai 1:4096.
Kata kunci: kambing, seroprevalensi, toxoplasma gondii
ABSTRACT
The recent study was carried out to investigate prevalance of T. gondii infection serologically in goat that slaughtered in Kampung Jawa, Denpasar. There are 300 blood samples, used sample are goat blood serum, those serum are taken serogical test in laboratory using Indirect Hemaglutination Assay Test (IHA). Besides IHA test, we took titer test, to see the level of severity that infects the goats. The results of serological test are 45 sample diagnose T. gondii positive, seroprevalance is 15% and titer test resuts are 1:32 to 1:4096.
Key words: goat, seroprevalances, toxoplasma gondii
PENDAHULUAN
Toksoplasmosis merupakan penyakit zoonosis yang disebabkan oleh infeksi T. gondii, penyakit ini ditularkan dari hewan ke manusia melalui stadium infektif parasit tersebut. Kucing dan hewan sebangsanya merupakan satu-satunya sumber penularan terpenting dari T. gondii, karena kucing merupakan satu-satunya hewan yang secara langsung
dapat menyebarkan oosita yang mencemari lingkungan dan potensial menulari manusia maupun hewan lain sebagai induk semang antara .
Penularan pada inang antara dapat terjadi melalui dua cara, pertama hewan menelan oosista T. gondii yang telah bersporulasi, selanjutnya di dalam usus dinding oosista akan dirusak oleh enzim pencernaan yang bersifat proteolitik, sehingga oosista pecah dan sejumlah
selanjutnya akan menembus dinding usus dan menyebar ke berbagai jaringan organ tubuh dengan cepat melalui aliran darah dan limfe. Pada inang terbentuk antibodi terhadap T. gondii, pada hari ketiga sampai kedelapan pasca infeksi terjadi proses terbentuknya sista intraseluler yang mengandung ribuan organisme parasit. Sista yang mengandung bradizoit adalah bentuk laten dari T. gondii, dan sangat tergantung dari kekebalan tubuh inang. Jika terjadi penurunan kekebalan tubuh, maka kista akan pecah, bradizoit akan keluar dan akan aktif serta bersifat invasif seperti halnya takizoit (Urquhart et al., 1987 ; Dubey, 1998a; Bowman et al., 2003).
Cara kedua penularan dapat terjadi akibat tertelan bradizoit atau takizoit yang berasal dari inang antara lainnya. Hewan menelan sista, di dalam lambung akan terjadi perusakan sista dan bradizoit akan terbebas, dalam waktu 18 jam setelah infeksi terbentuk menjadi takizoit di dalam lamina propria usus halus. Selanjutnya terjadi perkembangan dan penyebaran takizoit dengan cepat ke organ-organ ekstra intestinal dan akhirnya akan terbentuk bradizoit kembali dalam waktu 5 – 6 hari setelah tertelan bradizoit. perkembangan parasit terjadi seperti halnya cara pertama (Urquhart et al., 1987; Dubey, 1998a; Bowman et al., 2003).
Hasil-hasil penelitian terhadap seroprevalensi toksoplasmosis pada manusia di berbagai daerah di Indonesia telah dilaporkan, yaitu berkisar antara 3,1 % - 64 % (Chomel et al., 1993; Matsuo, 1995; Uga et al., 1996; Simanjuntak et al., 1998; Fan, 2002). Secara epidemiologi beberapa peneliti berpendapat, bahwa kebiasaan makan sangat menentukan terjadinya infeksi parasit tersebut, misalnya kebiasaan makan sate yang belum masak dengan sempurna (Gandahusada, 1991).
melaporkan bahwa seroprevalensi toksoplasmosis pada babi di dua kabupaten di Bali sebesar 32 %. Penelitian pada kucing sebagai inang akhir telah dilakukan terhadap keberadaan oosita melalui pemeriksaan koproskopis, dari pemeriksaan terhadap 27 ekor kucing di Bali, ternyata dua ekor kucing ditemukan adanya oosita T. gondii pada fesesnya (Damriyasa, data belum dipublikasikan). Laporan-laporan penelitian tersebut menunjukkan T. gondii berpotensi sebagai penyebab penyakit baik pada hewan maupun pada manusia.
Sampai saat ini belum ada data tentang faktor risiko toksoplasmosis di Bali terutama potensi hewan piaraan sebagai sumber penularan pada penduduk rentan terhadap toksoplasmosis. Dengan kondisi Bali yang memelihara hewan piaraan dalam satu pekarangan serta banyaknya berkeliaran kucing-kucing di tempat-tempat umum, maka perlu dilakukan penelitian tentang potensi hewan piaraan sebagai faktor risiko toksoplasmosis pada manusia di Bali. Data ini sangat dibutuhkan dalam strategi menekan penularan toxoplasmosis dari hewan ke manusia. Oleh karena itu penelitian ini sangat penting dilakukan di Bali.
Penelitian terhadap seroprevalensi toksoplasmosis pada ayam kampung di Bali telah dilakukan, hasilnya menunjukkan bahwa 24,8% dari 125 ekor yang diperiksa menunjukan adanya antibodi terhadap T. gondii (Dwinata et al., 2008). Penelitian terhadap keberadaan T. gondii yang dilaporkan di Bali menunjukkan bahwa penyakit zoonosis tersebut merupakan salah satu masalah kesehatan baik pada hewan maupun manusia. Potensi ternak lainnya sebagai sumber penularan perlu ditelusuri, salah satunya adalah kambing.
Dengan mendeteksi keberadaan antibodi terhadap T. gondii pada hewan dapat dijadikan salah satu indikator
g mengetahui prevalensi infeksi T. gondii pada kambing yang dipotong di beberapa tempat pemotongan kambing di Kampung-jawa Denpasar.
METODE PENELITIAN
Sampel Penelitian
Sampel yang digunakan pada penelitin ini adalah 300 ekor Kambing yang dipotong di Kampung Jawa, kota Denpasar. Masing-masing kambing diambil darahnya untuk dilakukan pemisahan serum. Serum yang diperoleh kemudian disimpan pada suhu minus 20o C sampai dilakukan pemeriksaan serologis.
Alat dan Bahan
Bahan penelitian berupa
Cellognost*- Toxoplasmosis H
(SIEMENS Toxoplasmosis IHA reagent) 1 x 5 µl, Reagent Buffer 1 x 6 µl, Serum Buffer 1 x 10 µl, Toxoplasmosis Conntrol Serum positive (IgG) 1 x 0.5 µl, Toxoplasmosis Conntrol Serum negative 1 x 0.5 µl, Serum kambing, Aquadest.
Peralatan yang digunakan dalam penelitian ini adalah stiker kertas, tabung sentrifuge, sentrifuge, transferpette, tabung eppendorf, pipet mikro, pipet 200 µl, plate ELISA U, wadah/palung elisa, tissu, rak shaker.
Metode Penelitian
Sampel kambing yang digunakan berasal dari tempat pemotongan kambing yang ada di daerah Kampung Jawa, Denpasar. Darah diambil langsung pada saat kambing tersebut disembelih. Selanjutnya darah yang tadi diambil dibawa ke laboratorium untuk di sentrifuge dan pisahkan serumnya. Setelah serum didapat, kemudian serum disimpan di Freezer yang ada di laboratorium Biologi Molekuler dengan suhu -20oC.
g yg g untuk mendeteksi keberadaan antibodi terhadap T. gondii menggunakan Uji IHA (Indirect Haemaglutination Test) dengan menggunakan Cellognost*-Toxoplasmosis H (SIEMENS).
Prosedur kerja dari uji IHA (Indirect Haemaglutination Test) adalah sebagai berikut: Sebanyak 50 µl serum buffer dimasukkan ke dalam semua sumuran mikrotitration plate. Toxoplasma Control Serum Positive (IgG) sebanyak 2 µl dimasukkan ke dalam sumuran A1 dan 2 µl Toxoplasma Control Serum Negative ke dalam sumuran A2 (sumuran A1 dan A2 digunakan sebagai control). Serum kambing yang akan di uji dimasukkan sebanyak 2 µl dan tambahkan 50 µl Cellognost* Toxoplasmosis H (SIEMENS Toxoplasmosis IHA Reagent, dikocok sebelum digunakan) kedalam setiap sumuran mikrotitration plate. Kocok mikrotitration plate dengan menggunakan mikrotitration plate shaker selama 15 detik dengan kecepatan 1100 rpm tutup mikrotitration plate dengan menggunakan plastik polystyrine, dan inkubasikan pada suhu ruangan ( 1525 ºC) Reaksi dapat dirbaca setelah 3-24 jam. Sampel positif tidak akan terlihat mengendap dan sampel negatif akan terlihat mengendap pada dasar mikrotitration plate.
Hasil uji serologis yang menunjukkan hasil positif akan dilanjutkan dengan uji titer antibodi. Prosedur kerja uji titer antibodi adalah sebagai berikut: pada sumuran A1-H1 masukkan 175 µl serum buffer, sedangkan pada sumuran sisanya dimasukkan 50 µl. Sumuran A1 masukkan 25 µl Toxoplasma Control Serum Positive dan pada sumuran B1 masukkan 25 µl Toxoplasma Control Serum Negative, sedangkan pada sumuran C1-H1 masukkna 25 µl (1:8) serum yang akan diuji titernya.
dengan cara memindahkan 50 µl larutan dari sumuran 1 ke sumuran 2, demikian seterusnya hingga sampai sumuran 12, sedangkan pada sumuran terakhir, dibuang 50 µl. Sebanyak 50 µl Cellognost* Toxoplasmosis H (SIEMENS Toxoplasmosis IHA Reagent) dimasukkan ke dalam sumuran 3 sampai sumuran 12, lalu Kocok mikrotitration plate dengan menggunakan mikrotitration plate shaker selama 15 detik dengan kecepatan 1100 rpm. Mikrotitration plate ditutup dengan menggunakan plastik polystyrine dan selanjutnya inkubasikan pada suhu ruangan (15-25 ºC) Reaksi dapat terbaca setelah 3-24 jam. Titer ditentukan dengan melihat samapai sumuran mana serum tidak mengendap.
. — seroprevalensi toksoplasmosis pada kambing yang dipotong di tempat pemotongan di Denpasar sebesar 15 %. Penelitian ini pertama kali dilakukan di Bali untuk mendeteksi keberadaan Toxoplasmosis pada kambing

pada kambing
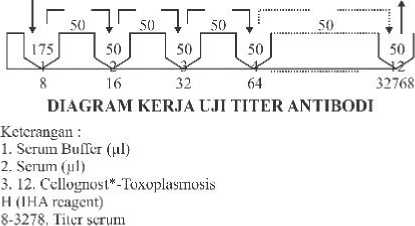
Titer antibodi dari kambing yang positif mengandung antibodi terhadap T.gondii bervariasi antara 1:32 sampai 1: 4096, seperti ditunjukkan pada tabel 2.
Tabel 1. ScbHran titer antibodi terhadap T. gondii pada kambing
|
Titer | ||||||||
|
1:32 |
1:64 |
1:128 |
1:256 |
1:512 |
1:1024 |
1:204« |
1:4096 | |
|
Jumlah |
8 |
16 |
6 |
8 |
? |
2 |
2 |
1 |
|
% |
17.8 |
35.6 |
133 |
17.8 |
4.4 |
4.4 |
4.4 |
2.2 |
Analisis Data
Data yang diperoleh dari uji serologis pada pemeriksaan ini adalah data kwalitatif yaitu positif atau negative. Untuk mengetahui seroprevalensi infeksi T.gondii adalah sebagi berikut :
Jumlah Positif
Prevalensi % = ________________ X
100%
Jumlah Sampel
HASIL DAN PEMBAHASAN
Titer antibodi pada kambing yang positif terinfeksi T.gondii pada pengenceran 1:32(17.8%) 1:64 (35.6%), 1:128 (13.3%), 1:256 (17.8 %) , 1:512
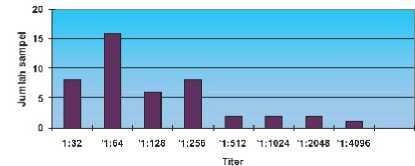
Gambar 2. Histogram sebaran titer antibodi terhadap T. gondii pada kambing
Hasil
Dari 300 ekor kambing yang diperiksa dengan metode Inderect haemaglutination (IHA) ditemukan pada 45 ekor positif mengandung antibodi T.
Pembahasan
Berdasarkan hasil penelitian , seroprevalensi infeksi T.gondii pada kambing yang dipotong di badung sebesar 15 %. Dibandingkan dengan
gondii pada kambing di beberapa negara, data hasil penelitian ini lebih rendah, seperti di Brazil seroprevalensi infeksi T. gondii dilaporkan 32,2 % (Ragozo et al.,2009), di Ethiophia 24,1 % (Negash et al., 2004) dan di Iran 23,7 %( Hamzavi, 2007). Hasil penelitian seroprevalensi T.gondii pada kambing ini sama besarnya pada yang ditemukan di Iran yaitu 15 % dengan metoda ELISA (Chiamak, 2006).
Penelitian T. gondii pada berbagai hospes intermidier di Bali telah dilaporkan oleh Damriyasa (2001) pada babi sebesar 32 %, Dwinata, et al., (2008) pada ayam sebesar 24,8% dan pada ibu hamil sebesar 10,9% (Dwinata, et al..,2009). Berdasarkan laporan penelitian tersebut menunjukkan bahwa T. gondii di Bali berpotensi sebagai penyebab penyakit pada hewan lain termasuk kambing.. Perbedaan hasil seroprevalensi T. gondii yang diperoleh dipengaruhi oleh iklim, lokasi pengambilan sampel, pola pakan, managemen pemeliharaan dan metoda pemeriksaan yang digunakan. Hasil seroprevalensi T. gondii pada kambing pada penelitian ini lebih rendah dibandingkan seroprevalensi pada hospes intermidier yang ditemukan di Bali, hal ini kemungkinan disebabkan kambing-kambing yang dipotong sebagian besar berasal dari luar Bali sehingga terjadi perbedaan kondisi dan tingkat pencemaran lingkungan oleh oosista T. gondii. Ternak kambing dapat terinfeksi T. gondii melalui rumput atau air yang tercemar oosista yang dikeluarkan oleh kucing (Ragozo, et al.,2009). Kucing merupakan induk semang akhir dari T. gondii (Astutik, 2005.) dan populasi kucing di suatu daerah akan berpengaruh terhadap kejadian toksoplasmosis. Ditemukannya antibodi T.gondii pada kambing pada penelitian ini mengindikasikan dapat merupakan sumber potensial bagi penularan toksoplasmosis pada manusia, karena
adalah memakan daging yang mengandung kista yang dimasak kurang baik (Levine, 1995).
Titer antibodi T. gondii dengan menggunakan uji IHA pada penelitian ini bervariasi 1:32 sampai 1: 4096. uji serologis dengan metoda IHA pengenceran 1 : 64 merupakan nilai cut-of yang berarti nilai diatasnya baru dianggap positif terinfeksi T. gondii. makin tinggi titer antibodi kemungkinan intensitas infeksi makin berat. Penelitian yang lain pada kambing melaporkan dengan metode IFA titer antibodi tertinggi 1 : 2560 (Hamzavi et al., 2007) ; dengan metode MAT titer tertinggi 1 : 3200 dan sudah dapat diisolasi adanya T. gondii pada kambing (Ragozo et al., 2009). Semakin tinggi titer antibodi, maka kemungkinan berhasil isolasi parasitnya makin tinggi(Ragozo et al., 2009). Tingginya titer antibodi pada kambing selain menunjukan intensitas infeksi, kemungkinan dapat juga dipengaruhi oleh adanya infeksi baru. Pada daging kambing yang ditemukan titer antibodi diatas 1:64 berpotensi sebagai sumber penularan pada manusia.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian, dapat disimpulkan bahwa antibodi T. gondii dapat dideteksi pada kambing yang dipotong di kampung jawa Denpasar dengan seroprevalensi sebesar 15%, dan titer antibodi tertinggi adalah 1:4096.
Saran
Perlunya penelitian lebih lanjut untuk mengisolasi parasit T. gondii dari daging dan hati pada kambing yang positif terdeteksi antibodi T. gondii.
UCAPAN TERIMA KASIH
Udayana sekaligus sebagai pembimbing I pada penelitian ini yaitu bapak Prof. Dr. drh. I Made Damriyasa, MS, bapak pembimbing II yaitu bapak drh. I Made Dwinata, M. Kes, serta seluruh pihak yang ikut berperan pada penelitian ini
DAFTAR PUSTAKA
Astutik, P. S. 2005. Identifikasi Protozoa Saluran Pencernaan Kucing Di Beberapa Lokasi Di Bali. Skripsi. Fakultas Kedokteran Hewan Universitas Udayana. Denpasar, Bali.
Bowman, DD. Barr, S. C. Hendrix, C. M. and Lindsay, D. S. (2003) Georgi’s Parasitology for Veterinarians. St. Louis, MO: Saunders. Pp 100-102.
Chiamak, G. 2005. Serological survey of antibadies to Toxoplasma gondii. Mohaghegh Ardabili University. Iran
Chomel, B. B., Kasten, R., Adams, C., Lambllotte, D., Theis,J., Goldsmith, R., Koss, J., Chionino, C., Widjana, D. P. And Sutisna, P. 1993. Serosurvey of some major Zoonotik Inection in Children and Teenagers in Bali Indonesia. Southeast Asian Journal of Tropical Medicine and Public Health, 24: 321-326.
Damriyasa, IM., edelhofer, R., Volmer, R. Bauer, C., and Zahner, H.2001a Current seroprevalence of Toxoplasma gondii infection in sows in two region of Germany. Proc. 18. Int. Conf. Wrld. Adv. Vet. Parasitol., Stessa-Italy. Abstr. Nr. A2p.
Damriyasa, I. M., Suratma N. A., Dwinata, I, M., Tenter, A., Nockler, K.and Bauer,, C. 2001b. Fecal and Serological Survey on Endoparasite
The World for Advancement of Veterinary Parasitology., Stressa-Italy 26-31 August 2001.
Damriyasa, I.M., Bauer, C., Edelhofer, R., Failing, K., Lind, P., Petersen, E., Schares, G., Tenter A.M., Volmer, R.and Zahner, H. 2005. Cross-Sectional Survey in Pig Breeding Farms in Hesse, Germany: Seroprevalence and Risk Factor of Infection with Toxoplasma gondii, Sarcocystis spp. And Neospora caninum in sows. Veterinary Parasitology, 126:271-286.
Dubey, JP. 1998a. Refinement of Pepsin Digestion Method for Isolation of Toxoplasma gondii from Infected Tissues. Veterinary Parasitology, 74:75-77.
Dwinata, IM., Oka, IBM., Damriyasa, IM. 2008 . Isolasi danUji Patogenitas Toxoplasma gondii Pada Ayam Kampung . Laporan Hasil Penelitian . Fakultas Kedokteran Hewan Universitas Udayana
Dwinata, IM., Damriyasa, IM., Sutarga, IM. 2009 . Potensi Kucing Sebagai Faktor Risiko Terhadap Toxoplasmosis pada Wanita Hamil di Bali . Laporan Hasil Penelitian . Fakultas Kedokteran Hewan Universitas Udayana
Fan, C, K., Su, K. E., Wui, G. H., Chiou, H. Y., 2002. Seroepidemiology of Toxoplasma gondii Infection Among Two Mountain Aboriginal Population and South East Asian Laborers in Taiwan. J. Parasitology, 88:411414.
Gandahusada. S. 1991. Study on the prevalence of Toxoplasmosis in Indonesia: A review.
Proceedings of the 33rd. Seameo Tropmed Regional
Southeast Asian J. Trop. Med.
|
Pub. Hlth. Vol. 22. Hamzavi, Y., Mostafaie, A., Nomanpour, B . Serological Prevalence of Toxoplasmosis in Meat Producting Animals . 2007 . Iranian J Parasitol. Levine, N. D. 1995. Protozoologi Veteriner. Gadjah Mada University Press. Yogyakarta. Matsuo, K. 1995. Investigation of Toxoplasma gondii Antibody in Human in Bandar Lampung. Bull. BPPH. III Bandar Lampung. Negash,T., Tilahun,G., Patton,S., Prevot,F.,Dorchies,PH. 2004. Serological survey on Toxoplasmosis in sheep and goats in Nazareth, Ethiopia. Revue Med. |
Ragozo, A.M.A., Yai, L.E.O., Oliveira, L.N . 2009 . Isolation of Toxoplasma Gondii from Goats from Brazil . American Societu of Parsitologists. Simanjuntak, G. M., Margono, S. S., Iskandar, T., Windi, C., Hutabarat, T. dan Gunawan, L. M. 1998. Survei Antibodi Toxoplasma Gondii pada Manusia dan Hewan di Daerah Sumatra Utara. Uga, S., Ono, K., Kataoka, N., Hasan, H. Seroepidemiology of five major zoonotic parasite infections in inhabitants of Sidoarjo, east Java, Indonesia. Southeast Asian J Trop Med Public Health. Urquhart GM, Armour J, Duncan Jl, Dunn AM, Jennings FW. 1987. Veterinary parasitology. Harlow, England: Longman Scientific & Technical. |
13
Discussion and feedback