RECENT DEVELOPMENT IN INVESTIGATION OF CHICKEN LEPTIN GENE: A REVIEW
on
Volume 13 No. 1: 81-92
Pebruari 2021
DOI: 10.24843/bulvet.2021.v13.i01.p13
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Peringkat 3, DJPRP Kementerian Ristekdikti
No. 21/E/KPT/2018, Tanggal 9 Juli 2018
Perkembangan Terkini Investigasi Gen Leptin pada Ayam: Ulasan
(RECENT DEVELOPMENT IN INVESTIGATION OF CHICKEN LEPTIN GENE: A REVIEW)
I Wayan Swarautama Mahardhika1*, Budi Setiadi Daryono1
1Gama Ayam Research Team, Laboratory of Genetics and Breeding, Faculty of Biology, Universitas Gadjah Mada. Jl. Teknika Selatan, Sinduadi, Mlati, Kabupaten Sleman, Daerah
Istimewa Yogyakarta 55281. *Email: i.wayan.sm@mail.ugm.ac.id
Abstrak
Perkembangan investigasi gen pengkode leptin (LEP) pada beberapa spesies golongan aves telah dilakukan secara mendalam selama kurun waktu 20 tahun. Ekspresi gen LEP pada genom beberapa spesies aves telah teridentifikasi diantaranya Falco peregrinus dan Falco cherrug, Pseudopodoces humilis, Taeniopygia guttata, Columba livia, Haliaeetus leucocephalus, Picoides pubescens, dan Melopsittacus undulatus. Namun identifikasi genetika molekuler gen LEP pada ayam (G. gallus gallus) masih diperdebatkan. Perkembangan industri peternakan ayam lokal asli Indonesia tergolong pesat, namun masih memiliki beberapa keterbatasan salah satunya produktivitas ternak ayam lokal asli Indonesia. Pemenuhan kebutuhan pangan nasional salah satunya berasal dari sektor peternakan unggas khususnya ayam lokal asli Indonesia dengan kontribusi sebesar 23% per tahun. Peningkatan produktivitas peternakan ayam lokal asli Indonesia dapat dicapai dengan persilangan selektif. Persilangan selektif berupaya dalam meningkatkan mutu genetik ternak ayam lokal asli Indonesia dengan memberdayakan plasma nutfah ayam lokal asli Indonesia. Persilangan selektif memungkinkan dihasilkannya hibrida ayam pedaging dan petelur dengan karakteristik unggul sesuai dengan rancangan pola persilangan yang ditetapkan. Dalam proses persilangan selektif dibutuhkan penerapan genetika Mendelian dan molekuler sebagai panduan dan evaluasi arah seleksi guna meningkatkan efektivitas persilangan. Beberapa gen yang berpengaruh signifikan terhadap produktivitas ayam telah berhasil diidentifikasi, namun beberapa kandidat gen penting lainnya seperti gen LEP masih membutuhkan riset yang mendalam. Ulasan ini mengintegrasikan riset gen LEP pada ayam dari awal penemuan hingga terobosan terkini.
Kata kunci: LEP; Gallus gallus; leptin; plasma nutfah; persilangan selektif
Abstract
The leptin coding gene (LEP) investigation in several avian species has been carried out in-depth for over 20 years. Genomic expression of LEP gene in numbers of avian species has been identified, including Falco peregrinus and Falco cherrug, Pseudopodoces humilis, Taeniopygia guttata, Columba livia, Haliaeetus leucocephalus, Picoides pubescens, and Melopsittacus undulatus. However, molecular genetics identification of LEP gene expression in chicken (G. g. gallus) is still debated. The Indonesian indigenous chicken poultry industry is growing rapidly, with some limitations, one of which involves Indonesian indigenous chicken's productivity. Indonesian indigenous chicken contributes 23% of national food consumption annually. Increased productivity of Indonesian indigenous chicken can be achieved through selective breeding. Selective breeding seeks to improve the genetic quality of Indonesian indigenous chicken by empowering Indonesian indigenous chicken germplasm. Selective breeding allows the production of meat-type and layer-type hybrids with superior characteristics following the design of the specified crossing pattern. Selective breeding requires both Mendelian and molecular genetics as guidance and evaluation methods to maintain breeding direction effectiveness. Several identified genes that have a significant implication on chicken productivity have been researched thoroughly. However, several other important gene candidates, including the LEP gene, still require in-depth research. This review integrates several studies on the chicken LEP gene from the initial discovery until the latest breakthrough.
Keywords: LEP; Gallus gallus; leptin; germplasm; selective breeding
PENDAHULUAN
Leptin diekspresikan oleh gen ob dan mutasinya mengakibatkan abnormalitas fenotip seperti obesitas dan infertilitas (Zhang et al., 1994; Klok et al., 2006; Ohkubo dan Adachi, 2008; Ohkubo, 2014). Leptin berasal dari kata yunani, leptos yang berarti tipis atau kurus (Hossner, 1998; Mrazova et al., 2012). Gen leptin pada ayam diidentifikasi sebagai LEP atau leptin gene (Ninov et al., 2008; Seroussi et al., 2016; Seroussi et al., 2017). Riset LEP sifatnya vital bagi peternakan ayam dalam kaitannya dengan peningkatan produktivitas (Ohkubo dan Adachi, 2008; Ohkubo, 2014). Perdebatan mengenai LEP autentik ayam (Gallus gallus gallus) telah terjadi selama 20 tahun (Rodriguez, 2014; Seroussi et al., 2016). Identifikasi cDNA LEP unggas identik dengan cDNA LEP pada tikus (Taouis et al., 1998; Ashwell, 1999; Dai et al., 2007; Ohkubo, 2014). Beberapa tim riset meragukan lokalisasi LEP pada genom ayam (Friedman-Einat et al., 1999; Pitel et al., 2000; Dunn et al., 2001; Amills et al., 2003). Pitel et al. (2000) menyimpulkan bahwa LEP pada ayam belum terpetakan dengan rinci. Ekspresi leptin ayam pada sel Purkinje cerebellum relevansinya tinggi dengan administrasi eksternal leptin pada sel Purkinje cerebellum tikus dengan pengaruhnya terhadap propagasi, aktivasi dan viabilitas sel (Seroussi et al., 2016). Seroussi et al. (2016) mendeteksi pola ekspresi LEP dan LEPR pada beberapa jaringan ayam diantaranya embrio, ovarium, hipotalamus, cerebrum dan kelenjar adrenal, namun tidak terdeteksi pada jaringan hati, otot dada, dan paru-paru. Seroussi et al. (2017) mengungkapkan bahwa berdasarkan perbandingan pemetaan genomik dan karakteristik sekuen, leptin ayam tidak terlokalisasi pada
mikrokromosom (Seroussi et al., 2016) dengan konten G-C yang tinggi dan region repetitif, melainkan pada ujung distal 1p kromosom ayam (Gallus gallus gallus).
Gen LEP meregulasi asupan kalori, alokasi energi dan fungsi responsif endokrin
hipotalamus dalam transformasi nutrisi (Abbasi et al., 2011). Peningkatan efisiensi pakan termasuk faktor kunci dalam mengurangi biaya produksi peternakan ayam dan meminimalisir dampak lingkungan peternakan ayam (de Verdal et al., 2011). Pakan mempengaruhi 70% biaya produksi peternakan ayam pedaging (Zhang dan Aggrey, 2003). Beberapa faktor yang dapat mengurangi asupan pakan yaitu perbaikan genetik dengan persilangan untuk menekan laju kebutuhan feed conversion ratio (FCR) (Ferket dan Gernat, 2006). Ulasan ini bertujuan untuk merangkum kemajuan riset gen leptin pada ayam. Riset mendetail mengenai ekspresi, lokalisasi dan asosiasi fisiologis leptin pada ayam dapat meningkatkan produktivitas peternakan ayam.
LEPTIN: ASOSIASI FISIOLOGIS, MEKANISME EKSPRESI DAN LOKALISASI GENOMIK AYAM
Asosiasi Fisiologis
Lipoprotein (LPL) dan transporter asam lemak (FABP, FATP dan CD36)
memfasilitasi transportasi asam lemak bebas pada membran selular. AQP7 termasuk golongan gerbang gliserol pada jaringan adiposa (Rodriguez et al., 2011b). AQP3 dan AQP7 menunjukkan distribusi sitosolik pada droplet lipid dan ditranslokasikan pada membran plasma sebagai respon stimulasi lipolitik oleh isoproterenol, dimana AQP9 secara konstitutif diekspresikan pada membran plasma jaringan adiposa. Stimulus lipolitik, seperti katekolamin yang distimulasi oleh leptin berujung kepada translokasi hormone-sensitive lipase (HSL) dan aktivasinya secara paralel oleh AQP3 dan AQP7 untuk pelepasan gliserol (Rodriguez et al., 2011; Walker et al., 2007). Leptin dan katekolamin berperan sebagai feedback inhibitor yang menekan ekspresi AQP7, untuk merestriksi pelepasan gliserol dari jaringan adiposa (Rodriguez et al., 2011) lihat Gambar 1.
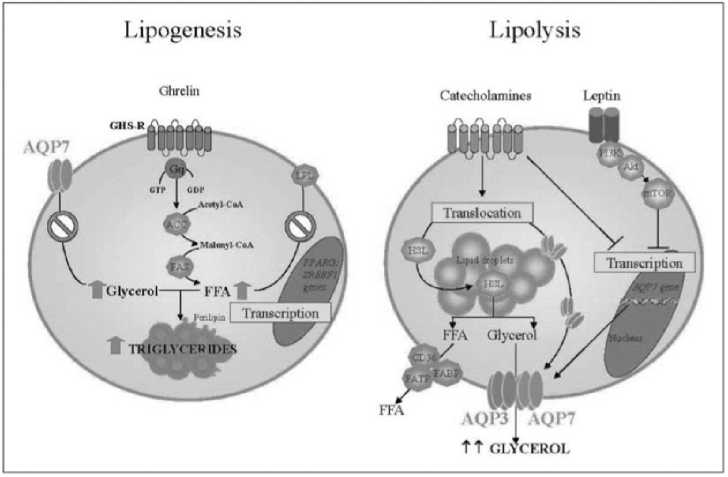
Gambar 1. Mekanisme antagonis lipogenesis dan lipolisis melalui ghrelin dan leptin. Sumber: Adaptasi dari Rodriguez (2014).
Keterangan: AC = Acetyl-CoA carboxylase; AQP = aquaporin; CD36 = fatty acid translocase; FFA = free fatty acids; FABP = fatty acid binding protein; FAS = fatty acid synthase; FATP = fatty acid transporter protein; GHS-R = growth hormone secretagogue receptor; HSL = hormone sensitive lipase; LPL = lipoprotein lipase; mTOR = mammalian target of rapamycin; PI3K = phosphatidylinositol 3-kinase; PPARG = peroxisome proliferator-activated receptor γ gene; SREBF1= sterol regulatory element-binding factor 1 gene
Leptin dan katekolamin berperan sebagai feedback inhibitor yang menekan ekspresi AQP7, regulasi umpan balik negatif tersebut pada fase lipolitik merestriksi pelepasan gliserol dari jaringan adiposa. Selama adipogenesis, ghrelin gene (GHRL) mengalami peningkatan translasi (Gurriaran-Rodriguez et al., 2011), dan ghrelin menstimulasi ekspresi adipogenic transcription factor peroxisome proliferator-activated receptor γ (PPAR γ) dan sterol regulatory element-binding transcription factor 1 (SREBF1) sehingga memicu diferensiasi adiposit.
Leptin meregulasi fungsi fisiologis orexigenic dan efek adipogenic (Rodriguez, 2014). Fungsi fisiologis yang diatur oleh ghrelin dan leptin bersifat antagonis dan dapat ditemukan pada mammalia dan aves. Anorexigenic merupakan efek penurunan kebutuhan pakan dan peningkatan metabolisme energi yang diregulasi oleh leptin untuk menjaga homeostasis (Gautron dan Elmquist, 2011), diikuti dengan
mekanisme pemecahan triasilgliserol adiposa (Rodriguez, 2014). Administrasi sentral leptin mengaktivasi semua area yang berkontribusi dalam regulasi perilaku makan dan homeostasis, menurunkan kebutuhan makan dan bobot tubuh (Harvey dan Ashford, 2003). Leptin meningkatkan metabolisme energi dengan menstimulasi neuron simpatik dan norepinefrin pada jaringan coklat adiposa (BAT, brown adipose tissue) (Rodriguez, 2014). Leptin juga meregulasi lipolytic effect pada jaringan adiposa putih dengan inhibisi lipolisis oleh adenosin deaminase (Frühbeck et al., 2001). Leptin juga menginduksi adipogenesis melalui peningkatan asupan makan dengan menstimulasi neuron reseptor NPY, AgRP dan orexin pada hipotalamus (Toshinai et al., 2003; Chen et al., 2004).
Mekanisme Ekspresi
Leptin receptor gene (LEPR) merupakan gen yang meregulasi translasi reseptor leptin yang memediasi pengikatan leptin dan terintegrasi secara fisiologis, termasuk asupan pakan dan metabolisme lipid antara
lain persentase dan bobot lemak abdominal pada aves termasuk ayam broiler (Wang et al., 2006; Bamidele et al., 2012; El-Moujahid et al., 2014).
LEPR atau disebut juga OB-R pada ayam terletak pada kromosom nomor 8 QTL tersusun atas 20 ekson (Wang et al., 2006; Adachi et al., 2012). Ditemukan korelasi positif antara pembentukan folikel ovarium dengan persentase tingkat leptin dan reseptor leptin pada jaringan folikular melalui steroidogenesis. Ekspresi mRNA LEPR tertinggi ditemukan pada lapisan theca folikel
kuning (F3-F1) ovarium ayam betina broiler, dimana administrasi eksternal mempengaruhi periode bertelur dengan (a) penundaan penghentian peneluran, (b) penipisan folikel kuning, (c) pengubahan steroidogenesis, dan (d) penghilangan apoptosis pada F3-F1 folikel kuning ovarium (Paczoska-Eliasiewicz et al., 2003; Bamidele et al., 2012). Ekspresi mRNA LEPR dalam persentase tinggi terdapat di otak dan ovarium (El-Moujahid et al., 2014), sedangkan persentase kecil terdapat di usus, ginjal dan hati (Mrazova et al., 2012) lihat Gambar 2.
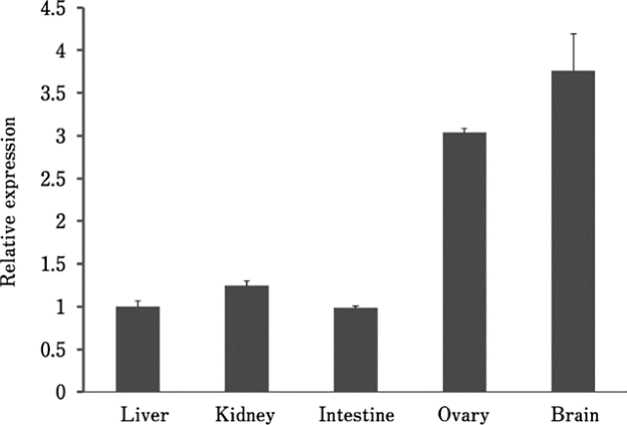
Gambar 2. Ekspresi LEPR mRNA pada jaringan tubuh ayam betina umur 5 minggu. Sumber: Adaptasi dari Ohkubo (2014)
Leptin merupakan hormon neuropeptida berukuran 16 kDa dengan yang terekspresikan oleh ekson 9-11 kromosom 8 (Abbasi et al., 2011). Leptin receptor gene (LEPR) terletak di NeuroPeptide Y (NPY) dan teraktivasi oleh pengikatan leptin yang meregulasi produksi hypohypothalamic NPY berkontribusi pada inhibisi perilaku makan unggas (Abbasi et al., 2011). Identifikasi cDNA LEPR aves pertama kali diidentifikasi pada ayam (Horev et al., 2000; Ohkubo et al., 2000) dan selanjutnya diidentifikasi pada kalkun (Richards dan Poch, 2003) dan bebek (Wang et al., 2011). LEPR ayam memiliki berat molekul 180 kDa dan dapat diekspresikan pada sel mammalia dan jaringan ayam (Ohkubo et al., 2007). Sebagai
tambahan, struktur isoform pendek cDNA chicken LEPR (chLEPR) berhasil dikloning dengan teknik splicing menggunakan struktur ekson pendek spesifik antara ekson 19 dan 20 (Liu et al., 2007). Gen pengkode LEPR pada ayam terdapat pada kromosom nomor 8 (Accession No. NC_011472.1) (Dunn et al., 2000).
Lokalisasi Genomik Ayam
Leptin (LEP) ditemukan oleh (Zhang et al., 1994) kemudian studi mengenai ekspresi leptin dan gen pengkodenya pada vertebrata mengalami peningkatan. Polimorfisme gen LEP pada bovidae, berasosiasi dengan lemak, asupan pakan dan produksi susu (Buchanan et al., 2002; Liefers et al., 2002; Nkrumah et al., 2005). Polimorfisme gen LEP pada babi,
berasosiasi dengan komposisi karkas dan ketebalan lemak subkutan (Robert et al., 1998). Identifikasi awal yang dilakukan Taouis et al. (1998) berhasil mengidentifikasi gen LEP pada ayam, tetapi hasil ini diprotes karena gen yang ditemukan tersebut tidak bersifat reprodusibel (Friedman-Einat et al., 1999) dan tidak mengkode gen LEP pada ayam (Pitel et al., 1999; Pitel et al., 2000). Identifikasi LEP pada beberapa spesies aves berhasil dilakukan diantaranya pada burung falkon (Falco peregrinus dan Falco cherrug), tibetan ground tit (Pseudopodoces humilis), burung finch zebra (Taeniopygia guttata), merpati batu (Columba livia), elang botak (Haliaeetus leucocephalus), burung pematuk downy (Picoides pubescens), budgerigar (Melopsittacus undulatus), burung puyuh (Coturnix japonica), dan bebek (Anas platyrhynchos) (Adachi et al., 2008; Hen et al., 2008; Niv-Spector et al., 2005). Hasil sekuen pada spesies aves tersebut menunjukkan tingginya angka konten G-C sebesar ~70% dan tingginya tingkat perbedaan bila dibandingkan dengan leptin pada mammalia sebesar ~30% (Taniguchi et al., 2002).
Penelitian yang dilakukan oleh Seroussi et al. (2016) berhasil mengidentifikasi gen LEP pada populasi ayam broiler (Cobb), ayam layer (Leghorn), red junglefowl (Gallus gallus) (Al-Nasser et al., 2007), dan bebek (Anas platyrhynchos). Karakterisasi sekuen mRNA pada ayam dan bebek menunjukkan tingginya konten G-C masing-masing sebesar 67% dan 74%, yang identik dengan spesies aves lain (75 ± 3,9%). Sekuen leptin pada ayam dan bebek menunjukkan rendahnya kesamaan identitas dibandingkan dengan spesies aves lain (Seroussi et al., 2016). Walaupun terdapat perbedaan sekuen primer, residu asam amino leptin memiliki kesamaan pada ayam dan bebek yang mengindikasikan adanya kesamaan mekanisme aktivasi leptin (Tachibana dan Tsutsui, 2016). Ekspresi gen LEP dan LEPR pada jaringan kelenjar adrenal mengindikasikan peran leptin dalam pengaturan respon stress dan sekresi glukokortikoid (Seroussi et al., 2016). Leptin pada aves dan ayam di jaringan adiposa
adrenal memicu respon hormonal melalui jalur hipotalamus-pituitari-adrenal dan pada sel Purkinje cerebellum memicu aktivitas food-anticipatory yaitu penurunan perilaku makan pada spesies aves (Seroussi et al., 2016). Selanjutnya interaksi leptin pada ayam berlangsung tanpa membutuhkan bentuk ekstraseluler tertentu dan interaksi untaian pendek reseptor LEPR pada permukaan membran sel.
Asumsi hilangnya gen pengkode protein pada ayam dibandingkan dengan vertebrata lain sebesar 30%, membuat pencarian lokasi gen LEP ditempuh dalam 2 tahap yaitu melalui peta genomik Galgal5 Gallus gallus domesticus dan melalui pembentukan synteny group yang terkonservasi diantara vertebrata. Synteny adalah suatu kondisi dimana posisi suatu lokus genetik pada kromosom suatu spesies diasumsikan memiliki kesamaan posisi pada spesies yang berbeda dan dijadikan dasar deduksi lokasi gen leptin pada ayam dengan membandingkan lokasi gen tersebut pada mammalia dan manusia (Seroussi et al., 2017).
Pencarian lokus alel yang menyimpan gen leptin pada ayam dengan peta genomik Galgal5 Gallus gallus domesticus memunculkan hipotesis bahwa LEP mengalami translokasi pada kromosom ayam ke mikrokromosom yaitu pada ujung distal kromosom 1p. Pada syntenic group kromosom ayam Galgal5 terdapat lima region kromosom dengan konten G-C tinggi berada pada kisaran 54-65% dibandingkan rerata persentase G-C pada kromosom 1 sebesar 40% (Seroussi et al., 2017). RNA-binding protein 28 (RBM28), region kromosom 1p dengan aproksimitas tertinggi konten G-C dan diketahui untuk terakumulasi pada jaringan adiposa ayam sebagai indikasi lokasi gen LEP.
Penyusunan genom dengan LEP melalui syntenic group menganotasikan gen RBM28 dengan aproksimitas konten G-C representatif sebesar ~70%, diperoleh konten G-C RBM28 sebesar ~69% melalui pengkodean pada 668 aa polipeptida dengan similaritas sebesar 51% terhadap manusia dan 65% terhadap aligator, sehingga RBM28
sebagai kandidat lokasi LEP pada jaringan adiposa ayam (Seroussi et al., 2017). Publikasi mengenai sekuen RNA RBM28 pada ayam cukup bervariasi yaitu pada layer lebih tinggi daripada broiler, deposisi lemak abdominal pada broiler menunjukkan perbedaan sebesar 2,8 kali pada kurun waktu 7 minggu, sementara pada broiler dan layer RNA LEP secara signifikan tidak terekspresikan pada lemak viseral (Resnyk et al., 2015; Seroussi et al., 2017) lihat Gambar 3.
Metode penentuan synteny group pada RH map dan GGA01 (conserved region) Galgal5 dengan marker gen ayam digunakan untuk menentukan lokasi gen LEP pada bagian distal kromosom 1p (Seroussi et al., 2017). Synteny group ditentukan dengan membandingkan kromosom ayam dan manusia seperti pada Gambar 4. Hasil yang didapatkan berhasil melacak 5 region dengan konten G-C tertinggi yaitu ARF5, SND1, LRRC4, RBM28 dan FLNC) (Seroussi et al., 2017).
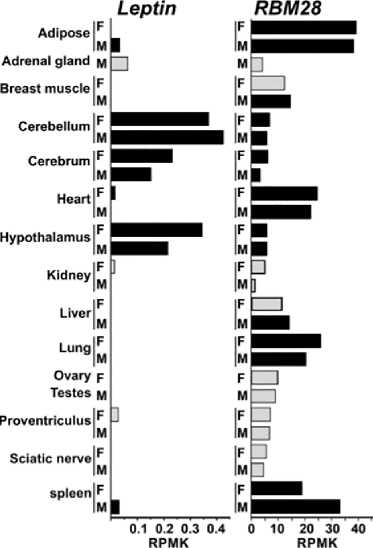
Gambar 3. Pola ekspresi RBM28 dan LEP berdasarkan analisis bioinformatika. Sumber: Adaptasi dari Seroussi et al. (2017)

Gambar 4. Ekspresi gen RBM28 dan leptin pada jaringan adiposa beberapa galur ayam dan manusia. Sumber: Adaptasi dari Seroussi et al. (2017). (A) lean (LL) dan fat (FL) galur broiler umur 7 minggu (B) layer (La) dan broiler (Br) betina (C) lemak viseral lean dan obese pada manusia.
Sebagai pembanding sekuen RNA RBM28 dan LEP pada manusia menunjukkan bahwa ekspresi RNA LEP pada individu dengan obesitas lebih tinggi dibandingkan non-obesitas (Seroussi et al., 2017). Studi yang dilakukan Seroussi et al. (2017) menyimpulkan bahwa kandidat terakurat bagi gen leptin adalah RBM28 dan CPT1B untuk dijadikan fondasi konstruksi Quantitative Trait Loci (QTL) berdasarkan konteks pertumbuhan ayam dan regulasi metabolik. Dasar penentuan RBM28 sebagai sekuen translator gen leptin yaitu tingginya ekspresi RBM28 pada lemak viseral ayam, hal ini koheren dengan fungsi leptin sebagai kontrol mekanisme homeostasis pada mammalia. Ekspresi RBM28 yang berimplikasi pada kerampingan dan perlambatan pertumbuhan merupakan bentuk evolusi adaptasi jaringan adiposa pada ayam atau unggas dimana leptin mengalami modifikasi ekspresi DNA sehingga tidak secara signifikan dapat ditentukan posisi gen terkait bila diukur dengan spesies lain dari syntenic group lain seperti mammalia dan golongan vertebrata lain. Faktor migrasi dan perubahan musim mendorong spesies aves untuk beradaptasi dan mengubah mekanisme kontrol asupan makanan, deposisi lemak dibandingkan dengan pola yang ditunjukkan pada mammalia (Seroussi et al., 2017). Secara genetik RBM28 dan LEP terpaut jarak sebesar 2 kilobasepair (kbp) dengan orientasi tail-to-tail. Investigasi mendetail terhadap gen dengan aproksimitas jarak genetik mendekati leptin menunjukkan hasil yang signifikan pada spesies ayam dengan fenotipe ramping dan jaringan adiposa yang kecil. Seroussi et al. (2017) menggunakan betina broiler Cobb dan ayam White Leghorn (Lohmann) dengan umur 1 hari dan dewasa sebagai sampel di dalam studi tersebut. Investigasi mendalam mengenai kandidat gen pengkode leptin RBM28 dan CPT1B dibutuhkan guna mengkonfirmasi temuan tersebut, disertai data polimorfisme SNP dan susunan ekson dan intron yang detail.
Pentingnya Riset Gen Pengkode Leptin pada Plasma Nutfah Ayam Lokal Indonesia
Peningkatan produktivitas dan daya saing ternak ayam lokal asli Indonesia terhadap ayam ras atau impor dapat dicapai dengan perbaikan mutu genetik secara terukur dan berkelanjutan. Menurut Ningsih dan Prabowo (2017) berbagai permasalahan dihadapi oleh sektor perunggasan salah satunya adalah produktivitas dan daya saing produk perunggasan. Menurut Nurfadillah et al. (2018) masalah agribisnis peternakan ayam adalah efisiensi rendah yang mengakibatkan tingginya biaya produksi. Peningkatan efisiensi dan kulitas produk perunggasan ditentukan oleh penyediaan bibit unggul khususnya bibit unggul ayam pedaging lokal Indonesia (Anggitasari dkk., 2016). Produktivitas ternak dapat diukur dengan tingkat feed conversion ratio (FCR) pakan yang dibutuhkan oleh baik ayam pedaging dan petelur. Pakan menghabiskan 70% biaya produksi total dalam industri peternakan ayam (Zhang dan Aggrey, 2003; Tangendjaja, 2007). Permasalahan produksi pakan adalah suplai bahan baku, fluktuasi kualitas pakan, dan harga serta keterbatasan informasi. Komposisi ransum unggas umumnya terdiri atas 55% jagung dan 23% bungkil kedelai dari total berat pakan (Tangendjaja, 2007). Berbagai penelitian bersifat konvensional terkait pakan telah dilakukan sebagai upaya meningkatkan protein, karbohidrat dan mineral dari hasil samping pertanian namun masih tidak layak industri (Tangendjaja, 2007). Hal ini mengakibatkan adanya ketergantungan impor bahan baku pakan berupa jagung dan kedelai. Berdasarkan data Pusat Pengkajian Perdagangan Dalam Negeri (2018) nilai impor jagung dan kedelai pakan selama periode Januari 2017 hingga Januari 2018 bersifat fluktuatif namun dengan tren yang meningkat. Peningkatan impor jagung periode Februari ke Maret 2018 mengalami peningkatan sebesar 33,31%.
Peningkatan impor kedelai periode Januari 2017 sebesar 302 ribu ton dan bila dibandingkan dengan periode Januari 2018 mengalami penurunan sekitar 24% (Pusat Pengkajian Perdagangan Dalam Negeri, 2018). Peningkatan produktivitas secara konvensional semata tidaklah cukup, diperlukan riset mengenai perbaikan mutu genetik plasma nutfah ayam lokal asli Indonesia. Biodiversitas plasma nutfah ayam lokal asli Indonesia sangatlah tinggi dengan jumlah 34 galur ayam bila dimanfaatkan dapat menjadi upaya konservasi dan alternatif penyediaan kebutuhan pangan hewani nasional (Nataamijaya, 2010; Daryono dkk., 2010; Henuk dan Bailey, 2014). Peningkatan produktivitas terkait tingkat FCR untuk menekan biaya produksi pakan sendiri dapat ditempuh dengan persilangan selektif. Persilangan selektif merupakan persilangan terukur dan terarah dengan tujuan menghasilkan hibrida galur ayam dengan karakter unggul parentalnya. Penilaian dan evaluasi karakter tersebut dilakukan secara Mendelian dan molekuler. Secara molekuler dibutuhkan pengetahuan mengenai ekspresi alel atau gen dalam populasi, yang dapat bersifat menguntungkan atau tidak. Terkait efisiensi pakan terdapat dua kandidat gen yang berkorelasi positif terhadap perilaku dan asupan pakan pada ayam yaitu GHRL dan LEP. Perakitan hibrida dengan tingkat FCR minimum dapat dilakukan dengan mengeliminasi beberapa gen atau mempertahankan beberapa gen yang berkorelasi dengan perilaku dan asupan pakan. Gen LEP mengekspresikan leptin yang secara fisiologis berperan dalam inhibisi perilaku makan serta berperan dalam peningkatan karakter fisiologis lain seperti produktivitas telur dan kualitas daging pada ayam (Abbasi et al., 2011). Perdebatan mengenai gen LEP selama 20 tahun bukan tanpa alasan, sebab dalam berbagai penelitian ekspresinya berkorelasi signifikan positif terhadap produktivitas hewan (Zhang et al., 1994; Robert et al., 1998; Buchanan et al., 2002; Liefers et al., 2002; Nkrumah et al., 2005; Abbasi et al., 2011; Seroussi et al., 2016; Seroussi et al., 2017). Riset mengenai
ekspresi gen LEP serta asosiasinya pada plasma nutfah ayam lokal asli Indonesia dapat menjadi awal pemberdayaan yang berkelanjutan menuju peningkatan
produktivitas produk unggas dan pakan. Gen LEP merupakan kandidat gen kunci pemuliabiakan dan peningkatan produktivitas ayam pedaging lokal dwiguna, pedaging dan petelur unggul Indonesia (Ohkubo, 2014).
SIMPULAN
Terobosan terkini mengenai lokalisasi gen LEP pada ayam (Gallus gallus) mengindikasikan RBM28 sebagai kandidat kuat. Riset mengenai ekspresi gen LEP serta asosiasinya pada plasma nutfah ayam lokal asli Indonesia dapat menjadi awal pemberdayaan dan konservasi genetik yang berkelanjutan menuju peningkatan
produktivitas produk unggas dan efisiensi pakan. Validasi gen LEP dan konstruksi data genomik ayam (Gallus gallus) serta korelasinya secara fenotipe dan fisiologis menjadi panduan dalam proses persilangan selektif plasma nutfah ayam lokal asli Indonesia kedepan.
DAFTAR PUSTAKA
Abbasi HA, Gharavysi S, Abdullahpour R. 2011. Genetic polymorphism exon 9-11 at the Leptin gene receptor in breeder hens of Mazandaran native fowls. J. Anim. Vet. Adv. 10(21): 2802-2805.
Adachi H, Takemoto Y, Bungo T, Ohkubo T.
2008. Chicken leptin receptor is functional in activating JAK-STAT pathway in vitro. J. Endocrinol. 197:335–342.
Adachi H, Murase D, Atomura S, Ohkubo T.
2012. Detection of leptin activity in living cells expressing chicken leptin receptor and STAT3. J. Poult. Sci. 49: 46-50.
Al-Nasser A, Al-Khalaifa H, Al-Saffar A, Khalil F, Al-Bahouh M, Ragheb G, Al-Haddad A, Mashaly M. 2007. Overview of chicken taxonomy and domestication. World’s Poult. Sci. J. 63(2): 285–300.
Amills M, Jimenez N, Villalba D, Tor M, Molina E, Cubilo D, Marcos C, Francesch A, Sanchez A, Estany J. 2003. Identification of three single nucleotide polymorphisms in the chicken insulinlike growth factor 1 and 2 genes and their associations with growth and feeding traits. Poult. Sci. 82: 1485–1493.
Anggitasari S, Sjofjan O, Djunaidi IH. 2016. Pengaruh beberapa jenis pakan komersial terhadap kinerja produksi kuantitatif dan kualitatif ayam pedaging. Buletin Peternakan. 40(3): 187-196.
Ashwell CM, Czerwinski SM, Brocht DM, McMurtry JP. 1999. Hormonal regulation of leptin expression in Broiler chickens. Am. J. Physiol. 276: R226– R232.
Bamidele O, As P Van, Elferink MG. 2012. Molecular characterization of the leptin receptor gene as a candidate gene in the pulmonary hypertension syndrome in broiler chickens. Pak. J. Biol. Sci. 15(24): 1187-1190.
Buchanan FC, Fitzsimmons CJ, Van Kessel AG, Thue TD, Inkelman-Sim DC, Schmutz SM. 2002. Association of a missense mutation in the bovine leptin gene with carcass fat content and leptin mRNA levels. Genet. Select. Evol. 34: 105-116.
Chen HY, Trumbauer ME, Chen AS, Weingarth DT, Adams JR, Frazier EG, Shen Z, Marsh DJ, Feighner SD, Guan XM, Ye Z, Nargund RP, Smith RG, Van der ploeg LH, Howard AD, MacNeil DJ, Qian S. 2004. Orexigenic action of peripheral ghrelin is mediated by
neuropeptide Y and agouti-related
protein. Endocrinol. 145(6): 2607–2612.
Dai HC, Long LQ, Zhang XW, Zhang WM, Wu XX. 2007. Cloning and expression of the duck leptin gene and the effect of leptin on food intake and fatty deposition in mice. Asian-Australasian J. Anim. Sci. 20(6): 850–55.
Daryono BS, Roosdianto I, Saragih HTS. 2010. Pewarisan Karakter Fenotip Ayam Hasil Persilangan Ayam Pelung dengan Ayam Cemani. J. Vet. 11(4): 257-263.
de Verdal H, Narcy A, Bastianelli D, Chapuis H, Même N, Urvoix S, Le Biham-Duval E, Mignon-Grasteau S. 2011. Improving the efficiency of feed utilization in poultry by selection. 1. Genetic parameters of anatomy of the gastrointestinal tract and digestive efficiency. BMC. Genet. 12: 59.
Dunn IC, Boswell T, Friedman-Einat M, Eshdat Y, Burt DW, Paton IR. 2000. Mapping of the leptin receptor gene (LEPR) to chicken chromosome 8. Anim. Genet. 31: 290.
Dunn IC, Girishvarma G, Talbot RT,
Waddington D, Boswell T, Sharp PJ. 2001. Evidence for low homology between the chicken and mammalian leptin genes. In: Avian Endocrinology (Dawson A and Chaturvedi CM eds.). Narosa Publishing House. New Delhi.
El-Moujahid EM, Chen S, Jin S, Lu Y. 2014. Association of leptin receptor gene polymorphisms with growth and feed efficiency in meat-type chickens. Poult. Sci. 93: 1910–1915.
Ferket PR, Gernat AG. 2006. Factors that affect feed intake of meat birds: A review. Int. J. Poult. Sci. 5: 905–911.
Friedman-Einat M, Boswell T, Horev G, Girishvarma G, Dunn IC, Talbot RT, Sharp PJ. 1999. The chicken leptin gene: has it been cloned? Gen. Comp. Endocrinol. 115: 354–363.
Frühbeck G, Gomez-Ambrosi J, Salvador J. 2001. Leptin-induced lipolysis opposes the tonic inhibition of endogenous adenosine in white adipocytes. FASEB J. 15: 333-340.
Gautron L, Elmquist JK. 2011. Sixteen years and counting: an update on leptin in energy balance. J.Clin. Invest. 121: 2087-2093.
Gurriaran-Rodriguez U, Al-Massadi O, Crujeiras AB, Mosteiro CS, Amil-Diz M, Beiroa D et al., 2011. Preproghrelin expression is a key target for insulin action on adipogenesis. J. Endocrinol. 210: R1-7.
Harvey J, Ashford ML. 2003. Leptin in the CNS: Much More than A Satiety Signal. Neuropharmacology 44: 845-854.
Hen G, Yosefi S, Ronin A, Einat P, Rosenblum CI, Denver RJ, Friedman-Einat. 2008. Monitoring leptin activity using the chicken leptin receptor. J. Endocrinol. 197: 325–333.
Henuk, YL, Bailey CA. 2014. Husbandry systems for native chickens in Indonesia. In: Proc. of the 16th AAAP Animal Science Congress. Yogyakarta
(Indones): Universitas Gadjah Mada. Pp. 759–762.
Horev G, Einat P, Aharoni T, Eshdat Y, Friedman-Einat M. 2000. Molecular cloning and properties of the chicken leptin-receptor (CLEPR) gene. Mol. Cell. Endocrinol. 162: 95–106.
Hossner KL. 1998. Cellular, molecular and physiological aspects of leptin: Potential application in animal production. Can. J. Anim. Sci. 78: 463–472.
Klok MD, Jakobsdottir S, Drent ML. 2007. The Role of Leptin and Ghrelin in the Regulation of Food Intake and Body Weight in Humans: A Review. Obes. Rev. 8(1): 21–34.
Liefers SC, te Pas MF, Veerkamp RF, Van Der Lende T. 2002. Associations between leptin gene polymorphisms and production, live weight, energy balance, feed intake and fertility in Holstein heifers. J. Dairy. Sci. 85: 1633-1638.
Liu X, Dunn IC, Sharp PJ, Boswell T. 2007. Molecular cloning and tissue distribution of a short form chicken leptin receptor mRNA. Domest. Anim. Endocrinol. 32: 155–166.
Mrázová Ľ, Angelovi M, Král M. 2012. Monitoring the expression of leptin receptor in avian model. Anim. Sci. Biotech. 45(1): 322–327.
Nataamijaya AG. 2010. Pengembangan potensi ayam lokal untuk menunjang peningkatan kesejahteraan petani. J. Litbang Pertanian. 29(4): 131-133.
Ningsih R, Prabowo DW. 2017. Tingkat integrasi pasar ayam broiler di sentra produksi utama: studi kasus Jawa Timur
dan Jawa Barat. Buletin Ilmiah Litbang Perdagangan. 11(2): 247-270
Ninov K, Ledur MC, Alves HJ, do Rosário MF, Nones K, Coutinho LL. 2008. Investigation of Leptin gene in Broiler and Layer chicken lines. Sci. Agric. 65(2): 214–219.
Niv-Spector L, Raver N, Friedman-Einat M, Grosclaude J, Gussakovsky
EE, Livnah O, Gertler A. 2005. Mapping leptin-interacting sites in recombinant leptin-binding domain (LBD) subcloned from chicken leptin receptor. Biochem. J. 390: 475–484
Nkrumah JD, Li C, Yu J, Hansen C, Keisler DH, Moore SS. 2005. Polymorphisms in the bovine leptin promoter associated with serum leptin concentration, growth, feed intake, feeding behavior, and measures of carcass merit. J. Anim. Sci. 83: 20-28.
Nurfadillah S, Rachmina D, Kusnadi N. 2018. Impact of trade liberization on Indonesian broiler competitiveness. J. Indonesian Trop. Anim. Agric. 43(4): 429-437.
Ohkubo T, Adachi H. 2008. Leptin signaling and action in birds. J. Poult. Sci. 45: 269273.
Ohkubo T, Nishio M, Tsurudome M, Ito M, Ito Y.2007. Existence of leptin receptor protein in chicken tissues: isolation of a monoclonal antibody against chicken leptin receptor. Gen. Comp. Endocrinol. 151: 269-273.
Ohkubo T, Tanaka M, Nakashima K. 2000. Structure and tissue distribution of chicken leptin receptor (cOb-R) mRNA. Biochim. Biophysica Acta. 1491: 303308.
Ohkubo T. 2014. Recent Progress in Avian Leptin Research Recent Progress in Avian Leptin Research. J. Poult. Sci. 51: 343-351.
Paczoska-Eliasiewicz HE, Gertler A, Proszkowiec M, Proudman J, Hrabia A, Sechman A, Rzasa J. 2003. Attenuation by leptin of the effects of fasting on ovarian function in hens (Gallus
domesticus). Reprod. 126(6): 739–751.
Pitel F, Bergé R, Coquerelle G, Crooijmans RPMA, Groenen MAM, Vignal A, Tixier-Boichard M. 2000. Mapping the naked neck (NA) and polydactyly (PO) mutants of the chicken with microsatellite molecular markers. Genet. Sel. Evol. 32: 73–86.
Pitel F, Monbrun C, Gellin J, Vignal A. 1999. Mapping of the LEP (OB) gene to a chicken microchromosome. Anim. Genet. 30: 73-74
Pusat Pengkajian Perdagangan Dalam
Negeri. 2018. Jakarta (Indones): Kementerian Perdagangan RI. p. 52-66
Richards MP, Poch SM. 2003. Molecular cloning and expression of the turkey leptin receptor gene. Com. Biochem. Physiol. B Biochem. Mol. Biol. 136: 833847.
Robert C, Palin MF, Coulombe N, Roberge C, Silversides FG, Benkel BF, McKay RM, Pelletier G. 1998. Backfat thickness in pigs is positively associated with leptin mRNA levels. Can. J. Anim. Sci. 78: 473–482
Rodriguez A, Becerril S, Valenti V, Moncada R, Mendez-Gimenez L, Ramirez B. 2011. Short-term Effects of sleeve gastrectomy and caloric restriction on blood pressure in diet-induced obese rats. Obes. Surg. 22: 1481-1490.
Rodriguez A, Catalan V, Gomez-Ambrosi J, Garcia-Navarro S, Rotellar F, Valenti V. 2011b. Insulin and leptin mediated control of aquaglyceroporins in human adipocytes and hepatocytse is mediated via the PI3K/Akt/mTOR signaling cascade. J. Clin. Endocrinol. Metab. 96: E586-597.
Rodriguez A, Catalan V, Gomez-Ambrosi J. and Frühbeck G. 2011a.
Aquaglyceroporins serve as metabolic gateways in adiposity and insulin resistance control. Cell Cycle. 10: 15481556.
Rodríguez, A. 2014. Novel molecular aspects of ghrelin and leptin in the control of adipobiology and the cardiovascular system. Obesity Facts. 7(2): 82–95.
Seroussi E, Cinnamon Y, Yosefi S, Genin O, Smith JG, Rafati N, Friedman-Einat M. 2016. Identification of the long-sought leptin in chicken and duck: Expression pattern of the highly GC-rich avian leptin fits an autocrine/paracrine rather than endocrine function. Endocrinol. 157(2): 737–751.
Seroussi E, Pitel F, Leroux S, Morisson M, Bornelöv S, Miyara S, Friedman-Einat M. 2017. Correction: Mapping of leptin and its syntenic genes to chicken chromosome 1p. BMC Genet. 18(1): 1– 8.
Tachibana T, Tsutsui K. 2016. Neuropeptide control of feeding behavior in birds and its difference with mammals. Front. Neurosci. 10: 1–13.
Tangendjaja B. 2007. Inovasi teknologi pakan menuju kemandirian usaha ternak unggas. Wartazoa. 17(1): 12-20
Taniguchi Y, Itoh T, Yamada T, Sasaki Y. 2002. Genomic structure and promoter analysis of the bovine leptin gene. IUBMB Life. 53: 131-135.
Taouis M, Chen JW, Daviaud C, Dupont J, Derouet M, Simon J. 1998. Cloning the chicken leptin gene. Gene 208: 239-242.
Toshinai K, Date Y, Murakami N, Shimada M, Mondal MS, Shimbara T. 2003. Ghrelin-induced food intake is mediated via the orexin pathway. Endocrinol. 144: 1506–1512.
Walker CG, Holness MJ, Gibbons GF, Sugden MC. 2007. Fasting induced increases in aquaporin 7 and adipose triglyceride lipase mRNA expression in adipose tissue are attenuated by peroxisome proliferator-activated
receptor alpha deficiency. Int. J. Obes. 31: 1165-1171
Wang F, Lu L, Yuan H, Tian Y, Li J, Shen J, Tao Z, Fu Y. 2011. Molecular cloning, expression, and regulation of goose leptin receptor gene in adipocytes. Mol. Cell. Biochem. 353: 267-274.
Wang Y, Li H, Zhang Y, Gu Z, Li Z, Wang Q. 2006. Analysis on Association of a SNP in the Chicken OBR Gene with Growth and Body Composition Traits.
Asian-Aust J. Anim. Sci. 19(12): 1706– 1710.
Zhang W, Aggrey SE. 2003. Genetic variation in feed utilization efficiency of meat-type chickens. World’s Poult. Sci. J. 59: 328–339.
Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. 1994. Positional cloning of the mouse obese gene and its human homologue. Nature. 372: 425–431 .
92
Discussion and feedback