ANTIBIOTIC RESISTANCE TO ESCHERICHIA COLI ISOLATED FROM LAYING HENS
on
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Peringkat 3, DJPRP Kementerian Ristekdikti
No. 21/E/KPT/2018, Tanggal 9 Juli 2018
Volume 11 No. 1: 28-32
Pebruari 2019
DOI: 10.24843/bulvet.2018.v11.i01.p05
Resistensi Antibiotik pada Escherichia coli yang Diisolasi dari Ayam Petelur
(ANTIBIOTIC RESISTANCE TO ESCHERICHIA COLI ISOLATED FROM LAYING HENS)
I Nengah Kerta Besung1*, I Gusti Ketut Suarjana1, Ketut Tono PG1
1Laboratorium Mikrobiologi Fakultas Kedokteran Hewan Universitas Udayana, Bali *Corresponding author: kerta_besung@unud.ac.id
ABSTRAK
Penelitian ini bertujuan untuk menentukan resistensi antibiotik pada Escherichia coli yang diisolasi dari ayam petelur. Sebanyak 100 sampel feses dari ayam petelur diambil dari peternakan di Kabupaten Tabanan, Bangli, dan Karangasem. E. coli diisolasi dan identifikasi dengan metode Carter (1990), yang dilanjutkan dengan uji sensitivitas kuman dengan metode difusi cakram menurut metode Kirby Bauer terhadap antibiotik oksitetrasiklin (30 µg), ampisilin (10 µg), streptomisin (10 µg), sulfametoksasol (30 µg), kloramfenikol (30 µg), dan kanamisin (30 µg). Data diameter hambatan antibiotik dibandingkan dengan standar kepekaan kuman dan diklasifikasikan sebagai sensitif, intermediit, dan resisten. Hasil penelitian menunjukkan bahwa E. coli sensitif terhadap kanamisin, sedangkan terhadap antibiotik yang lainnya bersifat intermediit dan resisten. Bertambahnya umur ayam, akan meningkatkan resistensi terhadap antibiotik.
Kata kunci: Escherichia coli; antibiotik; ayam petelur
ABSTRACT
The study aim was to determine the resistance of Escherichia coli to antibiotics that isolated in laying hens. A total of 100 samples of chicken feces were taken from Tabanan, Bangli and Karangasem districts. E. coli were isolated and identified by Carter (1990) method, followed by a bacterial susceptibility test with agar diffusion method from Kirby Bauer against antibiotics namely oxytetracycline (30 µg), ampicillin (10 µg), streptomycin (10 µg), sulfamethoxazole (30 µg), chloramphenicol (30 µg), and kanamycin (30 µg). The obtained data compared to the next sensitivity standard of the bacteria that classified as sensitive, intermediate, and resistant. The results showed that E. coli from chicken feces are sensitive to kanamycin, whereas the other antibiotics are intermediate or resistant. The increase in resistance is in line to the age of the chicken
Keywords : Escherichia coli; antibiotics; laying hens
PENDAHULUAN
Kejadian kolibasilosis belakangan ini pemunculannya sangat menonjol pada ayam pedaging, terutama yang berumur muda, antara 1 – 2 minggu. Angka kematian bisa mencapai 10% dan akan lebih besar lagi apabila disertai infeksi lain yang mengikutinya, seperti ND, M. gallisepticum atau IB. Meningkatnya kejadian penyakit seiring dengan rendahnya sanitasi perkandangan. E. coli yang merupakan flora normal di dalam pencernaan akan mengkontaminasi peralatan yang ada di perkandangan, sehingga bakteri E. coli ini
akan melimpah pada air yang kualitasnya jelek, terutama setelah turunnya hujan.
Penanganan kolibasilosis adalah dengan sanitasi yang baik disertai dengan pemberian obat antibakteri. Kesadaran dan pengetahuan peternak yang rendah terhadap pemakaian antibakteri akan berdampak buruk pada perkembangan resistensi kuman. Kuman yang awalnya sensitif terhadap antibakteri lambat laun akan berubah sifat menjadi resisten. Hal ini merupakan fenomena yang secara umum terjadi tidak hanya di Indonesia namun juga di negara berkembang lainnya (Braykov et al., 2016).
Kolibasilosis sudah resisten terhadap ampisilin, trimetoprim, sulfametoksasol, tetrasiklin, amikasin, kolistin, norflosaksin, florfenikol, enroflosaksin, cefaleksin, neomycin, kloramfenikol, dan gentamisin (Braykov et al., 2016; Schwaiger et al., 2008).
Terjadinya resistensi kuman terhadap antibiotik, karena kuman sering terpapar oleh antibiotik sehingga kuman mempunyai kemampuan untuk mencegah pengaruh antibiotik dengan jalan membentuk selaput sel yang dapat menghambat masuknya antibiotik ke dalam sel kuman. Perubahan sifat kuman menjadi resisten akan makin meningkat seiring dengan penggunaan antibakteri yang tidak terkontrol seperti dosis tidak tepat, lama pemberian, dan salah memilih obat. Adanya perubahan sifat kuman ke arah resisten menyebabkan kegagalan dalam pengobatan. Dengan demikian uji kepekaan kuman terhadap antibakteri harus dilakukan secara periodik dan kontinyu.
METODE PENELITIAN
Pengambilan Sampel
Sampel feses berasal dari peternakan ayam petelur di Kabupaten Tabanan, Bangli, dan Karangasem. Sebanyak 100 sampel yang digunakan pada penelitian diambil secara aseptis, langsung pada sekum atau kolon, untuk selanjutnya ditempatkan pada pot sampel dan dibawa di dalam termos berisi es.
Isolasi dan Identifikasi E. coli
Masing-masing sampel ditanam pada Nutrient Agar dan Eosin Methylene Blue Agar (EMBA). Koloni yang menampakkan dominan berwarna hijau metalik dengan pusat gelap dicurigai sebagai E.coli dan dilanjutkan dengan identifikasi kuman. Identifikasi dilakukan dengan pewarnaan Gram dan uji biokimia seperti Tripple Sugar Iron Agar (TSIA), Simmons citrate Agar (SCA), Sulphide Indol Motility (SIM), dan Methyl Red Voges Proskauer (MRPV).
Uji Kepekaan Kuman
Uji kepekaan kuman dilakukan dengan cara difusi agar dengan metode dari Kirby-Bauer (Bauer et al., 1966). Koloni kuman 3 - 5 koloni E. coli ditanam pada Mouller Hinton cair dan diinkubasikan selama 2 jam pada suhu 370 C hingga didapatkan kekeruhan setara dengan Mc Farland 0,5 (kandungan 106 sel/ml). Selanjutnya 0,5 ml kultur ditanam pada media Mouller hinton Agar (MHA) dan disebarkan secara merata dan diinkubasikan sekitar 30 menit.
Uji sensitifitas kuman dilakukan terhadap beberapa antimikroba: oksitetrasiklin (30 µg), ampisilinn (10 µg), streptomisin (10 µg), sulfametoksasol (30 µg), kloramfenikol (30 µg), dan kanamisin (30 µg). Sebagai kontrol digunakan kuman Escherichia coli ATCC 25922. Zona hambat pertumbuhan bakteri dari masing-masing cakram antibakteri diukur sebagai data penelitian.
Analisis Data
Semua sampel yang menunjukkan reaksi positif terhadap E. coli diuji kepekaannya dan dianalisis secara deskriptif yaitu dihitung persentase kuman yang sensitif, intermediit, dan resisten terhadap masing-masing antibakteri.
HASIL DAN PEMBAHASAN
Pengamatan terhadap ayam petelur yang menunjukkan gejala diare dilakukan di Kabupaten Tabanan, Bangli, dan Karangasem. Sampel yang sakit dari Kabupaten Tabanan berasal dari Desa Jatiluwih dan Baturiti, dari Kabupaten Bangli berasal dari Kabupaten Demulih, dan dari Karangasem berasal dari Pesedahan. Hasil isolasi kuman menunjukkan adanya kuman banyak kuman pada feses. Pada media EMBA sudah nampak ada koloni bakteri yang berwarna hijau metalik. Koloni bakteri yang tumbuh pada media EMBA yang berwarna hijau metalik dengan kilat logam, dicurigai sebagai kuman E. coli. Penegasan kuman
tersebut dilakukan dengan uji biokimia dan gula-gula.
Semua sampel yang dicurigai sebagai kuman E. coli, dilakukan pewarnaan Gram dan uji biokimia dan uji gula-gula. Hasilnya menunjukkan bersifat kuman bentuk batang Gram Negatif, pada TSIA bersifat acid slant, acid butt, tanpa H2S, dan ada gas, tidak tumbuh pada simmons citrate, MR positif, dengan VP negatif, positif, motil, memfermentasi glukosa dan laktosa.
Berdasarkan hasil di atas, menunjukkan bahwa kuman tersebut adalah E. coli. Bakteri ini bersifat anaerobik fakultatif yang ditemukan normal dan dominan di dalam usus ayam dan hanya 10 – 15% yang bersifat ganas. Kolibasilosis terjadi pada ayam yang dipelihara dalam keadaan sanitasi yang jelek (Jiang et al., 2005). Bakteri E. coli ditemukan dengan jumlah yang melimpah pada air dengan kualitas yang rendah (Zende et al.,2013). Bakteri E. coli disebut juga koliform fekal, hal ini karena E.coli ditemukan di dalam saluran usus ternak dan manusia dan didapatkan di dalam feses, sehingga E. coli dikenal sebagai indikator kontaminasi kotoran (Allocati et al., 2013).
Gejala klinis kolibasilosis antara lain : kematian mendadak yang terjadi pada
klinis. Apabila penyakit berjalan kronis, maka gejala yang terlihat yaitu kelesuan, napsu makan menurun serta munculnya gangguan pernafasan berupa ngorok pada malam hari disertai pengeluaran eksudat dari hidung (De Carli et al., 2015). Beberapa kasus kolibasilosis terjadi pada organ reproduksi unggas sehingga agak sukar diamati. Eksudat pada kantong hawa dan radang fibrinosa pada kantong jantung dan permukaan hati. Gejala lain berupa radang pusar (omphalitis), septicaemia dan enteritis(Qabajah et al., 2014).
Cara penularan walaupun ayam dari dari berbagai kelompok umur dapat terinfeksi oleh E. coli, namun ayam muda lebih sensitif dibandingkan ayam dewasa. Penyakit banyak ditemukan pada lingkungan yang kotor dan berdebu dan pada sekelompok ayam yang mengalami immunosupressif akibat penyakit infeksius. Distribusi E. coli sangat luas, bisa ditemukan di dalam litter, kotoran ayam, debu/kotoran lain dalam kandang serta lingkungan sekitar kandang, pakan, air minum dan sumber air , seperti sumur. Debu dalam kandang ayam dapat mengandung 105 – 106 sel E. coli/gram. Bakteri akan tahan lama di dalam kandang, terutama keadaan kering (De Carli et al., 2015; Sayad
et al., 2018).
120.0
100.0
80.0
60.0
40.0
20.0
0.0 HUB π
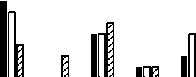
Z ?/ Z /Z <^
□ 1 bulan ■ 2 bulan □ 3 bulan □ 4 bulan
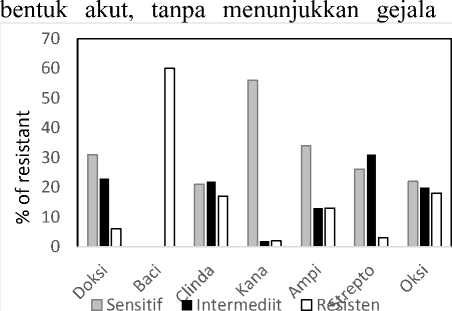
Gambar 1. Persentase kuman sensitif, intermediit, dan resisten terhadap berbagai antibiotika
Gambar 2. Persentase kuman resisten dan intermediit pada berbagai Umur
Gambar 1 menunjukkan bahwa kuman E. coli yang diisolasi dari peternakan ayam petelur menunjukkan resisten terhadap bacitracin (100%), oksitetrasiklin (30%), klindamisin (28,3%), ampisilin (21,7%), doksisiklin (10%), dan kanamisin (5%). Kuman yang menunjukkan intermediit terhadap streptomisin sebanyak 48,3%, doksisiklin 38,3%, Klindamisin 36,7%, oksitetrasiklin 33,3% dan kanamisin sebanyak 1,7%. Hasil ini menandakan bahwa kuman yang diisolasi sudah resisten terhadap antibiotik yang diuji kecuali terhadap kanamisin. Terhadap ampisilin dan doksisiklin sebanyak 56,7% dan 51,7%, sedangkan kepekaan kuman terhadap antibiotik yang lain di bawah 50%.
Gambar 2 di atas menunjukkan bahwa ada kenaikan resistensi kuman terhadap bertambahnya umur ayam. Makin tua umur ayam, maka makin meningkat resistensinya. Hal ini akibat pemberian antibiotik sudah lazim dilakukan oleh peternak. Makin tua umur ayam, makin sering kontak dengan antibiotik. Kejadian ini berdampak pada meningkatnya kepekaan kuman terhadap antibiotic yang sering digunakan. Hasil penelitian kepekaan E. coli yang diisolasi dari organ ayam pedaging penderita koliseptikemia menunjukkan bahwa 73,3% resisten, 20% intermediet, dan 6,7% sensitif terhadap antibiotik oksitetrasiklin, 100% resisten terhadap antibiotik ampisilin, 53,3% resisten dan 46,7% intermediet terhadap sulfametoksasol (Luhung et al., 2017).
Kejadian resistensi kuman E. coli pada unggas telah terjadi di Iran pada tahun 2012. Sebanyak 154 isolat E. coli yang diuji kepekaannya didapatkan 91.6% dan 62.3%. resisten terhadap kloramfenikol dan florfenicol, resisten terhadap Erytromsin dan tiamulin sebanyak 96.1% dan 87.0% (Braykov et al., 2016; Oluduro, 2012). Pada tahun 2012 di India juga telah dilaporkan adanya resistensi kuman E. coli pada unggas. Dari 35 isolat yang diuji, 20 isolat menunjukkan multiple drug resistance sebanyak 52,63%, resisten terhadap
cefaleksin sebanyak 73.68%, dan terhadap Kloramfenikol masih sensitif 100% (Joshi et al., 2012). Kejadian resistensi kuman E. coli pada unggas di Mesir juga menunjukkan angka yang tinggi. Antibiogram menunjukkan bahwa E. coli sudah resisten terhadap enroflokssin (72.2%), neomysin (75%), trimethoprim-sulfamethoksasol (82.2%), ampisilin (84.5%) dan amoksisilin (87.8%), asam nalidiksi (96.7%) dan deoksisiklin (98.3%) (Messaiuml et al., 2013).
SIMPULAN
Simpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa kuman E. coli yang berasal dari feses ayam diare menunjukkan sensitif terhadap kanamisin, sedangkan terhadap antibiotic yang lain sudah intermediit atau resisten. Meningkatnya umur ayam, makin meningkat resistensi kuman terhadap antibiotik.
Saran
Sebaiknya antibiotik yang digunakan tepat sasaran, dosis dan lama pemberian, agar terhindar dari resistensi kuman. Penggunaan antibiotik dilakukan secara cermat dan bijaksana agar tidak menimbulkan resistensi kuman.
UCAPAN TERIMAKASIH
Ucapan terimakasih ditujukan kepada Rektor Universitas Udayana atas pemberian dana yang bersumber dari Hibah Unggulan Udayana. Ucapan terimakasih juga ditujukan kepada Dekan Fakultas Kedokteran Hewan Universitas Udayana dan Kepala Laboratorium Mikrobiologi atas ijin pelaksanaan penelitian.
DAFTAR PUSTAKA
Allocati N, Masulli M, Alexeyev MF, Di Ilio C. 2013. Escherichia coli in Europe: an overview. Int. J. Environ. Res. Pub. Health. 10(12): 6235-6254.
Bauer AW, Kirby WM, Sherris JC, Turck M. 1966. Antibiotic susceptibility
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Peringkat 3, DJPRP Kementerian Ristekdikti
No. 21/E/KPT/2018, Tanggal 9 Juli 2018
testing by a standardized single disk method. Am. J. Clin. Pathol. 45(4): 493496.
Braykov NP, Eisenberg JN, Grossman M, Zhang L, Vasco K, Cevallos W, Levy K. 2016. Antibiotic Resistance in Animal and Environmental Samples Associated with Small-Scale Poultry Farming in Northwestern Ecuador. mSphere. 1(1): e15.
Carter ME, Chengappa MM. 1990. Diagnostic Procedure in Veterinary Bacteriology and Mycology (G. R. Carter & J. R. Cole Eds. 5th Ed.): Academic Press.
De Carli S, Ikuta N, Lehmann FK, da Silveira,VP, de Melo PG, Fonseca AS, Lunge VR. 2015. Virulence gene content in Escherichia coli isolates from poultry flocks with clinical signs of colibacillosis in Brazil. Poult. Sci. 94(11): 2635-2640.
Jiang YW, Sims MD, Conway DP. 2005. The efficacy of TAMUS 2032 in preventing a natural outbreak of colibacillosis in broiler chickens in floor pens. Poult. Sci. 84(12): 1857-1859.
Joshi S, Singh R, Singh SP. 2012. Antibiotic resistance profile of Escherichia coli isolates from Colibacillosis in and around Pantnagar, India. Vet. World. 5(7): 405-408.
Luhung YGA, Suarjana IGK, Gelgel KTP. 2017. Sensitivitas Isolat Escherichia coli Patogen dari Organ Ayam Pedaging Terinfeksi Koliseptikemia terhadap Oksitetrasiklin, Ampisilin dan
Sulfametoksazol. Bul. Vet. Udayana. 9(1): 60-66.
Messaiuml CR, Boukhors KT, Khelef, Hamdi H. 2013. Antimicrobial susceptibility of Escherichia coli strains isolated from broiler chickens affected by colibacillosis in Setif. Af. J. Microbiol. Res. 7(21): 2668-2672.
Oluduro AO. 2012. Antibiotic-resistant commensal Escherichia coli in faecal droplets from bats and poultry in Nigeria. Vet. Ital. 48(3): 297-308.
Qabajah M, Awwad E, Ashhab Y. 2014. Molecular characterisation of
Escherichia coli from dead broiler chickens with signs of colibacillosis and ready-to-market chicken meat in the West Bank. Br. Poult. Sci. 55(4): 442451.
Sayad A, Ibrahim F, Mukim US, Cho J, Madou M, Thong KL. 2018. A microdevice for rapid, monoplex and colorimetric detection of foodborne pathogens using a centrifugal microfluidic platform. Biosens. Bioelectron. 100: 96-104.
Schwaiger K, Schmied EM, Bauer J. 2008. Comparative analysis of antibiotic resistance characteristics of Gramnegative bacteria isolated from laying hens and eggs in conventional and organic keeping systems in Bavaria, Germany. Zoonoses Pub. Health. 55(7): 331-341.
Zende RJ, Chavhan DM, Suryawanshi PR, Rai AK, Vaidya VM. 2013. PCR detection and serotyping of enterotoxigenic and shigatoxigenic Escherichia coli isolates obtained from chicken meat in Mumbai, India. Vet. World. 6(10): 770-773.
32
Discussion and feedback